ЗНАЧЕНИЕ ЖЕЛЕЗА И ВИТАМИНОВ В9 и В12
Свиржевская Елизавета Леонидовна, кандидат ветеринарных наук, научный сотрудник ООО НПП «БИОТЕСТЛАБ».
Железо является символом индустриального общества, находит применение во многих сферах современной экономики. Железо – это важный микроэлемент, который принимает участие во многих биохимических реакциях, входит в состав крови и ядерного аппарата всех клеток. Сегодня доказано, что железо обеспечивает функционирование более сотни белков и ферментов в живом организме.
Железо (около 70%) является частью сложного белка гемоглобина, который входит в состав эритроцитов. Его главная функция – перенос кислорода во все клетки и ткани организма. Если количество эритроцитов уменьшается и снижается уровень гемоглобина, ощущается недостаток кислорода.
Существует три причины, которые влияют на уменьшение уровня гемоглобина:
- недостаток железа;
- недостаток витамина В12;
- недостаток витамина В9.
При недостатке железа в организме возникает железодефицитная анемия, которую определяют как болезнь, характеризующуюся уменьшением количества гемоглобина в крови. Костный мозг при этом продуцирует мелкие бедные эритроциты, с низким количеством гемоглобина, вследствие чего возникает кислородное голодание, недомогание, дрожь. Железо играет важную роль в регулировании температуры тела, и его дефицит приводит к неспособности согреться.
Как свидетельствуют данные литературы, у телят 1–3-дневного возраста анемия врожденная, что связано с неудовлетворительным кормлением сухостойных коров. Дефицит протеина в рационе влияет на синтез предшественника белка дыхательного пигмента – глобина.
Железодефицитная анемия у поросят – широко распространенное заболевание, при этом одним из ведущих факторов снижения количества железа в организме поросят является их особенность быстрого роста.
У пушных зверей, в частности норок, железодефицитная анемия обусловлена неполноценным кормлением. Заболевание проявляется у щенков в конце молочного периода и наносит значительный экономический ущерб, который связан с массовостью заболеваемости и гибели малышей.
Железодефицитная анемия у собак встречается чаще, чем у взрослых кошек. У 50% 5–10-недельных котят развивается железодефицитная анемия новорождённых.
Потребность молодняка в железе определяется двумя факторами — расходом железа на осуществление жизненных процессов и увеличением живой массы, а, следовательно, и объема крови.
С целью предупреждения железодефицитной анемии разработаны и внедрены в практику комплексные препараты на основе ферума III валентного, фолиевой кислоты (вит. В9), витамина В12.
Железо играет важную роль в организме как составная часть гемоглобина и многих других железосодержащих белков. Дефицит этого важного микроэлемента приводит к нарушениям деятельности ферментов, содержащих железо в клетках иммунной системы. Организм становится более восприимчивым к инфекциям. На фоне недостатка железа у животных развивается анемия.
Фолиевая кислота (вит. В9) – водорастворимый витамин, восстанавливается в организме до тетрагидрофолиевой кислоты – кофермента, который необходим на стадии раннего внутриутробного развития, после рождения, в периоды быстрого развития животного, для обмена веществ. Витамин В9 принимает участие в синтезе аминокислот, нуклеиновых кислот, пиримидинов, пуринов, обмене холина. Реакции, которые зависят от наличия данного витамина, являются фундаментальными для синтеза ДНК и поддержания его синтеза. Фолиевая кислота способствует лучшему усвоению витамина В12.
Недостаток В9 приводит к развитию мегалобластной анемии.
Цианокобаламин (вит. В12) – водорастворимый витамин, группа кобальтсодержащих биологически активных веществ. Витамин В12 обладает выраженным липотропным действием, т.е. предупреждает жировую инфильтрацию печени (жировой гепатоз);
- принимает участие в процессах трансметилирования, переноса водорода, активизирует синтез метионина, усиливая синтез и способность к накоплению протеина в организме;
- повышает фагоцитарную активность лейкоцитов и активизирует деятельность ретикулоэндотелиальной системы, повышает иммунитет;
- необходим для здоровой репродуктивной системы;
- принимает участие в регуляции функций кроветворных органов. Принимает участие в синтезе пуриновых и пиримидиновых оснований, нуклеиновых кислот, необходим для эритропоэза, активно влияет на накопление в эритроцитах соединений, содержащих сульфгидрильные группы.
Недостаток витамина В12 является причиной необратимых видов анемий, которые, независимо от проявления клинических симптомов, сопровождаются неврологическими расстройствами.
Витамин В12 функционирует как кофермент в синтезе нуклеиновых кислот, вместе с фолиевой кислотой вовлекается в метаболические процессы. Недостаток витамина В12 способствует нарушению синтеза тетрагидрофолиевой кислоты, которая необходима для образования тимидинмонофосфата, который входит в состав ДНК. Нарушается синтез пуринов и пиримидинов, которые входят в состав ДНК и РНК, что способствует нарушению образования и созревания эритроцитов.
Таким образом, сочетание комплекса витаминов В9, В12 с одновременным введением в организм комплекса Fe +3 в сбалансированном с витаминами количестве обладает синергетическим действием и благотворно влияет на систему гемопоэза.
Источник
В12-дефицитная анемия пожилых, или «у стариков всегда мерзнут ноги»
Анемия, обусловленная недостатком витамина В12 известна медицине давно, и раньше считалась неизлечимой, приводя к гибели больного несколько месяцев. Сегодня проблему составляет не лечение, а выявление патологии у пожилых, для которых она характерна. Ведь для этой категории пациентов большинство симптомов В12-дефицитной анемии – «обычное следствие старости», а значит и поводом для обследования не является.
У пожилых в 10 раз чаще
В12-дефицитная анемия в молодом возрасте – явление достаточно редкое, обусловленное в основном полным отказом от «животных» продуктов или нарушением всасывания витамина В12 и встречающееся примерно у 0,1% населения.
У пожилых распространенность этой патологии в 10-20 раз больше, и составляет уже 1-2% в возрасте до 75 лет, и около 4% — среди представителей старшей группы.
При этом этот В-12 обусловленная анемия – заболевание довольно многофакторное, а среди основных причин ее развития:
- недостаток внутреннего фактора Касла (вырабатываемого желудком и необходимого для усвоения В12 из пищи),
- дефицит В12 в питании
- выраженный дисбактериоз кишечника или гельминтозы.
1. Недостаточность внутреннего фактора Касла
Эта патология не зря занимает первое место среди причин В12-дефицитной анемии пожилых, ведь всасывание В12 в кишечнике возможно только в комплексе с «желудочным» фактором.
Иными словами, усвоение витамина В12 сильно нарушается при атрофии (атрофический гастрит) или резекции (удаление части органа) желудка. В то время как атрофический гастрит встречается у пожилых с частотой в 70-80%.
Причины же атрофического гастрита также отличаются разнообразием. Но у пожилых, значимую роль в этом играет аутоиммунная агрессия.
Антитела к обкладочным клеткам желудка или непосредственно самому фактору Касла встречаются у 90% пациентов с атрофией слизистой желудка. Однако на сегодня не ясно – являются ли они самостоятельной причиной таких гастритов, или развиваются как на фоне уже имеющегося нарушения.
2. Наследственность
Многие клиницисты обращают внимание на «преемственность» риска В12-дефицита среди близких родственников. Ведь у 20-30% пациентов с анемией и атрофическим гастритом в семье уже были (или есть) аналогичные заболевания.
Кроме того, среди пациентов без семейной предрасположенности средний возраст дебюта В12-анемии составляет 66 лет, а с отягощенной наследственностью — 51 год.
3. Дефицит В12 в питании
Не секрет, что у пожилых людей часто появляется склонность к растительной пище. Тогда как потребление мясных и молочных продуктов, а также яиц – сильно снижается или вообще прекращается. А ведь именно эти продукты являются незаменимым источником витамина В12, что также объясняет частоту В12-анемии у вегетарианцев.
4. Дисбактериоз кишечника или «глисты»
Дефицит витамина В12 может обусловлен и «простой конкуренцией», поскольку бактерии и паразиты довольно «прожорливы» в его отношении.
При этом, «ускоренному» размножению бактерий способствуют склонность пожилых к запорам и частота дивертикулеза кишечника. А среди глистных инвазий, наибольшее значение имеет широкий лентец.
Как заподозрить дефицит В12
Слабость, утомляемость, учащенное сердцебиение и другие «классические» (железодефицитные) признаки анемии, при недостатке В12 выражены очень слабо. И, в большинстве случаев, заставляют обратиться к врачу только по достижении тяжелой степени тяжести (гемоглобин на уровне 60-40 г/л и меньше).
При этом среди жалоб, провоцирующих обратиться за помощью – симптомы ухудшения сопутствующих заболеваний (стенокардия, аритмия, ИБС и другие), декомпенсация которых обусловлена длительным кислородным голоданием тканей (гипоксия) и нарушением «текучести» крови.
Еще одним, почти обязательным, признаком В12-дефицитной анемии пожилых является поражение периферических нервов, или фуникулярный миелоз.
Правда, признаки такой нейропатии выявляются только при тщательном осмотре, ведь:
- слабость в конечностях
- постоянное ощущение холода в ногах,
- онемение,
- покалывания
- и нарушение чувствительности
по мнению самих пожилых пациентов – «явление в этом возрасте нормальное», и «ноги у стариков мерзнут всегда». А значит и поводом для обследования такие симптомы быть «точно» не могут.
Обследование
«Картина крови» при В12-дефиците характеризуется снижением эритроцитов, гемоглобина, увеличением эритроцитарных индексов (MCV, MCH), а также недостатком тромбоцитов и лейкоцитов.
Эритроциты, при этом, характеризуются неправильной формой и/или размером (макроцитоз). А появление таких отклонений обусловлено колоссальным значением витамина В12 для нормального синтеза ДНК.
При дефиците В12, очевидно, сильнее «страдают» наиболее активно делящиеся клетки, и одной из таких систем как раз и является кроветворная.
Появление характерных отклонений в общем анализе крови, необходимо уточнить причину их возникновения. Поскольку не все макроцитарные анемии имеют В12-дефицитное происхождение.
3. Подтвержденный дефицит витамина В12, очевидно, нуждается в определении причин, от которых, очевидно, зависит эффективность дальнейшего лечения:
- обследование желудка
- комплекс «Гастрокомплекс» (0.H84.201) для выявления атрофии слизистой (лабораторный «аналог» ФГДС),
- анализ крови на антитела к обкладочным (париетальным) клеткам желудка (0.A56.201) и фактору Касла (9.0.A57.201);
- анализ кала на дисбактериоз (12.A1.900);
- анализ кала методом PARASEP (2.A12.101) (современный вариант кала на яйца глист) или комплексный анализ крови на антитела к гельминтам (50.0.H92.900).
Источник
Биодоступность железа и влияние ионов кальция на ее эффективность
Содержание железа в организме человека составляет в среднем 4,2 г. Около 75% от его общего количества входит в состав гемоглобина эритроцитов, которые переносят кислород от легких к тканям
Содержание железа в организме человека составляет в среднем 4,2 г. Около 75% от его общего количества входит в состав гемоглобина эритроцитов, которые переносят кислород от легких к тканям, 20% железа является резервным (костный мозг, печень, макрофаги), 4% входит в состав миоглобина, около 1% содержится в дыхательных ферментах, катализирующих процессы дыхания в клетках и тканях, а также в других ферментативных структурах. Железо осуществляет свою биологическую функцию, находясь в составе биологически активных соединений, преимущественно ферментов. Железосодержащие ферменты выполняют следующие основные функции:
- транспорт электронов (цитохромы);
- транспорт и депонирование кислорода (гемоглобин, миоглобин);
- участие в формировании активных центров;
- окислительно-восстановительные функции (оксидазы, гидроксилазы, супероксиддисмутазы и др.);
- транспорт и депонирование железа в плазме крови (трансферрин, ферритин).
Железо обладает несколькими особыми свойствами, которые отличают его от других биологически активных ионов и веществ.
В организме человека нет никаких специальных механизмов для выведения железа. В основном железо выделяется через кожу и кишечник (I. Guinote et al., 2006). Кроме этого, оно теряется также с волосами, ногтями, мочой и потом. Общее количество выделяемого железа у здорового человека (мужчины) составляет около 1 мг в сутки. Такое же количество в норме усваивается из потребляемой пищи (Linder, 1991). Отличие составляет менструальный период, когда потребление должно составлять около 4 мг железа в день. Таким образом, концентрация элемента в сыворотке крови зависит от его всасывания в желудочно-кишечном тракте, от накопления в селезенке, костном мозге и скелетных мышцах (миоглобин), а также от синтеза и распада гемоглобина и выделения его из организма. В пище железо может присутствовать в двух видах — гемовое и негемовое, которые характеризуются разными механизмами всасывания. Гемовое железо (порфириновое кольцо с атомом железа в центре, связанное с 4 атомами азота) в желудочно-кишечном тракте освобождается от белковых цепей и в виде металлопорфирина всасывается энтероцитами кишечника. Там происходит неспецифическое эндосомальное проникновение гема в клетку с последующим его разрушением. Далее, с помощью белковой транспортной системы IREG1, ионы железа окисляются до трехвалентного железа, связываются с трансферрином и покидают энтероцит, выходя в ток крови (Linder et al., 2006). В плазме крови железо перемещается в соединении с этим же белком, который выполняет как функцию депо, так и функцию переносчика. Наличие свободных ионов железа в крови не характерно и является патологией. Всасывание гемового железа происходит в пределах 15–50% (в среднем 20–30%).
Негемовое двухвалентное железо в желудке связывается белком гастроферрином и транспортируется в кишечник. Попадая в двенадцатиперстную кишку и проксимальную часть тощей кишки, железо проникает в энтероцит с помощью неспецифического ионного транспортера DMT1 (Divalent metal transport). Этот протонзависимый переносчик также участвует в транспорте многих других двухвалентных катионов, таких как Mn, Сu и Zn (M. Arredondo еt al., 2006). Кроме того, показано, что этот переносчик может транспортировать и некоторые одновалентные ионы, такие как Cu +1 , который образуется при действии аскорбата на Cu +2 (M. Linder et al., 2006). Таким образом, можно предположить, что в зависимости от концентрации этих ионов в диете или мультивитаминной таблетке возможна их конкуренция за транспортер DMT1. При этом имеются данные о том, что существует специфичность переносчика DMT1 по отношению к разным двухвалентным ионам, связанная с их расположением по ходу желудочно-кишечного тракта, что было показано путем транскрипции различных железонезависимых mRNA транспортера DMT1, и конкуренции за переносчик не существует.
В литературе описывается несколько механизмов транспортировки железа внутри энтероцита, основанные главным образом на экспериментах, проведенных на культуре ткани Caco2 (M. Linder et al., 2006). Согласно первой теории, двухвалентное железо, поступившее в энтероцит с помощью транспортера DMT1, доставляется посредством везикул с трансферрином (некоторые отводят ему роль внутриклеточного рецептора) или в свободном состоянии к базолатеральной мембране энтероцита, где присутствует другой транспортер — IREGI/ferroportin/MTP1 (Donovan et al., 2000). Этот транспортер окисляет двухвалентное железо до трехвалентного и транспортирует в кровь, где он соединяется с плазменным трансферрином. Согласно второй теории, внутри энтероцита железо транспортируется, по-видимому, в везикулах вместе с апотрансферрином, который путем эндоцитоза попадает из тока крови в энтероцит (эндо-/экзоцитоз) (Ma et al., 2002). Во время этой транспортировки двухвалентное железо окисляется до трехвалентного и путем экзоцитоза поступает через базилярную мембрану энтероцита в кровь. В этом процессе возможно участие уже упоминавшейся системы IREG. Согласно литературным данным, именно механизм транспорта железа через базолатеральную мембрану энтероцита в кровь является лимитирующим в процессе адсорбции железа (Roy and Enns, 2000). Усвоение неорганического двухвалентного железа обычно происходит в пределах 6–15%.
Негемовое трехвалентное железо может быть восстановлено с помощью ферриредуктазы до двухвалентного железа и усвоено с помощью DMT1. Восстановление трехвалентного железа сильно зависит от кислотности желудочного сока. Невосстановленное железо может всасываться с помощью специфической интегрин-мобифериновой системы IMP. Усвоение трехвалентного железа происходит наименее полно и редко превосходит 4%.
Количество железа, поступающего в эффекторную клетку, куда оно транспортируется с кровью, прямо пропорционально числу мембранных рецепторов. В клетке происходит высвобождение железа из трансферрина. Затем плазменный апотрансферрин возвращается в циркуляцию. Повышение потребности клеток в железе при их быстром росте или синтезе гемоглобина ведет к индукции биосинтеза рецепторов трансферрина и, напротив, при повышении запасов железа в клетке число рецепторов на ее поверхности снижается. Железо, высвободившееся из трансферрина внутри клетки, связывается с ферритином, который доставляет микроэлемент в митохондрии, где он включается в состав гема. Помимо синтеза гема, двухвалентное железо используется в митохондриях для синтеза железосерных центров. В организме человека происходит постоянное перераспределение железа. В количественном отношении наибольшее значение имеет метаболический цикл: плазма — красный костный мозг — эритроциты — плазма. Обычно 70% плазменного железа поступает в костный мозг. За счет распада гемоглобина в сутки высвобождается около 21–24 мг железа, что во много раз превышает поступление железа из пищеварительного тракта (1–2 мг/сут).
Существует выраженная обратная зависимость между обеспеченностью организма железом и его всасыванием в пищеварительном тракте. В основном всасывание железа происходит в двенадцатиперстной кишке и проксимальных отделах тощей кишки и отсутствует в подвздошной кишке.
Всасывание железа зависит от следующих причин: возраста, обеспеченности организма железом, состояния желудочно-кишечного тракта, количества и химических форм поступающего железа и прочих компонентов пищи. Для оптимального всасывания железа необходима нормальная секреция желудочного сока. Прием соляной кислоты способствует усвоению железа при ахлоргидрии. В таблице приведены основные вещества, содержащиеся в продуктах питания человека, которые могут активизировать или уменьшать всасывание железа, содержащегося в этих продуктах или мультивитаминной таблетке. Аскорбиновая кислота, восстанавливающая железо и образующая с ним хелатные комплексы, повышает доступность этого элемента так же, как и другие органические кислоты. Она является одним из наиболее сильных стимуляторов всасывания железа. Другим компонентом пищи, повышающим всасывание железа, является «фактор животного белка», в котором содержится миоглобин и гемоглобин. Улучшают всасывание железа простые углеводы: лактоза, фруктоза, сорбит, а также такие аминокислоты, как гистидин, лизин, цистеин, образующие с железом легковсасываемые хелаты.
Самыми сильными ингибиторами, блокирующими всасывание железа, являются фитаты и полифенолы. Фитаты представляют собой форму хранения фосфатов и минералов, присутствующих в зернах злаковых растений, овощах, семенах и орехах. Они активно тормозят всасывание железа, действуя при этом в прямой зависимости от дозы. Всасывание железа снижают такие напитки, как чай, содержащий таннин, а также другие полифенольные соединения, которые прочно связывают этот элемент. Феноловые соединения существуют почти во всех растениях и являются частью системы защиты против насекомых и животных. Поэтому чай применяют для профилактики повышенного усвоения железа у больных талассемией. Большое влияние на усвоение железа оказывают различные заболевания. Оно усиливается при недостаточности железа, при анемиях (гемолитической, апластической, пернициозной), гиповитаминозе В6 и гемохроматозе, что объясняется повышением эритропоэза, истощением запасов железа и гипоксией.
Из перечисленных веществ, которые могут уменьшать всасывание железа, особое внимание обращает на себя ион кальция. Кальций обладает высокой биологической активностью, в значительном количестве содержится в основных продуктах питания и, как правило, присутствует в одной мультивитаминной таблетке с железом.
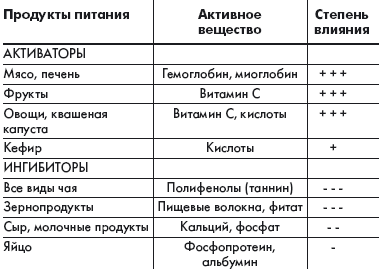 |
| Таблица. Активаторы и ингибиторы всасывания железа, содержащиеся в пищевом рационе человека |
В связи с этим вопрос о возможном влиянии кальция на биодоступность железа изучается длительное время как в экспериментах на животных, так и в исследованиях на людях.
Необходимо отметить, что клеточные механизмы всасывания, т. е. поступления ионов железа и кальция из просвета кишечника в ток крови через энтероциты кишечника, различны. Многочисленными работами было показано, что в этом процессе участвуют различные клеточные транспортеры (J. Hoenderop et al., 2005). Кроме того, имеются данные о том, что кальций уменьшает поступление в организм как гемового (L. Hallberg, 1991), так и негемового железа. Все вместе указывает на то, что кальций может влиять на биодоступность железа, оказывая ингибирующее влияние либо на транспорт его в желудочно-кишечном тракте, либо на связывание с рецепторами, расположенными на апикальной мембране энтероцитов.
В экспериментах на изолированный кишечной петле в условиях in vivo на крысах было показано уменьшение всасывания железа из раствора FeCl2, вводимого непосредственно в петлю при добавлении кальция. Причем эффект зависел от абсолютной концентрации кальция в двенадцатиперстной кишке, а не от молярного соотношения Ca/Fe (Barton et al., 1983). Изучение влияния на клеточный транспорт железа различных солей, содержащих кальций, показало, что наибольший ингибирующий эффект вызывает СаСО3, в то время как эффекты СаSO4 и Na2CO3 присутствуют, но в меньшей степени (Prather, 1992). Эта кальциевая соль, добавленная в количестве 500 мг, способна уменьшить всасывание негемового железа, содержащегося в пищевых продуктах на 32% в случае потребления пищи, не содержащей дополнительные ингибирующие вещества, и на 42% при потреблении продуктов в сочетании с яйцами, кофе и др. (Сook et al., 1991). СaCO3 уменьшает также всасывание железа при совместном использовании их в одной таблетке. В этом случае 300 мг кальциевой соли при совместном употреблении с 37 мг железа, присутствующего в виде FeSO4, уменьшает всасывание железа на 15% (Seligman et al., 1983; Cook et al., 1991).
На добровольцах провели исследования по усвояемости железа при совместном употреблении с кальцийсодержащими продуктами. Усвоение железа определяли радиоизотопным методом с использованием Fe 55 и Fe 59 . Здоровые женщины (21 чел.) потребляли в течение 10 дней дополнительное количество молока и сыра (
930 мг кальция в день). Это привело к снижению абсорбции железа на 30–50% (Hallberg, 1995). На основании полученных данных авторы предполагают, что ингибирование всасывания железа происходит на этапе «просвет кишечника — энтероцит».
В исследованиях на людях также изучалось влияние искусственных минеральных добавок: сульфата железа, цитрата и фосфата кальция и др. Работа была проведена на 61 здоровом испытуемом. Для оценки всасывания использовался также двойной радиоизотопный метод. При употреблении цитрата кальция (600 мг) абсорбция железа снижалась на 49%, фосфата — на 62% (Cook et al., 1991). Интересно, что в этом исследовании эффект от применения кальциевых добавок отмечался только на фоне употребления пищи. Вероятно, конкуренция между катионами возникала при заполненном кишечнике. Теоретически возможно, что высокие концентрации кальция могут изменять реологические свойства пищевого комка в просвете верхней части тонкого кишечника (Conrad et al., 1993). На людях также изучалось различие во влиянии кальция на потребление гемового и негемового железа. Так, в исследованиях на 27 добровольцах с применением полного промывания кишечника для измерения степени усвоения железа при использовании кальциевых добавок (450 мг) было показано снижение абсорбции только гемового железа на 20%. В этой работе добавление кальция не влияло на абсорбцию негемового железа (Z. K. Roughead, 2005). В другом исследовании, проведенном на 44 мужчинах и 81 женщине, наблюдали снижение всасывания гемового железа из рациона при добавлении кальция в дозах от 40 до 300 мг. Максимальное снижение наблюдалось при дозе 300 мг и составило 74%. Дальнейшее увеличение содержания кальция до 600 мг не приводило к возрастанию ингибирования иона железа (L. Hallberg et al., 1991). Противоречивые результаты, получаемые в разных работах, связаны, по-видимому, со сложностью воспроизведения точности методических подходов, проводимых на людях.
Во всех приведенных выше исследованиях было показано в той или иной мере уменьшение абсорбции железа в желудочно-кишечном тракте на 20–60% при совместном употреблении с кальцийсодержащими продуктами в ходе однократного приема пищи или таблетированных препаратов. Характерно, что использованные дозы кальция не превышали дневную норму взрослого человека (во всех описанных случаях суммарное поступление кальция за сутки было меньше 1000 мг). Однако непосредственный механизм антагонистического влияния кальция на всасывание железа остается неясным.
Серия исследований, проведенных на добровольцах при длительном совместном приеме пищи, содержащей определенное количество железа и кальция, не позволила получить однозначного ответа о влиянии иона кальция на биодоступность железа, а главное — на уровень гемоглобина у этих испытуемых. Часто эффект выявлялся (ингибирование составляет 19%), но был статистически недостоверен (Reddy et al., 1997). По-видимому, длительные исследования на людях осложняются контролем над соблюдением диеты и составлением диеты для контрольной группы (S. R. Lynch, 2000).
Анализ литературы позволяет заключить, что экспериментальные исследования на животных и работы, проведенные на испытуемых, подтвердили, что ионы кальция способны уменьшать уровень всасывания железа. Степень выявления эффекта зависела от используемых методических подходов, которые в разных работах отличались друг от друга, и это затрудняет интерпретацию результатов. Однако возможность таких взаимодействий может быть наиболее актуальна и должна безусловно учитываться для людей, страдающих железодефицитными состояниями (анемии) или входящих в группу риска по этому состоянию (дети, беременные и т. д.). Для лечения и профилактики таких состояний необходимо увеличить потребление железа, как за счет соблюдения соответствующей диеты, так и с помощью минеральных добавок. Но следует помнить, что эффективность этих мер может значительно снижаться на фоне потребления диетического кальция или кальцийсодержащих витаминных комплексов. Ограничивать потребление кальция не желательно, поскольку во многих случаях (беременность, возраст 12–18 лет) существует повышенная потребность в обоих элементах. Выходом из ситуации может служить раздельное применение кальция и железа. Экспериментальные данные показали, что интервал между приемом кальция и железа даже в 4 ч исключает эффект ингибирования (A. Gleeprup et al., 1993). Помимо этого, во время приема препарата железа стоит воздержаться от употребления любых продуктов, содержащих кальций, т. е. требуется исключить весь спектр молочной продукции, а также зеленые части растений.
В данном случае удобно применять витаминно-минеральные комплексы, которые заранее предусматривают раздельное употребление железа и кальция. И это не единственное сочетание жизненно важных микронутриентов, проявляющих антагонистические свойства. Таким образом, грамотное разделение компонентов витаминно-минеральных комплексов по времени приема является необходимым условием эффективности их применения.
Литература
- Arredondo M., Martinez R., Nunez M. T. et al. Inhibition of iron and copper uptake by iron, copper and zinc. Biol. Res. 2006; 39: 95–102.
- Barton J. C., Conrad M. E., Parmley R. T. Calcium inhibition of inorganic iron absorption in rats. Gastroenterology. 1983; 84: 90–101.
- Conrad M. E., Umbreit J. N. A concise review: iron absorption- the mucin — mobilferrin — integrin parthway. A competitive parthway for metal absorption. Am J Hematology. 1993; 42: 67–73.
- Cook J. D. Adaption in iron metabolism. Am J Clin Nutrition. 1990; 42: 67–73.
- Cook J. D., Dassenko S. A., Whittaker P. Calcium supplementation: effect on iron absorption. Am J Clin Nutrition. 1991a; 53: 106–111.
- Donovan A., Brownile A., Zhou Y. et al. Positional cloning of zebrafish ferraportin identifies a conserved vertebrate iron exporter. Nature. 2000; 403: 776–781.
- Gleerup A., Rossander-Hulten L., Hallberg L. Duration of the inhibitory effect of calcium on non-haem iron absorption in man. Eur I Clin Nutr. 1993; 47: 875–879.
- Guinote, Fleming R., Silva R. et al. Using skin to assass iron accumulation in human metabolic disorders. Ion Beam Analysis. 2006; 249: 697–701.
- Hallenberg L., Brune M., Erlandsson M. et al. Calcium: effect of different amounts on nonheme- and heme-iron absorption in humans. Am J Clin Nutrition. 1991; 53: 112–119.
- Hoenderop J. Gj., Nilius B., Bindels R. J. M. Calcium absorption across epithelia. Physiol. Rev. 2005; 85: 373–422.
- Linder M. C. Nutrition and metabolism of the trace element. Nutritional Biochemestry and Metabolism. 1991: 151–198.
- Linder M. C., Moriya M., Whon A. et al. Vesicular transport of Fe and interaction with other metal ions in polarized Caco2 Cell monolayers. Biol. Res. 2006; 39: 143–156.
- Lynch S. R. The effect of calcium on iron absorption. Nutr. Res. Rev. 2000; 13: 141–158.
- Ma Y., Specian R. D., Yen K. Y. et al. The transcytosis of divalent metal transporter 1 and apo-transferrin during iron uptake in intesyinal epithelium. Am J Physiol. 2002; 283: 965–97.
- Prather Ta and Miller DD Calcium carbonate depresses iron bioavailability in rats more than calcium sulfate or sodium carbonate. J Nutrition. 1992; 122: 327–332.
- Reddy M. B. and Cook J. D. Effect of calcium on nonheme-ironabsorption from a complete diet. Am J Clin Nutrition. 1997; 65: 1820–1825.
- Roughead Z. K., Zito C. A., Hunt J. R. Inhibitory effects of dietary calcium on the initial uptake and subsequent retention of heme and nonheme iron in humans: comparisons using an intestinal lavage method. Am J Clin Nutr. 2005; 82(3): 589—597.
- Roy C. N. and Enns C. A. Iron homeostasis: New tales from the crypt. Blood. 2000; 96: 4020—4027.
- Seligman P. A., Caskey J. H., Frazier J. L. et al. Measuremants of iron absorption from prenatal multivitamin-mineral supplements. Obstetrics and Gynecology. 1983; 61: 356–362.
Н. А. Медведева, доктор биологических наук, профессор
МГУ, Москва
Источник
