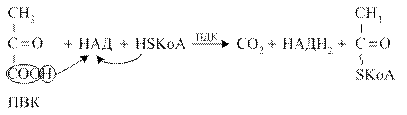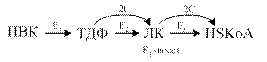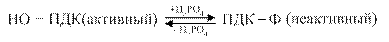Пируватдегидрогеназный комплекс
Пируватдегидрогеназный комплекс (ПДК) молекулярной массой 6*10 6 д., включает в себя три вида ферментов (Е1-Е3) и пять видов коферментов. При этом 2 кофермента (НАД и HS-КоА) находятся в свободном состоянии и входят в состав комплекса только в момент реакции. Общий вид реакции окислительного декарбоксилирования пирувата:
Ферменты пируватдегидрогеназного комплекса
Е1 – пируватдегидрогеназа декарбоксилирующая;
Е2 – дигидролипоилацетилтрансфераза (трансацетилаза);
Коферменты пируватдегидрогеназного комплекса
- Тиаминдифосфат (ТДФ, ТПФ), содержащий витамин В1, кофактор пируватдегидрогеназы.
- Липоевая кислота, кофактор трансацетилазы.
- Кофермент ФАД, содержащий витамин В2, кофактор дегидрогеназы дигидролипоевой кислоты.
- Кофермент НАД, содержащий витамин РР.
- Кофермент НS-КоА, содержащий аденин, рибозу, два остатка фосфорной кислоты, пантотеновую кислоту (витамин В3).
Окислительное декарбоксилирование ПВК протекает в несколько стадий, в процессе которых двухуглеродный фрагмент, образующийся из ПВК, переносится на липоевую кислоту, а затем на HS-КоА.
Витамины, входящие в состав пируватдегидрогеназного комплекса
В состав ПДК входит пять витаминов (РР. В2, липоевая кислота, В1, пантотеновая кислота).
Липоевая кислота
Липоевая кислота — витаминоподобное вещество, представляет собой восьмиуглеродную жирную кислоту с двумя -SH группами. Биологическая роль:является коферментом ПДК, участвует в окислении α — кетокислот.
Пантотеновая кислота, витамин В3
Пантотеновая кислота является витамином, который, в свою очередь, включает β — аланин и производное масляной кислоты. Она распространена в животных и растительных продуктах. Суточная потребность в пантотеновой кислоте составляет до 10 мг. Биологическая роль: входит в состав НS- КоА и участвует в окислительном декарбоксилировании α — кетокислот, участвует в активации жирных кислот. Авитаминоз проявляется дерматитом, депигментацией волос, поражением нервной системы.
Витамин В1, тиамин, антиневритный витамин
Витамин В1 включает в свой состав пиримидиновое кольцо, содержит аминогруппу. Суточная потребность в нём составляет 2 мг. Тиамин содержится в злаках, дрожжах. Биологическая роль: входит в состав кофермента ТДФ и участвует в окислительном декарбоксилировании α — кетокислот, а также является коферментом транскетолазной реакции в пентозофосфатном пути окисления глюкозы. Авитаминоз проявляется полиневритами (болезнь бери-бери).
Регуляция пируватдегидрогеназного комплекса осуществляется путём фосфолирирования — дефосфолирирования пируватдегидрогеназы
Активаторами ПДК служат АДФ и НАД окисленный. Ингибиторами этого комплекса являются АТФ и НАДН2..
5.1.2. Биологическая роль окислительного декарбоксилирования пирувата Биологическое значение процесса окислительного декарбоксилирования пировиноградной кислоты заключается в том, что оно является важным этапом катаболизма, позволяющим включаться в цикл Кребса тем веществам, при распаде которых образуется ПВК. Образовавшаяся молекула НАДН2 окисляется в длинной дыхательной цепи с образованием 3-х молекул АТФ. Окислительное декарбоксилирование пирувата протекает внутри митохондрий.
Дата добавления: 2016-09-26 ; просмотров: 9037 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Источник
Пируватдегидрогеназный комплекс — Википедия
Дефицит пируватдегидрогеназы. Симптомы. Диагностика. Что делать при диагнозе дефицит пируватдегидрогеназы. Консервативное лечение и операции. Платные и бесплатные клиники, в которых лечится дефицит пируватдегидрогеназы.
Коферменты [ править | править код ]
Комбинированное дегидрирование и декарбоксилирование пирувата до ацильной группы [en] , которая в дальнейшем войдёт в ацетил-СоА, осуществляется тремя различными ферментами, для функционирования которых необходимы пять различных коферментов или простетических групп: тиаминпирофосфат (ТРР), FAD, кофермент А (СоА), NAD и липоат. Четыре из них являются производными витаминов: тиамина, или витамина В1 (ТРР), рибофлавина, или витамина В2 (FAD), ниацина, или витамина РР (NAD), и пантотеновой кислоты, или витамин В5 (СоА)[2].
FAD и NAD являются переносчиками электронов, а ТРР известен также как кофермент пируватдекарбоксилазы [en] , участвующей в брожении[2].
Кофермент А имеет активную тиольную группу (—SH), которая имеет критическое значение для функционирования СоА в качестве переносчика ацильной группы в ряде метаболических реакций. Ацильные группы при этом ковалентно связываются с тиольной группой, образуя тиоэфиры. Из-за их относительно высокой стандартной свободной энергии гидролиза тиоэфиры обладают высоким потенциалом для переноса ацильных групп к различным молекулам-акцепторам. Поэтому ацетил-СоА иногда также называют «активированной уксусной кислотой»[2][3].
Пятый кофактор пируватдегидрогеназного комплекса, липоат, имеет две тиольные группы, которые могут подвергаться обратимому окислению с образованием дисульфидной связи (—S—S—), подобно тому, как это происходит между двумя остатками аминокислоты цистеина в белке. Из-за своей способности подвергаться окислению и восстановлению липоат может служить как в качестве переносчика электронов (или H+), так и ацильных групп[2].
Ознакомление с понятием
Пируватдегидрогеназный комплекс (PDH) – это комплекс белкового типа, роль которого заключается в осуществлении окисления пирувата в результате декарбоксилирования. Данный комплекс содержит в себе 3 фермента, а также два белка, необходимых для осуществления вспомогательных функций. Чтобы пируватдегидрогеназный комплекс мог функционировать, необходимо наличие определенных кофакторов. Их пять: СоА, никотинамидадениндинуклеотид, флавинадениндинуклеотид, тиаминпирофосфат и липоат.
Локализация PDH у бактериальных организмов сосредоточена в цитоплазме, эукариотические клетки хранят его в матриксе на митохондриях.
Реакция
Реакция, катализируемая комплексом пируватдегидрогеназы:
Ферменты [ править | править код ]
Пируватдегидрогеназный комплекс (PDH)
Трёхмерная модель PDH
Схематическое изображение PDH с указанием ферментов (Е1, Е2, Е3). Зелёным цветом выделена коровая часть, синим — липоильный домен Е2, который продолжается вперёд до соприкосновения с активными центрами молекул Е1 (жёлтый цвет). С кором также связано несколько субъединиц Е3 (красный), и, раскачиваясь, «рука» Е2 может достать до их активных центров
Пируватдегидрогеназный комплекс (PDH) включает 3 фермента: пируватдегидрогеназу [en] (Е1), дигидролипоилтрансацетилазу (Е2) и дигидролипоилдегидрогеназу [en] (Е3). Каждый из этих ферментов присутствует в комплексе во множестве копий. Количество копий каждого фермента, а следовательно, и размер комплекса варьирует среди различных видов. Комплекс PDH млекопитающих достигает около 50 нм в диаметре, что более чем в 5 раз превышает диаметр целой рибосомы; эти комплексы достаточно велики, чтобы быть различимыми в электронный микроскоп. В PDH коровы и грамположительной бактерии Bacillus stearothermophilus [en] [4] входят 60 идентичных копий Е2, которые формируют пентагональный додекаэдр (коровая часть [en] комплекса) диаметром около 25 нм. В кубический[5] кор PDH у грамотрицательной бактерии Escherichia coli входит 24 копии Е2. К Е2 присоединяется простетическая группа липоат, которая связывается амидной связью к ε-аминогруппе остатка лизина, входящего в состав Е2. Е2 состоит из трёх функционально различных доменов: аминотерминального липоильного домена, содержащего остаток лизина, связывающийся с липоатом; центрального Е1- и Е3-связывающего домена; внутреннего корового ацилтрансферазного домена, содержащего активные центры ацилтрансферазы. У дрожжей в PDH имеется единственный липоильный домен, у млекопитающих — два, а у E. coli — три. Домены Е2 разделяются линкерными последовательностями аминокислот, состоящими из 20—30 аминокислотных остатков, причём в них остатки аланина и пролина перемежаются с заряженными аминокислотыми остатками. Такие линкеры обычно принимают протяжённую форму, тем самым отделяя друг от друга три домена[6].
С активным центром Е1 связывается ТРР, а с активным центром Е3 — FAD. У человека фермент Е1 представляет собой тетрамер, состоящий из 4 субъединиц: двух Е1α и двух Е1β[7]. Также в состав комплекса PDH входят два регуляторных белка — протеинкиназа и фосфопротеинфосфатаза. Такая основная структура из Е1-Е2-Е3 оставалась консервативной в ходе эволюции. Комплексы такого устройства принимают участие и в других реакциях, например, окислении α-кетоглутарата в ходе цикла Кребса и окислении α-кетокислот, образующихся при катаболической утилизации разветвлённых аминокислот: валина, изолейцина, лейцина. У изученных видов Е3 PDH идентичен Е3 двух вышеупомянутых комплексов. Примечательное сходство структур белков, кофакторов и механизмов реакций, осуществляемых этими комплексами, свидетельствует об общности их происхождения[1]. При прикреплении липоата к лизину Е2 образуется длинная, гибкая «рука», которая может перемещаться с активного центра Е1 в активные центры Е2 и Е3, то есть на расстояния предположительно 5 нм и более[8].
Установлено, что у эукариот в состав пируватдегидрогеназного комплекса также входит 12 субъединиц некаталитического E3-связывающего белка [en] (E3BP). Точное его расположение неизвестно, однако криоэлектронная микроскопия показала, что он связывается с каждой из граней кора PDH дрожжей. Было высказано предположение, что этот белок заменил собой несколько субъединиц E2 в PDH коровы[9].
Пируватдегидрогеназный комплекс имеется и у некоторых анаэробных бактерий, например, Zymonomonas mobilis. У этой бактерии до 98 % пирувата участвует в спиртовом брожении, и лишь малая его часть окисляется до ацетил-СоА, СО2 и NADH. PDH Z. mobilis состоит из 4 ферментов: E1α массой 38,6 кДа, Е1β массой 49,8 кДа, Е2 массой 48 кДа и Е3 массой 50 кДа. Уникальной особенностью PDH этой бактерии является наличие в субъединице Е1β липоильного домена. Так же, как и у коровы, кор комплекса представлен субъединицей Е2, а сам комплекс организован в виде пентагонального додекаэдра. Гены, кодирующие субъединицы PDH этой бактерии, собраны в два различных кластера. Поскольку у Z. mobilis отсутствует ряд ферментов цикла трикарбоновых кислот, то PDH у этой бактерии выполняет исключительно анаболические функции[10].
Механизм
Механизм PDC с пируватом (R = H)
Пируватдегидрогеназа (E1)
Первоначально пируват и тиаминпирофосфат (TPP или витамин B 1 ) связываются субъединицами пируватдегидрогеназы . Тиазолиевое кольцо ТЭС находится в цвиттерионных форме, и анионные C2 углерод выполняет нуклеофильную атаку на С2 (кетон) карбонил пируваты. Полученный гемитиоацеталь подвергается декарбоксилированию с образованием эквивалента ацильного аниона (см. Химию циангидрина или альдегид-дитиан умполунг , а также конденсацию бензоина ). Этот анион атакует S1 окисленных липоатов, которые присоединены к остатку лизина . В S N 2-подобном механизме раскрытия кольца S2 замещается как сульфидный или сульфгидрильный фрагмент. Последующий коллапс тетраэдрического гемитиоацеталя выбрасывает тиазол, высвобождая кофактор TPP и генерируя тиоацетат на S1 липоата. Процесс, катализируемый E1, является лимитирующей стадией всего комплекса пируватдегидрогеназы.
Дигидролипоил трансацетилаза (E2)
На данный момент, липоаты-тиоэфир функциональность транслоцируется в dihydrolipoyl transacetylase активного сайта (Е2), где реакция transacylation передает ацетил из «поворотного кронштейна» от lipoyl к тиолу коэнзим А . Это производит ацетил-КоА , который высвобождается из ферментного комплекса и впоследствии входит в цикл лимонной кислоты . E2 также может быть известен как липоамидредуктаза-трансацетилаза.
Дигидролипоилдегидрогеназа (E3)
Dihydrolipoate , по- прежнему связан с остатком лизина комплекса, затем мигрирует к dihydrolipoyl дегидрогеназы активного сайта (Е3), где он подвергается Flavin опосредованного окисления, идентичного по химии к дисульфидной изомеразе . Во-первых, FAD окисляет дигидролипоат обратно до состояния покоя липоата, образуя FADH 2 . Затем кофактор NAD + окисляет FADH 2 обратно до состояния покоя FAD, производя NADH.
Гены [ править | править код ]
У человека гены, кодирующие ферменты PDH, расположены следующим образом. Ген E1α — PDHA1 — локализован на X-хромосоме. Известно более 30 мутантных аллелей этого гена, приводящих к развитию пируватдегидрогеназной недостаточности [en] — заболеванию, симптомы которого могут варьировать от слабовыраженного лактатацидоза до серьёзных пороков развития[11]. Накопление лактата в этом случае происходит из-за того, что PDH не может превращать пируват в ацетил-СоА, и из-за накопления пирувата лактат не может в него превращаться. Мужчины, чья Х-хромосома несёт мутантную аллель, обычно погибают в раннем возрасте, однако женщины тоже в некоторой степени подвержены этому заболеванию из-за инактивации одной из Х-хромосом. В клетках семенников имеется особая копия E1α — PDHA2, этот ген локализован на хромосоме 4[12].
Ген E1β — PDHB — расположен на хромосоме 3. Известно только 2 мутантные аллели этого гена, в гомозиготном состоянии приводящие к смерти в течение первого года жизни из-за пороков развития. Возможно, существуют и другие мутантные аллели, приводящие к смерти ещё до рождения. Ген E2 — DLAT (от англ. dihydrolipoamide s-acetyltransferase ) — локализован на 11-й хромосоме. Известны две аллели этого гена, в гомозиготе приводящие к проблемам, компенсируемым правильной диетой; вполне вероятно, что другие мутантные аллели приводят к смерти на внутриутробном этапе. Ген E3 — DLD — расположен на хромосоме 7. Этот ген имеет множество аллелей, многие из которых приводят к появлению генетических болезней, однако, связанных не с PDH, а с α-кетоглутаратдегидрогеназным комплексом [en] и проявляющихся в нарушении обмена аминокислот[7][12].
Регуляция
«По механизму обратной связи» ингибируют работу пируватдегидрогеназного комплекса конечные продукты окислительного декарбоксилирования — ацетил-КоА, НАДН.Н+, а также АТФ. Увеличивает активность комплекса пируват.
Также имеется регуляция со стороны гормонов: Инсулин увеличивает активность комплекса, глюкагон — снижает.
Примечания [ править | править код ]
- ↑ 12 Nelson, Cox, 2008, p. 616.
- ↑ 1234 Nelson, Cox, 2008, p. 617.
- ↑ Нетрусов, Котова, 2012, с. 123.
- ↑ Henderson C. E. , Perham R. N. Purificaton of the pyruvate dehydrogenase multienzyme complex of Bacillus stearothermophilus and resolution of its four component polypeptides. (англ.) // The Biochemical journal. — 1980. — Vol. 189, no. 1 . — P. 161—172. — PMID 7458900. [исправить]
- ↑ Izard T. , Aevarsson A. , Allen M. D. , Westphal A. H. , Perham R. N. , de Kok A. , Hol W. G. Principles of quasi-equivalence and Euclidean geometry govern the assembly of cubic and dodecahedral cores of pyruvate dehydrogenase complexes. (англ.) // Proceedings of the National Academy of Sciences of the United States of America. — 1999. — Vol. 96, no. 4 . — P. 1240—1245. — PMID 9990008. [исправить]
- ↑ Nelson, Cox, 2008, p. 618.
- ↑ 12Olson S. , Song B. J. , Huh T. L. , Chi Y. T. , Veech R. L. , McBride O. W. Three genes for enzymes of the pyruvate dehydrogenase complex map to human chromosomes 3, 7, and X. (англ.) // American journal of human genetics. — 1990. — Vol. 46, no. 2 . — P. 340—349. — PMID 1967901. [исправить]
- ↑ Nelson, Cox, 2008, p. 618—619.
- ↑ Stoops J. K. , Cheng R. H. , Yazdi M. A. , Maeng C. Y. , Schroeter J. P. , Klueppelberg U. , Kolodziej S. J. , Baker T. S. , Reed L. J. On the unique structural organization of the Saccharomyces cerevisiae pyruvate dehydrogenase complex. (англ.) // The Journal of biological chemistry. — 1997. — Vol. 272, no. 9 . — P. 5757—5764. — PMID 9038189. [исправить]
- ↑ Martin Dworkin, Stanley Falkow et al. The Prokaryotes: A Handbook on the Biology of Bacteria.. — Third edition. — Springer Science & Business Media, 2006. — Vol. 5. — P. 211—212. — 919 p. — ISBN 978-0387-25495-1 .
- ↑ Zhilwan Rahim. Pyruvate Dehydrogenase Complex Deficiency (PDCD). // Undergraduate Research Journal for the Human Sciences. — 2011. — Vol. 10.
- ↑ 12 Laurence A. Moran. Human Genes for the Pyruvate Dehydrogenase Complex (2007) (неопр.) .
Суммарное уравнение
СН3-СО-СООН + НS-КоА + НАД+ => СО2 + СН3-СО
Примечания
- Биологическая химия. Учебник ВУЗ. Гриф УМО. Т.Т.Березов, Б.Ф.Коровкин. -М.,2007.-704 с
Клиническая значимостьДефицит пируватдегидрогеназы (PCDC) может быть результатом мутации любого из ферментов или кофакторов. Его первичный клинический признак — лактоацидоз . Такие мутации PCDC, приводящие к последующему дефициту продукции NAD и FAD, препятствуют процессам окислительного фосфорилирования, которые играют ключевую роль в аэробном дыхании. Таким образом, ацетил-КоА вместо этого восстанавливается с помощью анаэробных механизмов до других молекул, таких как лактат, что приводит к избытку лактата в организме и связанным с ним неврологическим патологиям. Хотя дефицит пируватдегидрогеназы встречается редко, существует множество различных генов, когда они мутированы или нефункциональны, которые могут вызывать этот дефицит. Во-первых, субъединица E1 пируватдегидрогеназы содержит четыре различных субъединицы: две альфа-субъединицы, обозначенные как E1-альфа, и две субъединицы бета, обозначенные как E1-beta. Ген PDHA1, обнаруженный в субъединицах E1-альфа, при мутации вызывает 80% случаев дефицита пируватдегидрогеназы, поскольку эта мутация сокращает белок E1-альфа. Снижение функционального E1 альфа препятствует достаточному связыванию пируватдегидрогеназы с пируватом, тем самым снижая активность всего комплекса. Когда ген PDHB, обнаруженный в бета-субъединице E1 комплекса, мутирует, это также приводит к дефициту пируватдегидрогеназы. Аналогичным образом, были обнаружены мутации, обнаруженные в других субъединицах комплекса, такие как ген DLAT, обнаруженный на субъединице E2, ген PDHX, обнаруженный на субъединице E3, а также мутация в гене пируватдегидрогеназной фосфатазы, известная как PDP1, все были отслежены. обратно к дефициту пируватдегидрогеназы, в то время как их конкретный вклад в состояние болезни неизвестен. Источник ➤ Adblockdetector |