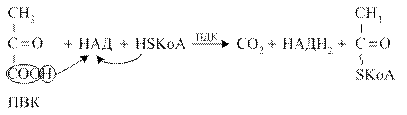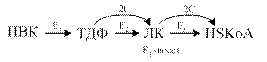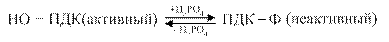Пируватдегидрогеназный комплекс
Пируватдегидрогеназный комплекс (ПДК) — комплекс трех ферментов, который осуществляет окислительное декарбоксилирование пирувата. Продуктами окисления являются углекислый газ, ацетил-КоА, НАДН . Н + .
Содержание
Реакция
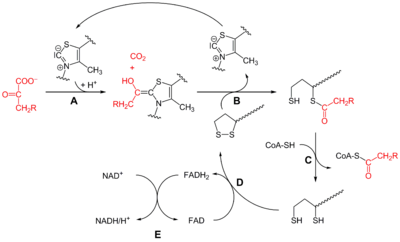
Реакция, катализируемая пируватдегидрогеназным комплексом:
| Пируват | ПДК | Ацетил-CoA | |
 |  | ||
| CoA-SH + NAD + | CO2 + NADH + H + | ||
 | |||
Компоненты
Пируватдегидрогеназный комплекс включает в себя 3 фермента, 3 кофактора (простетическая группа, связанная с апоферментом прочно ковалентно), 2 кофермента (простетическая группа, связанная с апоферментом непрочно нековалентно):
- Е1 — пируватдегидрогеназа декарбоксилирующая.
- Кофактором является активная форма витамина В1 — тиаминпирофосфат.
- Е2 — дигидролипоилацетилтрансфераза.
- Кофактором является витаминоподобное вещество — липоевая кислота, которая присоединив 2 атома водорода может превращаться в дигидролипоил.
- Коферментом является активная форма пантотеновой кислоты — НS-КоА, она принимает ацетильный остаток от липоевой кислоты.
- Е3 — дигидролипоилдегидрогеназа .
- Кофактором является флавинадениндинуклеотид (ФАД) — активная форма витамина В2.
- Коферментом является активная форма витамина PP — никотинамидадениндинуклеотид (НАД + ).
Регуляция
«По механизму обратной связи» ингибируют работу пируватдегидрогеназного комплекса конечные продукты окислительного декарбоксилирования — ацетил-КоА, НАДН . Н + , а также АТФ. Увеличивает активность комплекса пируват.
Также имеется регуляция со стороны гормонов: Инсулин увеличивает активность комплекса, глюкагон — снижает.
Источник
Пируватдегидрогеназный комплекс
Пируватдегидрогена́зный ко́мплекс, ПДК (англ. Pyruvate dehydrogenase complex, PDH, PDC ) — белковый комплекс, осуществляющий окислительное декарбоксилирование пирувата. Он включает в себя три фермента и два вспомогательных белка, а для его функционирования необходимы пять кофакторов (СоА, NAD + , тиаминпирофосфат (ТРР), FAD и липоевая кислота (липоат)). PDH локализован у бактерий в цитозоле, а у эукариот — в митохондриальном матриксе. Суммарное уравнение катализируемой реакции таково [1] :
Детально механизм этого процесса, а также его регуляция обсуждаются в статье Окислительное декарбоксилирование пирувата. Ниже рассмотрены особенности собственно ферментного комплекса.
Содержание
Коферменты
Некоторые коферменты PDH
Комбинированное дегидрирование и декарбоксилирование пирувата до ацильной группы [en] , которая в дальнейшем войдёт в ацетил-СоА, осуществляется тремя различными ферментами, для функционирования которых необходимы пять различных коферментов или простетических групп: тиаминпирофосфат (ТРР), FAD, кофермент А (СоА), NAD и липоат. Четыре из них являются производными витаминов: тиамина, или витамина В1 (ТРР), рибофлавина, или витамина В2 (FAD), ниацина, или витамина РР (NAD), и пантотеновой кислоты, или витамин В5 (СоА) [2] .
FAD и NAD являются переносчиками электронов, а ТРР известен также как кофермент пируватдекарбоксилазы [en] , участвующей в брожении [2] .
Кофермент А имеет активную тиольную группу (—SH), которая имеет критическое значение для функционирования СоА в качестве переносчика ацильной группы в ряде метаболических реакций. Ацильные группы при этом ковалентно связываются с тиольной группой, образуя тиоэфиры. Из-за их относительно высокой стандартной свободной энергии гидролиза тиоэфиры обладают высоким потенциалом для переноса ацильных групп к различным молекулам-акцепторам. Поэтому ацетил-СоА иногда также называют «активированной уксусной кислотой» [2] [3] .
Пятый кофактор пируватдегидрогеназного комплекса, липоат, имеет две тиольные группы, которые могут подвергаться обратимому окислению с образованием дисульфидной связи (—S—S—), подобно тому, как это происходит между двумя остатками аминокислоты цистеина в белке. Из-за своей способности подвергаться окислению и восстановлению липоат может служить как в качестве переносчика электронов (или H + ), так и ацильных групп [2] .
Ферменты
| Фермент | Сокращение | кофактор | # прокариоты | # эукариоты |
|---|---|---|---|---|
| пируватдегидрогеназа шифр КФ 1.2.4.1 | E1 | Тиаминпирофосфат | 24 | 30 |
| дигидролипоилтрансацетилаза шифр КФ 2.3.1.12 | E2 | липоевая кислота коэнзим А | 24 | 60 |
| дигидролипоилдегидрогеназа шифр КФ 1.8.1.4 | E3 | ФАД НАД + | 12 | 12 |
Пируватдегидрогеназный комплекс (PDH)
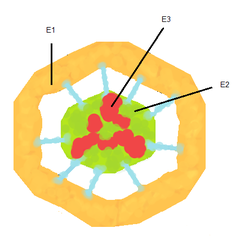
Пируватдегидрогеназный комплекс (PDH) включает 3 фермента: пируватдегидрогеназу [en] (Е1), дигидролипоилтрансацетилазу (Е2) и дигидролипоилдегидрогеназу [en] (Е3). Каждый из этих ферментов присутствует в комплексе во множестве копий. Количество копий каждого фермента, а следовательно, и размер комплекса варьирует среди различных видов. Комплекс PDH млекопитающих достигает около 50 нм в диаметре, что более чем в 5 раз превышает диаметр целой рибосомы; эти комплексы достаточно велики, чтобы быть различимыми в электронный микроскоп. В PDH коровы и грамположительной бактерии Bacillus stearothermophilus [en] [4] входят 60 идентичных копий Е2, которые формируют пентагональный додекаэдр ( коровая часть [en] комплекса) диаметром около 25 нм. В кубический [5] кор PDH у грамотрицательной бактерии Escherichia coli входит 24 копии Е2. К Е2 присоединяется простетическая группа липоат, которая связывается амидной связью к ε-аминогруппе остатка лизина, входящего в состав Е2. Е2 состоит из трёх функционально различных доменов: аминотерминального липоильного домена, содержащего остаток лизина, связывающийся с липоатом; центрального Е1— и Е3—связывающего домена; внутреннего корового ацилтрансферазного домена, содержащего активные центры ацилтрансферазы. У дрожжей в PDH имеется единственный липоильный домен, у млекопитающих — два, а у E. coli — три. Домены Е2 разделяются линкерными последовательностями аминокислот, состоящими из 20—30 аминокислотных остатков, причём в них остатки аланина и пролина перемежаются с заряженными аминокислотыми остатками. Такие линкеры обычно принимают протяжённую форму, тем самым отделяя друг от друга три домена [6] .
С активным центром Е1 связывается ТРР, а с активным центром Е3 — FAD. У человека фермент Е1 представляет собой тетрамер, состоящий из 4 субъединиц: двух Е1α и двух Е1β [7] . Также в состав комплекса PDH входят два регуляторных белка — протеинкиназа и фосфопротеинфосфатаза. Такая основная структура из Е1-Е2-Е3 оставалась консервативной в ходе эволюции. Комплексы такого устройства принимают участие и в других реакциях, например, окислении α-кетоглутарата в ходе цикла Кребса и окислении α-кетокислот, образующихся при катаболической утилизации разветвлённых аминокислот: валина, изолейцина, лейцина. У изученных видов Е3 PDH идентичен Е3 двух вышеупомянутых комплексов. Примечательное сходство структур белков, кофакторов и механизмов реакций, осуществляемых этими комплексами, свидетельствует об общности их происхождения [1] . При прикреплении липоата к лизину Е2 образуется длинная, гибкая «рука», которая может перемещаться с активного центра Е1 в активные центры Е2 и Е3, то есть на расстояния предположительно 5 нм и более [8] .
Установлено, что у эукариот в состав пируватдегидрогеназного комплекса также входит 12 субъединиц некаталитического E3-связывающего белка [en] (E3BP). Точное его расположение неизвестно, однако криоэлектронная микроскопия показала, что он связывается с каждой из граней кора PDH дрожжей. Было высказано предположение, что этот белок заменил собой несколько субъединиц E2 в PDH коровы [9] .
Пируватдегидрогеназный комплекс имеется и у некоторых анаэробных бактерий, например, Zymonomonas mobilis. У этой бактерии до 98 % пирувата участвует в спиртовом брожении, и лишь малая его часть окисляется до ацетил-СоА, СО2 и NADH. PDH Z. mobilis состоит из 4 ферментов: E1α массой 38,6 кДа, Е1β массой 49,8 кДа, Е2 массой 48 кДа и Е3 массой 50 кДа. Уникальной особенностью PDH этой бактерии является наличие в субъединице Е1β липоильного домена. Так же, как и у коровы, кор комплекса представлен субъединицей Е2, а сам комплекс организован в виде пентагонального додекаэдра. Гены, кодирующие субъединицы PDH этой бактерии, собраны в два различных кластера. Поскольку у Z. mobilis отсутствует ряд ферментов цикла трикарбоновых кислот, то PDH у этой бактерии выполняет исключительно анаболические функции [10] .
У человека гены, кодирующие ферменты PDH, расположены следующим образом. Ген E1α — PDHA1 — локализован на X-хромосоме. Известно более 30 мутантных аллелей этого гена, приводящих к развитию пируватдегидрогеназной недостаточности [en] — заболеванию, симптомы которого могут варьировать от слабовыраженного лактатацидоза до серьёзных пороков развития [11] . Накопление лактата в этом случае происходит из-за того, что PDH не может превращать пируват в ацетил-СоА, и из-за накопления пирувата лактат не может в него превращаться. Мужчины, чья Х-хромосома несёт мутантную аллель, обычно погибают в раннем возрасте, однако женщины тоже в некоторой степени подвержены этому заболеванию из-за инактивации одной из Х-хромосом. В клетках семенников имеется особая копия E1α — PDHA2, этот ген локализован на хромосоме 4 [12] .
Ген E1β — PDHB — расположен на хромосоме 3. Известно только 2 мутантные аллели этого гена, в гомозиготном состоянии приводящие к смерти в течение первого года жизни из-за пороков развития. Возможно, существуют и другие мутантные аллели, приводящие к смерти ещё до рождения. Ген E2 — DLAT (от англ. dihydrolipoamide s-acetyltransferase ) — локализован на 11-й хромосоме. Известны две аллели этого гена, в гомозиготе приводящие к проблемам, компенсируемым правильной диетой; вполне вероятно, что другие мутантные аллели приводят к смерти на внутриутробном этапе. Ген E3 — DLD — расположен на хромосоме 7. Этот ген имеет множество аллелей, многие из которых приводят к появлению генетических болезней, однако, связанных не с PDH, а с α-кетоглутаратдегидрогеназным комплексом [en] и проявляющихся в нарушении обмена аминокислот [7] [12] .
Источник
Пируватдегидрогеназный комплекс
Пируватдегидрогеназный комплекс (ПДК) молекулярной массой 6*10 6 д., включает в себя три вида ферментов (Е1-Е3) и пять видов коферментов. При этом 2 кофермента (НАД и HS-КоА) находятся в свободном состоянии и входят в состав комплекса только в момент реакции. Общий вид реакции окислительного декарбоксилирования пирувата:
Ферменты пируватдегидрогеназного комплекса
Е1 – пируватдегидрогеназа декарбоксилирующая;
Е2 – дигидролипоилацетилтрансфераза (трансацетилаза);
Коферменты пируватдегидрогеназного комплекса
- Тиаминдифосфат (ТДФ, ТПФ), содержащий витамин В1, кофактор пируватдегидрогеназы.
- Липоевая кислота, кофактор трансацетилазы.
- Кофермент ФАД, содержащий витамин В2, кофактор дегидрогеназы дигидролипоевой кислоты.
- Кофермент НАД, содержащий витамин РР.
- Кофермент НS-КоА, содержащий аденин, рибозу, два остатка фосфорной кислоты, пантотеновую кислоту (витамин В3).
Окислительное декарбоксилирование ПВК протекает в несколько стадий, в процессе которых двухуглеродный фрагмент, образующийся из ПВК, переносится на липоевую кислоту, а затем на HS-КоА.
Витамины, входящие в состав пируватдегидрогеназного комплекса
В состав ПДК входит пять витаминов (РР. В2, липоевая кислота, В1, пантотеновая кислота).
Липоевая кислота
Липоевая кислота — витаминоподобное вещество, представляет собой восьмиуглеродную жирную кислоту с двумя -SH группами. Биологическая роль:является коферментом ПДК, участвует в окислении α — кетокислот.
Пантотеновая кислота, витамин В3
Пантотеновая кислота является витамином, который, в свою очередь, включает β — аланин и производное масляной кислоты. Она распространена в животных и растительных продуктах. Суточная потребность в пантотеновой кислоте составляет до 10 мг. Биологическая роль: входит в состав НS- КоА и участвует в окислительном декарбоксилировании α — кетокислот, участвует в активации жирных кислот. Авитаминоз проявляется дерматитом, депигментацией волос, поражением нервной системы.
Витамин В1, тиамин, антиневритный витамин
Витамин В1 включает в свой состав пиримидиновое кольцо, содержит аминогруппу. Суточная потребность в нём составляет 2 мг. Тиамин содержится в злаках, дрожжах. Биологическая роль: входит в состав кофермента ТДФ и участвует в окислительном декарбоксилировании α — кетокислот, а также является коферментом транскетолазной реакции в пентозофосфатном пути окисления глюкозы. Авитаминоз проявляется полиневритами (болезнь бери-бери).
Регуляция пируватдегидрогеназного комплекса осуществляется путём фосфолирирования — дефосфолирирования пируватдегидрогеназы
Активаторами ПДК служат АДФ и НАД окисленный. Ингибиторами этого комплекса являются АТФ и НАДН2..
5.1.2. Биологическая роль окислительного декарбоксилирования пирувата Биологическое значение процесса окислительного декарбоксилирования пировиноградной кислоты заключается в том, что оно является важным этапом катаболизма, позволяющим включаться в цикл Кребса тем веществам, при распаде которых образуется ПВК. Образовавшаяся молекула НАДН2 окисляется в длинной дыхательной цепи с образованием 3-х молекул АТФ. Окислительное декарбоксилирование пирувата протекает внутри митохондрий.
Дата добавления: 2016-09-26 ; просмотров: 9025 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Источник