ГИДРОФОБНОСТЬ
ГИДРОФОБНОСТЬ (греч. hydor вода + phobos страх, боязнь) — свойство веществ (тел), внешнее проявление к-рого заключается в отсутствии у вещества способности растворяться в воде или смачиваться водой. Г., противоположна гидрофильности — молекулярному сродству твердых или жидких тел к воде (см. Гидрофильностъ). Г. играет значительную роль при образовании мицелл в р-рах полуколлоидов (см. Коллоиды), в процессах солюбилизации (см.), в образовании и проницаемости биологических мембран.
Вещества, обладающие Г., называют гидрофобными (напр., коллоидные частицы металлов, серы, графита и др.). Примерами гидрофобных твердых тел являются парафин, нафталин, жиры, воски и другие органические вещества, в молекулах которых преобладают гидрофобные (углеводородные) группы.
Г. представляет собой частный случай лиофобности — свойства веществ (тел), внешнее проявление к-рого заключается в малой степени молекулярного взаимодействия или в полном отсутствии такого взаимодействия веществ или тел с жидкостями, в контакте с к-рыми они находятся (в том числе и с водой).
Гидрофобные твердые тела хорошо смачиваются неполярными жидкостями (бензолом, маслами и т. п.) и поэтому часто называются олеофильными. Гидрофобные поверхности можно гидрофилизировать обработкой их р-рами поверхностноактивных веществ, молекулы которых, адсорбируясь на поверхности твердого тела, ориентируются своими полярными группами в водную фазу, вследствие чего эта поверхность приобретает гидрофильные свойства.
Библиография: Воюцкий С. С. Курс коллоидной химии, с. 160 и др., М., 1975; Думанский А. В. Лиофильность дисперсных систем, Киев, 1960.
Источник
Витамины гидрофобные или гидрофильные
(1) ГБОУ ВПО «Ивановская государственная медицинская академия» МЗ РФ, Иваново; (2) Российский сотрудничающий центр Института микроэлементов ЮНЕСКО, Москва; (3) ФГБУН «Вычислительный центр им. А.А. Дородницына» РАН, Москва
Введение
Витамин D – жирорастворимый витамин-гормон, влияющий на широкий спектр физиологических процессов, включая формирование структуры кости, иммуномодуляцию, развитие нервной системы, регуляцию сосудистого тонуса и артериального давления. Достаточная обеспеченность витамином D характеризуется противоопухолевым, нейропротекторным и нейротрофическим эффектами [1].
Для осуществления своих разносторонних биологических эффектов жирорастворимый витамин D должен эффективно всосаться из тонкого кишечника, поступить в кровь. Обогащенная биологически активными формами витамина D кровь доставляет витамин ко всем тканям организма, в которых расположены рецепторы витамина D (VDR – vitamin D receptor).
Всасывание и биодоступность
Скорость кишечного всасывания витамина D наиболее высока в проксимальных и средних сегментах тонкой кишки [2]. При этом, как и в случае других жирорастворимых витаминов [3], всасывание витамина D существенно зависит от присутствия других нутриентов [4].
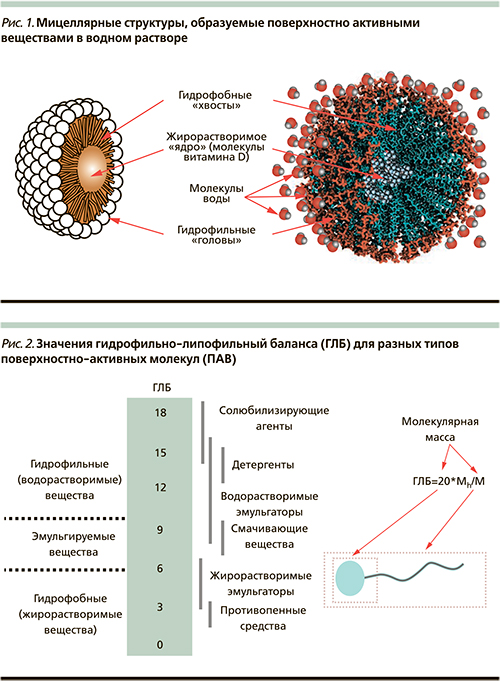
Фармакологические и физико-химические исследования показали, что кишечная абсорбция витамина D наиболее полно происходит из растворов т.н. мицелл [5]. В физической химии мицеллы (от лат. mica – крупинка) – коллоидные наночастицы, образующие мелкодисперсную взвесь в большом объеме растворителя. В случае биологических систем такими растворителями являются водные растворы, образующие внутреннюю среду организма.
Мицеллы – наночастицы (10… 1000 нм в диаметре) с «жировой начинкой» (содержащей витамин D) и гидрофильной оболочкой, которая позволяет наночастицам равномерно распределяться по всему объему водного раствора. Именно за счет образования мицелл и происходит «солюбилизация» витамина D (т.е. переход в водорастворимую форму) [6]. В настоящей работе рассмотрены результаты фармакологических исследований витамина D, указавшие на принципиальное значение мицеллообразования для полноценного всасывания витамина D.
Фундаментальные физико-химические принципы образования мицелл в водных растворах
В водной среде мицеллы образуются особыми амфифильными молекулами (поверхностно активными веществами – ПАВ, или эмульгаторами), т.е. молекулами, имеющими гидрофобный «хвост» (выталкиваемый из водного раствора вследствие сил поверхностного натяжения) и гидрофильную «голову» (наоборот, обладающую повышенным сродством к водному раствору). Такими молекулами являются, например, липиды. Поскольку гидрофобные хвосты амфифильных молекул выталкиваются из водного раствора, энергетически выгодной является такая конфигурация, в которой гидрофобные концы «скрыты» от растворителя, а гидрофильные концы молекул, наоборот, максимально взаимодействуют с молекулами воды.
Мицеллообразование имеет большое значение для усвоения организмом жирорастворимых витаминов и сложных липидов. Соли желчных кислот, образуемые в печени и поступающие из желчного пузыря, стимулируют мицеллообразование жирных кислот (ЖК). Именно за счет этих мицелл и осуществляется всасывание сложных липидов (например, лецитина) и жирорастворимых витаминов (А, D, Е и К) в тонком кишечнике.
Мицелла является энергетически выгодной конфигурацией амфифильных молекул (рис. 1). При образовании мицеллы несколько десятков или сотен амфифильных молекул объединяются так, что гидрофобные концы образуют ядро (внутреннюю область), а гидрофильные группы – поверхностный слой мицеллы, окруженный стабилизирующей оболочкой молекул растворителя и адсорбированных из водного раствора ионов.
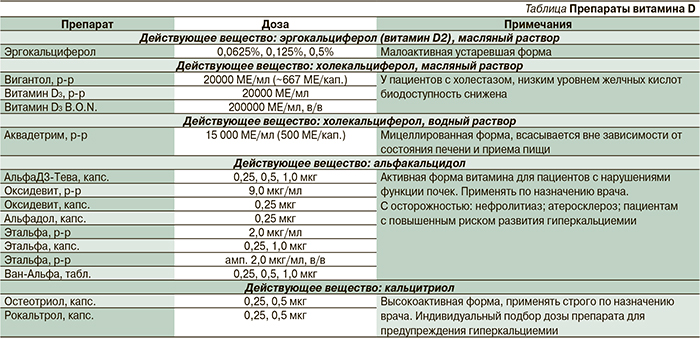
Мицеллы, как правило, имеют сферическую форму, хотя возможно образование эллипсоидов или цилиндров. Форма и размер мицеллы зависят от молекулярной структуры амфифильных молекул ПАВ (в частности, их гидрофильно-липофильного баланса, см. ниже) и таких условий образования раствора, как концентрация ПАВ, температура, рН и ионная сила («соленость»). Мицеллы образуются, только когда концентрация поверхностно-активного вещества больше, чем критическая концентрация мицеллообразования (ККМ), а температура системы превышает критическую температуру мицеллообразования (КТМ, или температура Крафта) [7, 8].
Важнейшим параметром любого ПАВ является гидрофильно-липофильный баланс (ГЛБ), который вычисляется как ГЛБ=20хMh/M, где Mh – молекулярная масса гидрофильной части («головы») молекулы, а M – молекулярная масса всей молекулы. Значение ГЛБ=0 соответствует полностью липофильной (гидрофобной) молекуле (например, бензол, бутан и др.), а значение 20 соответствует полностью гидрофильной (липофобной) молекуле (сама молекула воды, муравьиная кислота и др.) (рис. 2).
Зависимость параметров образуемых мицелл от молекулярной структуры инкапсулируемого в мицелле вещества может быть наглядно проиллюстрирована на примере включения витамина Е (токоферол), витамина D (холекальциферол) и экстракта масла лимона в мицеллы на основе одного и того же ПАВ (Tween-20, 1%-ный раствор) с относительно коротким гидрофобным хвостом (цепь из 11 атомов углерода, около 1,1… 1,3 нм) и очень большой гидрофильной головкой (включает 25 атомов кислорода). Вследствие короткого хвоста даже такие сравнительно небольшие молекулы, как витамины E и D, будут оказывать существенное воздействие на мицеллобразование в данной системе (рис. 3) [9].
Так, молекулы токоферола характеризуются вытянутой формой (гидрофобный «хвост» из 13 атомов, гидрофобная головка бензодигидропиранового ядра), поэтому токоферолы встраиваются, не нарушая структуры ядра.
В результате мицеллы получаются «одна к одной», т.е. имеют небольшой разброс в размерах.
Более «массивная» молекула витамина D (стероидное ядро с разветвленной цепью) вносит дополнительные искажения в процесс мицеллообразования, так что получающиеся мицеллы характеризуются гораздо большей неоднородностью размеров – пик уширяется.
В случае лимонного масла, которое является смесью различных молекул (средняя молекулярная масса порядка 1000 Да), эти компоненты смеси, очевидно, группируются по размерам и образуются мицеллы двух существенно различных размеров (два сравнительно больших пика на рис. 3).
Желчные кислоты, мицеллообразование и биоусвояемость витамина D
Оценка эффективности всасывания различных форм витамина D в эксперименте (моделирование фистул желудочно-кишечного тракта у крыс) указала на различные пути всасывания витамина D3 (1,25-дигидроксивитамина D3, 25-гидроксивитамина D3, холекальциферола) из мицеллярных растворов. При помещении мицеллярных растворов (содержащих 50 нмоль витамина D3 с радиоактивной меткой) в сегменты тощей кишки гидроксилированные формы витамина поступали в первую очередь в венозный кровоток. Средняя скорость венозного транспорта 1,25-(OH)2-D3 составила 1830 нмоль/мин/г, а 25-(OH)-D3 – ниже 900 нмоль/мин/г, а холекальциферола – всего 13 нмоль/мин/г. 25-гидроксилирование холекальциферола и 1-гидроксилирование всосавшегося 25-(OH)-D3 стимулировало транспорт через воротную вену. Без использования мицеллярной формы всасывание витамина D резко снижалось [10].
В норме мицеллы, содержащие витамин D, образуются в кишечном транзите под действием природных эмульгаторов – желчных кислот.
В эксперименте дефицит желчных кислот существенно снижал всасывание витамина D в кишечнике. При лигировании брыжеечных желчных протоков всасывание трех основных метаболитов витамина (витамин D3, 25-гидроксивитамин D3 и 1,25-дигидроксивитамина D3) в лимфу заметно снизилось [11]. Добавление таурохолата достоверно повышало всасывание витамина (рис. 4).
Смешанные мицеллы витамина D, образованные с использованием липидов, характеризуются улучшенным всасыванием витамина D в лимфу. Мицеллы для транспорта витамина D изготавливались с использованием ЖК, моноглицеридов и желчных кислот. Количество витамина D, появляющегося в лимфе экспериментальных животных, было значительно выше при интрадуоденальном введении именно смешанных мицелл на основе линолевой или пальмитиновой кислот по сравнению с мицеллами только на основе желчных кислот (таурохолат). Липиды в составе мицелл для переноса витамина D ускоряли процесс транспорта из слизистой оболочки внутрь эпителиоцитов кишечника [12].
Молекулярная структура ЖК и их концентрация модулируют мицеллообразование и всасывание витамина D. Исследование свойств мицелл, образованных различными ЖК, показало, что длинноцепочечные ЖК в концентрациях порядка 500 мкмоль/л снижают всасывание холекальциферола, а омега(Ω)-9 олеиновая кислота и Ω-3 эйкозапентаеновая кислота (ЭПК) значительно повышают всасывание холекальциферола (рис. 5.) [13]. Продуктами-концентраторами олеиновой кислоты являются орехи (фундук, кешью), папайя, треска, оливковое масло; продукты концентраторы ЭПК – сардины, скумбрия, сельдь.
Помимо мицеллообразования важно отметить и то, что влияние ЖК на всасывание витамина D зависит от воздействия кислот на белки липидного транспорта. Иначе говоря, витамин D (в форме провитамина, холекальциферола) всасывается не просто за счет пассивной диффузии, но и посредством таких белков – транспортеров холестерина, как NPC1 (Niemann-Pick type C proteins, осуществляет внутриклеточный транспорт липидов, предотвращает накопление липидов продуктов в эндосомах и лизосомах), SR-BI рецептор (scavenger receptor class B type I, облегчает всасывание сложных эфиров холестерина в печени из липопротеидов высокой плотности), MTTP (microsomal triglyceride transfer protein, микросомальный транспортный белок триглицеридов, играет центральную роль в сборке частиц липопротеидов), ABCA1 (АТФ-связывающий транспортер, регуляторный белок потока холестерина). Действительно, разные ЖК по-разному воздействуют на экспрессию этих белков (рис. 6) и, соответственно, на усвоение витамина D (рис. 5) [13].
С практической точки зрения результаты этого эксперимента позволяют сделать несколько важных выводов. Во-первых, пища с высоким содержанием олеиновой кислоты будет наиболее эффективно повышать всасывание витамина D из мицелл. В то же время высокое содержание пальмитиновой кислоты в пище (маргарин, твердые растительные жиры, свиной и говяжий жиры) будет затруднять усвоение витамина D (в частности, за счет достоверного снижения экспрессии белков – транспортеров холестерина).
Результаты клинических исследований подтвердили важность солюбилизации и мицеллообразования для усвоения витамина D. Всасывание витамина D3 в тощей кишке оценивалось у здоровых добровольцев после стандартизированного для всех участников завтрака (каша, йогурт, напиток). Изучение кривых концентраций витамина D3 в водной фазе в течение 30 минут после приема пищи показало, что более высокое всасывание коррелировало с более высокими уровнями желчных кислот и свободных ЖК (рис. 7). Существование таких корреляций соответствует образованию смешанных мицелл (витамин D3, липиды, желчные кислоты) в водной фазе [14].
В клиническом исследовании было показано, что эмульгатор d-α-токоферол полиэтиленгликоль-1000 сукцинат (ТПГС) усиливает всасывание витамина D при хроническом холестазе у детей. Сравнение эффектов приема 1000 МЕ/кг витамина D и той же дозы витамина D в смеси с ТПГС (25 МЕ/кг) показало, что у пациентов с холестазом прием только витамина D не приводил к достоверному повышению уровней 25-гидроксивитамина в крови (вследствие существенного снижения секреции желчных кислот). В то же время прием витамина D в смеси с ТПГС показал площадь под кривой на +156±33 нг/мл бóльшую по сравнению с витамином D (р
Источник
Ксероз кожи. Часть 2: лечение
Сухость кожи — неизменный симптом различных кожных заболеваний, таких как атопический дерматит, псориаз, экзема и т. д. В настоящее время доказано, что постоянное применение комбинированных увлажняющих и восстанавливающих липидный состав кожи средств явля
Сухость кожи — неизменный симптом различных кожных заболеваний, таких как атопический дерматит, псориаз, экзема и т. д. В настоящее время доказано, что постоянное применение комбинированных увлажняющих и восстанавливающих липидный состав кожи средств является существенным компонентом в терапии многих дерматозов [1]. Восстановить разрушенный эпидермальный барьер становится первоочередной задачей при сухой коже. Чем выше проницаемость кожи для воды, тем глубже проникают в нее поверхностно-активные вещества (ПАВ) моющих средств, микробы и токсины, вызывающие воспалительную реакцию и образование свободных радикалов в коже. Сухость кожи носит циклический характер с возрастной тенденцией к ухудшению состояния, поэтому очень важен рациональный косметический уход, адаптированный к физиологии и строению кожи. Увлажняющие средства снижают субъективное ощущение стянутости, сухости, дискомфорта, повышают эластичность и толерантность кожи, выравнивают микрорельеф и цвет кожи, укрепляют водно-липидную мантию.
Рост числа увлажняющих средств с разными механизмами действия происходит параллельно углублению знаний о физиологии рогового слоя. Изучение эпидермального барьера (в первую очередь липидного матрикса) привело к созданию нового терапевтического направления в дерматологии — «корнеотерапии». «Корнеотерапия» — «лечение рогового слоя» (от лат. corneum — роговой и англ. therapy — лечение). Его предложил известный американский дерматолог Альберт Клигман, которому принадлежит честь открытия роли ретиноидов в лечении угрей. А. Клигман стал пионером в исследованиях физиологии наружного покрова кожи, которые привели к развитию концепции «живого рогового слоя».
Устранить сухость рогового слоя можно различными способами:
1) создание на поверхности кожи окклюзии, препятствующей трансэпидермальной потере влаги (ТЭПВ);
2) применение заместительной терапии;
3) использование эмолентов;
4) создание осмотического увлажнения;
5) восстановление эпидермального барьера;
6) применение гигроскопичных средств;
7) активация синтеза аквапоринов.
Создание на поверхности кожи окклюзии, препятствующей трансэпидермальной потере влаги. Наверное, самый старый метод увлажнения — использование веществ, создающих на поверхности кожи водонепроницаемую пленку, препятствующую испарению. Таким образом достигается эффект компресса (окклюзионной повязки), что восстанавливает и улучшает диффузию жидкости из капилляров дермы в эпидермис. Увлажняющие средства с окклюзионным эффектом применяются главным образом в дерматологии, при лечении заболеваний, сопровождающихся повышенной сухостью кожи и воспалительными процессами, в косметологии после пластических операций, таких как шлифовка кожи, а также для защиты кожи при частом контакте с детергентами. Важно помнить, что данный метод можно использовать при ненарушенных свойствах межклеточных липидов. Этот метод позволяет захватывать и перераспределять влагу по всей толщине эпителия. Хотя, по мнению Кошевенко Ю. Н. (2008), такая окклюзия ведет не только к замедлению восстановления барьерной функции эпидермиса, но и к нарушению секреции ламилярных телец [2].
К увлажнителям окклюзивного типа относят:
1) жирные кислоты (ланолиновая, стеариновая и др.);
2) жирные спирты (ланолиновый, пальмитиновый, каприловый и т. д.);
3) углеводородные масла и воски (вазелин, парафин, минеральные масла, сквален);
4) фосфолипиды;
5) воски растительного и животного происхождения (карнаубский воск, ланолин);
6) твердые растительные масла (какао, ши, кокосовое, макадамии и т. д.).
Традиционно в дерматологии при сухой нежирной коже используются липофильные кремы по типу «вода в масле», такие кремы тяжело смываются и за счет окклюзионного эффекта не дают коже терять влагу, защищают от пересушивания [3].
Вазелин является самым надежным и проверенным окклюзионным покрытием в дерматологии. Он применяется в средствах, предназначенных для увлажнения кожи при псориазе, атопическом дерматите и др., так как он очень хорошо сохраняет влагу в коже. С одной стороны, вазелин создает физическую преграду на пути испаряющейся влаги, с другой стороны, «склеивает» роговые чешуйки, в результате чего уменьшается площадь контакта межклеточных промежутков с воздухом, что тормозит процесс трансэпидермального испарения воды. Гель, содержащий 5% вазелина, снижает ТЭПВ на 98%. Однако увлажнение кожи с помощью вазелина можно расценивать как пассивное, поскольку он лишь помогает сохранить ту влагу, которая уже есть в роговом слое. Иной вариант увлажнения — активный — заключается в том, что в роговой слой вносят гигроскопичные вещества, способные связывать и удерживать воду путем ионных взаимодействий [4].
В косметологии вазелин в настоящее время практически не применяется, так как субъективно некомфортен в использовании: плохо впитывается, блестит, оставляет ощущение липкой пленки. Некоторые косметологи рекомендуют кремы на основе вазелина для защиты кожи в зимний период. Однако, как показали исследования, вазелин создает обманчивое ощущение тепла и тем самым повышает вероятность возникновения обморожения [5, 6].
В увлажняющие средства, предназначенные для зимнего периода, часто включают насыщенные жиры (гусиный, барсучий, медвежий). Косметика, содержащая насыщенные жиры, хорошо смягчает кожу, защищает ее от обморожения и пересушивания, однако постоянно пользоваться ею не рекомендуется [5].
Необходимо добавить, что при низких температурах влага с поверхности кожи испаряется очень быстро, поэтому бытующее мнение о том, что зимой не нужно пользоваться увлажняющими препаратами, не более чем заблуждение. Важно их правильно подобрать. Зимние средства не должны образовывать слишком плотную окклюзивную пленку и нарушать процессы тканевого дыхания. Такие препараты обычно включают масло ши, жожоба, макадамии, которые быстро усваиваются кожей и создают тонкую подвижную пленку, не нарушая естественных процессов. В зимнее время года следует опасаться средств, содержащих гиалуроновую кислоту и мочевину, которые превосходно удерживают влагу, однако на морозе они превращаются в корку, в результате чего повреждаются сосуды кожи.
В последнее время стали популярны силиконовые окклюзионные покрытия (например, диметикон), которые широко используются в пластической хирургии после лазерной шлифовки, дермабразии, других операций. Силиконовая пленка, также как вазелин, сохраняет влагу в коже, предотвращая стресс, вызванный нарушением эпидермального барьера [5, 7–9].
Окклюзионные увлажняющие кремы быстро устраняют сухость кожи, уменьшают воспаление и зуд при кожных заболеваниях, однако они не устраняют причины обезвоживания кожи, способны вызвать местный отек тканей, поэтому подходят не всем. Таким образом, если процесс нормального восстановления барьерных структур рогового слоя нарушен, например, при некоторых кожных заболеваниях, окклюзионные кремы необходимы. Если же есть шанс на восстановление барьера рогового слоя, их необходимо использовать лишь в экстренных случаях. Людям со здоровой кожей они противопоказаны, так как могут нарушать барьерные свойства эпидермиса [2].
Заместительная терапия. Для того чтобы повысить увлажненность рогового слоя, в косметику добавляют те же вещества, которые входят в состав натурального увлажняющего фактора. Это мочевина, аминокислоты (серин, глицин, аланин, пролин), минералы (магний, калий, натрий, кальций), пирроглутамат натрия (Na-РСА), молочная кислота. Проникая в толщу рогового слоя, они локализуются вокруг корнеоцитов и создают своеобразную водную оболочку [10]. Подобное увлажнение имеет отсроченный, но пролонгированный эффект и в наименьшей степени зависти от влажности воздуха. Результат сохраняется до тех пор, пока увлажняющие компоненты не будут удалены вместе с роговыми чешуйками [5, 8, 10].
Мочевина в косметические рецептуры вводится в концентрации порядка 5%. Не рекомендуется использовать в косметике для чувствительной кожи и в детской косметике. Обладает увлажняющим, отшелушивающим и антимикробным действием. Когда человек потеет, часть пота испаряется, а мочевина остается на поверхности кожи, адсорбирует влагу из воздуха и удерживает ее в роговом слое. Она способна разрушать водородные связи белковых цепей, изменяя конфигурацию и агрегатное состояние, способствуя связыванию воды с поверхностью белка. Маленькая молекула мочевины хорошо проникает в кожу, поэтому одновременно может служить проводником других активных ингредиентов, включенных в косметический препарат [5, 6, 9].
Молочная кислота. По данным исследований молочная кислота и ее соли (лактаты) действуют не только как гигроскопичный агент, но и усиливают синтез церамидов кератиноцитами. L-изомер молочной кислоты проявляет наибольшую активность и значительно (до 48%) повышает содержание церамидов в роговом слое. Внедрение молочной кислоты в роговой слой существенно повышает его эластичность, устраняет симптомы ксероза и снижает степень ТЭПВ. Таким образом, молочная кислота оказывает увлажняющее, отшелушивающее, антимикробное действие [5, 6, 8, 10].
Пирроглутамат натрия (Na-PCA) — образуется в клетках в процессе кератинизации из белка филагрина, в косметике используется как увлажняющий ингредиент. Наилучший результат дает введение Na-PCA в липосомы [6, 10].
Аминокислоты. Из аминокислот, входящих в состав NMF, в косметологии применяются серин, лизин, валин, цитрулин. Как правило, в косметические препараты вводят не чистые аминокислоты, а белковые гидролизаты (например, протеины сои, шелка, молока). При нанесении серицина (белка шелка) в виде гидрогеля на поверхности кожи наблюдается глубокое и пролонгированное увлажнение кожи, восстановление аминокислотного компонента NMF, выравнивание микрорельефа кожи [5, 8].
Процедуры с использованием белка шелка заключаются в аппликации и растворении прямо на коже волокон кокона тутового шелкопряда и абсорбции этого гидролизата кожей. Химическое название этих волокон «фиброин» — фибриллярный белок с молекулярной массой 55 000–100 000 дальтон. В естественном состоянии волокна фиброина связаны между собой так называемой «шелковой резиной» (белок серицин). Для того чтобы сохранить волокна фиброина в сухом состоянии, ученые сумели разделить белковые тела друг от друга, чтобы затем при процедуре вновь воссоединить их. Часть пептидов и аминокислот постепенно проникает в роговой слой, удерживая в нем влагу длительное время [6].
Эмоленты. Для придания готовому продукту оптимальных сенсорных характеристик и регулирования окклюзионных свойств в увлажняющие средства добавляют сложноэфирные эмоленты. На основе полиненасыщенных жирных кислот (растительных масел) создаются увлажнители-эмоленты, которые заполняют пространство между отшелушивающимися роговыми клетками, замещают дефекты в роговом слое, образовавшиеся в результате избыточного слущивания корнеоцитов, восполняют недостаток поверхностных липидов. Эмоленты позволяют регулировать степень окклюзии, обеспечивают быстрый и пролонгированный смягчающий эффект. Проведенные исследования на животных свидетельствуют о том, что увлажнители этого типа способны вызывать образование комедонов. Таким образом, применение увлажнителей окклюзионного типа оправдано в тех случаях, когда необходимо экстренно перекрыть трансэпидермальную потерю влаги кожей и поддержать необходимый для нормальной жизнедеятельности клеток уровень увлажненности. Такими свойствами обладают серии препаратов постпилингового ухода за кожей, средства для рук, испытывающие ежедневные атаки ПАВ в составе моющих средств и разрушающих липидный барьер [8, 10, 11].
Осмотическое увлажнение достигается с помощью увеличения концентрации осмотически активных ингредиентов. Как известно, гидробаланс кожи нормализуют минеральные вещества, входящие в состав термальных вод. В настоящее время они применяются в основном в виде аэрозолей. Вапоризированные на роговой слой, они повышают его осмотическое давление. При этом вода из нижележащих слоев поступает в роговой слой и задерживается в нем, приводя в норму концентрацию солей и восстанавливая естественный водный баланс. Вследствие этого содержание воды увеличивается [10].
Восстановление эпидермального барьера. Для восстановления эпидермального барьера применяются липиды как в виде чистых масел, так и в комбинации с другими ингредиентами. Доказано, что местное применение липидов (церамидов, фосфолипидов, триглицеридов) ускоряет восстановление липидного барьера кожи, при этом оптимальное соотношение церамидов, жирных кислот и холестерина составляет 1:1:1–3:1:1. Процесс восстановления эпидермального барьера — это процесс длительный и происходит лишь после того, как клетки эпидермиса получат необходимый строительный материал и произведут достаточное количество церамидов и других эпидермальных липидов, из которых будут построены эпидермальные пласты [6].
В 90?е годы симпатии производителей косметики отвернулись от использования натуральных масел, поскольку в косметическое производство пришли силиконы (в списке ингредиентов их можно различить по окончанию «кон», например, симетикон, циклодиметикон и т. д.), синтетические производные жирных кислот (обычно они имеют сложные названия, такие как изопропилмиристат и др.) и другие достижения косметической химии. С этими веществами появилась возможность создавать косметические средства с точно заданными характеристиками, что весьма непросто с натуральными маслами. Однако позже было установлено, что кожа может извлекать из жиров и масел нужные ей жирные кислоты и использовать их для синтеза собственных эпидермальных липидов, простогландинов и других регуляторов местного иммунитета. Жирные кислоты поступают в кожу, как правило, с натуральными маслами, содержащими незаменимые жирные кислоты (линолевую, линоленовую, арахидоновую, а также их производные — гамма-линоленовую, арахидоновую и некоторые другие). Чаще в косметике используют оливковое, соевое, кукурузное масла или масло черной смородины, огуречника аптечного (бурачника), ослинника, энотеры [6].
Так как эти масла легко окисляются, в них добавляют антиоксиданты — витамин Е, каротиноиды. Полезно использовать масла, которые сами обладают антиоксидантным действием — масло авокадо, ши, семян винограда, зародыша пшеницы, рисовых отрубей. Масла с большим содержанием неомыляемой фракции (льняное, соевое, ши, зародышей пшеницы) дополнительно обладают фитоэстрогенным эффектом и высокими противовоспалительными свойствами.
Но всегда нужно помнить и об обратной стороне космецевтики на основе масел и жиров. Например, триглицериды создают окклюзию и нарушают процессы регенерации, не давая возможности работать натуральному увлажняющему фактору, т. е. получать влагу из воздуха. Минеральные масла тоже становятся причиной окклюзии, кроме прочего, повышают чувствительность кожи к ультрафиолету, что чревато фотосенсибилизацией и гиперпигментацией, поэтому летом не стоит усердствовать с препаратами с высоким содержанием триглицеридов и минеральных масел.
Церамиды в последнее время стали очень популярными ингредиентами в косметике. Популярность церамидов объясняется той ролью, которую они играют в поддержании целостности эпидермального барьера. Благодаря наличию многослойной липидной прослойки между роговыми чешуйками, роговой слой способен эффективно защищать кожу не только от проникновения посторонних веществ извне, но и от обезвоживания.
Для переноса гидрофильных активных веществ в эпидермис часто используются трансдермальные переносчики — комплексы гидрофобных молекул, окружающих активные компоненты. Наиболее популярными трансдермальными носителями являются липосомы — капсулы, построенные из церамидов или фосфолипидов. Стенка липосомы состоит из липидного бислоя, а внутреннее гидрофобное пространство содержит биологически активные вещества.
Липосомальные препараты на основе церамидов обладают хорошим косметическим эффектом, однако они довольно дороги и непросты в производстве из-за низкой растворимости церамидов в воде. В последнее время все большей популярностью пользуются эмульсии на основе насыщенных фосфолипидов (они похожи на церамиды, но имеют два гидрофобных хвоста). Это могут быть липосомы или плоские мембраноподобные структуры (ламеллы). Такие фосфолипиды формируют кристаллические структуры, аналогичные структуре липидных пластов рогового слоя. При попадании на поврежденный роговой слой липосомы или липидные ламеллы встраиваются в участки, лишенные липидов, тем самым временно восстанавливая эпидермальный барьер [2, 6, 10].
Фундаментальные исследования в области цитологии, биохимии и биофизики кожи привели к появлению нового препарата, сохраняющего водный баланс в коже — дерма-мембранная структура (DMS ® ) крема имитирует естественную структуру расположения липидов эпидермиса. DMS имеет ламеллярное строение и неопределяемые размеры частиц в отличие от каплевидных структур традиционных кремов. Именно данная технология используется при создании крема Физиогель, который имеет полный набор липидов, идентичных липидам эпидермиса. Особенностью данного крема, отличающей его от других кремов, является особое вещество — гидрогенизированный фосфатидилхолин (ГФХ). Как известно, природный фосфатидилхолин — ключевой компонент клеточных мембран кератиноцитов. В роговом слое он служит источником для сфингомиелина и церамидов. Гидрогенизированный фосфатидилхолин, входящий в состав Физиогеля, является по сути скелетом, на котором фиксируются липиды крема, создавая естественную самоэмульгирующуюся систему. Такая система обеспечивает крем рядом свойств:
- отсутствует способность образовывать эмульсии в виде «вода в жире» или «жир в воде»;
- формирует ламеллярную структуру DMS (пластинчатые структуры, состоящие из билипидных слоев, удерживающие физиологические липиды);
- способен проникать глубоко в роговой слой эпидермиса;
- усиливает барьерные свойства кожи и фотопротекцию.
Использование «самоэмульгирующихся» систем на основе фосфатидилхолина минимизирует риск раздражения и обосновывает использование для терапии хронических дерматозов. DMS обеспечивает «правильное» проникновение липидов — встраивается в роговой слой, но не проникает глубже.
Научные исследования, проведенные с помощью инструментальных методов исследования (электронные микрофотографии и определение корнеометрии), установили, что к 14?му дню сравнительного тестирования различных кремов Физиогель имеет показатели, не уступающие другим кремам по степени увлажненности кожи. А вот к 28-му дню показатель увлажненности увеличивается в 4 раза и намного опережает другие кремы. Данные исследования доказывают, что крем Физиогель оказывает не пассивное увлажнение, а активное, восстанавливая естественную водосберегающую структуру эпидермиса.
Следует помнить, что процесс восстановления кожи происходит медленно. Поэтому эффект от применения вазелина, эмолентов и увлажняющих средств будет заметнее, чем эффект от применения кремов, содержащих незаменимые жирные кислоты. Так как полиненасыщенные жирные кислоты не могут быть средством экстренной помощи при разрушении барьера, их нужно принимать регулярно, чтобы не допускать возникновения дефицитных состояний.
Увлажнение кожи гигроскопичными средствами. Для нормальной кожи без грубых патологий применяются неокклюзивные увлажняющие средства. Обычно это гели, содержащие гигроскопичные вещества (белки, полисахариды, глюкозаминогликаны).
Глицерин является эффективным увлажнителем в условиях нормальной атмосферной влажности. Глицерин гигроскопичен, но обладает высокой летучестью, что негативно сказывается на продолжительности эффекта увлажнения. Глицерин не обладает способностью проникать глубоко в роговой слой, поэтому его эффект поверхностный. Но он смягчает кожу, снижает температуру замерзания жидкости (препятствует замерзанию крема на лице в морозный день), во влажном воздухе работает как увлажнитель кожи, притягивая влагу из атмосферы. Однако в сухом воздухе оказывает обратный эффект — вытягивает воду из рогового слоя, поэтому при кратковременном контакте с кожей он оказывает увлажняющее действие, но потом, наоборот, усугубляет сухость кожи, вытягивая из нее влагу. Например, сорбитол менее гигроскопичен, чем глицерин, поэтому риск высушивания кожи меньше [4].
Пропиленгликоль используется в качестве растворителя в косметических рецептурах (заменяет воду). Нетоксичен, смягчает кожу, снижает температуру замерзания жидкостей, обладает антимикробным действием. Обладает высокой гигроскопичностью, однако, также как и глицерин, в сухой атмосфере может вытягивать воду из рогового слоя [4].
Гиалуроновая кислота (ГК) — гликозаминогликан, являющийся главным компонентом межклеточного матрикса живых тканей. До недавнего времени о ГК говорили как об основном веществе межклеточного вещества дермы. Однако исследования последних лет свидетельствуют о том, что ГК выполняет важнейшие функции в эпителиальном слое кожи и поступает в эпидермис не из дермы, а синтезируется самими корнеоцитами [12, 13]. При этом происходит синтез молекул с очень большой молекулярной массой — около 2 млн кДа, причем катаболизм ГК происходит также в лизосомах кератиноцитов. Этот природный полисахарид принимает активное участие в пролиферации, дифференцировке и миграции кератиноцитов, поэтому его количество находится под контролем разнообразных регуляторных молекул и поддерживается на уровне 0,1 мг/кг.
ГК является очень популярным ингредиентом средств по уходу за кожей. Косметические препараты с ГК обладают выраженным увлажняющим действием за счет образования тончайшей пленки на поверхности кожи, способствующей снижению ТЭПВ, которая активно всасывает влагу из воздуха. Это способствует увеличению содержания свободной воды в роговом слое, а также создает эффект «дополнительной влажности», который помогает снизить испарение воды с поверхности кожи. Как известно, ГК способна проникать в глубокие слои кожи и транспортировать вещества, связанные с ней или заключенные в ее сетчатую структуру.
Растворимый коллаген за счет своих гигроскопичных свойств образует увлажняющую пленку на коже, таким образом, уменьшает потерю воды через роговой слой.
Хитозан — полисахарид, получаемый из панцирей морских ракообразных. Образует на коже увлажняющую пленку, смягчает кожу и защищает ее от повреждений.
Бета-глюкан — полисахарид, получаемый из клеточной стенки пекарских дрожжей. Образует на коже увлажняющую пленку, защищает кожу от УФ-излучения, обладает иммуностимулирующим действием.
Активация синтеза аквапоринов. Как сказано в первой части статьи, в поддержании нормального уровня гидратации кожи важную роль играют трансмембранные белки аквапорины. В эпидермисе человека присутствует основной аквапорин кожи — аквапорин-3 (AQP-3), расположенный на мембране кератиноцитов.
При кожных патологиях, характеризующихся нарушением барьерной функции и сухости кожи, наблюдается изменение экспрессии аквапоринов. Интересным является факт, что эспрессия AQP-3 снижается прямо пропорционально степени экссудации при экземе, в то же время при атопическом дерматите отмечается его повышенная экспрессия [14–16].
При уменьшении содержания AQP-3 нарушается гидратация эпидермиса и барьерная функция кожи, снижается ее эластичность. Кроме того, доказано, что с возрастом количество AQP-3 в эпидермисе сокращается, что является основной причиной снижения уровня гидратации возрастной кожи. В настоящее время ведется активный поиск соединений, стимулирующий синтез аквапоринов. Модуляция их экспрессии — один из перспективных способов увлажнения кожи [14–16].
В заключение необходимо подчеркнуть, что речь идет не только о вспомогательной терапии космецевтики во время обострения, но и об очень важном вопросе — закреплении ремиссии путем активного восстановления целостности кожи и ее нормальной функции с помощью лечебно-косметических средств. Сегодня в арсенале врача присутствует достаточное количество увлажняющих и смягчающих лечебно-косметических средств, специально созданных для ухода за кожей больных, и умение ориентироваться в них является залогом успеха терапии.
Литература
- Ломакина Е. А. Роль барьерной функции кожи в патогенезе некоторых дерматозов // Современные проблемы дерматовенерологии, иммунологии и врачебной косметологии. 2009, № 2. С. 87–90.
- Кошевенко Ю. Н. Кожа человека. Т. 2. М.: Медицина, 2008. 754 с.
- Люльман Х. Наглядная фармакология. М.: Мир, 2008. 383 с.
- Эрнандес Е. Полигидрокислоты против ихтиоза // Пилинги. 2010, № 1. С. 18–22.
- Тимофеев Г. А. Методы аппаратного исследования кожи человека // Косметика и медицина. 2005; 4: 30–36.
- Марголина А. А., Эрнандес Е. И., Зайкина О. Э. Новая косметология. М., 2002. 208 с.
- Современная наружная терапия дерматозов (с элементами физиотерапии) / Под. ред Н. Г. Короткого. Тверь: «Губернская медицина», 2001. 528 с.
- Пучкова Т. В. Толковый словарь по косметике и парфюмерии. М.: Школа косметических химиков, 2005. 192 с.
- Иванова Л., Подоляк С. Активные увлажняющие компоненты в косметических средствах // Журнал по прикладной эстетике Les Nouvelles Esthetique. 2008, № 3. С. 125–132.
- Эрнандес Е. И. Увлажнение кожи. М.: ООО «Фирма Клавель», ООО «Школа косметических химиков», 2007. 32 с.
- Тимофеев Г. А. Сухость кожи. Функциональная диагностика. Тактика // Косметика и медицина. 2007, № 2. С. 58–62.
- Кошевенко Ю. Н. Кожа человека. Т. 1. М.: Медицина, 2006, 360 с.
- Мядлец О. Д., Адаскевич В. П. Морфофункциональная дерматология. М.: Медлит, 2006. 752 с.
- Ткаченко С., Эрнандес Е. Аквапорины в регуляции водного баланса кожи // Косметика и медицина. 2011, № 2. С. 26–33.
- Cork M. J., Robinson D. A., Vasilopoulos Y. et al. New perspectives on epidermal barrier dysfunction in atopic dermatitis: gene-environment interactions // J Allergy Clin Immunol. 2006; 118 (1): 3–21.
- Wilkinson J. D. The skin as a chemical barrier. In: The Physical Nature of the Skin. Marks R. M., Barton S. P., Edwards C. eds. MPT Press, 1988: 73–78.
Ю. А. Галлямова, доктор медицинских наук, профессор
О. А. Баринова
ГОУ ДПО РМАПО, Москва
Источник