Ферменты — биологические катализаторы
Вопрос 1. Какие вещества называются катализаторами?
Вещества, которые изменяют скорость химической реакции, оставаясь к концу ее неизменными, называются катализаторами.
Вопрос 2. Какую роль играют ферменты в клетке?
Ферменты – это белковые катализаторы, синтезируемые клетками. Они регулируют скорость и специфичность тысяч химических реакций, протекающих в клетке. Ферменты могут действовать в качестве катализатора не только в клетке, где они образовались, но и за её пределами, например, пищеварительные ферменты работают в полости желудочно-кишечного тракта. Многие ферменты просто растворены в цитоплазме. Молекулы одних ферментов состоят только из белков, другие включают белок и соединение небелковой природы (органическое — кофермент или неорганическое — ионы различных металлов). Ферменты строго специфичны: каждый фермент катализирует определенный тип реакций, в которых участвуют определенные виды молекул субстратов.
Вопрос 3. От каких факторов может зависеть скорость ферментативных реакций?
Скорость ферментативных реакций во многом зависит от концентрации фермента, природы вещества, температуры, давления, реакции среды (кислой или щелочной). Так ферменты теряют свою активность при нагревании; большинство ферментов от 50 до 600 С быстро инактивируются. На ферменты влияет кислотность или щёлочность среды, например, пепсин – фермент, выделяющийся слизистой желудка, — замечателен тем, что он активен только в кислой среде и лучше всего работает при рН =2. трипсин, расщепляющий белки и выделяемый поджелудочной железой, проявляет активность только в щелочной среде, при рН около 8,5. Большинство клеточных ферментов имеют оптимум при нейтральной среде. На активность фермента влияет его концентрация, если рН и температура системы постоянны и субстрат имеется в избытке, скорость реакции прямо пропорциональна количеству фермента. При постоянной температуре, рН и концентрации фермента в системе начальная скорость реакции возрастает вплоть до известного предела пропорционально количеству субстрата. Если ферментная система нуждается в каком-либо коферменте или специфическом ионе-активаторе, то концентрация этого вещества или иона может при определённых обстоятельствах определять общую скорость реакции. Некоторые ферменты специфически чувствительны к определённым ядам: цианиду, иодуксусной кислоте, фториду, люизиту и т. д., и даже очень маленькие концентрации этих ядов могут инактивировать ферменты. Одну из ферментативных реакций, участвующих в расщеплении глюкозы, тормозит фторид, а другую – иодуксусная кислота. Один из ферментов системы переноса электронов (цито-хромоксидаза) особенно чувствителен к цианиду, при незначительной концентрации которого фермент инактивируется, и нарушается клеточное дыхание, что приводит к смерти клеток. Оказавшись в ненадлежащем месте, ферменты сами могут действовать как яды. Например, внутриклеточной инъекции 1мг кристаллического трипсина достаточно для того, чтобы убить крысу. Действие различных ядов змей, пчёл и скорпионов обусловлено тем, что эти яды содержат ферменты, разрушающие клетки крови или клетки других тканей и органов.
Вопрос 4. Почему большинство ферментов при высокой температуре теряет каталитические свойства?
Высокая температура среды, как правило, вызывает денатурацию белка, т. е. нарушение его природной структуры. Поэтому при высокой температуре большинство ферментов утрачивает свои каталитические свойства.
Вопрос 5. Почему недостаток витаминов может вызвать нарушения в процессах жизнедеятельности организма?
Многие витамины входят в состав ферментов. Поэтому недостаток в организме витаминов ведет к ослаблению активности ферментов в клетках, а следовательно, может вызвать нарушения в процессах жизнедеятельности.
Источник
Витамины это катализатор химических реакций
Установите соответствие между характеристикой химического вещества и веществом в организме человека.
| ФУНКЦИИ ВЕЩЕСТВ | ХИМИЧЕСКИЕ ВЕЩЕСТВА |
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
| A | Б | В | Г | Д | Е |
Ферменты — это белки, катализирующие химические реакции. Ферменты — глобулярные белки, синтезируемые живыми клетками. В каждой клетке имеются сотни ферментов. Они помогают осуществлять биохимические реакции, действуя как катализаторы. Без них реакции в клетке протекали бы слишком медленно и не могли бы поддерживать жизнь.
Гормоны — это вещества белковой и жировой природы, выделяются только в кровь. Гормоны биологически активные вещества, вырабатываемые эндокринными железами и выделяемые ими непосредственно в кровь. Гормоны влияют на жизнедеятельность органов, для которых они предназначены, изменяя биохимические реакции путем активации или торможения ферментативных процессов.
Витамины — в основном поступают с пищей, входят в состав ферментов и необходимы для нормального обмена веществ. Витамины — сложные органические вещества, содержащиеся в продуктах питания в очень малых количествах. Они не служат источником энергии, но абсолютно необходимы для нормальной жизнедеятельности организма. Недостаточность того или иного витамина приводит к нарушению обмена веществ; данное состояние называется авитаминозом.
Примечание к пункту Г.
Понятно, что все эти биологически активные вещества необходимы для нормальной жизнедеятельности. Но витамины часто представляют собой активные небелковые части ферментов — коферменты, то есть без витаминов и ферменты не будут работать. Без витаминов жизнь невозможна, необходимо постоянное их поступление в организм, в котором они подвергаются быстрому распаду.
Источник
Витамины. Биологические катализаторы
Витамины (от лат. vita – жизнь) – биоорганические соединения, которые обозначают буквами латинского алфавита. Различают жирорастворимые витамины (A, Д, Е, К) и водорастворимые (В, С, РР и др.). Суточная потребность человека в витаминах составляет несколько микрограммов (1 мкг = 10 -6 г), только витамин С нужен в количестве 100 мг в сутки. Недостаток витаминов в организме является причиной заболеваний – авитаминозов.
Витамины участвуют во всех биохимических и физиологических процессах, они являются регуляторами жизнедеятельности, оказывают влияние на рост, развитие, обмен веществ.
Витамины и их роль в организме:
| Витамины | Роль в организме |
| А | При недостатке развивается «куриная слепота»; человек или животное не видят в сумерках. |
| Д | При недостатке развивается рахит, кости содержат недостаточное количество кальция и фосфора, что приводит к искривлению костей. |
| К | При недостатке снижается свертываемость крови. |
| Е | Недостаток приводит к нарушению белкового, углеродного, жирового обмена. |
| С | При недостатке развивается цинга, заболевание сопровождается кровотечением десен, слабостью, головокружением. |
| В | Входит в состав ферментов – катализаторы, ускоряющие химические реакции, и гормонов – биологически активных веществ. При недостатке развиваются поражения нервной системы – расстройства движений, параличи. |
Катализаторы – вещества, изменяющие скорость химических реакций. Ферменты – это биокатализаторы, вещества, которые ускоряют биохимические реакции в десятки и сотни тысяч раз. В живой клетке биохимические реакции протекали бы очень медленно или не проходили бы совсем без участия ферментов. В настоящее время известны тысячи ферментов.
— они специфичны, ускоряют только определенные реакции;
— функционируют при определенных условиях.
Пример: в желудочном соке содержатся ферменты – пепсин, липаза. Пепсин расщепляет сложные белки на простые, этот фермент действует только в кислой среде (в желудке соляная кислота). Липаза расщепляет только эмульгированный жир молока.
Механизм действия ферментов. Молекулы ферментов имеют активный центр – участок, на котором идет реакция. Форма и строение активного центра соответствуют только определенным молекулам (они комплементарны друг другу). На заключительном этапе биохимической реакции комплекс «фермент – вещество» распадается на свободный фермент и конечные продукты данной реакции.
Все процессы в живом организме прямо или косвенно осуществляются с участием ферментов. Например, под их действием составные компоненты пищи (белки, углеводы, липиды и др.) расщепляются до более простых соединений, а из них уже затем синтезируются новые, свойственные данному виду макромолекулы. Поэтому нарушения образования и активности ферментов нередко ведут к возникновению тяжелых болезней.
Скорость ферментативных реакций зависит от многих факторов: природы и концентрации фермента и субстрата, температуры, давления, кислотности среды, наличия ингибиторов и т. д. Например, при температурах, близких к нулю, скорость биохимических реакций замедляется до минимума. Это свойство широко используется в различных отраслях народного хозяйства, особенно в сельском хозяйстве и медицине. В частности, консервация различных органов (почек, сердца, селезенки, печени) перед их пересадкой больному происходит при охлаждении с целью снижения интенсивности биохимических реакций и продления времени жизни органов. Быстрое замораживание пищевых продуктов предотвращает рост и размножение микроорганизмов (бактерий, грибов и др.), а также инактивирует их пищеварительные ферменты, так что они оказываются уже не в состоянии вызвать разложение пищевых продуктов.
Дата добавления: 2017-06-02 ; просмотров: 955 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Источник
Ферменты, витамины, катализаторы
глава 42
глава 44
глава 49
Содержание
Мы часто слышим слово «ФЕРМЕНТ», но все ли точно понимают, что оно означает? Иногда используется синоним — «ЭНЗИМ».
Ферментами могут быть белки, которые, как и любые белки, состоят из более или менее длинной цепочки аминокислотных остатков, и эта цепочка затем еще сворачивается сложным образом, образуя сначала так называемую «вторичную структуру», а затем и «третичную». Нередко несколько белков соединяются в один комплекс, и тогда это называется «четвертичной структурой».
Ферментами могут быть и РНК, о которых мы уже много писали. И наконец, ферментами могут быть комплексы РНК и белков.
Так что же делает ту или иную молекулу ферментом? Точнее — какие именно молекулы мы называем ферментами? Те, которые обладают способностью резко ускорять, то есть «катализировать», химические реакции (поэтому мы можем их называть КАТАЛИЗАТОРАМИ). Причем реакции могут ускоряться в миллионы раз! Например, какой-то фермент может притянуть к себе две разных молекулы и соединить их в одну. Или наоборот — другой фермент может притягивать к себе молекулы и разбивать их на части. А если бы эти молекулы просто плавали и ждали удобного случая, чтобы с ними могло что-то случиться, чтобы они объединились или разбились на части, то наша жизнь бы стала попросту невозможной, ведь биохимические реакции внутри клетки просто перестали бы идти.
Наверное, наиболее известными ферментами являются ВИТАМИНЫ.
Важная особенность ферментов заключается в том, что они, осуществляя свои функции, сами почти не расходуются. Поэтому НЕ НАДО бездумно пичкать себя мультивитаминами в угаре впечатлений от просмотра рекламы. Если витаминов станет слишком много, они начнут тебя отравлять. Витамины в избыточном количестве — это яд! Возможно тебе попадались истории о том, как люди, съевшие печень кита или белого медведя, моржа или тюленя, сильно отравились из-за того, что там очень много витамина А. Это не сказки — так оно и есть. Впрочем, в современных условиях человек, съевший кусочек печени кита, не успеет отравиться витамином А, так как скорее отравится ртутью…
В 1 грамме медвежьей печени содержится 5 наших дневных доз витамина А! Сколько граммов печени съест на обед голодный охотник? Грамм триста, наверное. После такого обеда выжить ему будет трудно.
Характерные симптомы некритического отравления витамином А: через пару часов возникает головная боль, тошнота, рвота, понос, сильные рези в желудке и кишечнике. Температура повышается до 40°С. Возникает жар, одышка, учащенное сердцебиение, светобоязнь, болезненность при движении глазными яблоками. Через двое суток часа кожа начинает сильно шелушиться и сходить пластами… а казалось бы — витаминчики, полезно. Полезно, но в меру. При нормальном образе жизни и питания человек получает достаточное количество витаминов из своей пищи. И лишь в том случае, если питание у человека неполноценное, требуются витаминные добавки.
Снабжение клетки энергией, производство нуклеиновых кислот, белков, углеводов, жиров, снятие копий с ДНК… все эти и очень-очень многие другие внутриклеточные процессы не будут идти без ферментов. Именно поэтому некоторые яды успешны именно потому, что, присоединяясь к ферментам, лишают их ферментативных функций.
Источник
Биологические катализаторы
Урок 10. Введение в общую биологию и экологию 9 класс ФГОС

Конспект урока «Биологические катализаторы»
Начнём с цитаты известного советского химика и инженера, академика Георгия Константиновича Борескова:
«Если бы на Земле вдруг исчезли все катализаторы, наша планета скоро стала бы безжизненной пустыней, омываемой океаном слабой азотной кислоты».
Неуютная картина, не правда ли? Поэтому сегодняшняя наша цель – разобраться, почему же Земля всё-таки выглядит более привычно для нашего глаза.
Из уроков химии вам должно быть известно, что такое катализ. Давайте вспомним. Катализом называется явление ускорения реакции без изменения её общего результата. Термин «катализ» был введён в 1835 году шведским учёным Йёнсом Якобом Берцелиусом.
Для протекания многих химических реакций необходимы специальные условия. Чаще всего на скорость реакций влияют температура и давление. Чем они выше, тем быстрее протекает химическая реакция. Но её скорость можно увеличить, не изменяя внешних условий, а просто добавив к реагирующей смеси определённые вещества. Так, металлический родий почти в 10000 раз ускоряет разложение муравьиной кислоты на углекислый газ и водород. Такие вещества, увеличивающие скорость реакции, но не входящие в состав продуктов реакции, называются катализаторами.
В клетках живых организмов каждую секунду происходят тысячи химических реакций.
И это несмотря на то, что в живой клетке умеренная температура и нормальное давление. Например, бактерии из рода Азотобактер могут при обычных условиях разрывать прочнейшую молекулу азота, где атомы соединены тремя ковалентными связями и присоединять их к водороду. А для того, чтобы проделать то же самое человеку в промышленности, необходимо создать давление в 350 раз большее, чем на поверхности Земли и поднять температуру до 500 градусов Цельсия.
Естественно, бактерии не обходятся при этом без катализаторов. Кстати, люди также пытались применить их при получении аммиака. Перепробовав при этом более 20000 различных веществ.
Что же за всесильные вещества – эти катализаторы?
Катализаторами химических реакций в неживой природе могут быть самые различные вещества. Это и уже упомянутый нами экзотический родий, который используется для изготовления зеркал супермощных лазеров и обычный оксид марганца, применяемый для получения кислорода даже в школьной лаборатории.
Кроме того, неорганические катализаторы могут ускорять реакции с разными веществами. Например, родий не только эффективно разлагает муравьиную кислоту, но и борется с выбросами вредных оксидов азота в автомобильных катализаторах.
Другое дело – биологические, а значит, органические катализаторы. На них мы остановимся более подробно.
Многочисленные исследования прошлого нашей планеты говорят о том, что на начальном этапе зарождения жизни каталитической способностью обладали некоторые молекулы рибонуклеиновых кислот.
И тогда это свойство РНК имело очень важное значение. Сегодня же роль молекул РНК как катализаторов крайне мала. А основными биокатализаторами в клетке являются ферменты. Которых уже к 2013 году было описано более пяти тысяч видов.
Термин фермент (от латинского fermentum – «брожение», «закваска») был предложен в XVII веке химиком ван Гельмонтом при обсуждении механизмов пищеварения.
Абсолютно все процессы в живом организме прямо или косвенно осуществляются с участием ферментов или энзимов, как их ещё называют. Это и фиксация углерода в процессе фотосинтеза, и расщепление питательных веществ в пищеварительном тракте, и синтез источника энергии для всех живых организмов – АТФ, и многое –многое другое.
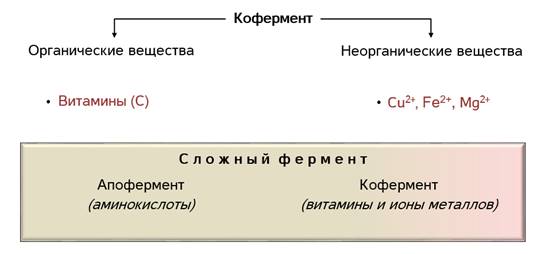
Как вы помните, по химической природе биологические катализаторы относятся к белкам. Они могут быть как простыми, состоящими только из аминокислот, так и сложными, включающими белок и небелковую часть – простетическую группу. Простетическая группа фермента называется кофермент, а белковая часть – апофермент.
В роли коферментов выступают органические и неорганические вещества. Среди органических это могут быть витамины, например, аскорбиновая кислота. А из неорганических – ионы различных металлов. Например, ионы меди, железа, магния.
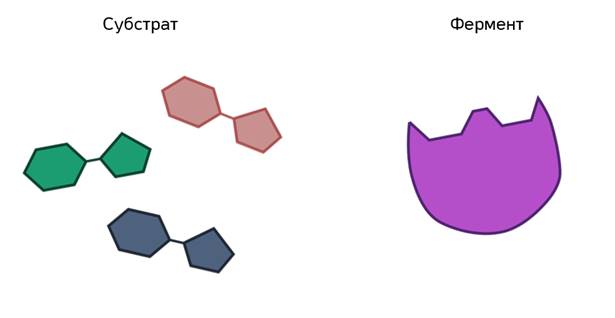
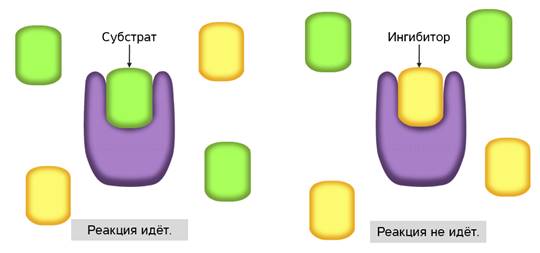
Ферменты ускоряют химические реакции за счёт тесного взаимодействия с молекулами исходных реагирующих веществ – так называемых субстратов. Зачастую размеры молекул субстратов значительно меньше размеров молекул самих ферментов, хотя, казалось бы, должно быть наоборот. Поэтому с субстратом или субстратами, потому что их может быть несколько, взаимодействует не вся молекула фермента, а лишь небольшой её участок – активный центр фермента. Построен он чаще всего из нескольких аминокислотных остатков, которые образуют его уникальную структуру. Почему уникальную? Дело в том, что форма и химическое строение активного центра таковы, что с ним могут связываться только те субстраты, структура которых подходит к структуре активного центра.
Магия этого процесса неизвестна до сих пор. Несмотря на то, что человечество в ближайшее время планирует полёты на Марс, оно не в состоянии разобраться со своим организмом. Но существует теория. Её выдвинул ещё в 1890 году немецкий химик Эмиль Фишер.
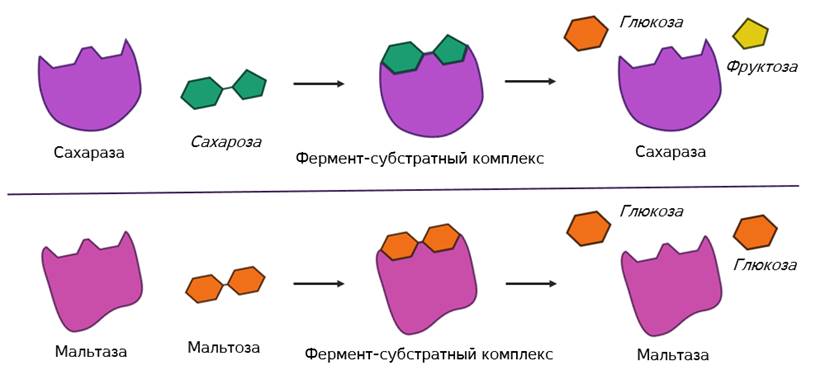
Называется его предположение моделью «ключ-замок». То есть, субстрат по своему строению подходит к активному центру, как ключ к замку с образованием короткоживущего фермент-субстратного комплекса.
В этом комплексе молекула субстрата деформируется и в её структуре ослабляются определённые химические связи. Что приводит к облегчённому их разрыву и в конечном итоге к ускорению химической реакции.
После этого фермент-субстратный комплекс распадается на конечные продукты и свободный фермент, а активный центр последнего тут же готов принимать новые молекулы субстрата. Получаем такой же итог, как и в случае работы обычных химических катализаторов – скорость реакции увеличивается, а сам катализатор при этом не расходуется и может использоваться многократно.
Но в самом механизме работы органических и неорганических катализаторов есть кардинальное отличие. Каждый фермент действует только на определённый тип связи и ускоряет только одну определённую реакцию. То есть обладает специфичностью. Как вы поняли, специфичность объясняется соответствием активного центра только определённым субстратам. Поэтому, например, фермент мальтаза, разлагающий дисахарид мальтозу до двух молекул глюкозы оказывается не способным разрушать молекулы сахарозы. Несмотря на то, что сахароза также является дисахаридом.
Наверное, именно благодаря специфичности, биологические катализаторы работают на несколько порядков быстрее, по сравнению со своими неорганическими коллегами. Они ускоряют химические реакции в миллионы и миллиарды раз! Против ускорения в сотни и тысячи раз для обычных катализаторов. Например, одна молекула каталазы за одну секунду способна расщепить 44000 молекул перекиси водорода. Причём, делает она это при нормальном давлении и умеренной температуре.
Но за высокую скорость работы всегда нужно чем-то расплачиваться. Белковая природа ферментов накладывает на них жёсткие ограничения. Как вы помните, структуры белковых молекул могут существовать только при определённых условиях с минимальными от них отклонениями. А так как модель «ключ-замок» основана именно на соответствии структур субстрата и активного центра фермента, то малейшее нарушение строения биологического катализатора приводит к невозможности его связывания с субстратом. Ферменты могут выполнять свои функции только при определённой температуре, определённом диапазоне рН и других факторов. Например, ферменты слюны амилаза и мальтаза разрушают углеводы пищи в слабощелочной среде, а пепсин желудка расщепляет белки уже в кислой. Если повышение температуры ускоряет скорость протекания реакций с неорганическими катализаторами, то ферментативные реакции при значительном повышении температуры замедляются и прекращаются. Именно поэтому температура нашего тела выше 40 градусов оказывается несовместима с жизнью.
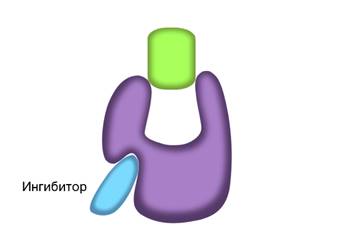
Скорость работы ферментов зависит не только от температуры. Некоторые биологические катализаторы, кроме активного центра, имеют и несколько регуляторных центров. С ними также могут связываться определённые вещества и оказывать влияние на активность фермента. Все их можно разделить на две группы. Активаторы – вещества, повышающие скорость ферментативных реакций. От латинского activus — «активный, деятельный». И ингибиторы – вещества, снижающие или блокирующие активность ферментов. От латинского inhibere — «задерживаю, останавливаю».
Активирующее влияние на скорость ферментативной реакции оказывают разнообразные вещества органической и неорганической природы. Например, в желудке человека соляная кислота активирует фермент пепсин. Максимальная активность которого лежит в пределах рН от полутора до двух.
Ингибирование ферментов может быть обратимым и необратимым. Если вещество-ингибитор вызывает стойкое изменение пространственной структуры фермента, то такое ингибирование будет необратимым.
А вот обратимое ингибирование, в свою очередь, бывает двух типов. Давайте их рассмотрим.
С активным центром фермента могут связываться вещества, сходные по структуре с субстратом. Никакой реакции при этом нет, но между ингибиторами и субстратом происходит конкуренция за активный центр. Поэтому такой тип ингибирования называется конкурентным.
Конкурентное ингибирование широко используется в медицине. Антибиотики, противоопухолевые препараты, используемые в качестве лекарственных средств, являются конкурентными ингибиторами.
В неконкурентном ингибировании не участвуют вещества, сходные с субстратом. При таком типе ингибирования, молекулы ингибиторов присоединяются к регуляторному центру фермента. Это вызывает изменение пространственной структуры активного центра, что препятствует присоединению к нему молекул субстрата. Тем самым снижается скорость ферментативной реакции.
Уникальные способности ферментов уже много лет используются человеком в хозяйственной деятельности. В настоящее время развивается новая отрасль науки – промышленная энзимология. Которая, в свою очередь, является основой биотехнологии.
Мы уже упоминали об использовании ферментов в медицине. Фармацевтическая промышленность научилась производить искусственный аналог гормона надпочечников кортизола – преднизолон. Который используется при лечении ревматоидного артрита.
Широкое применение ферменты-энзимы находят также в пищевой промышленности. Их применяют в производстве сыров, соков, овощных и фруктовых пюре. Не обходится без применения ферментов хлебопечение, производство алкогольных напитков. Для улучшения вкуса, аромата и консистенции их применяют для обработки мяса.
В текстильной и кожевенной промышленности ферменты позволяют значительно увеличить выход овчины, а обработка кожи перед дублением делает её поверхность чистой, гладкой и тонкой.
Перспективным является применение ферментов, разлагающих целлюлозу. В результате этого из древесины, торфа, сельскохозяйственных и городских отходов можно получить ценные биотехнологические продукты: глюкозу, этанол, ацетон и другие. Особую актуальность это имеет в наши дни, когда проблема загрязнения окружающей среды выходит на передний план.
Источник