Железодефицитные состояния у подростков: принципы коррекции
Рассмотрена проблема железодефицитных состояний у подростков, факторы, способствующие их развитию, лабораторные критерии железодефицитных состояний у детей, клиническая картина и подходы к лечению железодефицитных состояний, включая диету и применение пре
The problem of iron-deficiency states in teenagers was considered, as well as factors contributing to their development, laboratory criteria of iron-deficiency states in children, clinical representation and approaches to the treatment of iron-deficiency states including diet and use of iron preparations.
Одним из важных направлений в педиатрии является подростковая медицина, или гебиатрия, — раздел медицины, изучающий процессы полового созревания, взросления, роста и развития организма подростка, а также специфические заболевания, характерные для подросткового периода жизни.
Пубертатный период имеет свои уникальные особенности, обусловленные мощной вегетативной, эндокринной и иммунной перестройкой организма на фоне физиологического ростового скачка, а также нарушениями психосоциальной адаптации. Именно в это время формируются многочисленные транзиторные функциональные расстройства и проявляются ранее скрытые органические дефекты: гипоталамическая дисфункция, с широким спектром клинических проявлений (вегетососудистая дистония, метаболический синдром и пр.), врожденная неполноценность соединительной ткани (висцероптозы, суставная гипермобильность, остеохондроз и пр.), что способствует снижению адаптации к воздействию внешней среды. Следует отметить, что нозологические формы в этот возрастной период имеют существенные отличия. Так, у подростков доминируют заболевания эндокринной, нервной и костно-мышечной систем, тогда как инфекционные и простудные заболевания чаще регистрируются у детей младшего возраста, у взрослых возрастает частота новообразований и болезней системы кровообращения. Для этого возраста характерна полисистемность (полиморбидность) заболеваний. Например, у девушки, считающей себя практически здоровой, при тщательном обследовании диагностируются дисменорея, железодефицитное состояние, нарушение осанки, плоскостопие, нефроптоз, нестабильность шейного отдела позвоночника, хронический тонзиллит, миопия, синдром раздраженного кишечника с запором, дисфункция билиарного тракта, кристаллурия.
Железодефицитное состояние относится к одной из актуальных проблем подросткового возраста. Уменьшение количества железа в организме приводит к нарушению образования гемоглобина и снижению темпов его синтеза, накоплению свободного протопорфирина в эритроцитах, развитию гипохромной анемии и трофических расстройств в органах и тканях.
В настоящее время не вызывает сомнения, что главным фактором, способствующим развитию железодефицитной анемии у подростков, является несоответствие между запасами железа в организме и потребностями в нем.
Дефицит железа в подростковом возрасте значительно чаще наблюдается у девушек, что может быть обусловлено обильными менструациями. Однако в тех случаях, когда потребности в железе намного превышают его поступление, железодефицитная анемия может развиться и у юношей. Наиболее частыми причинами в данном случае являются интенсивный рост подростка, занятия тяжелыми видами спорта, исходный низкий уровень железа на фоне несбалансированного питания, вегетарианства. Следует помнить, что железодефицитная анемия часто наблюдается при таких состояниях, как нервная анорексия, идиопатический гемосидероз легких, синдром Гудпасчера, атрансферринемия, коллагенозы, заболевания желудка и 12-перстной кишки, в том числе ассоциированные с Н. pylori, повторные кишечные инфекции, лямблиоз, глистные инвазии, воспалительные заболевания кишечника, инфекционные заболевания (туберкулез, бруцеллез, микоз и пр.), а также при хронической почечной недостаточности и в процессе диализного лечения [1, 2].
Выделяют прелатентный дефицит железа (опустошаются запасы железа только из депо при сохранении транспортного и гемоглобинового фондов железа), латентный дефицит железа (составляет 70% от всех железодефицитных анемий) и железодефицитная анемия (составляет 30% от всех железодефицитных состояний) (табл.).
Клиническая картина железодефицитной анемии состоит из двух ведущих синдромов: анемического и сидеропенического. Для последнего характерны дистрофические изменения кожи и ее придатков; извращение вкуса и обоняния, мышечные боли (ввиду дефицита миоглобина), мышечная гипотония, изменения нервной регуляции.
Следует отметить, что клинические проявления заболевания в подростковом возрасте отличаются от проявлений у детей раннего возраста. Так, для них более характерны койлонихии, синева склер (через истонченную склеру просвечивает сосудистая оболочка), вкусовые и обонятельные нарушения, дисфагия, диспепсия.
Диагностика железодефицитных состояний основывается на определении представленных выше лабораторных показателей. Основным критерием является содержание ферритина в сыворотке крови [3]. Однако при невозможности определения данного показателя можно ориентироваться на уровень гемоглобина, определение которого доступно в любом медицинском учреждении.
Целесообразно ежегодное определение уровня гемоглобина у девушек, имеющих обильные кровопотери при менструации или иной природы, низкое потребление железа с пищей (пищевые ограничения для снижения веса, вегетарианство и пр.), железодефицитную анемию различной природы в анамнезе. Юноши нуждаются в контроле уровня гемоглобина, если интенсивно занимаются тяжелыми видами спорта (анемия атлетов).
Во всех случаях железодефицитного состояния необходимо установить непосредственную причину его возникновения и по возможности ее ликвидировать (устранить источник кровопотери, провести терапию основного заболевания, осложнившегося сидеропенией). Лечение должно быть комплексным и нацеленным не только на устранение анемии как симптома, но и на ликвидацию дефицита железа и восполнение его запасов в организме.
Необходимо обогатить рацион подростка продуктами — основными источниками железа, при этом имеет значение не только количество железа в конкретном продукте, но и степень его всасывания и возможность усвоения организмом.
Мясо, особенно красное (телятина, говядина, баранина), является лучшим источником гемового железа, из него усваивается 20–25% железа. Железо из курицы и свинины усваиваются в меньшей степени. А в печени и рыбе железо содержится в виде ферритина и гемосидерина, поэтому усваивается еще хуже.
Негемовое железо (овощи, фрукты, орехи) усваивается плохо (1–5%), причем на его усвоение влияет много факторов, которые могут как улучшать, так и ухудшать его всасывание. Так, усиливают всасывание железа: витамин С (особенно много в цитрусовых), соляная кислота (содержится в желудочном соке), фруктоза (фрукты, мед). Ухудшают всасывание железа: препараты, снижающие кислотность желудочного сока (антисекреторные препараты, антациды), кальций (много в молочных продуктах), оксалаты (шпинат, капуста, свекла, орехи, шоколад, чай и пр.), полифенолы (какао, кофе, черный и некоторые виды травяного чая), фитиновая кислота (грецкие орехи, миндаль, бобовые, отруби) [4].
Однако когда анемия уже развилась, ее нельзя вылечить только диетой: железодефицитная анемия лечится препаратами железа. Питание помогает поддерживать нормальный баланс железа в организме после лечения.
К наиболее часто применяемым соединениям железа в педиатрической практике относятся препараты железа трехвалентного гидроксид полимальтозат и соли двухвалентного железа — сульфат, фумарат, хлорид и глюконат. Для улучшения всасывания соли двухвалентного железа комбинируют с органическими кислотами, аминокислотами и другими соединениями. Предпочтение отдается пероральным формам, так как по сравнению с парентеральным введением скорость восстановления уровня гемоглобина почти не отличается, а количество побочных эффектов резко снижено. Прием препаратов железа рекомендуется за 1 час до еды, предпочтительно в вечернее время, так как процесс абсорбции железа увеличивается во второй половине суток.
Терапевтический эффект при пероральном приеме железа появляется постепенно. Первым положительным клиническим признаком является исчезновение или уменьшение мышечной слабости. На 8–12 день от начала лечения повышается содержание ретикулоцитов в периферической крови. Нормализация гемоглобина происходит к 4–5 неделе от начала терапии.
В последние годы в терапии железодефицитных состояний у подростков активно применяют железосодержащие препараты нового поколения на основе полимальтазного комплекса гидроокиси трехвалентного железа — Мальтофер и Мальтофер Фол, который кроме железа содержит фолиевую кислоту, принимающую участие в выработке нуклеиновых кислот, пуринов, аминокислот, стимулирущих эритропоэз.
Результаты применения Мальтофера различными авторами оцениваются положительно [5]. Одной из привлекательных характеристик этого препарата является его низкая токсичность. Препарат хорошо переносится, имеет приятный вкус и форму жевательных таблеток, что, несомненно, повышает приверженность к терапии. При железодефицитной анемии детям и подросткам в возрасте от года до 12 лет Мальтофер назначается в дозе 50–100 мг в сутки, при латентном дефиците и для профилактики дефицита железа — по 25–50 мг в сутки. Детям и подросткам старше 12 лет — по 100–300 мг в сутки, а при латентном дефиците железа и в профилактических целей — по 50–100 мг в сутки. Длительность терапии, как правило, составляет не менее 2 мес, что обусловлено степенью дефицита железа в организме и истощения его запасов, скоростью кроветворения, всасываемостью. В случае клинически выраженного дефицита железа нормализация гемоглобина достигается лишь через 2–3 мес после начала лечения. Для восстановления внутренних резервов железа прием в профилактических дозах должен быть продолжен в течение нескольких месяцев. При продолжающихся кровопотерях необходимо проводить профилактические курсы лечения препаратом железа (по 1 мес 2–4 раза в год).
Литература
- Коровина Н. А., Заплатников А. Л., Захарова И. Н. Железодефицитные анемии у детей (руководство для врачей). М., 1999. С. 64.
- Финогенова Н. А., Чернов В. М., Морщакова Е. Ф. и др. Анемии у детей: диагностика и лечение. М., 2000. С. 9–17.
- Финогенова Н. А., Чернов В. М., Морщакова Е. Ф. и др. Анемии у детей. Диагностика, дифференциальная диагностика, лечение. М., 2004. С. 20–64.
- Городецкий В. В., Годулян О. В. Железодефицитные состояния и железодефицитная анемия: лечение и диагностика (метод. рекомендации). М., 2006. С. 25.
- Соболева М. К. Опыт применения препаратов Мальтофер и Мальтофер Фол при лечении железодефицитной анемии у детей и подростков // Сибирский консилиум. 2003, № 1, с. 79–82.
Т. А. Бокова 1 , кандидат медицинских наук
Г. В. Масликова, кандидат медицинских наук
ГБУЗ МО МОНИКИ им. М. Ф. Владимирского, Москва
Источник
В12-дефицитная анемия — симптомы и лечение
Что такое в12-дефицитная анемия? Причины возникновения, диагностику и методы лечения разберем в статье доктора Слесарчук О. А., гематолога со стажем в 15 лет.
Определение болезни. Причины заболевания
B12-дефицитная анемия (B12ДА) — это заболевание, при котором снижается уровень эритроцитов и гемоглобина из-за недостатка в организме витамина В12.
Синонимы: анемия Аддисона — Бирмера, мегалобластная, пернициозная анемия.
Витамин B12 участвует в образовании всех клеток крови (эритроцитов, лейкоцитов, тромбоцитов), клеток желудочно-кишечного тракта и обеспечивает нормальное функционирование клеток нервной системы. Поэтому при анемии, связанной с дефицитом витамина B12, часто наблюдаются признаки поражения желудочно-кишечного тракта и нервной системы, а в анализе крови снижается уровень тромбоцитов и лейкоцитов [3] .
Распространённость
B12ДА встречается у 1500 человек на 1 миллион населения, как у детей, так и у взрослых. Однако чаще болеют люди старше 60 лет. У женщин заболеваемость выше, чем у мужчин: соотношение 10:7 [1] [2] .
Причины B12-дефицитной анемии
Причинами развития B12ДА являются недостаточное поступление витамина в организм, нарушение его высвобождения из пищи, нарушение всасывания, транспорта, обмена (метаболизма) или повышенное его расходование. Разберём подробнее каждую причину.
1. Недостаточное поступление. Витамин B12 содержится только в продуктах животного происхождения. Если с пищей поступает мало витамина В12 или не поступает совсем, например при вегетарианстве или веганстве, через 2-4 года развивается B12ДА. У грудных детей дефицит может развиться при сниженном содержании B12 в грудном молоке из-за дефицита витамина у матери [1] [2] [3] [4] [8] .
2. Нарушение высвобождения В12 из пищи может быть вызвано следующими причинами:
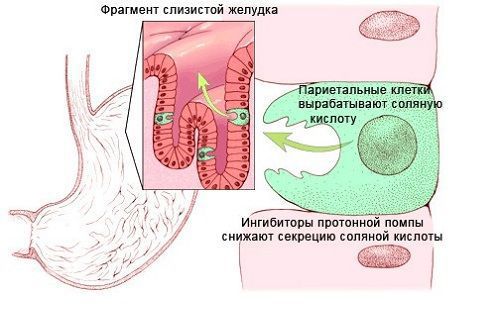
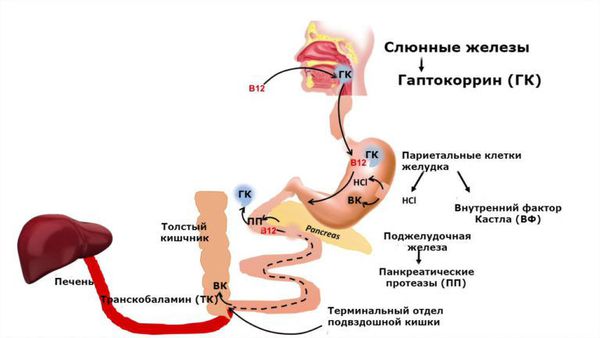
- Утратой или повреждением париетальных клеток желудка. Витамин B12 в пище присутствует в белковой форме. В желудке В12 высвобождается из пищи под воздействием соляной кислоты и ферментов желудочного сока, расщепляющих белок. Соляная кислота вырабатывается париетальными клетками желудка. Причинами нарушения её продукции может быть утрата или повреждение париетальных клеток в результате:
- Хирургического вмешательства на желудке: тотальной или субтотальной резекции, например при раке желудка.
- Атрофического гастрита — хронического воспаления желудка. В том числе аутоиммунного гастрита, при котором иммунная система ошибочно распознаёт париетальные клетки желудка как чужеродные и разрушает их с помощью специфических антител.
- Рака или полипоза желудка, которые повреждают и вытесняют париетальные клетки слизистой оболочки.
- Недостатком ферментов поджелудочной железы. После высвобождения из пищевых белков витамин В 12 связывается с белком слюны гаптокоррином, который защищает витамин от кислой среды желудка. В двенадцатиперстной кишке В12 высвобождается под воздействием ферментов поджелудочной железы. Причинами нехватки ферментов может быть недостаточность поджелудочной железы, хронический панкреатит или синдром Золлингера — Эллисона (опухоль поджелудочной железы) [17] .
3. Нарушение всасывания витамина в тонком кишечнике. Возможные причины:
- Недостаток внутреннего фактора Кастла. После высвобождения витамина из белков слюны В12 связывается с внутренним фактором Кастла — белком, который вырабатывают париетальные клетки желудка. Только благодаря этой связи витамин может всасываться в тонком кишечнике. Причины недостатка внутреннего фактора Кастла:
- Врождённый дефицит внутреннего фактора Кастла — наследственное заболевание, которое характеризуется дефектом гена, ответственного за образование этого фактора.
- Утрата париетальных клеток желудка.
- Врождённые и приобретённые болезни кишечника:
- Синдром Имерслунд — Гресбека — редкое наследственное заболевание, вызванное нарушением работы рецептора сubam в подвздошной кишке. С помощью этого рецептора происходит всасывание витамина В12.
- Целиакия — непереносимость глютена, при которой повреждается слизистая оболочка тонкого кишечника.
- Болезнь Крона — хроническое воспалительное заболевание кишечника.
- Опухоли тонкого кишечника, в том числе лимфомы.
- Резекция участка подвздошной кишки.
- Длительный приём некоторых лекарственных препаратов: ингибиторов протонной помпы, аминосалициловой кислоты, метформина, колхицина, неомицина, бигуанидов, циметидина, оральных контрацептивов и др. [1][2][3][4][6][9][10]
4. Нарушение транспорта. После всасывания в кишечнике витамин B12 поступает в кровь, где связывается с белком-транспортёром транскобаламином II. Он доставляет витамин клеткам-потребителям. Врождённый дефект белка-транспортёра либо появление к нему антител приводит к нарушению транспорта витамина B12 и к его дефициту [11] .
5. Нарушение метаболизма. Проникая из крови в клетки, витамин B12 принимает участие в сложных биохимических процессах, приводящих к синтезу ДНК, делению и созреванию клеток, обмену жирных кислот и гомоцистеина. Врождённые и приобретённые дефекты ферментов, обеспечивающих эти процессы, могут приводить к развитию B12ДА [2] [4] .
6. Повышенное расходование витамина В12. Может быть вызвано [4] :
- Состояниями, связанными с повышенным потреблением: многоплодная беременность [18] , тиреотоксикоз[19] , онкогематологические заболевания (множественная миелома, миелопролиферативные заболевания).
- Конкурентным потреблением витамина: бактериями, например при дивертикулёзе и синдроме «слепой петли»; паразитами — при дифиллоботриозе и власоглаве [3] .
Симптомы В12-дефицитной анемии
При дефиците внутреннего фактора, дефиците транспортного белка, нарушении внутриклеточного метаболизма и некоторых других врождённых состояниях симптомы B12ДА могут появиться у детей в первые месяцы или годы жизни. При недостаточности поступления с пищей или нарушении всасывания симптомы развиваются постепенно, обычно у детей в возрасте старше 7 лет и у взрослых.
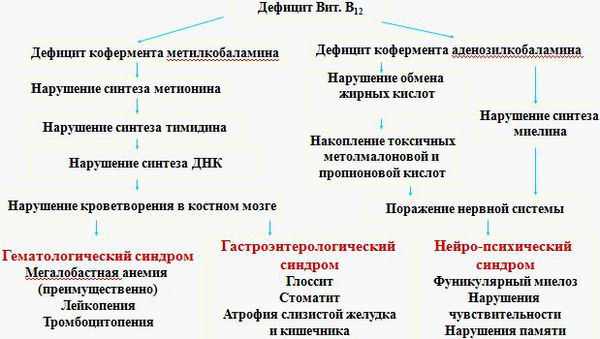
Все проявления B12ДА можно разделить на 3 группы:
- симптомы, связанные со снижением гемоглобина — анемический синдром;
- симптомы поражения желудочно-кишечного тракта — гастроэнтерологический синдром;
- симптомы поражения нервной системы — нейропсихический синдром.
Каждая из этих групп симптомов может присутствовать по отдельности, а может встречаться их сочетание.
Анемический синдром
При B12ДА, как и при любой анемии, наблюдается бледность кожи, иногда с желтушным оттенком. Может беспокоить общая слабость, повышенная утомляемость, сонливость, одышка при незначительной физической нагрузке.
Возможно учащённое сердцебиение, шум в ушах, головокружение, потемнение в глазах, мелькание «мушек» перед глазами. Обращает на себя внимание снижение памяти, работоспособности, успеваемости в школе или ВУЗе. У детей на фоне анемического синдрома возможно нарушение роста и развития.
Симптомы поражения желудочно-кишечного тракта
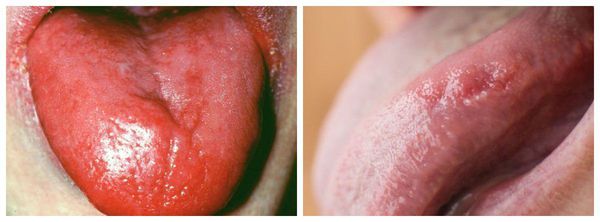
Для больных B12ДА специфичным симптомом является воспаление языка, которое сопровождается неприятными ощущениями и болями. При этом язык ярко-красного цвета, со сглаженными сосочками («лакированный язык», Гунтеровский глоссит), участками воспаления, трещинами и изъязвлениями. Может наблюдаться появление язвочек в углах рта и болей в деснах и губах.
Возможно снижение аппетита и, как следствие, потеря веса, ощущение тяжести в животе, диарея. Иногда незначительно увеличивается печень и селёзенка, что может быть выявлено при пальпации живота врачом либо при УЗИ органов брюшной полости.
Симптомы поражения нервной системы
Поражение нервной системы при B12ДА называется фуникулярным миелозом. Он затрагивает задние и боковые столбы спинного мозга, а также периферические нервы. Чаще встречается у мужчин. Это состояние проявляется онемением, парестезиями (ощущением ползанья мурашек), слабостью в ногах и нарушением походки. Реже наблюдаются подобные жалобы со стороны рук, при этом возникает трудность при выполнении точных движений.
Иногда нарушается слух, обоняние, зрение, возникают психические нарушения от раздражительности до тяжёлой деменции и психоза. Могут возникнуть такие неврологические проявления, как недержание мочи и непроизвольная дефекация. У детей раннего возраста симптомами поражения нервной системы могут быть мышечная слабость, дрожание, непроизвольные сокращения мышц. Возможна задержка психомоторного развития и потеря навыков [1] [2] [3] [4] [6] [7] .
Патогенез В12-дефицитной анемии
Витамин B12 поступает в организм с продуктами животного происхождения: мясные продукты, яйца, сыр, молоко. Из связи с белками пищи витамин высвобождается сначала под воздействием кулинарной обработки, а затем соляной кислоты и ферментов желудочного сока.
В двенадцатиперстной кишке витамин B12 соединяется с внутренним фактором Кастла, который синтезируется париетальными клетками желудка. Благодаря фактору Кастла витамин B12 поступает в клетки слизистой оболочки подвздошной кишки. После этого он связывается с транспортным белком транскобаламином II и переносится кровью клеткам-потребителям, в основном в печень и костный мозг.
В клетке витамин B12 преобразуется в два кофермента: метилкобаламин и аденозилкобаламин . Коферменты — это соединения, необходимые для функционирования ферментов.
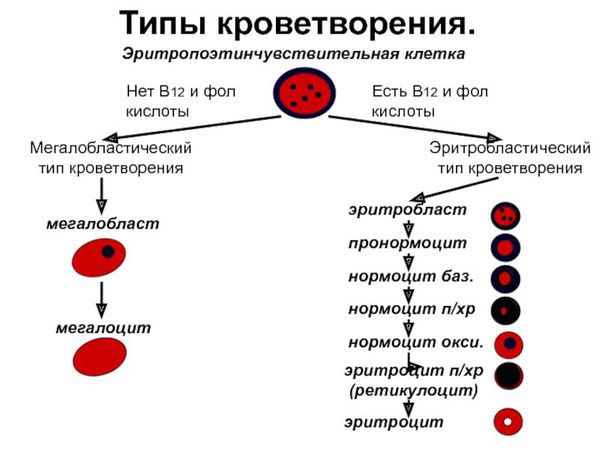
Метилкобаламин является коферментом для фермента метионинсинтазы, который преобразует одну аминокислоту — гомоцистеин в другую — метионин. При сбое этого процесса в организме накапливается гомоцистеин, не образуются пиримидиновые основания, необходимые для формирования ДНК. В результате нарушается синтез ДНК и процессы деления клеток. К этому изменению особенно чувствительны быстроделящиеся клетки — кроветворные клетки костного мозга, из которых образуются клетки крови, а также эпителиальные клетки желудочно-кишечного тракта. Отсюда появление таких изменений в анализе крови, как анемия, лейкопения (снижение количества лейкоцитов), тромбоцитопения (снижение количества тромбоцитов), а также атрофия слизистых оболочек.
Второй кофермент — аденозилкобаламин — принимает участие в обмене жирных кислот, который необходим для метаболизма миелина (вещества, образующего оболочку нервных волокон). Неправильный обмен жирных кислот вследствие недостатка витамина B12 приводит к накоплению токсичных для нервной системы кислот — метилмалоновой и пропионовой. Нарушается синтез миелина в задних и боковых столбах спинного мозга. Как следствие, появляется клиника поражения нервной системы [1] [2] [3] [4] [6] .
Классификация и стадии развития В12-дефицитной анемии
Классификация В12ДА по причинам развития:
- Наследственные (врождённые) формы. Описаны у детей с генетическими аномалиями, которые приводят к нарушению транспорта и метаболизма витамина B12.
- Приобретённые формы:
- первичная форма обусловлена аутоиммунной причиной дефицита витамина B12, то есть наличием антител к париетальным клеткам желудка или к фактору Кастла. Зачастую первичная форма B12ДА осложняет течение таких заболеваний, как аутоиммунный тиреоидит, витилиго или сахарный диабет 1 типа[6] .
- Вторичная форма возникает на фоне строгой веганской диеты [3][7][11] .
Стадии развития B12ДА:
- Начальная — латентный дефицит. Уровень витамина в сыворотке крови снижен, однако число эритроцитов и уровень гемоглобина остаются в норме. Клинических проявлений на данной стадии может не наблюдаться. Лабораторно возможно выявить изменение параметров эритроцитов: увеличение среднего объёма эритроцита (параметр MCV в анализе крови) и среднего содержания гемоглобина в эритроците (параметр MCH).
- Стадия клинических проявлений. Наблюдается при снижении уровня гемоглобина, когда появляются симптомы анемии, и при поражении нервной системы.
Степени тяжести В12ДА:
- Лёгкая — снижение уровня гемоглобина до 90 г/л.
- Средней тяжести — уровень гемоглобина в пределах 90-70 г/л.
- Тяжёлая — уровень гемоглобина ниже 70 г/л.
Осложнения В12-дефицитной анемии
Задержка роста и развития у детей возможна в результате снижения гемоглобина при B12ДА.
Сердечная недостаточность. У пожилых пациентов анемия может ухудшить течение сопутствующей сердечно-сосудистой патологии в виде развития сердечной недостаточности [14] .
Потеря массы тела может стать результатом снижения аппетита и проявлений со стороны желудочно-кишечного тракта.
Присоединение инфекционных осложнений возможно при развитии глубокой лейкопении (низкого уровня лейкоцитов). Снижение тромбоцитов, как правило, незначительное и не приводит к геморрагическим осложнениям.
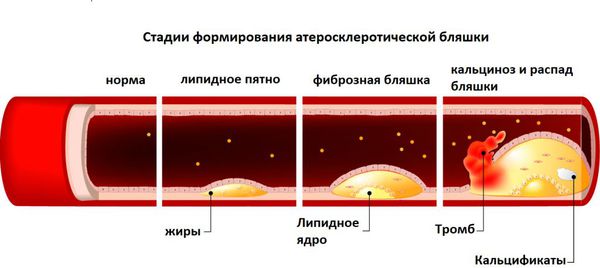
Атеросклероз, тромбоз. Повышение уровня гомоцистеина на фоне дефицита витамина B12 может вызвать атеросклероз и формирование тромбов. Накапливаясь в организме, гомоцистеин повреждает внутреннюю стенку артерий, что приводит к разрывам внутренней оболочки сосудов — эндотелия. В месте повреждения оседает холестерин и кальций — образуется атеросклеротическая бляшка, вследствие чего просвет сосуда сужается, а иногда закупоривается. Это грозит тромбозом или разрывом сосуда [15] [16] .
Также описано такое тяжёлое осложнение B12ДА, так тромботическая микроангиопатия — заболевание, в основе которого лежит поражение мелких сосудов и формирование в их просвете тромбов, что сопровождается воспалением сосудистой стенки. Как следствие, может развиваться ишемия органов и тканей.
Поражение головного и спинного мозга без лечения может привести к спастичности (чрезмерно высокому мышечному тонусу и непроизвольным движениям) и параплегии (полному параличу обеих рук или ног). С началом лечения B12ДА анемический синдром и неврологические проявления быстро купируются. Однако при выраженном дефиците витамина B12 поражение спинного мозга может быть необратимым [1] [6] [17] .
Диагностика В12-дефицитной анемии
Для правильной постановки диагноза B12ДА важен осмотр врача-гематолога. Для уточнения и коррекции проблем, связанных с работой желудочно-кишечного тракта, потребуется консультация гастроэнтеролога. Для оценки неврологических проявлений может быть необходим осмотр врача-невролога.
Осмотр пациента
При осмотре врач может обратить внимание на бледность и лёгкую желтушность кожи, увеличение частоты сердечных сокращений и расширение границ сердца. Необходимо провести осмотр полости рта, особенно языка. Невролог может оценить тонус мышц и наличие патологических рефлексов.
Лабораторная диагностика
Одним из самых важных этапов диагностики является оценка клинического анализа крови. В анализе наблюдается:
- снижение гемоглобина — анемия;
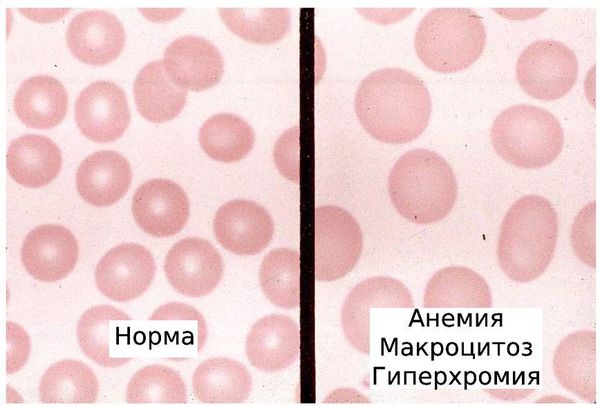
- макроцитоз — наличие в крови большого количества аномально крупных эритроцитов (макроцитов);
- гиперхромия — интенсивное окрашивание эритроцитов, вызванное повышенным количеством гемоглобина в крови;
- может наблюдаться снижение числа лейкоцитов и тромбоцитов.
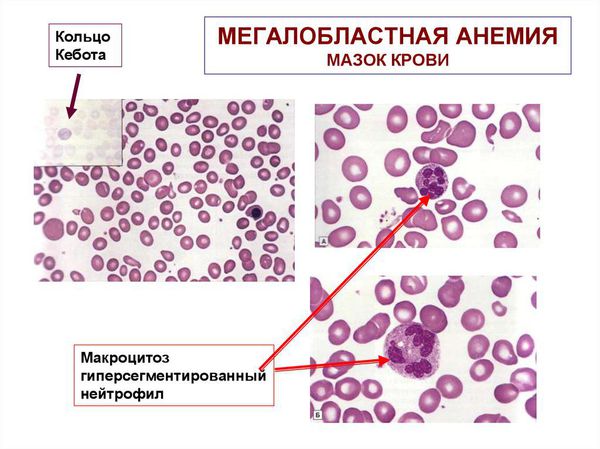
Необходимо выполнение мазка крови , в котором врач-морфолог может увидеть патологические формы эритроцитов:
- овалоциты (эритроциты овальной формы) и дегенеративные формы;
- увеличение разницы эритроцитов по своему размеру (параметр RDW);
- специфические патологические включения, такие как тельца Жолли и кольца Кебота;
- мегалоциты и мегалобласты — в тяжёлых случаях.
Могут встречаться также патологические формы нейтрофилов:
- гигантские нейтрофилы;
- нейтрофилы с гиперсегментацией ядра (5 и более сегментов);
- метамиелоциты — незрелые нейтрофильные лейкоциты.
Количество молодых форм эритроцитов (ретикулоцитов), как правило, снижено. При наличии лабораторной возможности дополнительную полезную информацию могут предоставить ретикулоцитарные индексы: увеличивается средний объём ретикулоцитов и среднее содержание гемоглобина в ретикулоцитах, повышается фракция незрелых ретикулоцитов [1] [2] [4] [5] .
В биохимическом анализе крови:
- снижен уровень витамина B12;
- может быть повышен непрямой билирубин и лактатдегидрогеназа — признак раннего разрушения (гемолиза) эритроцитов в крови и распада предшественников эритроцитов в костном мозге [4] ;
- уровень железа и ферритина в норме.
Обязательно нужно оценить уровень фолиевой кислоты , поскольку изменения в клиническом анализе при дефиците B12 и фолиевой кислоты схожи, а лечение отличается. При подозрении на B12ДА, но при нормальном уровне витамина B12 и фолиевой кислоты, рекомендовано определение голотранскобаламина сыворотки (активного витамина B12). В случае дефицита B12 его содержание снижено. Может быть выявлено повышение уровня гомоцистеина и метилмалоновой кислоты в сыворотке крови [2] [3] .
В общем анализе мочи может наблюдаться стойкая протеинурия — появление белка в моче. В ряде случаев отмечается повышение уровня метилмалоновой кислоты и гомоцистеина.
Дополнительные лабораторные исследования, которые могут помочь выявить причину дефицита витамина B12:
- исследование антител к внутреннему фактору Кастла (IgG) и париетальным клеткам желудка в сыворотке крови;
- исследование желудочного сока на выявление внутреннего фактора Кастла и антител к этому фактору (IgA, синтезируются париетальными клетками желудка);
- тест Шиллинга — определяет активность внутреннего фактора Кастла и всасывание витамина B12 в кишечнике;
- тесты на мальабсорбцию (нарушение всасывания питательных веществ) [5] .
Возможна пренатальная диагностика генетически обусловленной недостаточности транспортного белка транскобаламина II, поскольку он синтезируется амниоцитами (клетками плодной оболочки).
Инструментальная диагностика
При ультразвуковом исследовании органов брюшной полости можно обнаружить незначительную гепатоспленомегалию — увеличение печени и селезёнки.
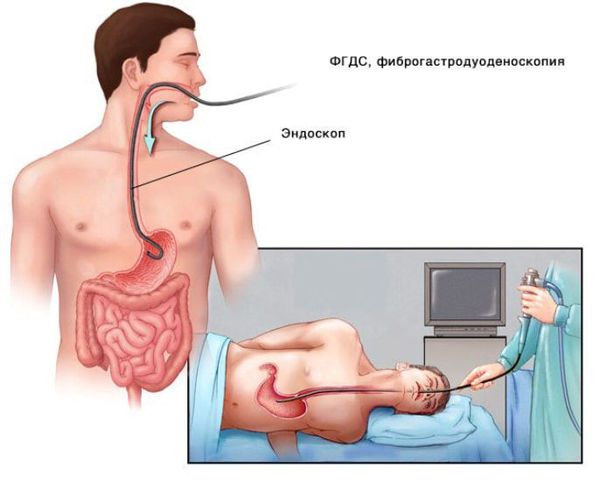
Для выявления заболеваний желудочно-кишечного тракта, которые могут нарушать всасывание витамина B12, всем пациентам с впервые выявленной B12ДА показано выполнение эндоскопических исследований — фиброгастродуоденоскопии (ФГДС) и колоноскопии. При ФГДС может быть выявлен хронический атрофический гастрит, дуоденит, может наблюдаться уменьшение желудочной секреции. При наличии патологических изменений обязательно выполнение биопсии слизистой желудка с дальнейшим гистологическим исследованием [3] [4] .
Дифференциальная диагностика
Дифференциальный диагноз при В12-дефицитной анемии, особенно со снижением лейкоцитов и тромбоцитов, проводится с такими заболеваниями системы крови:
- Миелодиспластический синдром — группа гематологических заболеваний, при которых костный мозг не производит достаточного количества одного или более типов клеток крови: тромбоцитов, лейкоцитов, эритроцитов.
- Апластическая анемия — это анемия, возникающая вследствие недостаточной продукции эритроцитов из-за уменьшения количества кроветворных стволовых клеток.
Для уточнения диагноза может потребоваться выполнение пункции костного мозга и его морфологическое исследование. При наличии B12ДА специалист морфолог описывает в костном мозге характерные изменения стволовых клеток-предшественников:
- гиперплазию (разрастание) эритроидного ростка — стволовых клеток-предшественников, из которых образуются эритроциты;
- мегалобластный тип кроветворения, при котором образуются крупные клетки с зернистыми ядрами, патологические митозы, тельца Жолли;
- нарушение созревания клеток миелоидного ряда и предшественников тромбоцитов: гигантские метамиелоциты, гиперсегментация нейтрофилов, многоядерные мегакариоциты [1][2][3][4] .
Лечение В12-дефицитной анемии
При анемии, которая связана с недостаточностью поступления витамина с пищей, лечение предполагает коррекцию диеты в комбинации с внутримышечным введением витамина B12. Диета с достаточным содержанием витамина B12 предполагает употребление продуктов животного происхождения. Овощи, фрукты, хлеб не содержат витамин B12.
При других причинах коррекция диеты будет неэффективна. Во всех случаях лечение подразумевает введение препарата витамина В12 по стандартным схемам. Дозы препарата могут отличаться в зависимости от возраста больного и от наличия неврологических симптомов.
Лечение обычно проводится в амбулаторных условиях. Показанием для госпитализации в стационар может послужить тяжёлая анемия (уровень гемоглобина менее 70 г/л) и пожилой возраст.
При подозрении на B12ДА без лабораторного её подтверждения категорически не рекомендуется начинать лечение витамином B12 либо поливитаминными комплексами, поскольку введение B12 приводит к быстрому исчезновению морфологических аномалий клеток, что в свою очередь затруднит постановку правильного диагноза. Ошибочное использование фолиевой кислоты при дефиците B12 может привести к усугублению неврологических симптомов. Поэтому очень важно начинать терапию только после лабораторного подтверждения диагноза.
Первый этап терапии — насыщение. Он длится 4-6 недель и предполагает внутримышечное введение препарата цианокобаламин в лечебной дозе. В некоторых случаях может быть эффективно использование сублингвальных форм витамина B12. Признаки улучшения состояния наблюдаются после первых 3-5 инъекций препарата.
Первым лабораторным признаком эффективности терапии является ретикулярный криз — повышение уровня ретикулоцитов в крови в 2-3 раза по сравнению с исходным на 4-7 день от начала терапии. Нормализация уровня гемоглобина достигается через 1-2 месяца, периферическая нейропатия купируется медленнее.
На фоне терапии цианокобаламином в связи с активным делением клеток-предшественников в костном мозге возможно присоединение дефицита фолиевой кислоты и железа, поэтому спустя 7-10 дней от начала терапии витамином B12 необходимо дополнительно назначить фолиевую кислоту, а при снижении уровня ферритина — препараты железа.
Второй этап — закрепляющая терапия: витамин B12 вводится в той же дозе, но кратность введения уменьшается.
Третий этап — поддерживающая терапия. Она проводится пожизненно. Переливание эритроцитарной взвеси показано при тяжёлой анемии с признаками гипоксии и недостаточности кровообращения. При развитии нейтропении (снижения количества нейтрофилов) и присоединении инфекционных осложнений может потребоваться проведение антибактериальной терапии [1] [3] [4] [6] .
Прогноз. Профилактика
Независимо от возраста больного, при ранней постановке диагноза, своевременном начале лечения и правильном наблюдении после выздоровления прогноз при B12ДА благоприятный. Ухудшению прогноза могут способствовать сопутствующие сердечно-сосудистые заболевания у пожилых больных, а также поражение нервной системы (фуникулярный миелоз).
Профилактика B12ДА сводится к коррекции рациона питания. При невозможности ликвидировать причину заболевания (например, при удалении части желудка или при недостаточности внутреннего фактора Кастла) профилактика сводится к регулярному пожизненному введению препарата витамина B12. Анализ крови необходимо контролировать 1 раз в 3-4 месяца. Больным с атрофическим гастритом рекомендовано ежегодное выполнение ФГДС, поскольку у них повышен риск новообразований желудка [3] [6] .
Источник
_575.gif)