Порядок выполнения работы.
В стакан или колбочку отмеривают 10 мл мочи и 10 мл дистиллированной воды, перемешивают, подкисляют 20 каплями 10% раствора хлористоводородной кислоты и титруют 0,001 н. раствором 2,6-дихлорфенолиндофенола до розовой окраски, на этом основан принцип метода реакции. Расчет содержания аскорбиновой кислоты в моче проводят по формуле:
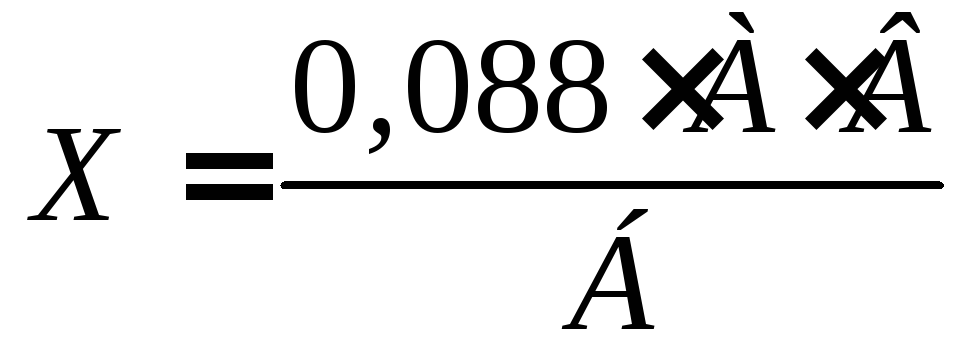
где Х – содержание аскорбиновой кислоты, мг/сут; 0,088 – содержание аскорбиновой кислоты, мг; А – результат титрования 0,001 н. раствором 2,6-дихлорфенолиндофенола, мл; Б – объем мочи, взятый для титрования, мл; В – среднее суточное количество мочи (для мужчин – 1500 мл, для женщин – 1200 мл).
Вывод: записать результаты опыта и расчётных данных.
Опыт 2. Количественное определение витамина Р в чае.
Известно несколько соединений, оказывающих Р-витаминное действие (рутин и др.). В основе их лежит скелет флавона.
Наиболее изучены строение и свойства рутина:
Действие витамина Р и витамина С взаимосвязано, они участвуют в окислительно-восстановительных процессах. Терапевтическое действие витамина С более эффективно в присутствии витамина Р. При недостатке в организме витамина Р у человека повышается проницаемость капилляров.
Рутин – кристаллическое вещество желто-оранжевой окраски. Содержится в тех же продуктах, что и витамин С: в чае, фруктах и ягодах – бруснике, клюкве н др. Количественное определение витамина Р проводят в вытяжке из чая.
Принцип метода. Рутин способен окисляться перманганатом калия; в качестве индикатора применяется индигокармин, который вступает в реакцию с перманганатом калия после того, как окислится весь рутин. Экспериментально установлено, что 1 мл 0,1 н. раствора перманганата калия окисляет 6,4 мкг рутина.
Порядок выполнения работы.
К 100 мг чая приливают 50 мл горячей дистиллированной воды и проводят экстракцию в течение 5 мин. 10 мл экстракта чая отмеривают в стаканчик или колбочку, добавляют 10 мл дистиллированной воды и 5 капель индигокармина (появляется синее окрашивание). Титруют из микробюретки 0,05 н. раствором КМпО4 до появления устойчивой желтой окраски.
Определяют процентное содержание рутина в чае. Расчет производят по следующей формуле:
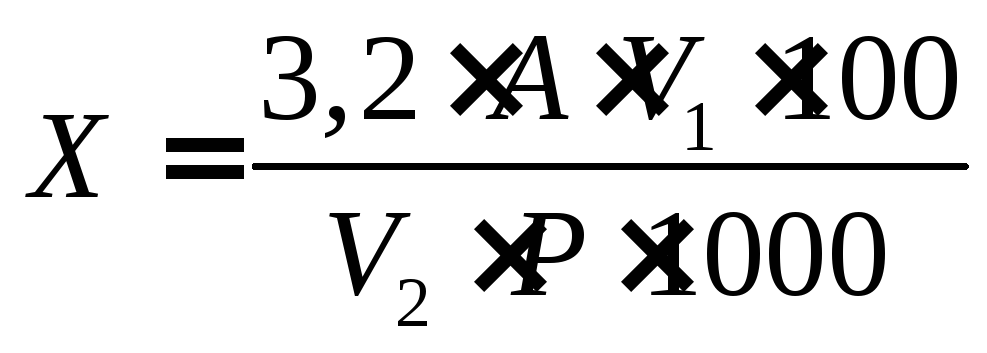
где Х – содержание витамина Р в препарате, %; 3,2 – стандартный пересчетный коэффициент; А – результат титрования 0,05 н. раствором перманганата калия, мл; V1 – объем, в котором растворена взятая для анализа навеска, мл; 100 – общее количество вещества для расчета процентного содержания, г; V2 – объем раствора, взятого для титрования, мл; Р – навеска, мг; 1000 – перевод .микрограммов в миллиграммы (Р = 30 – 50мг/100 г).
Вывод: краткое описание хода работы, записать результаты опыта и расчётных данных.
Качественные реакции на жирорастворимые витамины.
Опыт 1. Реакция на витамин А (ретинол).
Качественные реакции на витамин А основаны на образовании окрашенных соединений сложной структуры.
Принцип метода. В основе приведенной реакции лежит способность серной кислоты отнимать от витамина А воду с образованием цветных продуктов реакции.
Порядок выполнения работы.
В сухую пробирку вносят 1 каплю рыбьего жира и 4-5 капель хлороформа. Смесь хорошо перемешивают встряхиванием и добавляют 1 каплю концентрированной серной кислоты. Появляется сине-фиолетовое окрашивание, быстро переходящее в красно-бурое.
Вывод: записать результаты опыта.
Опыт 1.1. Реакция витамина А с сульфатом железа.
Принцип метода. При взаимодействии ретинола с FeSО4 в кислой среде образуется соединение розово-красного цвета. Каротины дают в этой реакции зеленоватое окрашивание.
Порядок выполнения работы.
К 1-2 каплям рыбьего жира осторожно (работают под тягой) прибавляют 5-10 капель насыщенного раствора сульфата железа (FeSO4, приготовленного на ледяной уксусной кислоте, и добавляют 1 каплю концентрированной серной кислоты. Появляется голубое окрашивание, постепенно переходящее в розово-красное.
Вывод: записать результаты опыта.
Опыт 1.2. Реакция витамина А с треххлористой сурьмой
В результате водоотнимающего действия хлорида сурьмы (SbCl3 витамин А превращается в соединение синего цвета. Эта цветная реакция используется для количественного определения витамина А колориметрическим методом.
Порядок выполнения работы.
В совершенно сухую пробирку помещают 1 каплю рыбьего жира и 4-5 капель насыщенного (33%-го) раствора хлорида сурьмы (III) в безводном хлороформе. Появляется синее окрашивание, которое постепенно переходит в розово-фиолетовое.
Внимание! Пробирка должна быть сухой, так как в присутствии воды реакция не идет из-за способности хлорида сурьмы (III превращаться в таких условиях в хлороксид сурьмы, который не может реагировать с ретинолом, вызывая помутнение раствора. Для устранения следов влаги в пробу можно добавить 1-2 капли уксусного ангидрида.
Источник
Пищевая химия: учебник для студентов вузов
Лабораторная работа 31. Фотоколориметрические методы определения витамина D
Витамины D и родственные им стерины дают цветные реакции с различными реагентами, что широко используется при колориметрическом определении витамина. Большинство стеринов, в том числе и витамины D , дают интенсивное окрашивание с серной кислотой (реакция Либермана-Бухарда) с максимумом поглощения при 620 нм. В присутствии ацетилхлорида раствор витамина D дает с 1,3-дихлоргидрином глицерина зеленое окрашивание с максимумом поглощения при 625 нм. С фурфуролом в присутствии трихлоруксусной кислоты витамин D дает цветную реакцию, после нагревания развивается розово-фиолетовое окрашивание с максимумом поглощения при 500–550 нм.
С йодом в этилендихлориде в присутствии витаминов D 2 , D 3 развивается интенсивное желтое окрашивание с максимумом поглощения при 450 нм. Интенсивность окрашивания повышается при добавлении п-хлорбензоата ртути. Реагент обладает высокой специфичностью по отношению к витамину D и более высокой чувствительностью, чем с 1,3-дихлоргидрином глицерина, но менее чем с треххлористой сурьмой. При этом провитамин D и холестерол не мешают определению.
Практическое значение имеет метод, в основе которого лежит цветная реакция с треххлористой сурьмой. Витамины D 2 , D 3 образуют с треххлористой сурьмой в хлороформе окрашенное соединение оранжевого цвета с максимумом поглощения при 520 нм. Реакция не достаточно специфична, но широко используется для количественного анализа продуктов с D -витаминной активностью. Для повышения стабильности реагента добавляют свежеперегнанный ацилхлорид (2,5–3%) или уксусный ангидрид. Эргостерол с треххлористой сурьмой дает красное окрашивание, а холестерол – желтое.
Ход анализа. Точную навеску анализируемого продукта (3–6 г) внести в коническую колбу с пришлифованной пробкой вместимостью 100 мл, добавить 10 мл 10%-го раствора гидроксида калия и закрыть колбу обратным холодильником и поместить на час в водяную баню при температуре кипения спирта.
После омыления колбу с гидролизатом охладить, отсоединить холодильник и добавить 20 мл дистиллированной воды. Содержимое колбы количественно перенести в делительную воронку. Колбу трижды ополоснуть небольшими порциями дистиллированной воды и смывы объединить с гидролизатом. Гидролизат, содержащий неомыляемую фракцию, экстрагировать диэтиловым эфиром, используя на каждую экстракцию соответственно 50, 25, 25 мл эфира. Объединенные эфирные вытяжки перенести в делительную воронку и отмыть от щелочи дистиллированной водой, подкисленной соляной кислотой (1–2 капли концентрированной кислоты на литр), до отрицательной реакции промывных вод по фенолфталеину. Общий объем дистиллированной воды, взятой для промывки эфирных вытяжек, не должен превышать 200 мл.
Органический слой (верхний) отделить, собрать в плоскодонную колбу и оставить над осушителем (5–7 г свежепрокаленного сульфата натрия) при периодическом перемешивании. Спустя 30 минут после полного осветления раствора осушитель отфильтровать через воронку Шотта и собрать фильтрат в круглодонную колбу со шлифом. Дважды промыть осушитель на фильтре небольшими порциями диэтилового эфира (по 5 мл) и добавить их к основному фильтрату. Растворитель отогнать на ротационном вакуумном испарителе в атмосфере инертного газа при температуре 30 o С до сухого остатка.
Неомыляемый остаток растворить в сухом хлороформе и количественно перенести в мерную колбу с таким расчетом, чтобы полученный раствор содержал 100–1000 МЕ/мл (2,5–25 мкг/мл) витамина D . Объем раствора в мерной колбе довести до метки тем же растворителем. Отобрать из мерной колбы 1 мл раствора в фотоколориметрическую кювету, добавить три капли свежеперегнанного ацетилхлорида, 6 мл раствора хлорида сурьмы в хлороформе и выдержать ровно 4 минуты после добавления последнего реагента. Измерить оптическую плотность анализируемой смеси при 500 нм в кюветах с длиной оптического пути 10 мм относительно контрольного раствора.
Контрольный раствор . Отмерить в фотоколориметрическую кювету 1 мл хлороформа, 6 мл раствора треххлористой сурьмы в хлороформе и три капли ацетилхлорида. По величине оптической плотности определить по калибровочному графику концентрацию витамина. Массовую долю витамина D ( С D , млн –1 ) в анализируемой пробе рассчитать по формуле:
С D = C K × V 1 m × V 2 ,
где С К – концентрация витамина D , найденная по калибровочному графику, мкг/мл;
V 1 – общий объем хлороформного раствора после экстракции, мл;
V 2 – объем хлороформного раствора, взятый на проведение цветной реакции, 1 мл;
m – навеска исследуемого материала, г.
Построение калибровочного графика . Точную навеску кристаллического кальциферола (2,5 мг) растворить в 15 мл хлороформа и количественно перенести в мерную колбу вместимостью 100 мл (с таким расчетом, чтобы содержание витамина D составило 10 3 МЕ/мл). Из стандартного раствора приготовить пять калибровочных растворов с массовой концентрацией кальциферола от 100 до 1000 МЕ/мл (2,5–25 мкг/мл) по схеме, приведенной в таблице 2.1.11.
Таблица 2.1.11. Схема приготовления калибровочных растворов кальциферола
Источник
Пищевая химия: учебник для студентов вузов
Лабораторная работа 30. Фотоколориметрические методы определения витамина А
Витамин А дает окрашенные соединения сложной структуры с треххлористой сурьмой, треххлористым мышьяком, дихлоргидрином глицерина. На практике для количественного анализа продуктов, содержащих витамин А, используют метод Карра – Прайса.
Определение витамина А по реакции с хлоридом сурьмы
В основе метода Карра – Прайса лежит цветная реакция хлороформного экстракта витамина А с раствором треххлористой сурьмы в присутствии уксусного ангидрида. В результате водоотнимающего действия хлорида сурьмы витамин А превращается в соединение сложного состава синего цвета с максимумом поглощения при 620 нм. Качественная реакция хлорида сурьмы с веществами, обладающими А-витаминной активностью, не специфична – аналогичное окрашивание дают все соединения с сопряженными связями. Образующаяся синяя окраска не стабильна и переходит со временем в розово-фиолетовую, что осложняет анализ и требует строгого соблюдения времени выдерживания до фотометрирования. Кроме того, присутствие влаги в реакционной смеси даже в незначительном количестве вызывает гидролиз хлорида сурьмы до хлороксида сурьмы, который не реагирует с витамином А, а вызывает помутнение смеси. Поэтому для устранения следов влаги в реакционную смесь добавляют уксусный ангидрид.
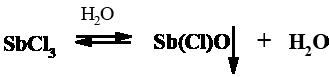
Ход анализа . Точную навеску анализируемого продукта (3–6 г сухого или 15 г жидкого продукта) растворить в 20 мл дистиллированной воды в круглодонной колбе со шлифом вместимостью 250 мл. После полного растворения навески добавить 40 мл этилового спирта и 5–7 мл 50%-го раствора гидроксида калия. Колбу закрыть обратным холодильником и поместить в водяную баню при температуре 85 0 С. Для стабилизации витамина А добавить 30–50 мг аскорбиновой кислоты.
Спустя 30 минут колбу с гидролизатом вынуть из бани, охладить и отсоединить холодильник. Содержимое колбы количественно перенести в делительную воронку. Колбу трижды ополоснуть небольшими порциями дистиллированной воды (общий объем 50 мл). Смывы объединить с основным гидролизатом и собрать в делительной воронке. Гидролизат, содержащий неомыляемую фракцию, трижды экстрагировать диэтиловым эфиром, используя на каждую экстракцию по 50 мл эфира. Эфирные вытяжки объединить и отмыть от щелочи дистиллированной водой до отрицательной реакции промывных вод по фенолфталеину. Объем дистиллированной воды не должен превышать 500 мл.
Органический слой (верхний) отделить и собрать в плоскодонную колбу. Эфирный экстракт оставить над осушителем (20 г безводного сульфата натрия) при периодическом перемешивании. Спустя 30 минут осушитель отфильтровать в круглодонную колбу со шлифом через воронку Шотта. Дважды промыть осушитель на фильтре небольшими порциями диэтилового эфира (по 10 мл). Растворитель отогнать на ротационном вакуумном испарителе в атмосфере инертного газа при температуре не выше 40 о С, полученный неомыляемый остаток растворить в 10 мл безводного хлороформа, количественно перенести в мерную колбу вместимостью 25 мл и довести объем до метки хлороформом. Концентрация витамина А должна составить примерно 3 мкг/мл.
В колориметрическую кювету внести 0,4 мл полученного раствора, добавить 1–3 капли уксусного ангидрида, 4 мл насыщенного раствора треххлористой сурьмы в хлороформе и перемешать. Не позднее чем через 10 с измерить оптическую плотность раствора на фотоэлектроколориметре при длине волны 620 нм в кювете с длиной оптического пути 10 мм относительно раствора хлороформа. Массовую долю витамина А ( С А , млн –1 ) рассчитать по формуле:
C A = 0 , 303 × C K × V 1 m ,
где С К – концентрация витамина А, найденная по калибровочному графику, МЕ/мл;
V 1 – объем раствора неомыляемой части в хлороформе, 25 мл;
m – навеска исследуемого продукта, г;
0,303 – коэффициент пересчета МЕ в млн –1 .
Построение калибровочного графика . Точную навеску кристаллического ретинолацетата, содержащего не менее 10 5 МЕ/мл, растворить в хлороформе (в мерной посуде) с таким расчетом, чтобы содержание ретинолацетата составило около 100 МЕ/мл. Из стандартного раствора приготовить пять калибровочных растворов с массовой концентрацией ретинолацетата 2–10 МЕ/0,4 мл (табл. 2.1.7).
Таблица 2.1.7. Схема приготовления калибровочных растворов ретинолацетата
Источник