Биологическая роль оксидоредуктаз.
Оксидоредуктазы— отдельный класс ферментов, катализирующих лежащие в основе биологического окисления реакции, сопровождающиеся переносом электронов с одной молекулы (восстановителя — акцептора протонов или донора электронов) на другую (окислитель — донор протонов или акцептор электронов).
Ферменты этого класса катализируют окислительно-восстановительные реакции, лежащие в основе биологического окисления. Класс насчитывает 22 подкласса. Коферментами этого класса являются НАД, НАДФ, ФАД, ФМН, убихинон, глутатион, липоевая кислота.
Витамин в1 (тиамин). Нахождение в природе, биологическая роль тиаминпирофосфата (кокарбоксилазы) как кофермента альдегиддегидрогеназ и дегидрогеназ.
Витамин В1 (тиамин, анейрин, аневрин).
Действующей в организме формой витамина В1 является его дифосфат, называемый также кокарбоксилазой; в медицине употребляется, кроме того, монофосфат тиамина и целый ряд его производных, превращающихся в кокарбоксилазу в процессе метаболизма.
Кокарбоксилаза — группа ряда ферментов, биохимическая функция которых заключается в декарбоксилировании пировиноградной кислоты (СНзСОСООН) и расщеплении С—С-связей других α-кетокислот и α-кетоспиртов, в результате чего становится возможным биосинтез ацилпроизводных кофермента А.

Излишнее накопление α-кетокислот, особенно пировиноградной кислоты, образующейся при ферментативном расщеплении углеводов, крайне вредно для организма. Упомянутая уже болезнь бери-бери, особенно широко распространенная в Юго-Восточной Азии, вызывается отсутствием витамина В1 в пище. Потребность здорового человека в тиамине невелика и составляет всего 1,5—2 мг/сут, но и она часто не удовлетворяется за счет питания. При целом ряде сердечно-сосудистых и нервных заболеваний употребление значительно больших количеств тиамина или кокарбоксилазы становится совершенно необходимым.
Витамин в2 (рибофлавин), флавинмононуклеотид (фмн) и флавинадениндинуклеотид (фад).
Витамин В2, или рибофлавин, описан как желтый пигмент коровьего молока. Впоследствии он много раз описывался в разные годы как желтый водорастворимый фактор молока, солода, яиц, печени, свиного сердца.
Он представляет собой D-рибитильное производное гетероциклической системы изоаллоксазина; такие производные носят общее название — флавины.
За счет окислительно-восстановительного превращения флавинового кольца флавиновые коферменты осуществляют окислительно-восстановительные реакции в составе многих важнейших ферментных систем: оксидаз (в частности, оксидаз D- и L-аминокислот, моноаминооксидазы, регулирующей уровень катехоламинов в крови) и дегидрогеназ (часто с участием никотинамидадениндинуклеотида и убихинонов).
Основными источниками рибофлавина и его коферментных форм являются молоко, овощи, печень, почки и дрожжи; дополнительно он поступает в организм также за счет деятельности кишечной микрофлоры. При недостатке витамина в первую очередь обычно развиваются заболевания кожи (себоррея, псориаз), появляются трещины в углах рта (хейлоз), начинается воспаление слизистой оболочки рта, поражение сетчатки и роговой оболочки глаза, а затем проявляется ряд заболеваний кроветворной системы и желудочнокишечного тракта, мышечная слабость и остановка роста у молодых организмов. Потребность в рибофлавине составляет 2—4 мг/сут, но лечебные дозы могут достигать 5—19 мг/сут.
Источник
2.5. Коферменты и витамины
Ферменты могут быть как простыми, так и сложными белками. Сложные ферменты состоят из белковой части – апофермента и небелковой – кофермента. Апофермент определяет специфичность фермента. Кофермент стабилизирует апофермент, участвует в катализе, входит в состав активного центра ферментов.
Коферменты представлены веществами органической природы – нуклеотидами, витаминами.
Классификация коферментов основана на принадлежности их к определенному классу ферментов. Только класс гидролаз не имеет коферментов.
Коферменты оксидоредуктаз: НАД, НАДФ, ФАД, ГЕМ, кофактор-витамин С.
НАД – никотинамидадениндинуклеотид. Этот кофермент включает два нуклеотида, которые соеденены фосфодиэфирной связью. Первый представлен адениловой кислотой (АМФ), второй содержит амид никотиновой кислоты + рибоза + остаток фосфорной кислоты.
аденин – рибоза – фосфат
никотинамид – рибоза — фосфат
Активная часть НАД – амид никотиновой кислоты (витамин РР). Дегидрогеназы содержащие НАД, отщепляют от субстрата водород, при этом субстрат окисляется, а НАД восстанавливается. Например:

С 
Соон надн2 соон
ФАД включает два нуклеотида: АМФ и ФМН (флавинмононуклеотид)
аденин – рибоза – фосфат
изоаллоксазин – рибитол – фосфат
Биологическая роль: ФАД-кофермент флавиновых ферментов, катализирующих окислительно-восстановительные реакции (тканевое дыхание, дезаминирование аминокислот, распад жирных кислот, пуриновых и пиримидиновых оснований и.т.д.)
ФМН и ФАД содержат витамин В2 (рибофлавин).
Коферменты трансфераз: HS КоА, ПФ, АТФ.
ПФ – пиридоксальфосфат. ПФ образуется путем фосфорилирования перидоксаля при участии АТФ.
Биологическая роль ПФ:
Участвует в реакциях трансаминирования аминокислот, катализируемых трансаминазами (трансферазы). Трансаминирование осуществляется путём обмена кетогруппы в — кетокислотах на аминогруппу в аминокислотах, в результате чего образуется новая кетокислота и новая аминокислота.
По химической природе представляет сложное органическое соединение, в состав которого входит пантотеновая кислота (витамин В3).
HS КоА переносит ацильные и ацетильные остатки:
RCOOH + HSKoA 
Аденин – рибоза – р – о
АТФ – это высокоэргическое соединение, энергия макроэргических связей (
) которых может использоваться при различных синтезах, сокращении мышц, активном транспорте, нервном возбуждении и.т.д.
Как коферемент, АТФ участвует во многих реакциях:
глюкоза + АТФ 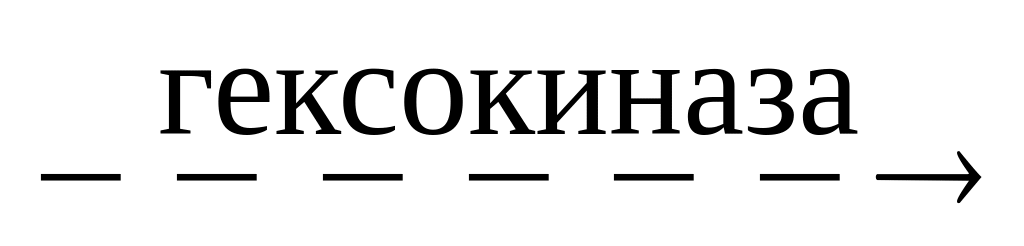
тиамин + АТФ 
Перенос аденилата (при активации аминокислот в биосинтезе белка)
А МК + АТФ амилоациладенилат
Коферменты лиаз: ТДФ, ПФ.
ТДФ – тиаминдифосфат, является производным витамина В1 (тиамин).
Участвует в декарбоксилировании кетокислот (ПВК, -кетоглутаровая кислота).
Участвует в неокислительной ветви пентозного цикла в составе транскетолаз.
Является коферментом декарбоксилаз аминокислот. Эти ферменты осуществляют отщепление СО2 от карбоксильной группы аминокислот, при этом образуются высокоактивные биогенные амины (-аминомаслянная кислота, дофамин, серотонин).
Источник
ОКСИДОРЕДУКТАЗЫ
ОКСИДОРЕДУКТАЗЫ (КФ 1.) — класс ферментов, катализирующих окислительно-восстановительные реакции; локализуются в различных структурах клетки, в основном в митохондриях, пероксисомах, а также в цитозоле, т. е. являются внутриклеточными ферментами. Изменение активности и изоферментного спектра нек-рых О., особенно дегидрогеназ (см.), служит вспомогательным диагностическим тестом при ряде заболеваний.
Субстраты, к-рые окисляются при участии О., рассматриваются как доноры электронов или атомов водорода. Систематическое название О. согласно классификации, предложенной Международным биохимическим союзом и Международной комиссией по ферментам, составляется по схеме «донор водорода : акцептор электронов оксидоредуктаза».
Класс О. пока включает 21 подкласс. К подклассу 1 класса оксидоредуктаз (КФ 1.1) относят ферменты, действующие на группу СН—ОН донора; к подклассу 2 (КФ 1. 2) относят ферменты, действующие на альдегидную или кето-группы донора; к подклассу 3 (КФ 1. 3) относят ферменты, действующие на группу —CH—CH донора; к подклассу 4 (КФ 1.4) — ферменты, действующие на CH—NH2 группу донора; к подклассу 5 (КФ 1. 5) — ферменты, действующие на C—NH группу донора, и т. д.
Третья цифра классификационного шифра фермента класса О. (подподкласс) указывает на тип акцептора электронов: 1 — НАД или НАДФ, 2 — цитохром, 3 — молекулярный кислород, 4 — дисульфид, 5 — хинон и т. д. Четвертая цифра классификационного шифра обозначает порядковый номер конкретного фермента в подподклассе.
Помимо систематического названия О. имеют тривиальные названия. Термин «дегидрогеназы» используют в тех случаях, когда акцептором атомов водорода от донора являются любые молекулы, кроме кислорода.
Термин «оксидазы» применяют в тех случаях, когда акцептором электронов является молекула кислорода (см. Оксидазы).
В качестве примеров в таблице приведены систематические и тривиальные названия нек-рых НАД (НАДФ)-зависимых дегидрогеназ, активность и изоферментный спектр к-рых используются в клин, практике в качестве дополнительного диагностического теста.
В зависимости от природы кофактора О. можно разделить на три группы: 1) НАД- или НАДФ-зави-симые дегидрогеназы; 2) флавин-зависимые дегидрогеназы и оксидазы, в молекуле к-рых роль простетической группы играют ФАД или фла-винмононуклеотид (ФМН); 3) Цитохромы, содержащие железопорфири-новую кольцевую систему в качестве простетической группы.
Различные НАД(НАДФ)-зависимые дегидрогеназы обычно легко диссоциируют на белок и простетическую группу (кофермент) и находятся в динамическом равновесии с растворенной частью НАД или НАДФ. Это обеспечивает сопряженное действие различных дегидрогеназ. Так, простетическая группа одной дегидрогеназы, восстанавливаясь в комплексе с молекулой фермента, может перейти в р-р и, ассоциируясь с другими дегидрогеназами, может в комплексе с ними восстанавливать (гидрировать) молекулы различных акцепторов (см.Окисление биологическое).
Многие НАД(НАДФ)-зависимые дегидрогеназы (глицеральдегид-3-фосфатдегидрогеназа, алкогольдегидрогеназа, лактат-, малат-, глутаматдегидрогеназы и др.) получены в вы-сокоочищенном и криста ллическом виде. Установлено, что большое число НАД(НАДФ)-зависимых дегидрогеназ имеет в составе своей молекулы ионы двухвалентных металлов (Mg 2+ , Mn 2+ , Zn 2+ и др.).
Измерение скорости ферментативной реакции, катализируемой НАД(Ф)-зависимыми дегидрогеназами, основано на измерении интенсивности поглощения при 340 нм, к-рая повышается в процессе восстановления НАД или НАДФ, или на измерении величины pH, изменение к-рой связано с освобождением протона, сопровождающим восстановление НАД+ или НАДФ+, либо на измерении флюоресценции, поскольку окисленные формы НАД и НАДФ в отличие от их восстановленных форм характеризуются сильной флюоресценцией в области 440 нм. Восстановленные формы НАД(Ф)-зави-симых дегидрогеназ не окисляются молекулярным кислородом. Перенос ими водорода на соответствующие акцепторы происходит в анаэробных условиях. Как правило, за начальной стадией анаэробного окисления субстрата следует реакция аэробного окисления восстановленного НАД (НАДФ) с участием системы флавино-вых ферментов и цитохромов (см. Дыхательные ферменты).
Наиболее важную роль из флавин-зависимых дегидрогеназ играют НАД(Ф)•Н-дегидрогеназа, сукцинатдегидрогеназа и дигидролипоил-дегидрогеназа, входящая в состав пируватдегидрогеназного и альфа-кетоглутаратдегидрогеназного комплексов. Нек-рые флавиновые О. содержат также, помимо ФАД и ФМН, катионы металлов. Напр., сукцинат-дегидрогеназа, помимо ФАД, содержит комплексно связанное железо. Для флавинзависимых дегидрогеназ характерны широкие спектры поглощения при 370 и 450 нм. При ферментативном или хим. восстановлении максимум поглощения в области 450 нм исчезает. Окислительно-восстановительный процесс, катализируемый флавинзависимыми дегидрогеназами, сопровождается также характерными изменениями в спектре флюоресценции, к-рые используют при определении активности флавин-зависимых дегидрогеназ.
Цитохромная система представлена различными цитохромами (см.), различающимися между собой спектрами поглощения восстановленной и окисленной форм и величиной окислительно-восстановительного потенциала. У млекопитающих в митохондриях найдены Цитохромы b, c, c1, a3 и в микросомах — цитохром b5. Последний цитохром дыхательной цепи, цитохром а3, реагирующий с кислородом, называется цитохром-оксидазой.
При ряде патол, состояний наблюдают изменение активности и изоферментного спектра нек-рых НАД(Ф)-зависимых дегидрогеназ. Так, при нек-рых заболеваниях печени (напр., при остром инф. гепатите) в сыворотке крови в разгаре болезни резко повышена активность лактатдегидрогеназы (см.) и алкогольдегидрогеназы (см.), а в более поздние сроки — активность глутаматдегидрогеназы. При остром инфекционном гепатите, а также при злокачественных новообразованиях наблюдают изменение изоферментного спектра нек-рых дегидрогеназ, в т. ч. появление аномальных молекулярных форм фермента. Определение активности и изоферментного состава лактатдегидрогеназы в сыворотке крови является важным тестом при дифференциальной диагностике инфаркта миокарда и наблюдении за его течением (см. Инфаркт миокарда). Генетически обусловленная гемолитическая анемия (см.) характеризуется снижением активности в эритроцитах одной из оксидоредуктаз — НАДФ-зависимой глюкозо-6-фосфатдегидрогеназы (КФ 1. 1. 1. 49), что вызывает уменьшение образования АТФ в эритроцитах, задержку ионов Na + и связанной с ними воды, набухание и гемолиз эритроцитов. При полном отсутствии активности этого фермента гемолитическая анемия проявляется спонтанно уже в детском возрасте. Причиной гемолитической анемии может быть также врожденная недостаточность или полное отсутствие активности еще одной О.— глутатионредуктазы (КФ 1. 6. 4. 2), вызывающие патологическое снижение концентрации глутатиона в эритроцитах.
Таблица. СИСТЕМАТИЧЕСКИЕ И ТРИВИАЛЬНЫЕ НАЗВАНИЯ НЕКОТОРЫХ ДЕГИДРОГЕНАЗ, ИСПОЛЬЗУЮЩИХ В КАЧЕСТВЕ КОФЕРМЕНТОВ НАД ИЛИ НАДФ, И КАТАЛИЗИРУЕМЫЕ ИМИ РЕАКЦИИ
Источник






