Витамин в2 является составной частью кофермента флавинадениндинуклеотида
CAS номер: 83-88-5
Брутто формула: C17H20N4O6
Внешний вид: кристаллический порошок, темно-желтого цвета, горький на вкус
Химическое название и синонимы: riboflavin,Лактофлавин, Рибофлавин, Витамин B2, 7,8-Dimethyl-10-ribitylisoalloxazine.
Физико-химические свойства:
Температура плавления — 290 гр. Цельсия
Растворимость в воде — 0,07 г / л (20 ºC)
Рибофлавин – водорастворимый витамин, участвующий в своих коферментных формах в окислительно-восстановительных реакциях. Являясь активным центром ферментов – дегидрогеназ и оксидаз, представлен в виде флавинмононуклеотида (ФМН) и флавинадениндинуклеотида (ФАД).
Рибофлавин носит название витамина В2, он необходим для организма и играет роль в выработке энергии, метаболизме жиров и лекарств, а также в нормальном функционировании, росте и развитии клеток. Рибофлавин естественным образом содержится в некоторых пищевых источниках, добавляется к другим продуктам и доступен в качестве пищевой добавки. Рибофлавин также вырабатывается бактериями, присутствующими в толстой кишке во время нормального пищеварения.
Абсорбция рибофлавина происходит преимущественно в проксимальной части тонкой кишки. Недавние исследования показывают, что ФАД и ФМН необходимо преобразовывать в рибофлавин с помощью кистевых пограничных фосфатаз. Абсорбция усиливается с пищей и уменьшается на пустой желудок. Снижение всасывания можно наблюдать при обструктивных заболеваниях желчевыводящих путей, гепатите и циррозе печени. Поглощение рибофлавина в толстой кишке является адаптивным абсорбционным механизмом, зависящим от концентрации в просвете и числа рецепторов в энтероцитах и регулируется энергозависимой транспортной системой.
Дефицит рибофлавина определяется термином как арибофлавиноз. Признаки, связанные с дефицитом, включают хейлоз, угловой стоматит, глоссит, дерматит мошонки и вульвы, себорейный дерматит, кератит и глазные изменения. Тяжелые состояния дефицита связаны с нормохромной, нормоцитарной анемией и невропатией. Клинические признаки и симптомы дефицита развиваются после недостаточного поступления рибофлавина в организм с пищей в течение 3-8 месяцев. Дефицит рибофлавина, отмечаемый во всем мире, распространен в основном в слаборазвитых странах.
В пищевой промышленности рибофлавин используется, как пищевой краситель (Е101), либо в качестве витаминной добавки. Препараты, содержащие рибофлавин, выпускаются в виде капсул, таблеток, в составе мультивитаминных комплексов.
Рибофлавин получают непосредственно из культуры с высоким выходом путем культивирования микроорганизма, продуцирующего рибофлавин, в среде с использованием низшего (С1-С4) алифатического соединения. Затем происходит отделение рибофлавина, содержащегося в культуре, в виде нагретого водного раствора от твердых веществ, и кристаллизация рибофлавина из нагретого водного раствора. Рибофлавин также получают с высоким выходом путем культивирования рибофлавин-продуцирующих дрожжей, принадлежащих к роду Saccharomyces, которые нуждаются в пурине и / или устойчивы к 3-амино-1,2,4-триазолу в среде, и собирают образующийся рибофлавин.
Кроме того, рибофлавин получают с высоким выходом даже в присутствии ионов железа, предварительно выращивая в жидкости дрожжи, продуцирующие рибофлавин, принадлежащие к роду Saccharomyces, и затем выращивая их в среде, продуцирующей рибофлавин, содержащей ионы цинка.
Действие на организм:
В структуре дегидрогеназ участвует в мультиферментной реакции окисления и декарбоксилирования пировиноградной кислоты, как активный центр дегидролипоат-дегидрогеназы возвращается вместе с липоевой кислотой в окисленное состояние в результате чего выделяется НАДН ФАД Участвует в дегидратации янтарной кислоты (сукцината) в составе сукцинатдегдрогеназы и в алфа-кетоглуторатдегидрогеназе для образовании Глутамата из алфа-Кетоглутората в цикле трикарбоновых кислот.
Окисляет жирные кислоты, являясь коферментом ацетил-КоА-дегидрогеназы. Процесс проходит во всех тканях организма, для образования энергии (кроме нервной ткани).
В составе изофермента глицерол-трифосфат-дегидрогеназы участвует в переносе атомов водорода из митохондрий при образовании энергии из глюкозы в печени и скелетных мышцах.
В дыхательной цепи молекулы ФАДН (вместе с НАДН) в процессе окисления передают атомы водорода (ФАД возвращается в окисленную форму) на ферменты дыхательной цепи, которые в дальнейшем переносятся за мембрану митохондрий, расходуя в процессе энергию электронов. Создается разница градиента водорода, которого уже больше за пределами органеллы и уже в реакции фосфорилирования, используя АТФ-синтетазу водород присоединяется к АДФ, образуя АТФ. Таким образом ФАД включается в образование энергии, необходимой для дыхания клетки.
В структуре D-оксидаз кофермент ФАД, а в молекуле L-оксидаз как коэнзим ФМН — приводит к прямому аэробному окислительному дезаминированию аминокислот.
Уничтожает биогенные амины (гистамин, серотонин, дофамин и т.д.) в составе ферментов-оксидаз.
Таким образом, коферментные формы Рибофлавина – ФАД и ФМН являются участниками окислительно-восстановительных реакций, без которых не смогли бы протекать многие важнейшие энергетические процессы в организме.
Гиповитаминоз приводит в первую очередь к поражению высокоаэробных тканей, использующих большое количество энергии – это кожа и слизистые. Вызывается не правильным хранением продуктов, вследствие чего происходит разрушение рибофлавина, алкоголизма, голода и нарушения всасываемости в ЖКТ. Клиническая картина недостатка Витамина В, выражается в виде сухости, воспаления и васкуляризации видимых слизистых оболочек, сухости и шелушения кожи.
Некоторые исследования показали, что добавки рибофлавина могут уменьшить приступы мигрени, и некоторые люди с мигренью принимают riboflavin для ее лечения мигрени, чтобы помочь контролировать возникающие симптомы.
Источник
Флавинадениндинуклеотид
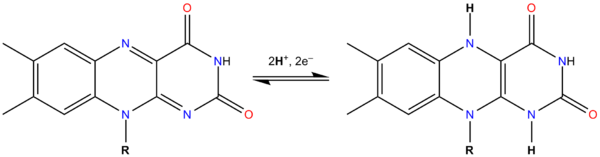
FAD — флавинадениндинуклеотид — кофермент, принимающий участие во многих окислительно-восстановительных биохимических процессах. FAD существует в двух формах — окисленной и восстановленной, его биохимическая функция, как правило, заключается в переходе между этими формами. [1]
FADH2
FAD может быть восстановлен до FADH2, при этом он принимает два атома водорода.
Молекула FADH2 является переносчиком энергии и восстановленный кофермент может быть использован как субстрат в реакции окислительного фосфорилирования в митохондрии. Молекула FADH2 окисляется в FAD, при этом выделяется энергия, эквивалентная (запасаемая в форме) двум молям ATP.
Основной источник восстановленного FAD у эукариот — цикл Кребса и бета-окисление липидов. В цикле Кребса FAD является простетической группой фермента сукцинатдегидрогеназы, которая окисляет сукцинат до фумарата, в бета-окислении липидов FAD является коферментом Ac-CoA дегидрогеназы. [2]
FAD образуется из рибофлавина, многие оксидоредуктазы, называемые флавопротеинами, для своей работы используют FAD как простетическую группу в реакциях переноса электронов.
Примечания
- ↑Кнорре Д. Г., Мызина С. Д. Биологическая химия. — 3. — Москва: Высшая школа, 2000. — 479 с. — 7000 экз. — ISBN 5060037207
- ↑Марри Р., Греннер Д., Мейес П., Родуэлл В. Биохимия человека: в двух томах. — Москва: Мир, 2004. — Т. 1. — 381 с. — 2000 экз. — ISBN 5030036008
См. также
Wikimedia Foundation . 2010 .
Смотреть что такое «Флавинадениндинуклеотид» в других словарях:
флавинадениндинуклеотид — флавинадениндинуклеотид … Орфографический словарь-справочник
ФЛАВИНАДЕНИНДИНУКЛЕОТИД — (ФАД) органическое соединение, производное витамина В2 (рибофлавина); небелковая часть (кофермент) ряда ферментов дегидрогеназ, катализирующих окислительно восстановительные реакции в организме … Большой Энциклопедический словарь
ФЛАВИНАДЕНИНДИНУКЛЕОТИД — ФАД, рибофлавин 5 аденозиндифосфат, кофермент мн. флавинзависимых дегидрогеназ, широко распространённых в живых организмах. Молекула Ф. состоит из аденозин 5 фосфата и ФМН. Содержащие Ф. флавопротеиды входят в состав дыхат. цепи. Осн. функция Ф.… … Биологический энциклопедический словарь
флавинадениндинуклеотид — сущ., кол во синонимов: 2 • кофермент (14) • фад (2) Словарь синонимов ASIS. В.Н. Тришин. 2013 … Словарь синонимов
флавинадениндинуклеотид — Кофермент, кофактор группы ферментов (d–аминокислотная оксидаза, глюкозооксидаза и ксантиноксидаза) [http://www.dunwoodypress.com/148/PDF/Biotech Eng Rus.pdf] Тематики биотехнологии EN flavin adenine dinucleotide … Справочник технического переводчика
Флавинадениндинуклеотид — рибофлавин 51 аденозиндифосфат, небелковый компонент (кофермент) большинства ферментов флавопротеидов (См. Флавопротеиды), присутствующих во всех живых клетках; производное Рибофлавина (витамина B2). Участвует в… … Большая советская энциклопедия
флавинадениндинуклеотид — (ФАД), органическое соединение, производное витамина В2 (рибофлавина); небелковая часть (кофермент) ряда ферментов дегидрогеназ, катализирующих окислительно восстановительные реакции в организме. * * * ФЛАВИНАДЕНИНДИНУКЛЕОТИД… … Энциклопедический словарь
флавинадениндинуклеотид — flavinadenindinukleotidas statusas T sritis chemija apibrėžtis Kofermentas. santrumpa( os) FAD atitikmenys: angl. flavin adenine dinucleotide; flavine adenine dinucleotide rus. флавинадениндинуклеотид … Chemijos terminų aiškinamasis žodynas
флавинадениндинуклеотид — (ФАД) кофермент многих оксидоредуктаз, представляющий собой производное рибофлавина (витамина В2), содержащее два остатка фосфорной кислоты … Большой медицинский словарь
ФЛАВИНАДЕНИНДИНУКЛЕОТИД — (ФАД), органич. соединение, производное витамина В2 (рибофлавина); небелковая часть (кофермент) ряда ферментов дегидрогеназ, катализирующих окислит. восстановит. реакции в организме … Естествознание. Энциклопедический словарь
Источник
Тесты «Ферменты»
1. Ферменты являются:
В) активаторами субстратов;
Г) переносчиками веществ через мембрану;
Д) медиаторами нервного импульса.
2. Ферменты могут состоять только из:
Б) белка и небелковой части;
Г) низкомолекулярных азотсодержащих органических веществ;
Д) липидов и углеводов.
3. Тест. Кофактор – это:
А) активная часть простого фермента;
Б) показатель активности фермента;
В) показатель стабильности фермента;
Г) белковая часть сложного фермента;
Д) небелковая часть сложного фермента.
4. Кофермент – это:
А) легкоотделяющаяся белковая часть сложного фермента;
Б) неотделяющаяся небелковая часть сложного фермента;
В) белковая часть сложного фермента;
Г) небелковая часть простого фермента;
Д) непрочносвязанная небелковая часть сложного фермента.
5. Простетическая группа – это:
А) белковая часть сложного фермента;
Б) стабилизатор структуры фермента;
В) активатор сложного фермента;
Г) прочносвязанная с ферментом небелковая часть;
Д) часть фермента, образующая каталитический центр.
6. По типу реакций ферменты подразделяются на:
А) оксидазы, трансферазы, гидролазы, каталазы, изомеразы, эстеразы;
Б) оксидоредуктазы, изомеразы, гидролазы, эстеразы, пероксидазы, лиазы;
В) оксидазы, оксидоредуктазы, каталазы, гидролазы, эстеразы, лиазы;
Г) оксидоредуктазы, гидролазы, лиазы, карбоксилазы, изомеразы, лигазы;
Д) оксидоредуктазы, гидролазы, трансферазы, изомеразы, лиазы, лигазы.
7. К оксидоредуктазам относятся:
8. К оксидазам относятся:
Тест 9. В состав пиридинзависимых дегидрогеназ входят:
Г) пантотеновая кислота и цитохромы;
Д) пангамовая кислота и АТФ.
10. В состав флавинзависимых дегидрогеназ входят:
Д) кофермент А (КоА).
А) катализируют гидролиз субстратов;
Б) ускоряют окислительно-восстановительные реакции с участием кислорода;
В) ускоряют окислительно-восстановительные реакции в анаэробной среде;
Г) ускоряют реакции переноса только электронов;
Д) ускоряют реакции отщепления водорода и электронов от субстрата на промежуточный окислитель.
А) ускоряют реакции гидрирования субстратов;
Б) катализируют превращения альдегидов в спирты;
В) ускоряют реакции переноса гидроксо-групп внутри молекулы субстрата;
Г) катализируют гидролитическое расщепление субстратов;
Д) ускоряют реакции отщепления воды от субстрата.
13. К гидролазам относятся:
А) протеазы, липазы;
Б) декарбоксилазы, карбоксилазы;
Д) цитохромы, убихинон.
14. К протеазам относятся:
Д) пепсин, трипсин.
15. Протеазы катализируют расщепление:
А) сложноэфирных связей;
Б) углерод-углеродных связей (С-С);
В) пептидных связей;
Г) гликозидных связей;
Д) углерод-водородных связей (С-Н).
16. Трансферазы катализируют и могут содержать:
А) перенос групп внутри молекулы субстрата; витамин В2;
Б) перенос групп от одной молекулы к другой; витамин В6;
В) перенос остатков фосфорной кислоты от АТФ на глюкозу;
Г) отщепление от субстрата низкомолекулярных соединений; витамин В1;
Д) присоединение к субстрату низкомолекулярных соединений; витамин Н.
17. К трансферазам относится:
18. Лиазы катализируют:
А) реакции соединения молекул;
Б) реакции изомеризации;
В) расщепление связей в субстрате с помощью воды;
Г) расщепление связей в субстрате без участия воды;
Д) перенос электронов от одного субстрата к другому.
19. К лиазам относятся:
А) катализируют расщепление связей в субстрате с помощью воды;
Б) катализируют отщепление от субстрата углекислого газа, воды или аммиака;
В) для выполнения своих биохимических функций используют энергию АТФ;
Г) катализируют реакции синтеза;
Д) катализируют реакции переноса групп атомов в молекуле субстрата.
21. К лигазам относятся:
22. Абсолютную специфичность к субстрату проявляет фермент:
23. Пантотеновая кислота является составной частью:
А) липоевой кислоты;
Г) тетрагидрофолиевой кислоты;
24. Реакции превращения аминокислот связаны с участием:
25. Тиаминпирофосфат, липоевая кислота и коэнзим А одновременно входят в качестве кофакторов в состав:
А) синтетазы высших жирных кислот;
Г) пируватдегидрогеназы декарбоксилирующей;
26. Реакции переноса одноуглеродных групп (например, формильной) протекают при участии:
Г) тетрагидрофолиевой кислоты;
Д) флавинадениндинуклеотида (ФАД).
А) способствует усвоению витамина А;
Б) содержит в составе витамин А;
В) катализирует перенос углеводных остатков (арабинозы);
Г) катализирует перенос остатков жирных кислот;
Д) катализирует отщепление ацильных остатков от субстратов.
28. В состав родопсина – рецепторного белка сетчатки глаза входит:
29. Реакция, протекающая по уравнению
R1–O–R2 + H3PO4 R1OPO3H2 + R2–OH является реакцией:
30. Превращение 2H2O2 → 2H2O + O2 происходит при участии:
31. Оксидаза (А); дегидрогеназа (Б); каталаза (В); пероксидаза (Г); гидратаза (Д) ускоряют реакции:
Источник