Витамин в1 реакции окислительного декарбоксилирования
еУМЙ РТПГЕУУ ЛБФБВПМЙЪНБ ТБУУНБФТЙЧБФШ У ПВЭЕК ФПЮЛЙ ЪТЕОЙС, ФП НПЦОП ЧЩДЕМЙФШ ФТЙ ПУОПЧОЩЕ ЕЗП ЮБУФЙ:
лБФБВПМЙЪН ПУОПЧОЩИ РЙЭЕЧЩИ ЧЕЭЕУФЧ
- тБУЭЕРМЕОЙЕ Ч РЙЭЕЧБТЙФЕМШОПН ФТБЛФЕ . ьФП ЗЙДТПМЙФЙЮЕУЛЙЕ ТЕБЛГЙЙ, РТЕЧТБЭБАЭЙЕ УМПЦОЩЕ РЙЭЕЧЩЕ ЧЕЭЕУФЧБ Ч ПФОПУЙФЕМШОП ОЕВПМШЫПЕ ЮЙУМП РТПУФЩИ НЕФБВПМЙФПЧ: ЗМАЛПЪБ, БНЙОПЛЙУМПФЩ, ЗМЙГЕТЙО, ЦЙТОЩЕ ЛЙУМПФЩ.
- уРЕГЙЖЙЮЕУЛЙЕ РХФЙ ЛБФБВПМЙЪНБ . рТПУФЩЕ НЕФБВПМЙФЩ РПДЧЕТЗБАФУС УРЕГЙЖЙЮЕУЛЙН ТЕБЛГЙСН ТБУЭЕРМЕОЙС, Ч ТЕЪХМШФБФЕ ЛПФПТЩИ ПВТБЪХЕФУС МЙВП РЙТПЧЙОПЗТБДОБС ЛЙУМПФБ, МЙВП БГЕФЙМ — уПб. рТЙЮЕН БГЕФЙМ — уПб НПЦЕФ ПВТБЪПЧБФШУС ЙЪ РЙТХЧБФБ Ч ТЕЪХМШФБФЕ ПЛЙУМЙФЕМШОПЗП ДЕЛБТВПЛУЙМЙТПЧБОЙС. нПЗХФ ФБЛЦЕ ПВТБЪПЧБФШУС ДТХЗЙЕ УПЕДЙОЕОЙС, ОЕРПУТЕДУФЧЕООП ЧЛМАЮБАЭЙЕУС Ч ГЙФТБФОЩК ГЙЛМ.
- гЙФТБФОЩК ГЙЛМ Й ДЩИБФЕМШОБС ГЕРШ ЪБЧЕТЫБАФ ТБУЭЕРМЕОЙЕ РЙЭЕЧЩИ ЧЕЭЕУФЧ ДП ЛПОЕЮОЩИ РТПДХЛФПЧ — уп 2 Й о 2 п.
уМЕДПЧБФЕМШОП, ОБЮЙОБС УП УФБДЙЙ ПВТБЪПЧБОЙС РЙТХЧБФБ РТПЙУИПДЙФ ХОЙЖЙЛБГЙС РХФЕК ЛБФБВПМЙЪНБ. йЪ ВПМШЫПЗП ЮЙУМБ ЙУИПДОЩИ УПЕДЙОЕОЙК ПВТБЪХЕФУС ЧУЕЗП ДЧБ — РЙТХЧБФ Й БГЕФЙМ — уПб. рТПГЕУУ, ОБЮЙОБАЭЙКУС ПФ РЙТХЧБФБ, ОБЪЩЧБЕФУС ПВЭЙН РХФЕН ЛБФБВПМЙЪНБ Й Ч УЧПА ПЮЕТЕДШ ЧЛМАЮБЕФ:
- ПЛЙУМЙФЕМШОПЕ ДЕЛБТВПЛУЙМЙТПЧБОЙЕ РЙТХЧБФБ
- ГЙФТБФОЩК ГЙЛМ.
йНЕООП Ч ПВЭЕН РХФЙ ЛБФБВПМЙЪНБ ПВТБЪХЕФУС ПУОПЧОБС НБУУБ УХВУФТБФПЧ ДМС ТЕБЛГЙК ДЕЗЙДТЙТПЧБОЙС. уПЧНЕУФОП У ДЩИБФЕМШОПК ГЕРША Й ПЛЙУМЙФЕМШОЩН ЖПУЖПТЙМЙТПЧБОЙЕН ПВЭЙК РХФШ ЛБФБВПМЙЪНБ СЧМСЕФУС ПУОПЧОЩН ЙУФПЮОЙЛПН ЬОЕТЗЙЙ Ч ЖПТНЕ бфт.
пЛЙУМЙФЕМШОПЕ ДЕЛБТВПЛУЙМЙТПЧБОЙЕ РЙТПЧЙОПЗТБДОПК ЛЙУМПФЩ
уХННБТОЩК ТЕЪХМШФБФ НОПЗПУФБДЙКОПК ТЕБЛГЙЙ ЧЩЗМСДЙФ УМЕДХАЭЙН ПВТБЪПН:
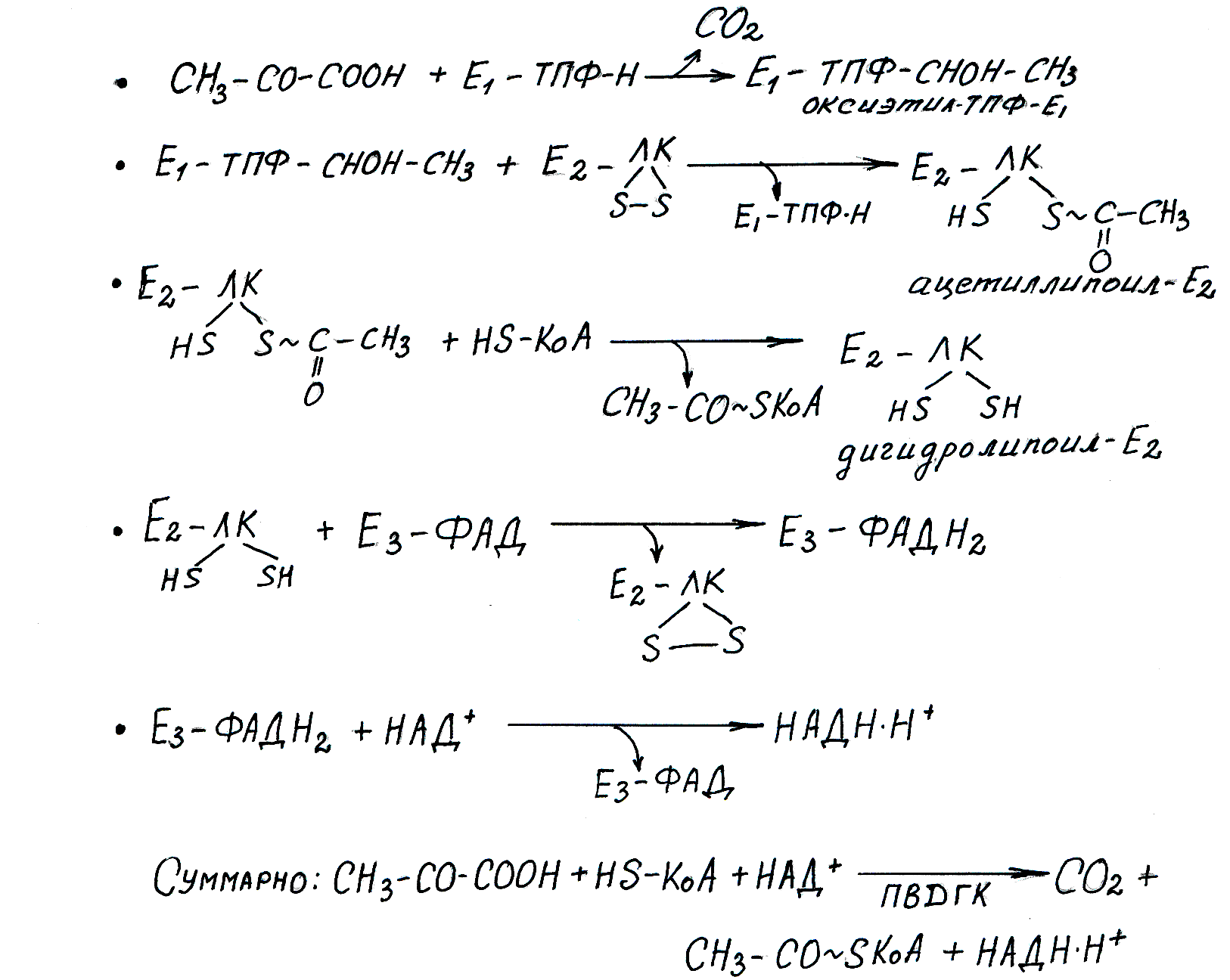
тЕБЛГЙС ЛБФБМЙЪЙТХЕФУС ФТЕНС ЖЕТНЕОФБНЙ, ТБВПФБАЭЙНЙ Ч ПРТЕДЕМЕООПК РПУМЕДПЧБФЕМШОПУФЙ Й ПВЯЕДЙОЕООЩНЙ Ч РЙТХЧБФДЕЗЙДТПЗЕОБЪОЩК ЛПНРМЕЛУ:
ьФПФ ЛПНРМЕЛУ ЖЕТНЕОФПЧ ТБВПФБЕФ РПДПВОП ЛПОЧЕКЕТХ, Ч ЛПФПТПН РТПДХЛФ РЕТЕДБЕФУС ПФ ЖЕТНЕОФБ Л ЖЕТНЕОФХ. фБЛПК РТЙОГЙР РПЧЩЫБЕФ ЬЖЖЕЛФЙЧОПУФШ ТБВПФЩ ЖЕТНЕОФПЧ, ФБЛ ЛБЛ УОЙЦБЕФ УМХЮБКОПУФШ Ч ЛПОФБЛФЕ ТЕБЗЙТХАЭЙИ ЧЕЭЕУФЧ У ЖЕТНЕОФПН. дБМЕЕ РТЙЧПДСФУС ОБЪЧБОЙС ЖЕТНЕОФПЧ Й ИБТБЛФЕТЙУФЙЛБ ЛБФБМЙЪЙТХЕНЩИ ТЕБЛГЙК.
- рЙТХЧБФДЕЛБТВПЛУЙМБЪБ (1). ч ЛБЮЕУФЧЕ ЛПЖЕТНЕОФБ Ч ТЕБЛГЙЙ ХЮБУФЧХЕФ ФЙБНЙОДЙЖПУЖБФ — РТПЙЪЧПДОПЕ ЧЙФБНЙОБ ч 1 . жЕТНЕОФ ЛБФБМЙЪЙТХЕФ ПФЭЕРМЕОЙЕ ЛБТВПЛУЙМШОПК ЗТХРРЩ Ч ЧЙДЕ уп 2 , Б БГЕФЙМШОЩК ПУФБФПЛ РТЙУПЕДЙОСЕФ Л МЙРПЕЧПК ЛЙУМПФЕ — ЛПЖЕТНЕОФХ ЧФПТПЗП ЖЕТНЕОФБ. рПМХЮБЕФУС БГЕФЙМ—МЙРПБФ.
- дЙЗЙДТПМЙРПБФ—БГЕФЙМФТБОУЖЕТБЪБ(2) — ЧФПТПК ЖЕТНЕОФ ЛПНРМЕЛУБ. лБФБМЙЪЙТХЕФ РЕТЕОПУ БГЕФЙМШОПЗП ПУФБФЛБ, УПЕДЙОЕООПЗП У МЙРПЕЧПК ЛЙУМПФПК ОБ ЧФПТПК ЛПЖЕТНЕОФ HS—уПб У ПВТБЪПЧБОЙЕН БГЕФЙМ—уПб. фБЛЙН ПВТБЪПН, Ч ЬФПК ТЕБЛГЙЙ ХЮБУФЧХАФ ДЧБ ЛПЖЕТНЕОФБ: МЙРПЕЧБС ЛЙУМПФБ, РТПЮОП УПЕДЙОЕООБС У ЖЕТНЕОФПН, Й ЛПЖЕТНЕОФ б, ПВЯЕДЙОСАЭЙКУС У ЖЕТНЕОФПН Ч НПНЕОФ ТЕБЛГЙЙ. чПДПТПД ПУФБЕФУС УЧСЪБООЩН У МЙРПЕЧПК ЛЙУМПФПК, ЛПФПТБС РТЕЧТБЭБЕФУС Ч ДЙЗЙДТПМЙРПБФ.
- дЕЗЙДТПЗЕОБЪБ ДЙЗЙДТПМЙРПЕЧПК ЛЙУМПФЩ (3) ПФЭЕРМСЕФ ЧПДПТПД ПФ МЙРПЕЧПК ЛЙУМПФЩ Й РЕТЕОПУЙФ ЕЗП ОБ NAD + . дБМЕЕ ЧПДПТПД ФТБОУРПТФЙТХЕФУС ДЩИБФЕМШОПК ГЕРША
зМБЧОЩЕ РТПДХЛФЩ ТЕБЛГЙЙ — ЬФП NADH+H + Й БГЕФЙМ—уПб. NADH+H + ДБМЕЕ ПЛЙУМСЕФУС Ч ДЩИБФЕМШОПК ГЕРЙ, ЗДЕ ЬОЕТЗЙС ЙУРПМШЪХЕФУС ОБ УЙОФЕЪ 3 НПМШ бфт, Б БГЕФЙМ—уПб ПЛЙУМСЕФУС Ч ГЙФТБФОПН ГЙЛМЕ. рЙТХЧБФДЕЛБТВПЛУЙМБЪОЩК ЛПНРМЕЛУ ОБИПДЙФУС ОБ ЧОХФТЕООЕК НЕНВТБОЕ НЙФПИПОДТЙК Й УПЕДЙОЕО У ОЕК УП УФПТПОЩ НБФТЙЛУБ.
гЙФТБФОЩК ГЙЛМ (ГЙЛМ лТЕВУБ, ГЙЛМ ФТЙЛБТВПОПЧЩИ ЛЙУМПФ) — ЬФП УЙУФЕНБ ТЕБЛГЙК, РТЙЧПДСЭБС Л РПМОПНХ ПЛЙУМЕОЙА ДЧХИХЗМЕТПДОПЗП БГЕФЙМШОПЗП ЖТБЗНЕОФБ, ЙНЕАЭЕЗП ТБЪМЙЮОПЕ РТПЙУИПЦДЕОЙЕ. гЙФТБФОЩК ГЙЛМ СЧМСЕФУС ПВЭЙН ЛПОЕЮОЩН РХФЕН ПЛЙУМЕОЙС ВЕМЛПЧ, ЦЙТПЧ Й ХЗМЕЧПДПЧ. чУЕ ТЕБЛГЙЙ ГЙФТБФОПЗП ГЙЛМБ, ЛБЛ Й ПЛЙУМЙФЕМШОПЗП ДЕЛБТВПЛУЙМЙТПЧБОЙС РЙТХЧБФБ, МПЛБМЙЪПЧБОЩ Ч НЙФПИПОДТЙСИ. ч ИПДЕ ПДОПЗП РПМОПЗП ГЙЛМБ РТПЙУИПДЙФ:
- РПМОПЕ ПЛЙУМЕОЙЕ БГЕФЙМШОПЗП ПУФБФЛБ ДП ДЧХИ НПМЕЛХМ уп 2 ;
- ПВТБЪПЧБОЙЕ ФТЕИ НПМЕЛХМ ЧПУУФБОПЧМЕООПЗП NAD + Й ПДОПК НПМЕЛХМЩ FADH 2 ;
- ПВТБЪПЧБОЙЕ ПДОПК НПМЕЛХМЩ GTP Ч ТЕЪХМШФБФЕ УХВУФТБФОПЗП ЖПУЖПТЙМЙТПЧБОЙС.
тЕБЛГЙЙ ГЙФТБФОПЗП ГЙЛМБ, ЖЕТНЕОФЩ Й ЙИ ИБТБЛФЕТЙУФЙЛБ РТЙЧЕДЕОБ ОБ ТЙУХОЛЕ:
уИЕНБ ГЙФТБФОПЗП ГЙЛМБ; ЖЕТНЕОФЩ: 1— РЙТХЧБФДЕЗЙДТПЗЕОБЪОЩК ЛПНРМЕЛУ, 2— ГЙФТБФУЙОФБЪБ, 3— БЛПОЙФБЪБ, 4— ЙЪПГЙФТБФДЕЗЙДТПЗЕОБЪБ, 5— a —ЛЕФПЗМХФБТБФДЕЗЙДТПЗЕОБЪОЩК ЛПНРМЕЛУ, 6— УХЛГЙОЙМ—лПб—ФЙПЛЙОБЪБ, 7— УХЛГЙОБФДЕЗЙДТПЗЕОБЪБ, 8— ЖХНБТБЪБ, 9— НБМБФДЕЗЙДТПЗЕОБЪБ
уПРТСЦЕОЙЕ ПВЭЙИ РХФЕК ЛБФБВПМЙЪНБ У ДЩИБФЕМШОПК ГЕРША
ч ПВЭЙИ РХФСИ ЛБФБВПМЙЪНБ РТПЙУИПДЙФ РСФШ ТЕБЛГЙК ДЕЗЙДТЙТПЧБОЙС: ПДОБ ОБ УФБДЙЙ ПЛЙУМЙФЕМШОПЗП ДЕЛБТВПЛУЙМЙТПЧБОЙС РЙТХЧБФБ Й ЮЕФЩТЕ Ч ГЙФТБФОПН ГЙЛМЕ. чУЕ 10 БФПНПЧ ЧПДПТПДБ РЕТЕОПУСФУС ОБ ЛПЖЕТНЕОФЩ ДЕЗЙДТПЗЕОБЪ, ЛПФПТЩЕ Ч УЧПА ПЮЕТЕДШ ПЛЙУМСАФУС Ч ДЩИБФЕМШОПК ГЕРЙ. пЛЙУМЕООЩЕ ЛПЖЕТНЕОФЩ ЧПЪЧТБЭБАФУС Ч ТЕБЛГЙЙ ПВЭЙИ РХФЕК ЛБФБВПМЙЪНБ. тЕЗЕОЕТБГЙС ЛПЖЕТНЕОФПЧ — ЬФП ПВСЪБФЕМШОПЕ ХУМПЧЙЕ ДМС РТПФЕЛБОЙС ТЕБЛГЙЙ ДЕЗЙДТЙТПЧБОЙС . фБЛЙН ПВТБЪПН, ПВЭЙК РХФШ ЛБФБВПМЙЪНБ Й ДЩИБФЕМШОБС ГЕРШ ОЕРТЕТЩЧОП УЧСЪБОЩ НЕЦДХ УПВПК Й ПФДЕМШОП ЖХОЛГЙПОЙТПЧБФШ ОЕ НПЗХФ.
ьОЕТЗЕФЙЛБ ГЙФТБФОПЗП ГЙЛМБ Й ПВЭЙИ РХФЕК ЛБФБВПМЙЪНБ
ъБ ПДЙО ПВПТПФ ГЙФТБФОПЗП ГЙЛМБ УЙОФЕЪЙТХЕФУС 12 НПМЕЛХМ бфт . дЕЧСФШ ЙЪ ОЙИ ПВТБЪХАФУС ЪБ УЮЕФ ЬОЕТЗЙЙ ФТБОУРПТФБ Ч ДЩИБФЕМШОПК ГЕРЙ ФТЕИ РБТ ЧПДПТПДБ ПФ ФТЕИ НПМЕЛХМ NADH + H + . дЧЕ НПМЕЛХМЩ бфт УЙОФЕЪЙТХАФУС РТЙ ПЛЙУМЕОЙЙ 1 НПМЕЛХМЩ FADH 2 , ФБЛ ЛБЛ Ч ДЩИБФЕМШОПК ГЕРЙ Ч ДБООПН УМХЮБЕ ДЕКУФЧХАФ ФПМШЛП ДЧБ РХОЛФБ УПРТСЦЕОЙС У ПЛЙУМЙФЕМШОЩН ЖПУЖПТЙМЙТПЧБОЙЕН ADP. лТПНЕ ФПЗП, Ч ГЙФТБФОПН ГЙЛМЕ РТПЙУИПДЙФ ПДОБ ТЕБЛГЙС УХВУФТБФОПЗП ЖПУЖПТЙМЙТПЧБОЙС, ДБАЭБС 1 НПМШ GTP (бфт). ч ПВЭЙИ РХФСИ ЛБФБВПМЙЪНБ УЙОФЕЪЙТХЕФУС 15 НПМЕЛХМ бфт. фТЙ ЙЪ ОЙИ РТЙ ПЛЙУМЙФЕМШОПН ДЕЛБТВПЛУЙМЙТПЧБОЙЙ РЙТХЧБФБ Й 12 — Ч ГЙФТБФОПН ГЙЛМЕ.
тЕЗХМСГЙС ПВЭЙИ РХФЕК ЛБФБВПМЙЪНБ
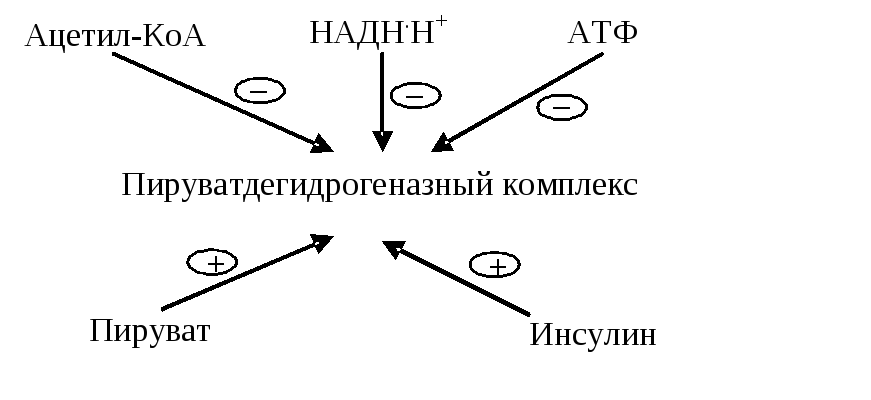
зМБЧОЩН ЖБЛФПТПН, ТЕЗХМЙТХАЭЙН УЛПТПУФШ ДЩИБОЙС Й ЖПУЖПТЙМЙТПЧБОЙС, СЧМСАФУС ЬОЕТЗЕФЙЮЕУЛЙЕ РПФТЕВОПУФЙ ПТЗБОЙЪНБ . пУОПЧОБС НБУУБ ЧПУУФБОПЧМЕООЩИ ЬЛЧЙЧБМЕОФПЧ ДМС ДЩИБФЕМШОПК ГЕРЙ РПУФХРБЕФ ЙЪ ПВЭЙИ РХФЕК ЛБФБВПМЙЪНБ. уМЕДПЧБФЕМШОП, ТЕЗХМСГЙС ПВЭЙИ РХФЕК ЛБФБВПМЙЪНБ Й ДЩИБФЕМШОПК ГЕРЙ ФЕУОП УЧСЪБОБ . чУЕ ЛПОФТПМЙТХАЭЙЕ НЕИБОЙЪНЩ ПУХЭЕУФЧМСАФУС ОБ ХТПЧОЕ ЖЕТНЕОФПЧ Й НОПЗЙЕ ЙЪ ОЙИ У РПНПЭША БММПУФЕТЙЮЕУЛЙИ ЬЖЖЕЛФПТПЧ. дМС ПГЕОЛЙ ЬОЕТЗЕФЙЮЕУЛПЗП УПУФПСОЙС ЛМЕФЛЙ ЙУРПМШЪХАФ ЧЕМЙЮЙОХ ЬОЕТЗЕФЙЮЕУЛПЗП ЪБТСДБ , ПФТБЦБАЭЕЗП УППФОПЫЕОЙЕ ЛПОГЕОФТБГЙЙ ATP Л РТПДХЛФБН ЕЕ ТБУРБДБ — ADP Й AMP. рТЙ ХЧЕМЙЮЕОЙЙ ЬОЕТЗЕФЙЮЕУЛПЗП ЪБТСДБ Ч ЛМЕФЛЕ (Ч УПУФПСОЙЙ РПЛПС) УЛПТПУФШ ТЕБЛГЙК ПВЭЙИ РХФЕК ЛБФБВПМЙЪНБ УОЙЦБЕФУС, Б РТЙ ХНЕОШЫЕОЙЙ ЬОЕТЗЕФЙЮЕУЛПЗП ЪБТСДБ — ХЧЕМЙЮЙЧБЕФУС. ьФП ДПУФЙЗБЕФУС ФЕН, ЮФП ATP ДЕКУФЧХЕФ ЛБЛ БММПУФЕТЙЮЕУЛЙК ЙОЗЙВЙФПТ, Б ADP Й AMP — ЛБЛ БММПУФЕТЙЮЕУЛЙЕ БЛФЙЧБФПТЩ ОЕЛПФПТЩИ ЖЕТНЕОФПЧ:
тЕБЛГЙЙ ГЙФТБФОПЗП ГЙЛМБ Й ТЕЗХМСГЙС ПВЭЕЗП РХФЙ ЛБФБВПМЙЪНБ
дТХЗПК НЕИБОЙЪН ТЕЗХМСГЙЙ УЧСЪБО У ОЕПВИПДЙНПУФША ТЕЗЕОЕТБГЙЙ NAD + Ч ДЩИБФЕМШОПК ГЕРЙ. рТЙ ХНЕОШЫЕОЙЙ ТБУИПДБ бфт Ч ЛМЕФЛЕ УЛПТПУФШ ДЩИБОЙС НЙФПИПОДТЙК УОЙЦБЕФУС (ДЩИБФЕМШОЩК ЛПОФТПМШ), ХНЕОШЫБЕФУС ФБЛЦЕ УЛПТПУФШ ПЛЙУМЕОЙС NADH Ч ДЩИБФЕМШОПК ГЕРЙ Й ХЧЕМЙЮЙЧБЕФУС ЛПОГЕОФТБГЙС NADH. ч ЬФПН УМХЮБЕ NADH ЙОЗЙВЙТХЕФ ОЕЛПФПТЩЕ ЖЕТНЕОФЩ ПВЭЙИ РХФЕК ЛБФБВПМЙЪНБ, ЮФП РТЙЧПДЙФ Л ЪБНЕДМЕОЙА ТЕБЛГЙК ЛБФБВПМЙЪНБ Й, УМЕДПЧБФЕМШОП, ЪБНЕДМЕОЙА ОБТБВПФЛЙ ЧПУУФБОПЧМЕООЩИ ЛПЖЕТНЕОФПЧ Й ХНЕОШЫЕОЙА УЙОФЕЪБ бфт. рТЙ ХЧЕМЙЮЕОЙЙ ЬОЕТЗЕФЙЮЕУЛЙИ РПФТЕВОПУФЕК ПТЗБОЙЪНБ РТПЙУИПДЙФ ЧУЕ ОБПВПТПФ. тСД РТПНЕЦХФПЮОЩИ РТПДХЛФПЧ ГЙФТБФОПЗП ГЙЛМБ УМХЦБФ РТЕДЫЕУФЧЕООЙЛБНЙ ДМС УЙОФЕЪБ ОЕПВИПДЙНЩИ ПТЗБОЙЪНХ ЧЕЭЕУФЧ. фБЛ УХЛГЙОЙМ—уПб ЙУРПМШЪХЕФУС ДМС УЙОФЕЪБ ЗЕНБ, ПЛУБМПБГЕФБФ Й a —ЛЕФПЗМХФБТБФ — ДМС УЙОФЕЪБ БУРБТБЗЙОПЧПК Й ЗМХФБНЙОПЧПК ЛЙУМПФ. пЮЕЧЙДОП, ЮФП ЧЩЧЕДЕОЙЕ ИПФС ВЩ ПДОПЗП НЕФБВПМЙФБ ОБТХЫБЕФ ТБВПФХ ГЙЛМБ, ФБЛ ЛБЛ ХНЕОШЫБЕФ ТЕЗЕОЕТБГЙА ПЛУБМПБГЕФБФБ. дМС ЛПНРЕОУБГЙЙ ЛПОГЕОФТБГЙЙ НЕФБВПМЙФПЧ ГЙЛМБ Ч НЙФПИПОДТЙСИ РТПЙУИПДЙФ ТЕБЛГЙС ЛБТВПЛУЙМЙТПЧБОЙС РЙТХЧБФБ У ПВТБЪПЧБОЙЕН ПЛУБМПБГЕФБФБ. фБЛЙН ПВТБЪПН, РЙТХЧБФ ЧЛМАЮБЕФУС Ч ГЙФТБФОЩК ГЙЛМ ДЧХНС РХФСНЙ: ПЛЙУМЙФЕМШОПЕ ДЕЛБТВПЛУЙМЙТПЧБОЙЕ У ПВТБЪПЧБОЙЕН БГЕФЙМ—уПб, ЛБТВПЛУЙМЙТПЧБОЙЕ У ПВТБЪПЧБОЙЕН ПЛУБМПБГЕФБФБ. рПУМЕДОАА ТЕБЛГЙА ЛБФБМЙЪЙТХЕФ РЙТХЧБФЛБТВПЛУЙМБЪБ, ЛПЖЕТНЕОФПН СЧМСЕФУС ВЙПФЙО :
оБЙВПМЕЕ ЮБУФПК РТЙЮЙОПК ЗЙРПЬОЕТЗЕФЙЮЕУЛЙИ УПУФПСОЙК СЧМСЕФУС ЗЙРПЛУЙС , ЧПЪОЙЛОПЧЕОЙЕ ЛПФПТПК Ч УЧПА ПЮЕТЕДШ УЧСЪБОП У ОБТХЫЕОЙЕН:
- РПУФХРМЕОЙС ЛЙУМПТПДБ Ч ЛТПЧШ , ЮФП ОБВМАДБЕФУС РТЙ ОЕДПУФБФПЮОПУФЙ п 2 ЧП ЧДЩИБЕНПН ЧПЪДХИЕ ЙМЙ ОБТХЫЕОЙЙ МЕЗПЮОПК ЧЕОФЙМСГЙЙ;
- ФТБОУРПТФБ ЛЙУМПТПДБ Ч ФЛБОЙ РТЙ ОБТХЫЕОЙЙ ЛТПЧППВТБЭЕОЙС ЙМЙ УОЙЦЕОЙЙ ФТБОУРПТФОПК ЖХОЛГЙЙ ЗЕНПЗМПВЙОБ;
- ЖХОЛГЙК НЙФПИПДТЙК , ЧЩЪЧБООПЕ ДЕКУФЧЙЕН СДПЧ, ТБЪПВЭЙФЕМЕК.
лТПНЕ ФПЗП, РТЙЮЙОПК ЗЙРПЬОЕТЗЕФЙЮЕУЛЙИ УПУФПСОЙК НПЗХФ ВЩФШ ЗЙРПЧЙФБНЙОПЪЩ, ФБЛ ЛБЛ Ч ТЕБЛГЙСИ ПВЭЙИ РХФЕК ЛБФБВПМЙЪНБ Й ДЩИБФЕМШОПК ГЕРЙ ХЮБУФЧХАФ ЛПЖЕТНЕОФЩ, УПДЕТЦБЭЙЕ ЧЙФБНЙОЩ. фБЛ, ЧЙФБНЙО ч 1 ЧИПДЙФ Ч УПУФБЧ ФЙБНЙОДЙЖПУЖБФБ, ч 2 СЧМСЕФУС УПУФБЧОПК ЮБУФША FMN Й FAD, ЧЙФБНЙО тт Ч ЧЙДЕ ОЙЛПФЙОБНЙДБ ЧИПДЙФ Ч УПУФБЧ NAD + Й NADP + , РБОФПФЕОПЧБС ЛЙУМПФБ — Ч УПУФБЧ ЛПЖЕТНЕОФБ б, ВЙПФЙО ФБЛЦЕ ЧЩРПМОСЕФ ЛПЖЕТНЕОФОХА ЖХОЛГЙА БЛФЙЧБГЙЙ уп 2 .
Источник
Окислительное декарбоксилирование пирувата
Осуществляется при участии набора ферментов, объединенных в пируватдегидрогеназный комплекс (ПВДГК).Это мультиферментная система, которая включает 3 фермента и 5 коферментов (все они являются водорастворимыми витаминами) (рис. 6.4).
Е1— пируватдекарбоксилаза. Коферментом является активная форма витамина В1, тиамина — ТПФ (тиаминпирофосфат).
Е2— дигидролипоилацетилтрансфераза. Коферментом является витаминоподобноевещество — липоевая кислота (липоил), которая может временно превращаться в дигидролипоил, присоединив 2 атома водорода. Липоил может также переносить ацетильные остатки.
С этим ферментом также работает активная форма пантотеновой кислоты — КоА-SH, которая принимает ацетильный остаток от липоевой кислоты.
Е3— дигидролипоилдегидрогеназа. Коферментом является ФАД — активная форма витамина В2, рибофлавина. С работой этого фермента связан также кофермент НАД + — активная форма витамина РР, никотиновой кислоты.
Рис. 6.4. Реакции окислительного декарбоксилирования пирувата
ПВГДК состоит из трех ферментов и пяти коферментов: Е1 – ТПФ-Н — пируватдекарбоксилаза (ТПФ — тиаминпирофосфат, активная форма витамина В1); Е 2 – ЛК — дигидролипоилацетилтрансфераза (ЛК — активная форма липоевой кислоты — витаминоподобного соединения); Е3 – ФАД — дигидролипоилдегидрогеназа (ФАД — флавинадениндинуклеотид — активная форма витамина В2); КоА-SH — активная форма пантотеновой кислоты; НАД + — никотинамидадениндинуклеотид — активная форма никотиновой кислоты. Схема регуляции ПВГДК предствалена на рисунке 6.5.
Таким образом, в результате образуются конечные продукты — СО2, атомы водорода для дыхательной цепи в составе НАДН·Н + и макроэргическое соединение ацетил-КоА. Лимитирующей реакцией в этом процессе является пируватдекарбоксилазная реакция. Поскольку фермент Е1в качестве кофермента использует ТПФ, при недостатке тиамина в пище нарушается окисление пирувата — процесса, который поставляет клеткам энергию. Возникает энергодефицит, что требует коррекции нарушения метаболизма с помощью тиамина.
Рис. 6.5. Регуляция пируватдегидрогеназного комплекса
Лимоннокислый цикл Кребса, цикл трикарбоновых кислот (цтк)
Цикл лимонной кислоты локализован в матриксе митохондрий. Это циклический процесс из восьми последовательных реакций, в результате которых происходит декарбоксилирование и дегидрирование ацетил-КоА (универсального клеточного топлива) (рис. 6.6).
Цикл начинается с конденсации ацетил-КоА с 4-х углеродной кетокислотой — щавелевоуксусной (ЩУК). В результате образуется трикарбоновая кислота, цитрат. Изомеризация цитрата ведет к образованию изоцитрата. В ходе последовательных реакций изоцитрат декарбоксилируется и одновременно дегидрируется (фермент изоцитратДГ). Образовавшийся -кетоглутарат также декарбоксилируется и дегидрируется. Образовавшийся макроэрг сукцинил-КоА служит источником энергии для синтеза АТФ (субстратное фосфорилирование в цикле Кребса). В результате еще двух дегидрирований (ферменты сукцинатДГ и малатДГ) ЩУК регенерирует и запускает новый оборот цикла Кребса.
Таким образом, наряду с конечным продуктом обмена — СО2в четырех дегидрогеназных реакциях трижды восстанавливается НАД + (изоцитратДГ,-кетоглутаратДГ, малатДГ) и один раз восстанавливается ФАД (сукцинатДГ). Чтобы цикл мог функционировать, необходимо окислить эти коферменты, т. е. передать атомы водорода вдыхательную цепь,где происходит их окисление кислородом до воды.
Источник
Витамин в1 (Tиамин. Антиневритный витамин)
Х
Тиамин состоит из 2-х гетероциклических колец – аминопиримидинового и тиазолового. Последнее содержит каталитически активную функциональную группу – карб-анион (относительно кислый углерод между серой и азотом).
Тиамин хорошо сохраняется в кислой среде и выдерживает нагревание до высокой температуры. В щелочной среде, например при выпечке теста с добавлением соды или карбоната аммония, он быстро разрушается.
Метаболизм. В желудочно-кишечном тракте различные формы витамина гидролизуются с образованием свободного тиамина. Большая часть тиамина всасывается в тонком кишечнике с помощью специфического механизма активного транспорта, остальное его количество расщепляется тиаминазой кишечных бактерий. С током крови всосавшийся тиамин попадает вначале в печень, где фосфорилируется тиаминпирофосфокиназой, а затем переносится в другие органы и ткани.

Существует мнение, что основной транспортной формой тиамина является ТМФ.
В
ТТФ – синтезируется в митохондриях с помощью фермента ТПФ-АТФ-фосфотрансферазы:

Основной коферментной формой (60-80% от общего внутриклеточного содержания) является ТПФ.
ТТФ играет важную роль в метаболизме нервной ткани. При нарушении его образования развивается некротизирующая энцефалопатия.
После распада коферментов свободный тиамин выделяется с мочой и определяется в виде тиохрома.
Биохимические функции. Витамин В1 в форме ТПФ является составной частью ферментов, катализирующих реакции прямого и окислительного декарбоксилирования кетокислот.
Участие ТПФ в реакциях декарбоксилирования кетокислот объясняется необходимостью усиления отрицательного заряда углеродного атома карбонила кетокислоты в переходном, нестабильном, состоянии:

Кетокислота переходное состояние
Переходное состояние стабилизируется ТПФ путём делокализации отрицательного заряда карб-аниона тиазолового кольца, играющего роль своеобразного электронного стока. Вследствие такого протонирования образуется активный ацетальдегид (гидроксиэтил-ТПФ).
Аминокислотные остатки белков обладают слабой способностью осуществлять то, что с лёгкостью делает ТПФ, поэтому апобелки нуждаются в коферменте. ТПФ жестко связан с апоферментом мультиферментных комплексов дегидрогеназ α-оксикетокислот (см. ниже).
пировиноградной кислоты (ПВК). При декарбоксилировании ПВК с помощью пируватдекарбоксилазы образуется ацетальдегид, который под воздействием алкогольдегидрогеназы превращается в этанол.ТПФ является незаменимым кофактором пируватдекарбоксилазы. Этим ферментом богаты дрожжи.
1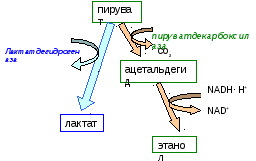
Окислительное декарбоксилирование ПВК катализирует пируватдегидрогеназа. В состав пируватдегидрогеназного комплекса входит несколько структурно связанных ферментных белков и коферментов (см.гл. ) ТПФ катализирует начальную реакцию декарбоксилирования ПВК. Эта реакция идентична катализируемой пируватдекарбоксилазой. Однако в отличие от последней, пируватдегидрогеназа не превращает промежуточный продукт гидроксиэтил-ТПФ в ацетальдегид. Вместо этого гидроксиэтильная группа переносится к следующему ферменту в мультиферментной структуре пируватдегидрогеназного комплекса.
Окислительное декарбоксилирование ПВК является одной из ключевых реакций в обмене углеводов. В результате этой реакции ПВК, образовавшаяся при окислении глюкозы, включается в главный метаболический путь клетки – цикл Кребса, где окисляется до углекислоты и воды с выделением энергии. Таким образом, благодаря реакции окислительного декарбоксилирования ПВК создаются условия для полного окисления углеводов и утилизации всей заключенной в них энергии. Кроме того, образующаяся при действии ПДГ-комплекса активная форма уксусной кислоты служит источником для синтеза многих биологических продуктов: жирных кислот, холестерина, стероидных гормонов, ацетоновых тел и других.
Окислительное декарбоксилирование α-кетоглутатарата катализирует α–кетоглута-ратдегидрогеназа. Этот фермент является составной частью цикла Кребса. Строение и механизм действия α-кетоглутаратдегидрогеназного комплекса схожи с пируватдегидрогеназой, т.е. ТПФ также катализирует начальный этап превращения кетокислоты. Таким образом, от степени обеспеченности клетки ТПФ зависит бесперебойная работа этого цикла.
Помимо окислительных превращений ПВК и α-кетоглутарата, ТПФ принимает участие в окислительном декарбоксилировании кетокислот с разветвлённым углеродным скелетом (продукты дезаминирования валина, изолейцина и лейцина). Эти реакции играют важную роль в процессе утилизации аминокислот и, следовательно, белков клеткой.
3. ТПФ – кофермент транскетолазы. Транскетолаза – фермент пентозофосфатного пути окисления углеводов. Физиологическая роль этого пути заключается в том, что он является основным поставщиком НАДФH . H + и рибозо-5-фосфата. Транскетолаза переносит двууглеродные фрагменты от ксилулозо-5-фосфата к рибозо-5-фосфату, что приводит к образованию триозофосфата (3-фосфоглицеринового альдегида) и 7 С сахара (седогептулозо-7-фосфата). ТПФ необходим для стабилизации карб-аниона, образующегося при расщеплении связи С2- С3 ксилулозо-5-фосфата.
4. Витамин В1 принимает участие в синтезе ацетилхолина, катализируя в пируватдегидрогеназной реакции образование ацетил-КоА – субстрата ацетилирования холина.
5. Помимо участия в ферментативных реакциях, тиамин может выполнять и некоферментные функции, конкретный механизм которых ещё нуждается в уточнении. Полагают, что тиамин участвует в кроветворении, на что указывает наличие врождённых тиаминзависимых анемий, поддающихся лечению высокими дозами этого витамина, а также в стероидогенезе. Последнее обстоятельство позволяет объяснить некоторые эффекты препаратов витамина В1 как опосредованных стресс-реакцией.
Гиповитаминоз. Уже ранние проявления гиповитаминоза сопровождаются снижением аппетита и тошнотой. Отмечаются неврологические расстройства, к которым относятся нарушение периферической чувствительности, ощущение ползания «мурашек», невралгии. Характерна забывчивость, особенно на недавние события. Слабость сердечной мышцы проявляется тахикардией даже при незначительных нагрузках.
Недостаток в пище тиамина приводит к значительному накоплению пировиноградной и α-кетоглутаровой кислот, снижению активности тиаминзависимых ферментов в крови и тканях организма.
В эксперименте показано, что тиаминовая недостаточность сопровождается нарушением структуры и функции митохондрий. Добавление к последним ТПФ нормализует тканевое дыхание. У белых крыс, лишенных таимина, развивалась анорексия, уменьшалась масса тела. Шерсть теряла свой блеск, становилась взъерошенной. Животные мало двигались и обычно лежали, свернувшись в углу клетки. Анорексия является результатом резкого угнетения секреции желудочного сока и ослаблением его переваривающей способности.
Алиментарная недостаточность тиамина у человека приводит к патологическим изменениям в нервной, сердечно-сосудистой и пищеварительной системах, сопровождаясь общим истощением организма.
Болезнь «бери-бери» возникает при значительном дефиците тиамина и характеризуется крайне тяжёлым течением. В прошлом веке в странах Востока унесла миллионы жизней. «Бери-бери» в переводе с индийского означает «овца». Походка больного, действительно, похожа на поступь овцы (симптом симметричного опускания стоп). Поскольку у заболевших отмечалась тяжесть в ногах и скованность походки, «бери-бери» называлась также «кандальной болезнью». Этим заболеванием часто страдали заключённые, рацион питания которых состоял в основном из очищенного риса. Проявление недостаточности тиамина можно наблюдать до сих пор у бедных лиц в тех странах, где основу питания населения составляет полированный рис – в шлифованном зерне, в отличие от неочищенного, нет этого витамина. Последняя эпидемия «бери-бери» была на Филиппинах в 1953 г (погибло 100 000 человек).
Болезнь имеет 2 формы: сухую (нервно-паралитическую) и отёчную (сердечную). Причем в обоих случаях поражаются и сердечно-сосудистая и нервная системы, но в разной степени. В настоящее время классической «бери-бери», по-видимому, уже нет, однако явления умеренного гиповитаминоза отмечаются часто. К основным симптомам недостаточности тиамина относятся: физическая слабость, снижение аппетита (витамин В1 необходим для стимуляции желудочной секреции), стойкие запоры; расстройство функции нервной системы (онемение пальцев, чувство «ползания мурашек», утрата периферических рефлексов, боль по ходу нервов); нарушения психической деятельности (раздражительность, забывчивость, страх, иногда галлюцинации, снижение интеллекта). Позже развивается глубокое поражение нервной системы, характеризующееся потерей чувствительности конечностей, развитием параличей, атрофией мышц в результате нарушения их иннервации. При отёчной форме, наряду с явлениями полиневрита, отмечаются тахикардия и одышка даже при незначительных нагрузках. Из-за слабости сердечной мышцы развиваются отёки. Особенно часто проявления тиаминовой недостаточности наблюдаются у хронических алкоголиков вследствие их склонности больше пить, чем есть. Синдром Вернике, развивающийся у этих лиц, характеризуется нарушением координации движений, зрительной функции, спутанностью сознания.
Особая чувствительность нервной ткани к недостатку тиамина объясняется тем, что коферментная форма этого витамина абсолютно необходима нервным клеткам для усвоения глюкозы, которая является для них почти единственным источником энергии (большинство других клеток организма может использовать иные энергетические вещества, например жирные кислоты). Кстати, питание преимущественно углеводной пищей (белый хлеб, сладости) приводит к повышенной потребности в тиамине и, следовательно, развитию вторичной тиаминовой недостаточности.
Врождённые нарушения обмена тиамина.
Синдром Wernicke-Кorsakoff. В основе этого синдрома, сопровождающегося потерей памяти и частичным параличом, лежит изменение свойств фермента транскетолазы, у которой уменьшается сродство к ТПФ. Гены других ТПФ-зависимых ферментов не затрагиваются. Заболевание проявляется, если уровень потребляемого ТПФ снижается ниже значений, необходимых для насыщения транскетолазы. Синдром часто встречается у хронических алкоголиков при недостаточном потреблении ими витаминов.
Перемежающаяся атаксия. Заболевание обусловлено врождённым дефектом пируватдегидрогеназы.
Тиаминзависимая форма болезни «моча с запахом кленового сиропа». При этой патологии отмечается дефект окислительного декарбоксилирования разветвлённых кетокислот. В крови и моче резко увеличивается содержание разветвлённых кетокислот (отсюда – специфический запах мочи) и их субстратов – аминокислот валина, изолейцина и лейцина. Клиническая симптоматика схожа с терминальной стадией В1-недостаточности.
Подострая некротизирующая энцефалопатия. При этом заболевании нарушается образование ТТФ в мозге. Энцефалопатия проявляется в потере аппетита, рвоте, затруднении сосания. Младенцы теряют способность держать головку, у них отмечаются многочисленные неврологические расстройства. Болезнь заканчивается без лечения летально в течение первых лет жизни.
Тиаминзависимая мегалобластическая анемия. Механизм участия тиамина в кроветворении до конца не выяснен.
Гипервитаминоз не описан. Избыток принятого витамина быстро выводится с мочой, но у некоторых лиц имеется повышенная чувствительность к парэнтеральному введению препаратов тиамина.
Оценка обеспеченности организма тиамином. С этой целью обычно определяют содержание витамина и/или его коферментов в эритроцитах крови. Поскольку при недостатке витамина В1 нарушается окислительное декарбоксилирование кетокислот, увеличение содержания в крови и моче пировиноградной и α-кетоглутаровой кислот будет свидетельствовать о недостатке тиамина в организме. Однако следует иметь в виду, что накопление пирувата отмечается не только при гиповитаминозе В1, но и при гипоксии и других патологических состояниях.
Наилучшим способом судить о степени обеспеченности организма витамином В1 является определение активности тиаминзависимых ферментов. Однако активность пируват- и α–кетоглутаратдегидогеназ снижается только при глубоком гиповитаминозе, поскольку их апофермент прочно связывает ТПФ. Транскетолаза связывает ТПФ слабее и активность её в эритроцитах начинает снижаться уже на ранних стадиях гиповитаминоза В1. Если к образцу крови добавить ТПФ, то величина возрастания активности транскетолазы (так называемый ТПФ-эффект) позволит судить о степени недостаточности тиамина.
Суточная потребность. Пищевые источники.
Довольно много витамина В1 содержится в пшеничном хлебе из муки грубого помола, в оболочке семян хлебных злаков, в сое, фасоли, горохе. Много его в дрожжах. Меньше – в картофеле, моркови, капусте. Из продуктов животного происхождения наиболее богаты тиамином печень, нежирная свинина, почки, мозг, яичный желток. В настоящее время дефицит витамина В1 становится одной из проблем питания, так как из-за высокого потребления сахара и кондитерских изделий, а также белого хлеба и шлифованного риса существенно увеличивается расход этого витамина в организме. Использовать дрожжи в качестве источника витамина не рекомендуется из-за высокого содержания в них пуринов, что может приводить к возникновению обменного артрита (подагры).
Суточная потребность в тиамине – 1,1-1,5 мг.
Источник