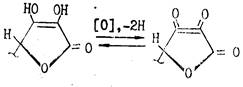Витамин с технологическая схема получения
Аскорбиновая кислота — γ-лактон 2,3-дегидро-L-гулоновой кислоты, или L-трео-2,3,4,5,6-пентагидроксигексен-2-овая кислота-4-лактон, витамин С — один из важнейших витаминов для человека и теплокровных животных [81, 149–152, 161].
Получение аскорбиновой кислоты [148, 149]
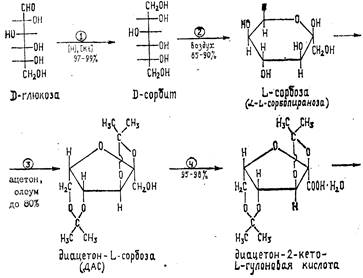
Аскорбиновая кислота в промышленности производится из D-глюкозы по методу Рейхштейна — Грюсснера (рис. 15.6.58).
Рис. 15.6.58. Схема синтеза аскорбиновой кислоты
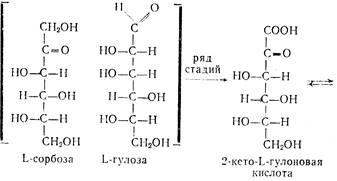
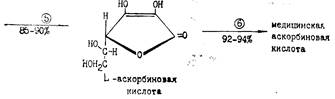
D-Глюкозу (19) гидрируют в D-сорбит (30) и ферментативно (Acetobacter suboxydans) окисляют его в L-сорбозу (23). Циклическую форму α -L-сорбофуранозы действием ацетона и серной кислоты превращают в диизопропилиденсорбозу (62). Ацетонирование сорбозы при низких температурах (–5 °С) дает существенное повышение выхода ди-О-изопропилиденового производного. Дальнейшее окисление диацетонсорбозы до кислоты (63) обычно выполняется с помощью гипохлорита натрия в присутствии сульфата никеля. Изопропилиденовые защитные группировки снимают действием хлороводородной кислоты в безводной среде (этанол-хлороформ, 65 °С, 50 ч). Образующаяся циклическая форма переходит в 2-оксогулоновую кислоту (64), при действии на которую кислоты происходит лактонизация; промежуточно образующееся соединение затем енолизуется, давая аскорбиновую кислоту (65).
Сырой продукт выделяют, очищают активированным углем и перекристаллизовывают из воды. Обычно выход на каждой стадии превышает 90 %, выход конечного продукта в расчете на исходную глюкозу превышает 50 %.
L-Аскорбиновая кислота представляет собой кристаллическое вещество белого цвета, проявляющее достаточно сильные кислотные и восстановительные (окислительный потенциал равен +127 мВ) свойства (табл. 15.6.67).
Таблица 15.6.67
Физические свойства L-аскорбиновой кислоты [149]
| Показатель | Значение |
|---|---|
| Молекулярная масса | 176,14 |
| Температура плавления, °С | 190–192 (с разложением) |
| Плотность, г/см 3 | 1,65 |
| рK1 (С3–ОН) | 4,25 |
| рK2 (С2–ОН) | 11,79 |
.files/image005.gif) в воде в воде | +23 |
.files/image009.gif) в метаноле в метаноле | +49 |
| Растворимость при 20 °С, г/100 см 3 : | |
| в воде | 33 |
| в этаноле | 3 |
| в глицерине | 1 |
Производные аскорбиновой кислоты [150]
Наиболее многочисленными производными аскорбиновой кислоты, используемыми в медицинской практике, являются ее различные эфиры.
Противоопухолевыми средствами, проявляющими высокую активность, являются 5,6-О-бензилиден- (66) и 5,6-О-диизопропилиденаскорбиновая (67) кислоты и их соли щелочных и щелочноземельных металлов (рис. 15.6.59).
Рис. 15.6.59. Строение производных аскорбиновой кислоты
Алкилированные сложные эфиры аскорбиновой кислоты (68) используются для предупреждения и лечения расстройств системы кровообращения.
3-О-Глюкозиласкорбинат (69) активирует фагоцитарную активность при суточной дозе 1–500 мг/кг, поэтому он рекомендуется для лечения бактериальных и вирусных инфекционных заболеваний.
6-О-Ретиноильный (70), 2,6-О-диретиноильный (71) и 2,5,6-О-триретиноильный (72) эфиры аскорбиновой кислоты (рис. 15.6.60) обладают активностью как витамина А, так и витамина С и рекомендованы в качестве добавок к пище.
Рис. 15.6.60. Ретиноильные эфиры аскорбиновой кислоты
Во Франции, ФРГ и США выпускают препарат, содержащий аскорбинат железа и технеций, использующийся для обнаружения новообразований. При лечении лейкемии комплексом аскорбиновой кислоты с титаном и медью (Ti 3+ : Cu 2+ : аскорбиновая кислота = 1 : 6 : 36) при приеме в течение двух лет дозами 200 мг/день наблюдали полное выздоровление пациентов. Этот же комплекс является активным препаратом против артрита в виде водного раствора или таблеток в дозе 100–200 мг/сут.
При острой и хронической ишемической кардиопатии применяют аскорбинат магния вместе с пиридамолом в соотношении 5 : (1–15) : 1. При мускульной усталости рекомендуется препарат, содержащий смесь калиевой и магниевой солей аскорбиновой кислоты. Двойная магниевая соль аскорбиновой кислоты и аспарагина рекомендуется как средство против астении при физической и умственной усталости.
Комплексы кобальта и железа с аскорбиновой и аминомасляной кислотами обладают противосудорожным действием. При железодефицитных анемиях рекомендуется применение аскорбината железа.
Аскорбинат цинка проявляет бактерицидную активность и стимулирует образование коллагена при пероральном введении.
Аскорбинат натрия рекомендуется применять при бронхиальной астме. Эта соль также значительно увеличивает бактерицидную активность салицилата натрия, тетрациклина и пенициллина относительно стафилококков.
При различных обменных нарушениях широко используется аскорбинат кальция, который регулирует солевое содержание в организме.
Фармацевтическое средство против ревматического артрита содержит в качестве активного компонента хининсульфат и аскорбиновую кислоту, которые, вероятно, образуют аддукт.
Аскорбиновую кислоту и ее соли используют в качестве антиоксидантов для стабилизации фармацевтических препаратов и пищевых продуктов [153].
Источник
Технология получения витамина С (L-аскорбиновая кислота)
Витамин С, необходимый для нормальной жизнедеятельности человека, впервые выделен из лимона. Он участвует во многих видах окислительновосстановительных процессов, положительно действует на нервную систему; выступает как мощный противоцинготный препарат.
Рис. 6.11. Строение витамина С
Витамин С синтезируют следующими способами:
— экстракция из растений;
— смешанный ферментативно-химический синтез.
В промышленных масштабах витамин С получают двумя способами:
1) метод Рейхштейна;
2) двухстадийный ферментативный синтез.
Метод Рейхштейна впервые использован в 1933 г. и до сих пор применяется компаниями «BASF», «Roshe», «Takeda». Его сущность заключается в двухстадийном превращении L-сорбозы в диацетонкетогулоновую кислоту. Процесс получения аскорбиновой кислоты представлен на рис. 6.12.
Рис. 6.12. Схема процесса получения аскорбиновой кислоты
Рис. 6.13. Схема ферментативного способа (а) и химизм получения L-аскорбиновой кислоты (б)
Технология включает 5 стадий:
1) получение D-сорбита из D-глюкозы методом каталитического восстановления глюкозы водородом при давлении 8-10 МПа и температуре 135140°C;
2) получение а-сорбозы из D-сорбита путем биохимического глубинного окисления;
3) получение диацетонсорбозы из сорбозы путем обработки сорбозы ацетоном в присутствии серной кислоты;
4) окисление диацетонсорбозы в диацетонкетогулоновую кислоту с помощью КМпО4 или других сильных окислителей;
5) образование аскорбиновой кислоты в среде органического растворителя (хлороформа или дихлорэтана) в присутствии соляной кислоты, после чего техническую аскорбиновую кислоту перекристаллизовывают в чистый продукт.
Известен способ получения аскорбиновой кислоты с помощью микроорганизмов. Питательной средой выступают глюкоза и дрожжи (
200 мг/г биомассы) либо грибы рода Fusarium или рода Aspergillus и бактерии Strepto- cocous thermopiles.
Витамин С выпускают в различных формах — в виде порошков, гранул, аскорбатов натрия и кальция (рис. 6.13, а) [6].
Получение витамина группы D
Под этим термином понимают несколько соединений, относящихся к стеринам; наиболее активными из них являются эргокальциферол (D2) (рис. 6.14) и холкальциферол (D3) [5].
Витамин D регулирует содержание кальция и неорганического фосфора в крови, участвует в минерализации костей. Его хронический дефицит приводит к развитию рахита у детей и разрежению костей у взрослых (остеопороз). Кальциферолы содержатся в продуктах животного происхождения — рыбьем жире, печени трески, яйцах. При избытке витамина D у детей и взрослых (гипер- витаминоз) развивается интоксикация. Витамин D не разрушается при кулинарной обработке, очень чувствителен к свету, действию кислорода.
Витамин D2 получают по технологической схеме, сходной с представленной на рис. 6.5.
Источник
Курсовая работа: Технология производства аскорбиновой кислоты (витамина С)
| Название: Технология производства аскорбиновой кислоты (витамина С) Раздел: Рефераты по химии Тип: курсовая работа Добавлен 14:59:35 05 декабря 2010 Похожие работы Просмотров: 10776 Комментариев: 15 Оценило: 9 человек Средний балл: 5 Оценка: 5 Скачать | |||||||||||||||
 |
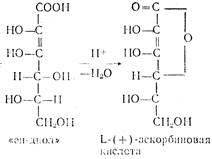 |
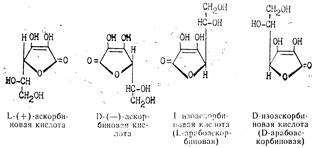
Аскорбиновая кислота имеет два асимметрических атома углерода в положениях 4 и 5 и образует четыре оптических изомера и два рацемата:
Биологически активной является L-(+)-форма. Д-(—)-форма является антивитамином и не существует в природе. Принятое строение аскорбиновой кислоты подтверждается рентгеноструктурным анализом. Молекулярная модель, установленная этим методом, показывает, что все атомы углерода и кислорода цикла лежат в одной плоскости, кроме С4 , лежащего вне ее.
Аскорбиновая кислота представляет собой белое кристаллическое вещество с Тпл 192°, очень чувствительна к нагреванию, хорошо растворима в воде, плохо в спиртах (за исключением метанола), практически нерастворима в неполярных растворителях. Она очень чувствительна к тяжелым металлам, медь и железо разрушающе, действуют на аскорбиновую кислоту. Аскорбиновая кислота легко отщепляет протон гидроксила в положении Сз кольца и по силе не уступает карбоновым кислотам:
Аскорбиновая кислота является двухосновной, однако, ее считают практически одноосновной, поскольку pKI =4 12 а рКII =11,57.
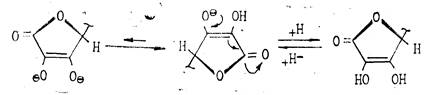
Кислотность обусловлена фенольной НО-группой. Аскорбиновая кислота легко образует соли — наиболее известна ее натриевая соль (аскорбинат натрия). Аскорбиновая кислота очень легко окисляется и обладает сильной восстановительной способностью. Процесс окисления аскорбиновой кислоты протекает сложно, начальной стадией его является образование т. н. дегидроаскорбиновой кислоты под влиянием кислорода воздуха или других окислителей. Этот процесс является обратимым:
При рН этерификация —> «енолизация» —> «лактонизация»).
6 стадия. Получение медицинской аскорбиновой кислоты. Перекристаллизация технической аскорбиновой кислоты.
Выход продукта в пересчете па глюкозу составляет в целом до 54%.
Химическая схема производства аскорбиновой кислоты
 | ||
 | ||
Технология производства аскорбиновой кислоты
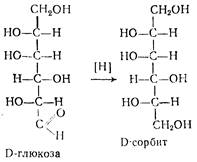
Стадия 1. Производство D-сорбита из D-глюкозы
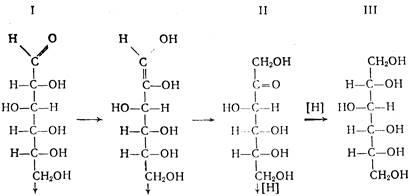
В производстве синтетической аскорбиновой кислоты D-сорбит является первым промежуточным продуктом синтеза. D-сорбит представляет собой белый кристаллический порошок, легко растворимый в воде. Сырьем для его производства является D-глюкоза. Это сравнительно дорогое сырье, стоимость его составляет 40—44% от себестоимости аскорбиновой кислоты, поэтому замена D-глюкозы на непищевые виды сырья является важной проблемой.
Процесс восстановления D-глюкозы можно осуществлять двумя методами:
Электролитическое восстановление D-глюкозы в D-сорбит осуществляется при комнатной температуре в электролизерах со свинцовыми анодами и катодами из сплава никеля. Процесс проводят в присутствии NaOH и сульфата натрия или аммония при рН=10. Преимущество процесса заключается в мягких условиях его проведения, в отсутствии дорогостоящих катализаторов и автоклавов. Однако в процессе электролитического восстановления получается раствор D-сорбита, загрязненный его изомером—D-маннитом (до 15%). Разделение этих изомеров представляет большие трудности. Недостатком процесса является также высокая щелочность раствора и сложность конструкции электролизера. Поэтому в настоящее время на витаминных предприятиях принят каталитический метод.
Каталитическое гидрирование (восстановление) можно представить следующей схемой:
Выход составляет 98—99% от теоретически возможного. Особенностью этой стадии производства является протекание ряда побочных реакций: окисление D-глюкозы (I) в D-глюконовую кислоту (VI) кислородом воздуха в присутствии катализатора; фенолизация D-глюкозы в щелочной среде с последующей изомеризацией в D-фруктозу (II) и D-маннозу (IV). D-фруктоза может далее превращаться в D-сорбит (III) и D-маннит (V). В побочных процессах гидрогенолиза глюкозы, кроме D-сорбита, образуются также этиленгликоль, глицерин, пропиленгликоль и др. побочные продукты. Основные побочные процессы протекают по схеме:
 | ||
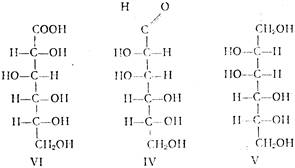 | ||
Основная задача при осуществлении технологического процесса—свести к минимуму образование этих побочных продуктов. Это достигается рядом мер, которые будут рассмотрены несколько позже.
Технологическая схема получения D-сорбита включает следующие операции:
1) Приготовление и регенерация скелетного никелевого катализатора.
2) Приготовление 50—55%-ного раствора D-глюкозы.
3) Получение D-сорбита.
4) Очистка водного раствора D-сорбита от ионов тяжелых металлов.
5) Получение кристаллического D-сорбита для выпуска пищевого D-сорбита.
Процесс гидрирования глюкозы осуществляют двумя способами: или автоклавным периодическим способом, или в непрерывно действующих аппаратах.
Процесс приготовления и регенерации никелевого катализатора из сплава Ni—Al изучался ранее в других курсах, поэтому в предлагаемом тексте лекций не рассматривается.
Для гидрирования приготавливают 50—55%-ный водный раствор D-глюкозы при 70—75°С, очищают раствор активированным углем при 75 °С, фильтруют через нутч-фильтр. В очищенный раствор добавляют известковую воду до рН 8,0—8,1 и раствор направляют на гидрирование.
В настоящее время разработан способ непрерывной очистки 50%-ных растворов глюкозы на гранулированном угле АГ-3. Расход его значительно меньше, чем порошкообразного, он легче регенерируется. Наряду с этим проводятся исследования по очистке 50%-ных водных растворов глюкозы с использованием полимерных мембран и ионообменных смол.
Автоклавный процесс гидрирования осуществляют при температуре 135—140°С, и рН=7,5—7,8 под давлением 70— 100 атм. при непрерывной подаче водорода, полученного электролитическим путем, в автоклав. Окончание процесса определяют по прекращению падения давления водорода в автоклаве в течение 20 мин. Раствор сорбита охлаждают до 75— 80 °С, снижают давление в автоклаве до 5—7 атм. и направляют раствор сорбита совместно с катализатором на фильтрацию. Катализатор отделяют на друк-фильтре и тщательно отмывают горячей водой. Затем катализатор направляют на регенерацию. Как уже указывалось, процесс гидрирования сопровождается рядом побочных реакций. Для того, чтобы свести их к минимуму, необходимо в периодическом процессе:
— не допускать хранения щелочного раствора D-глюкозы с катализатором;
— проводить реакцию гидрирования при рН, близком к нейтральному (7,3—7,5), т. к. в щелочной среде D-глюкоза будет подвергаться распаду при t==135—140°С.
Однако при смешении катализатора с раствором D-глюкозы в автоклаве наблюдается некоторое снижение величины рН, поэтому рН раствора в начале процесса следует доводить до 8,0, а раствор глюкозы готовить на дистиллированной воде (он должен быть прозрачным и не содержать посторонних солей). Следует использовать особо чистый, электролитический водород. Катализатор необходимо тщательно подготовить и промыть. Величина зерен катализатора—1—2 мм. Остаточное содержание глюкозы по окончании гидрирования не должно превышать 0,1% по массе.
Па предприятиях Венгрии, Германии, некоторых американских фирм, в России (г. Йошкар-Ола) процесс гидрирования глюкозы в сорбит ведут непрерывным способом.
При непрерывном способе более эффективным является применение суспензированного катализатора, т. к. при этом достигается повышение контактной поверхности катализатоpa и наилучшее использование объема автоклава. На основе венгерской лицензионной технологии процесс гидрирования в Йошкар-Оле (рис. 1) осуществляют в каскаде из колонных автоклавов при температуре 140—165°С и давлении 150 атм.
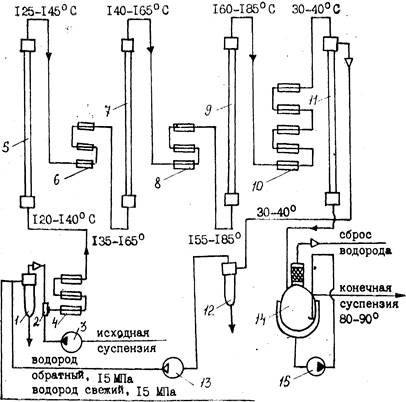 |
Рис. 1. Схема узла гидрирования D-глюкозы непрерывным способом:
1 — маслоотделитель; 2 — смеситель; 3-—насос высокого давления; 4, 6. 8 — пароподогреватели высокого давления; 5, 7, 9 — — реакторы высокого давления: 10 — холодильник высокого давления; 11—сепаратор высокого давления; 12 — брызугоуловитель высокого давления; 13 — циркуляционный компрессор; 14 — сепаратор с брызгоуловителем; 15 — циркуляционный насос
Предварительно готовят 50%-ный раствор глюкозы при t=80°С, охлаждают его до 30—40 °С и подают на гидрирование через специальный смеситель с катализатором.
В системе смесителей готовят 10%-ную суспензию никелевого катализатора в известковой или аммиачной воде, смешивают ее с 50%-ным раствором глюкозы и насосами-дозаторами направляют в три последовательно соединенные колонны. Водород подается в тот же смеситель. По окончании процесса гидрирования раствор сорбита совместно с катализатором поступает для сепарации водорода в сборник, а затем на фильтрацию (система сепаратор—фильтр). Отработанный катализатор промывают горячей водой и передают на регенерацию, а раствор D-сорбита — на очистку.
В настоящее время проведены испытания более технологичного и простого процесса гидрирования на стационарном никелевом катализаторе. Медно-никелевый стационарный катализатор применяют в ГДР для гидрирования глюкозы при t=120—140°С и избыточном давлении 201—240 кгс/см 2 .Непрерывный процесс гидрирования позволяет применять автоматические контроль и регулирование, обеспечивать более высокое качество продукта и увеличивать производительность труда.
Очистка сорбитного раствора
Очистка производится двумя способами:
1) химическим — методом осаждения ионов тяжелых металлов (меди, железа, никеля) с помощью двузамещенного фосфорнокислого натрия (Na2 HPО4 ) имела. К 20—25%-ному раствору сорбита добавляют 1,5—2% Na2 HP04 и 2—S% мела (к массе раствора), нагревают dтечение 1 ч до 85— 90 °С, фильтруют через нутч-фильтр или фильтр-пресс с применением асбестовой или угольной подушки. По окончании фильтрации раствор сорбита подвергают анализу.
2) на ионообменных смолах — 25—30%-ный раствор сорбита пропускают через две колонны, заполненные катионитом (Н- + -форма) 1\У-2. При этом рН раствора значительно снижается за счет ионного обмена. Для повышения рН до 4,0— 4,6 раствор пропускают через 3 непрерывно действующие колонны, заполненные слабоосновным анионитом ЭДЭ-10П.
Для получения кристаллического продукта очищенный раствор сорбита выпаривают в вакуум-аппарате при вакууме не ниже 650 мм рт. ст. до содержания сухих веществ 70— 80%. Часть раствора сорбита упаривают на РПИ до содержания влаги 5% и кристаллизуют. Кристаллы отфильтровывают, промывают спиртом и высушивают при температуре 35—40 °С. Получают чистый медицинский сорбит, используемый для лечебных и пищевых целей. Гранулированный D-сорбит из водного концентрата производят на специальной сушильной установке.
Стадия 2. Производство L-сорбозы из D-сорбита
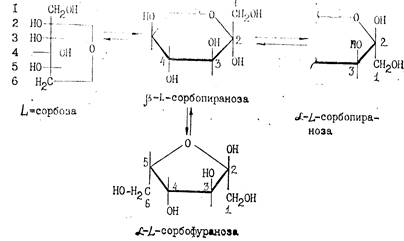
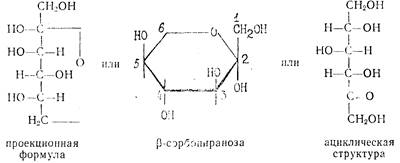 |
L-сорбоза является кетогексозсй, в кристаллическом виде имеет р-форму пиранозы. Хорошо растворима в воде, плохо в спирте, Тпл= 165°С. Строение L-сорбозы можно представить различными структурами-
L-сорбоза чувствительна к нагреванию, особенно в растворах. Наиболее устойчива при рН 3,0. При рН 3 . В аппарат с определенной скоростью, обеспечивающей необходимую степень превращения D-сорбита в L-сорбозу, непрерывно подается рабочая культура, стерильная среда (водный раствор сорбита с концентрацией D-сорбита 22%), а также сжатый воздух. Процесс проводится при температуре 30—36°С, давлении 0,2—0,5 атм, рН==4—4,5 в течение 28—39 ч. Обогрев осуществляется горячей водой через секционные рубашки. Окисленный раствор непрерывно отводится из верхней части колонного ферментатора в сборник, а затем поступает на доокисление в периодически действующие ферментаторы, где глубина окисления повышается с 70—80% до 95%. Окисленный раствор сорбита с содержанием сухих веществ 20—25% направляют на очистку.
Очистку проводят с помощью активированного угля, который отфильтровывают на фильтр-прессе. Затем проводят процессы упаривання при t=45—50°С под вакуумом и кристаллизации, фуговки и сушки сорбозы в сушилках кипящего слоя при t=60—100°С до содержания влаги не более 0,7%. С целью повышения качества, снижения потерь при упаривании раствора сорбозы разработан метод непрерывного упаривания и кристаллизации сорбозы в вакуум-кристаллизаторе при пониженной температуре (35 °С) и температуре теплопередающей поверхности не выше 70—92 °С с последующей фуговкой сорбозы и возвратом маточного раствора
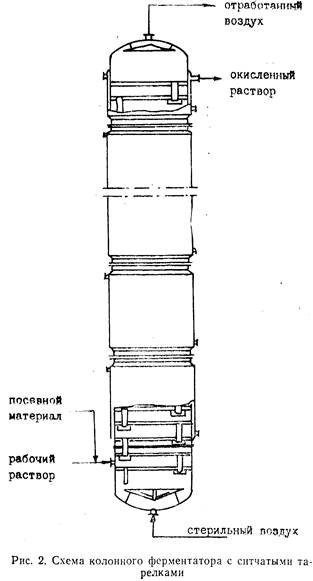 |
сорбозы в вакуум-кристаллизатор. Потери сорбозы уменьшаются, а
выход сорбозы возрастает до 90%. Производительность непрерывного способа выделения сорбозы на 10% выше, чем периодического. Непрерывное выделение кристаллической сорбозы может также осуществляться следующим образом. Окисленный раствор непрерывно отводится из колонного аппарата в сборник и далее поступает в сепаратор для очистки от белковых частиц, затем направляется в колонну с катпоиптом, и далее— в колонну с анионитом. Очищенный раствор насосом подают в распылительную сушилку, где сушат при /=70°С, Окончательная сушка производится в шнековой сушилке до влажности не более 0,1%. Последний метод особенно перспективен в крупнотоннажных производствах.
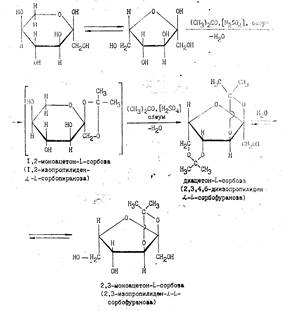
Стадия 3. Производство диацетоп- L -сорбозы из L-сорбозы
Диацетоп- L -сорбоза (ДАС) — кристаллическое вещество с Tпл=78°С, хорошо растворима в воде, бсизппе, эфире, бензоле и др. органических растворителях. Получают ДАС в виде раствора светло-коричневого цвета с содержанием сухих веществ не менее 14—17%.
Процесс ацетонированпя является одной из основных и самых сложных стадий в производстве аскорбиновой кислоты. Проводят этот процесс с целью защиты гидроксильных групп при дальнейшем окислении ДАС.
Механизм ацетонирования чрезвычайно сложен, однозначного толкования его нет. Предполагается, что механизм реакции ацетонирования должен учитывать существование L-сорбозы в двух формах—фураноидной и пираноидной, которые, в свою очередь, существуют в а- и р-формах:
Предполагают, что моноацетонированию подвергаются те формы L-сорбозы, которые имеют гидроксильную группу, расположенную рядом с полуацетальным гидроксилом при Са-атоме по той же стороне цикла (L-cx-сорбопираноза и L-a-сорбофураноза). Следует подчеркнуть, что механизм ацетонирования определяется также и катализаторами ацетонирования. В качестве катализаторов могут быть использованы:
серная кислота, олеум, хлорид цинка, сульфоновые кислоты, ионообменные смолы (сульфокатиониты в Н + -форме).
Реакцию ацетонировання упрощенно можно представить следующей схемой:
В соответствии с этой схемой реакция ацетонирования L-сорбозы является обратимой, и направление ее зависит от различных условий. Установлено влияние следующих факторов.
1. Температура. При уменьшении температуры равновесие между ДАС и другими ацетоновыми производными смещается в сторону образования ДАС. Поэтому реакция ацетонирования должна проводиться при минимально допустимой (с учетом, конечно, требуемой скорости процесса) температуре (12—14°С) с последующим охлаждением до —10—20°С для смещения равновесия в сторону образования ДАС.
2. Присутствие воды. ДАС в присутствии воды и кислоты легко гидролизуется. Вода может образоваться также при реакциях «уплотнения» ацетона. Поэтому содержание воды в реагентах должно быть минимальным (в L-сорбозе не более 0,1%, ацетоне—0,1—0,2%). Для связывания воды применяют 20%-ный олеум, используемый в качестве катализатора. Исходя из этих соображений, заманчивой представляется идея удаления воды или ее химического связывания.
3. рН среды. В присутствии кислоты, а также в щелочной среде протекает побочная реакция образования окиси мезитила из ацетона:
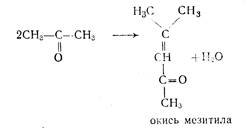 |
Поэтому важно следить за рН массы после нейтрализации, не допуская высокой щелочности.
4. Содержание олеума. Имеет важное значение, т. к. избыток его ускоряет процесс конденсации ацетона, а уменьшение его количества ускоряет гидролиз ДАС несвязанной частью воды.
5. Порядок смешения реагентов при нейтрализации ДАС:
прямая или обратная нейтрализация. Показано, что при обратной нейтрализации ацетонового раствора ДАС выход ее увеличивается.
6. Температура нейтрализации и интенсивность перемешивания реакционной массы. При понижении температуры нейтрализации от +5°С до 0°С выход ДАС повышается; при увеличении интенсивности перемешивания в ацетонаторах выход ДАС тоже возрастает, причем значительно. Все перечисленные факторы учитываются в технологическом процессе получения ДАС.
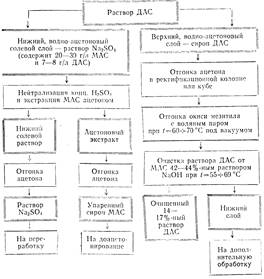
Технологический процесс получения ДАС включает 5 основных и 5 дополнительных операций. Основные: ацетонирование, нейтрализация, отгонка ацетона и отделение ДАС от солевого раствора, отгонка окиси мезитила, очистка ДАС. Дополнительные: экстракция моноацетонсорбозы (MAC) пз солевого раствора, отгонка ацетона с упариванием и получением сиропа MAC, доацетонирование MAC, отгонка ацетона от солевого раствора, регенерация ацетона.
Процесс можно вести периодическим и непрерывным способом. Наиболее передовой промышленной технологией является непрерывный способ получения ДАС.
Процесс ацетонирования L-сорбозы проводится в реакторах-ацетонаторах. Используется каскадная схема из 4-х’ ацетонаторов.
В ацетонатор с помощью дозирующих насосов через теплообменник непрерывно подают ацетон с температурой не выше —2°С и олеум. Скорость подачи ацетона регулируют в зависимости от количества дозируемой из бункера сорбозы. Скорость подачи олеума и сорбозы регулируется в пределах 60—90 л/ч и 80—181,2 кг/ч, соответственно. Ацетонаторы снабжены скоростными мешалками. Поддерживается кислотность в пределах 82—105г/л и температура не выше 16 С. Из 1-го ацетонатора по мере его наполнения масса самотеком поступает во 2-ой ацетонатор, где поддерживается температура не выше 24 °С и далее в 3-ий, работающий аналогично второму, но температура в нем не выше 18 °С. Далее масса поступает в 4-ый реактор, работающий при температуре 18°С, где ацетонирование завершается. Затем масса через холодильник поступает в реакторы-охладители, где ее охлаждают до —17°С и передают на стадию нейтрализации.
Нейтрализация кислого ацетонового раствора моно- и диацетон- L -сорбозы может, также как и ацетонирование, проводиться как периодическим способом, так и непрерывным.
Непрерывный способ более производителен и позволяет получить ДАС более высокого качества. По непрерывному способу нейтрализацию ведут в системе из 4-х нейтрализаторов, куда с помощью насоса одновременно подают разбавленный (8%-ный) раствор щелочи со скоростью 550—680 л/ч н кислый ацетоновый раствор со скоростью 1100—1500 л/ч, поддерживая температуру в пределах 2—10 C C и щелочность 0,5—2 г/л.
Нейтрализованный водно-ацетоновый раствор MAC и ДАС направляют в отгонный аппарат при температуре 80— 110°С ведут отгонку влажного 10—20%-ного ацетона. Затем упаренный раствор охлаждают до 33—38 °С и производят деление слоев. Процесс проводится или в делительной воронке, или на флорентине, или в колонне непрерывного действия по схеме:
Доацетонирование MAC проводят в ацетонаторе, куда поступает раствор MAC, охлажденный ацетон и олеум. Процесс ведут при температуре 8—12 °С в течение 2—2,5 ч, затем массу охлаждают до —10 °С——20 °С и передают на нейтрализацию. Далее поступают, как при ацетонировании сорбозы. Дополнительный выход ДАС—5,6%.
Ацетон, полученный в процессе отгонки, полностью регенерируют. Регенерацию ацетона осуществляют на ректификационных колоннах, соединенных с соответствующими аппаратами (дефлегматоры, холодильники, сборники, насосы). Процесс ректификации регулируется автоматически. Кубовый остаток от ректификации обезвреживают гипохлоритом натрия.
Из солевого раствора сульфата натрия планируется получать чистый сульфат натрия.
Очищенный 14—-17%-ный сироп ДАС направляют на стадию окисления. Суммарный выход ДАС достигает 78—87% от теоретически возможного.
Стадия 4. Производство гидрата днацетон-2-кето- L -гулоновой кислоты
Четвертой стадией промышленного синтеза аскорбиновой кислоты является окисление диацетонсорбозы (ДАС) в 2,3,6-ди-о-нзопропилнден-а- L -кетогулоновую кислоту (ДКГК). Гидрат ДКГК кристаллизуется в виде бесцветных кристаллов с Гп.л=98—99°С, хорошо растворим в спирте, эфире, почти не растворим в ледяной воде. При кипячении с водой гидрат легко омыляется и переходит в 2-кето-Ь-гулоновую кислоту, процесс гидролиза легко идет в кислой среде.
Процесс окисления ДАС осуществляется под действием достаточно сильных окислителей—перманганата калия или гипохлорита натрия. Наряду с химическими методами окисления широко используется в промышленности электрохимическое окисление ДАС.
Окисление ДАС перманганатом калия осуществляется в водно-щелочной среде при t=32—34°С. Полученную натриевую соль диацетон-2-кето-Ь-гулонов®й кислоты переводят в ДКГК с помощью 20%-ного раствора НС1 при t-2°C (pH1.7-2,0). Выход ДКГК—95—96%.
Присущие этому процессу недостатки—высокая стоимость и дефицитность КМп04 , а также довольно большой его расход (несмотря на то, что КМп04 является очень эффективным и удобным для применения окислителем) делают его неперспективным для широкого применения.
Наиболее перспективными с экономической точки зрения являются гипохлоритный и электрохимический методы окисления ДАС, применяющиеся на ряде заводов. Рассмотрим эти два метода более подробно.
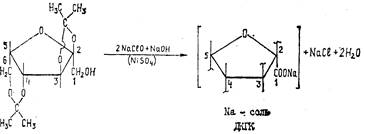 |
Гипохлоритный метод. Процесс окисления ДАС гипохлоритом натрия протекает по схеме:
Механизм окисления при помощи NaCIO в присутствии NiS04 заключается в следующем.
В щелочной среде образуется гидрат закиси никеля, окисляемый NaCIO до №203:
Окись никеля (Ni 34 -) далее действует как катализатор, выделяя кислород из NaCIO. Окись никеля превращается в закись, которая снова окисляется в окись никеля:
NaCIO +Ni203-^2NiO^ NaCI 1-0з.
Выделяющийся кислород окисляет ДАС. Процесс сильно экзотермичен. Реакция, как правило, протекает с быстрым повышением температуры до 100—102 °С.
На процесс окисления и на качество ДКГК влияют ряд факторов. Концентрация щелочи в NaCIO должна поддерживаться на уровне около 70 г/л при концентрации активного хлора 150—170 г/л. Количество NaCIO не должно превышать теоретического, т. к. при его избытке увеличиваются потери ДКГК. Температура окисления должна быть не ниже 65 °С и не выше 80 °С. Концентрация ДАС—до 18—20%. При более высокой концентрации окисление протекает слишком энергично. Расход окислителя зависит от качества ДАС. На выход ДКГК оказывает влияние величина рН реакционной массы (процесс ведут при р11==7,5—8,0).
Основной побочный процесс — окисление примеси MAC с образованием оксалата и ацетата натрия, хлористого натрия и хлороформа.
Процесс получения гидрата ДКГК состоит из следующих операции:
1. Приготовление раствора сернокислого никеля.
2. Подготовка раствора NaClO.
3. Приготовление разбавленной соляной кислоты.
4. Получение натриевой соли ДКГК методом непрерывного окисления ДАС гипохлоритом натрия.
5. Получение гидрата ДКГК.
Предварительно готовят раствор сернокислого никеля в дистиллированной воде с концентрацией 200-—400 г/л.
С целью стабилизации процесса окисления п раствор гипохлорита натрия вводят 42—44-%-иый раствор Na.OH. После 1 ч выдержки раствор передают на стадию окисления. Раствор содержит 50 г/л NaOH, 150 г/л активного хлора.
Готовят также 19,44-ный раствор соляной кислоты.
Процесс окисления ведут в непрерывно действующей колонне с кольцами Рашига. Рабочий раствор ДАС (содержание щелочи—10—15 г/л, ДАС—20%) подогревают до 35— 80 °С и насосом подают в напорную емкость, откуда самотеком — в нижнюю часть окислительной колонны. В линию подачи ДАС направляют раствор сульфата никеля. В нижнюю часть окислительной колонны из напорной емкости самотеком подают раствор гипохлорита натрия. Скорость подачи регулируют и измеряют соответствующими приборами. Скорость подачи раствора ДАС—750 л/ч, катализатора—7—10,8 л/ч, раствора NaClO—из расчета 1 кг активного хлора на 1 кг 100% ДАС.
Окисленный раствор из верхней части колонны непрерывно поступает в реактор с рассольным охлаждением. Раствор фильтруют от окислов никеля и охлаждают до 5—-10°С. К охлажденному раствору в смеситель подают разбавленную соляную кислоту до рН===4,5—5,5. Затем масса направляется в реактор, где происходит выделение гидрата ДКГК разбавленной соляной кислотой при рН 1,7—2,0 и температуре не выше 10°С. Гидрат ДКГК отфильтровывают и промывают ледяной водой. После этого гидрат ДКГК, содержащий 10% влаги, направляют в пневматическую сушилку, где сушат воздухом с температурой 80 °С. Высушенный гидрат передается на стадию получения технической аскорбиновой кислоты. Выход гидрата ДКГК—90% от теоретически возможного.
В настоящее время на некоторых витаминных комбинатах внедрен непрерывный процесс выделения гидрата ДКГК. Процесс регулируется автоматически. Достигнут выход гидрата 96,3%. Способ окисления ДАС с помощью гипохлорита натрия, несмотря на высокую эффективность и экономичность, имеет ряд недостатков: значительная коррозия аппаратуры вследствие использования водного раствора гипохлорита натрия, большое количество неорганических отходов, плохие санитарные условия и др.
Электрохимический метод . Электрохимическое окисление в щелочных средах—перспективный промышленный способ окисления ДАС. В настоящее время способ значительно усовершенствован и является непрерывным. Электрохимический метод окисления разработан в 1970 г. Ранее окисление ДАС до ДКГК осуществлялось на графитовых электродах. В промышленности СССР и Болгарии довольно долго использовали графитовые электроды, которые впоследствии были заменены на металлические.
Низкая механическая и коррозионная стойкость графита, ограничения по плотности тока, неблагоприятное соотношение эффективной поверхности к объему электрода — все это не давало возможности использовать электрохимический способ для многотоннажных производств.
Процесс электрохимического окисления проводится в присутствии катализатора — хлористого пли сернокислого никеля.
Механизм процесса может быть представлен следующим образом:
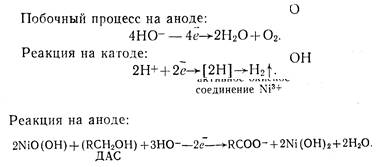 |
Особенностью процесса является участие гидроксид-ионов в процессе окисления. При рИ 2 до остаточной концентрации ДАС не более 2.5 г/л. Электроокислительная система состоит из 4-х контуров, связанных между собой последовательно. Подача электролита в первый контур осуществляется через ротаметр. Каждый контур состоит из электроокислителя, фазоразделителя, насоса, теплообменника. Циркуляция электролита по контуру обеспечивается работой насоса.
Источник
➤ Adblockdetector
.files/image008.gif)
.files/image010.gif)
.files/image011.gif)