Можно ли вылечиться от азооспермии?
По статистике, азооспермия диагностируется примерно у 1-2% взрослых мужчин. При этой репродуктивной патологии в семенной жидкости полностью отсутствуют половые клетки, делая невозможным зачатие естественным способом. Азооспермия может быть как врождённой, так и приобретённой. В нашем центре репродукции и планирования беременности в Краснодаре можно пройти полное обследование, чтобы выяснить причины патологии, оценить возможность сперматогенеза и составить план лечения. Как показывает практика, если ткани яичек функционируют хотя бы на 10-50%, прогноз лечения в целом благоприятен.
Симптомы
При азооспермии нарушения сексуальной функции не происходит, однако зачатие становится невозможным. Чаще всего заболевание сопровождается снижением выработки мужских гормонов. Если патология является врождённой, это обычно приводит к общей недоразвитости половых органов – гипогонадизму. Некоторые пациенты с азооспермией жалуются на болевые ощущения, отёчность в области мошонки. Характерными признаками патологии являются аномальный размер и дряблость яичек, причём, чем меньше орган, тем ниже его способность к синтезу половых клеток, что, в свою очередь, отрицательно сказывается на результатах спермограммы.
Разновидности азооспермии
В зависимости от этиологии и симптомов протекания заболевания, выделяют несколько основных форм азооспермии:
- Обструктивная (экскреторное бесплодие). В этом случае размер яичек и уровень гормонов остаются в пределах нормы, однако герминогенные клетки и сперматозоиды не могут попасть в семенную жидкость из-за двухсторонней непроходимости (обструкции) семявыводящих протоков.
- Необструктивная. При такой форме заболевания физических препятствий для проникновения половых клеток в семенную жидкость нет, однако их выработка нарушена вследствие нарушений гормонального фона или генетических патологий.
- Смешанная. Одна из самых тяжёлых форм азооспермии, вызванная сочетанием сразу нескольких патологий – например, непроходимостью семенных каналов и гормональными сбоями.
Помимо этого, существует понятие функциональной азооспермии. В этом случае речь идёт о временной патологии, вызванной воздействием определённых внешних факторов – например, приёмом стероидных гормональных препаратов или противоопухолевых средств, стрессовые состояния.
Методы диагностики
Для успешного лечения азооспермии крайне важно правильно определить причину заболевания. В нашем центре планирования и ведения беременности в Краснодаре подобный диагноз может быть поставлен только после 2-х и более исследований семенной жидкости под микроскопом, подтвердивших отсутствие половых клеток. В зависимости от результатов первичного обследования, врач может назначить дополнительные анализы:
- ультразвуковое исследование яичек, семенных пузырьков, предстательной железы и других половых органов;
- инструментальные измерения объёма яичек с применением орхидометра Прадера и штангенциркуля;
- спермограмма (для получения точной клинической картины проводится минимум 2 раза с интервалом в 14-21 день);
- анализ крови на уровень ФСГ, тестостерона, ингибина В, пролактина и генетические исследования (определение кариотипа, AZF-фактора, гена CFTR).
На этапе диагностики лечащий врач также обязательно назначает анализы для исключения венерических заболеваний. Необструктивную форму заболевания диагностируют повышении уровня фолликулостимулирующего гормона до 7,6 MF/л и более на фоне общей недоразвитости яичек.
Варианты лечения
Большинство методов лечения азооспермии направлены на стимуляцию естественного сперматогенеза. В зависимости от причин патологии, врач может порекомендовать такие варианты:
- Гормональная терапия. Для стимуляции выработки мужских половых клеток назначают препараты эстрогена и лютеинизирующего гормона. Длительность курса лечения определяется индивидуально и, как правило, составляет от 3 до 6 месяцев.
- Хирургическое вмешательство. При обструктивных формах азооспермии восстановить половую функцию возможно, устранив причины непроходимости – врождённые аномалии, варикоцеле и др.
- Извлечение половых клеток методом биопсии. Если предыдущие методы не помогли, рассматривается вариант извлечения активных сперматозоидов из семенных канальцев с последующим искусственным оплодотворением.
Эффективность лечения во многом зависит от возраста и образа жизни пациента. При обнаружении хромосомных аномалий лечащий врач может назначить дополнительное обследование у генетика для определения уровня риска для эмбрионов. Кроме того, если назначаются гормональные препараты, прерывание их приёма может значительно снизить вероятность успеха при повторном лечении.
Источник
Необструктивная азооспермия – клинические рекомендации
*Импакт фактор за 2018 г. по данным РИНЦ
Читайте в новом номере
a:2:
Дифференциальная диагностика
Спермограмма
Больные с НОА обычно имеют нормальные объем (>1,5 мл) эякулята и значение pH (>7,2), что говорит о нормальном состоянии семенных пузырьков и отсутствии обструкции в семявыносящих каналах пациента [2, 10].
После оценки объема эякулята изучают центрифугированную сперму для исключения криптозооспермии, которая определяется как присутствие очень маленького числа живых сперматозоидов [2]. Обнаружение живых сперматозоидов может позволить провести ИКСИ с их использованием, что исключает проведение хирургического извлечения сперматозоидов. До 10% пациентов, которым изначально определили отсутствие сперматозоидов в эякуляте, удается получить сперматозоиды для ИКСИ после дополнительного анализа центрифугированного образца [13].
Диагноз азооспермии подтверждают по нескольким спермограммам, поскольку возможна транзиторная азооспермия, которая может быть связана с воздействием токсических веществ, факторов окружающей среды, инфекций или ятрогенных факторов [14, 15].
Клинический диагноз
У подавляющего большинства пациентов НОА можно на клиническом уровне отличить от обструктивной азооспермии (ОА) путем тщательного анализа диагностических показателей, в т. ч. анамнеза, результатов медицинского осмотра и анализа уровней гормонов. Эти показатели позволяют с достаточно высокой уверенностью определить, обструктивный или необструктивный характер имеет азооспермия (табл. 1) [16].
Это важно, поскольку при ОА, в отличие от НОА, определяется сохранность сперматогенеза [9, 17, 18]. В случае ОА чаще всего происходит механическая обструкция в каком-либо участке половых путей: семявыносящем протоке, семенных канальцах.
В целом при ОА высок процент успеха реконструктивных операций, восстанавливающих проходимость семявыносящих путей, а также пункционных видов биопсии яичек [19–21], несмотря на это, имеются исследования, которые демонстрируют угнетение функции яичек, связанное с длительностью и уровнем обструкции.
Говоря о НОА, в качестве более благоприятного для терапии состояния следует отметить гипогонадотропный гипогонадизм (ГГ). ГГ – редкое эндокринное заболевание, характеризующееся недостаточностью сперматогенеза вследствие отсутствия стимуляции его гонадотропинами [22]. Пациентов с ГГ легко распознать по крайне низкому уровню гонадотропинов гипофиза и андрогенов (фолликулостимулирующий (ФСГ) и лютеинизирующий гормоны (ЛГ) 7,6 МЕ/мл) [16, 18, 26]. Уровень ЛГ у этих мужчин обычно повышен или близок к верхней границе нормы. Поскольку отрицательная обратная связь секреции ФСГ и ЛГ определяется количеством сперматогониев и клеток Лейдига, уровни ФСГ и ЛГ могут быть нормальными [24]. Гипогонадизм определяется низким уровнем Т ( 60 пг/мл) подавляет секрецию ЛГ и ФСГ и напрямую ингибирует биосинтез Т [30]. Низкий уровень Т у мужчин, страдающих ожирением, также может отражать адаптацию к изменениям уровня глобулина, связывающего половые гормоны (ГСПГ), а не истинный дефицит Т [33]. Поэтому необходимо оценивать уровень Э и ГСПГ в сыворотке у мужчин с азооспермией и ожирением. Эти анализы могут помочь принять решение относительно лечения перед выполнением биопсии яичек. По причине суточных колебаний уровня Т кровь для его измерения забирают до 10:00 [27, 34].
Из-за необратимого характера поражения сперматогенеза у больных с НОА биопсия яичек и ВРТ являются единственной возможностью получить биологическое потомство. Однако неопределенность исхода биопсии яичек заставляет искать надежные прогностические факторы.
Клинико-лабораторные показатели
К сожалению, на сегодняшний день прогностическая ценность существующих маркеров, таких как ФСГ и Т сыворотки, уровень ингибина Б, а также суммарного объема яичек достаточно низка. Это подтверждается многочисленными зарубежными и собственными исследованиями. И даже после объединения клинических и лабораторных параметров, результатов гистопатологического анализа, этиологии заболевания эти результаты также не могут являться надежным прогностическим фактором [40].
По результатам обследования 101 мужчины с НОА в нашей клинике сперматозоиды были найдены у 59,1% мужчин после микрохирургической биопсии яичка [41]. Нами были сделаны выводы о том, что хотя такие факторы, как этиология, объем яичек и уровни гонадотропинов гипофиза в сыворотке могут отражать общее состояние сперматогенеза, они не позволяют точно определить, следует ли пациенту выполнять биопсию, и выделить пациентов с большей вероятностью успеха этой манипуляции.
Молекулярно-генетическое исследование
Молекулярная диагностика – это важный диагностический метод, позволяющий не только выявить мужчин, у которых НОА вызвана генетическими проблемами, но и определить шансы пациентов на успех биопсии [46–53].
Микроделеция – это делеция части хромосомы, которая обычно затрагивает несколько генов, но имеет небольшой размер и не выявляется обычными цитогенетическими методами, такими как кариотипирование [53, 54]. Длинное плечо Y-хромосомы содержит область Yq11, в которой расположены 26 генов, участвующих в регуляции сперматогенеза [49, 53, 55, 56]. Эту область называют AZF (azoospermia factor, «фактор азооспермии»), поскольку происходящие в ней микроделеции часто связаны с азооспермией (рис. 2). Молекулярно-биологические исследования позволили выявить 3 участка AZF, названные AZFa, AZFb и AZFc и содержащие по одному основному гену-кандидату AZF [56]. Микроделеции в области AZF выявляются примерно у 10% мужчин с НОА [49].
Чаще всего выявляются делеции на участке AZFc (
80%), за которым следуют AZFb (1–5%), AZFa (0,5–4%) и AZFbc (1–3%) [54–56]. Делеции в этих участках области AZF вызывают видимые нарушения развития половых клеток.
Делеции фактора азооспермии, при которых удаляется весь участок AZFa, всегда связаны с тестикулярной гистопатологической картиной – тотальной аплазией герминогенного эпителия, без областей активного сперматогенеза. Поэтому микроделеция в участке AZFa означает практически нулевые шансы на успех биопсии яичка [46, 48–50, 59].
Клинические проявления полных делеций AZFb и AZFbc сходны с таковыми AZFa, поскольку шансы на успешность биопсии близки к нулю [46, 48, 50]. Блок или остановка сперматогенеза – наиболее частый тестикулярный гистопатологический фенотип делеций AZFb и AZFbc, но встречается и аплазия герминогенного эпителия [49].
У пациентов с делецией AZFc, напротив, обычно имеется очаговый сперматогенез: биопсия яичка успешна в 50–70% случаев [47, 49]. У таких мужчин микроделеции AZFc, по-видимому, не влияют на вероятность зачатия ребенка с помощью ИКСИ [47, 62–66], хотя некоторые исследователи отмечали нарушения развития эмбриона [49, 67]. Сыновья мужчин с микроделециями AZFc могут унаследовать этот генетический порок, следовательно, иметь бесплодие. В таком случае необходима генетическая консультация по поводу риска зачатия сына с бесплодием и другими генетическими нарушениями.
В настоящее время имеются работы, в которых продемонстрированы исследования микроделеций в регионе AZFc у здоровых мужчин, в которых также были обнаружены делеции, но при этом сперматогенез не страдал.
После генетического анализа больным, не имеющим полной микроделеции AZFa, AZFb или AZFb и других нарушений кариотипа, связанных с отсутствием сперматогенеза, предлагается биопсия яичек с целью получения сперматозоидов.
Роль предоперационной терапии, проводимой перед извлечением сперматозоидов
Медикаментозное лечение
Пациенты с ГГ имеют высокий шанс на получение сперматозоидов при приеме экзогенных гонадотропинов, в то время как у мужчин с нормогонадотропной или гипергонадотропной функцией гипофиза эмпирическое медикаментозное лечение считается менее эффективным из-за высокого уровня гонадотропинов в крови. Тем не менее такое лечение может быть потенциально полезным мужчинам с НОА, поскольку стимуляция клеток Лейдига и Сертоли эндогенными гонадотропинами очень слаба. Секреция гонадотропинов определяется частотой, амплитудой и продолжительностью ее импульсов, но из-за высоких исходных уровней эндогенных гонадотропинов у большинства мужчин с НОА относительные амплитуды секреции ФСГ и ЛГ низки [71–74]. Кроме того, примерно у половины этих мужчин низок эндогенный уровень общего Т (
Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Источник
Азооспермия
Подробнее о патологии
Патологии спермы часто приводят к проблемам с зачатием – почти в половине случаев бесплодия в паре. Азооспермия – состояние, при котором в семенной жидкости мужчины отсутствуют сперматозоиды – одно из самых тяжелых отклонений. Спермиев не просто мало, как при олигозооспермии, их нет вообще. Диагностируется у каждого пятого мужчины с бесплодием. Естественное зачатие в такой ситуации невозможно.
20-30 лет назад азооспермия была непреодолимым препятствием на пути к беременности. Сейчас такой диагноз не приговор для репродуктивной функции мужчины. Методы лечения зависят от вида и причины патологии.
Преимущества лечения азооспермии в центре «Линия жизни»
Отцовство при этом недуге стало возможным благодаря относительно недавним достижениям вспомогательных репродуктивных технологий. Значит, в клинике, куда вы обратитесь, должны быть внедрены новые методики. В Центре репродукции «Линия жизни» применяется несколько эффективных методов, которые позволяют преодолеть отсутствие сперматозоидов в семенной жидкости. Мы помогаем стать папами мужчинам с самым сложным анамнезом!
- Мы имеем все нужное, чтобы обеспечить комплексную диагностику и получить развернутую характеристику особенностей сперматогенеза у конкретного пациента
- Специалисты центра обладают высокой квалификацией и большим практическим опытом в микрохирургии
- Часто зачатие невозможно без проведения ЭКО. «Линия жизни» среди лидеров по результативности программ экстракорпорального оплодотворения
Виды и причины
Как лечить азооспермию? Ответ на вопрос зависит в первую очередь от формы патологии у конкретного пациента. Потому что каждая обладает характерными признаками, которые требуют совершенно разных подходов в лечении.
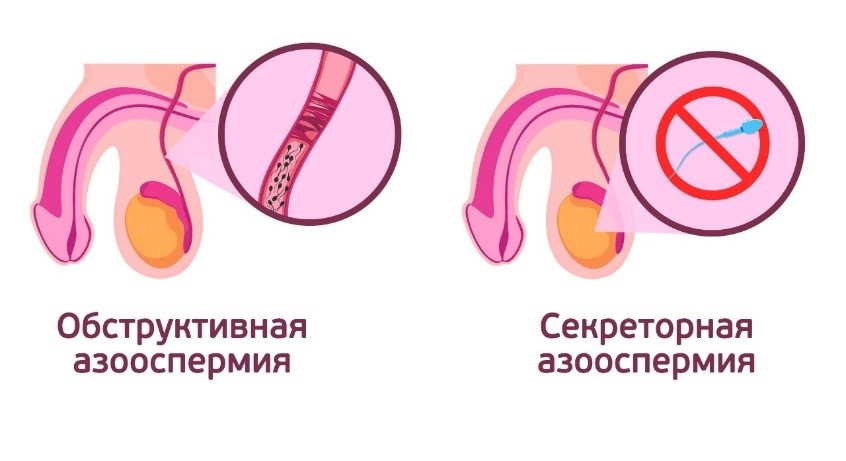
Обструктивная азооспермия
Связана с нарушенной проходимостью или полной непроходимостью спермиев из яичек наружу. При такой форме яички вырабатывают нормальные сперматозоиды с хорошим потенциалом к зачатию, но они не добираются до нужного места из-за препятствия.
Непроходимость может быть связана с врожденной патологией – когда у новорожденного мальчика отсутствуют семенные канальцы, вызвана воспалительными процессами, хирургическими вмешательствами (вазэктомией – мужской стерилизацией, операцией по поводу паховой грыжи), травмами репродуктивных органов. Перекрыть семенные протоки могут рубцовые образования или кисты, затруднить выброс семени – склеротические явления в придатках, предстательной железе, уретре.
Обструктивная форма выявляется в 25-30% всех случаев.
Секреторная азооспермия
При этой форме у мужчины все в порядке с семявыводящими протоками. Спермии отсутствуют в эякуляте из-за дисфункции яичек, которые не вырабатывают сперматозоиды вовсе или вырабатывают в недостаточном количестве.
К секреторной или необструктивной азооспермии могут привести:
- гормональные нарушения на фоне дисфункции гипофиза и щитовидной железы;
- врожденное недоразвитие яичек;
- повреждение яичек, связанное с варикоцеле, травмами, грыжей мошонки;
- лучевая и химиотерапия онкологических заболеваний;
- гиповитаминоз и голодные диеты;
- диабет и патологическое ожирение;
- венерические болезни, сепсис и туберкулез;
- работа на химическом производстве, рентгеновское облучение;
- прием угнетающих сперматогенез лекарственных средств.
Секреторный вид встречается примерно в 60% случаев.
Другие виды патаспермии
Есть еще одна форма – транзиторная или временная. Она возникает на не определенный период времени, полностью обратима, может быть следствием как обструктивных, так и секреторных факторов. Кроме «чистых видов» существует смешанная азооспермия, при которой одновременно наблюдаются дисфункция яичников и непроходимость семявыносящих протоков. Встречается редко и считается самой сложной для лечения формой.
Как ставится диагноз?
В большинстве случаев азооспермия проявляется только бесплодием – мужчины не испытывают болезненных ощущений, недомогания, проблем с эректильной функцией. А так как у проблем с зачатием может быть много причин (включая другие патологии спермы – олигозооспермию, тератозооспермию), необходимо для начала подтвердить или опровергнуть отсутствие спермиев в эякуляте, и таким образом установить причину патоспермии.
Диагностика азооспермии включает несколько видов исследований:
- Осмотр андролога. Позволяет выявить внешние признаки – уменьшение размеров яичек, нарушение строения яичек и придатков, предстательной железы, возможные аномалии уретры и пр.
- Спермограмма. Микроскопическое исследование эякулята позволяет определить наличие/отсутствие сперматозоидов, а если они есть – уточнить их концентрацию и подвижность, изучить строение. Кроме того, в рамках исследования устанавливается наличие в сперме лейкоцитов и антиспермальных тел.
- Биопсия придатков или яичек. Помогает выяснить, есть ли сперматогенез, определить причины его нарушения.
- Анализ крови на гормоны. Дает возможность подтвердить секреторную форму.
- Рентгеновское исследование семенных протоков с применением контрастного вещества (генитография) позволяет определить точные характеристики обструктивной азооспермии.
Достижение беременности при азооспермии
Проанализировав результаты обследования, определив форму и вероятную причину патологии, врач разрабатывает оптимальную тактику дальнейших действий. Цель всегда одна – добиться беременности и рождения здорового малыша.
Оперативная и консервативная терапия
Если у мужчины диагностировано обструктивная азооспермия, восстановить репродуктивную функцию может помочь операция. Чтобы открыть спермиям путь из яичек, используются микрохирургические реконструктивные методы. Схема проведения операции зависит от локализации и протяженности участка с непроходимостью.
При секреторной азооспермии у лечения мало перспектив. Впрочем, при отдельных гормональных нарушениях пациентам назначается медикаментозная терапия, направленная на коррекцию эндокринных нарушений и возобновление сперматогенеза. Если причиной патологии стало варикоцеле, то к преодолению бесплодия может привести оперативное лечение основного заболевания.
Иногда лечение дает результат. Но в целом шансы стать отцом естественным путем у пациентов с этой патологией остаются довольно низкими. При отсутствии эффекта или при заведомой бесперспективности хирургических/медикаментозных методов на помощь приходят вспомогательные репродуктивные технологии. Врач рекомендует паре с мужским фактором бесплодия программу ЭКО.
ЭКО при азооспермии
Процедуре экстракорпорального оплодотворения больше 40 лет, и значительную часть этого срока она применялась в том числе для решения проблемы азооспермии. Однако раньше все ограничивалось использованием донорской спермы – генетическое отцовство для мужчин с азооспермией было недоступно. С внедрением и развитием методов биопсии ситуация изменилась. Сейчас ЭКО проводится с собственной спермой мужчины, которую предварительно получают непосредственно из яичек и придатков. Для этого используются различные виды биопсии.
Читайте подробную информацию о биопсии яичек/придатков в центре «Линия жизни» здесь
Биопсия яичка далеко не всегда позволяет получить достаточное для классического ЭКО количество здоровых спермиев. Поэтому в наших клиниках для преодоления бесплодия при азооспермии ЭКО дополняется методикой ИКСИ (ICSI). В ходе процедуры эмбриолог вводит отобранный сперматозоид – самый лучший из тех, что удалось получить – непосредственно в яйцеклетку. Для проведения ЭКО с ИКСИ может быть достаточно одной качественной мужской половой клетки.
Получение сперматозоидов из ткани яичек и их последующее использование в ЭКО с ИКСИ серьезно расширяет возможности преодоления азооспермии. Дополнительным фактором высокой результативности программ ЭКО в нашем центре становится четкое взаимодействие между урологами, репродуктологами и эмбриологами.
Чтобы записаться на прием к репродуктологу или урологу, оставьте заявку на сайте или позвоните нам в клинику.
Источник