Тема 9.13. Биогенные амины: синтез, инактивация, биологическая роль
1. Некоторые аминокислоты и их производные могут подвергаться декарбоксилированию — отщеплению α-карбоксильной группы. Продуктами реакции являются СО2 и биогенные амины (табл. 9.7). Образование биогенных аминов происходит с участием ферментов декарбоксилаз в присутствии кофермента пиридоксальфосфата.
2. В нервных клетках декарбоксилирование глутамата приводит к образованию γ-аминомасляной кислоты (ГАМК), которая являетсяосновным тормозным медиатором. Инактивации ГАМК происходит либо путем трансаминирования и превращения в сукцинат, являющийся метаболитом ЦТК, либо окислительным путем под действием моноаминооксидазы (МАО)

ГАМК в виде препаратов гаммалон или аминалон применяют при нарушениях мозгового кровообращения, умственной отсталости, эндогенных депрессиях и травмах головного мозга.
3. В нервной ткани из серина синтезируется ацетилхолин, который также относится к биогенным аминам:

4. Серотонин — нейромедиатор проводящих путей, образуется в гипоталамусе, надпочечниках из аминокислоты триптофана:

5. К биогенным аминам относятся и катехоламины (дофамин, норадреналин и адренамин) (см. рис. 9.23, В).
Таблица 9.7. Биологическая роль и предшественники некоторых биогенных аминов

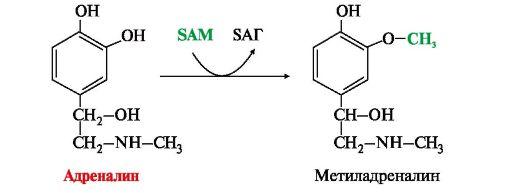
• метилирование с участием SAM под действием метилтрансфераз — характерно для гистамина, адреналина, норадреналина:
При окислении биогенных аминов происходит дезаминирование и образование альдегида, а затем кислоты, которые выводятся почками:
1. Белки являются одним из важнейших элементов живого организма, именно поэтому мы начнем с описания роли и строения именно этого класса биоорганических соединений. Белки в организме выполняют следующие функции: 1. Структурная или пластическая функция. Белки являются универсальным строительным материалом, из которого состоят практически все структуры живых клеток. Например, в организме человека белки составляют около 1/6 от массы тела. Причем, у тренированных людей с хорошо развитыми мышцами эта цифра может быть и выше. 2. Каталитическая функция. Многие белки, называемые ферментами или энзимами, выполняют в живых системах функцию катализаторов, то есть изменяют скорости протекания химических реакций (о чем подробно будет сказано ниже). 3. Сократительная функция. Именно белковые молекулы лежат в основе всех форм движения живых систем. Мышечное сокращение = это, прежде всего работа белков. 4. Регуляторная функция. В основе этой функции лежит способность белковых молекул реагировать и с кислотами и основаниями, называемых в химии амфотерностью. Белки участвуют в создании гомеостаза(поддержание постоянства внутренней стреды) организма. Многие белки являются гормонами. 5. Рецепторная функция. В основе этой функции лежит способность белков реагировать на возникающие изменения условий внутренней среды организма. Различные рецепторы в организме, чувствительные к температуре, давлению, освещенности являются белками. Рецепторы гормонов – это тоже белки. 6. Транспортная функция. Белковые молекулы имеют большой размер, хорошо растворимы в воде, что позволяет им легко перемещаться по водным растворам и переносить различные вещества. Например, гемоглобин переносит газы, альбумины крови переносят жиры и жирные кислоты. 7. Защитная функция. Белки защищают организм, прежде всего, участвуя в создании иммунитета. 8. Энергетическая функция. Белки не являются главными участниками энергетического обмена, но все же до 10% суточной потребности организма в энергии обеспечивают именно они. В то же время, это слишком ценный продукт, чтобы использовать его, как источник энергии. Поэтому белки используются в качестве источника энергии только после углеводов и жиров.
По материал Интернет
Изучение проблемы нормы белка в питании человека имеет, кроме академического интереса, большое социальное значение. Принятые в нашей стране нормы белка для взрослого человека и для детей разного возраста основаны на результатах многочисленных научных исследований отечественных ученых, учитывают разные климатические условия, условия труда, профессию, возраст и другие факторы. Эти нормы выводятся из оптимального содержания белка в пищевом рационе. Так, взрослый человек, занимающийся умственным трудом или подвергающийся средней физической нагрузке (полностью механизированный труд), должен получать 100–120 г белкав сутки при трате общего количества энергии 12000 кДж. При изменении условий труда (недостаточно механизированный труд) и больших тратах энергии нормабелка увеличивается на 10 г на каждые 2100 кДж. Рабочие, выполняющие тяжелую физическую работу, должны получать 130–150 г белка в сутки.
Потребности в белках детей определяются в первую очередь возрастом и массой тела. Дети даже раннего детского возраста нуждаются в 55–72 г белка в сутки. С возрастом (от 12 до 15 лет) эта норма увеличивается до суточной нормы взрослого человека. Суточные потребности в белке резко возрастают прибеременности и лактации, а также при некоторых патологических состояниях, когда организм теряет белок с мочой или асцитной жидкостью, экссудатами при нефритах, тяжелых инфекционных заболеваниях, ожогах, травмах и т.д.
На долю аминокислот (в составе белков и свободных) приходится более 95 % всего азота организма. Поэтому об общем состоянии аминокислотного и белкового обмена можно судить по азотистому балансу, т. е. разнице между количеством азота,поступающего с пищей, и количеством выделяемого азота (главным образом в составе мочевины).
Азотистый баланс — схема.
У взрослого здорового человека при нормальном питании имеет место азотистое равновесие, т. е. количество выделяемого азота равно количеству поступающего. В период роста организма, а также при выздоровлении после истощающих заболеваний выводится азота меньше, чем поступает, — положительный азотистый баланс. При старении, голодании и в течение истощающих заболеваний азота выводится больше, чем поступает, — отрицательный азотистый баланс. При положительном азотистом балансе часть аминокислот пищи задерживается в организме, включаясь в состав белков и клеточных структур; общая масса белков в организме увеличивается. Наоборот, при отрицательном азотистом балансе общая масса белков уменьшается (катаболическое состояние). Если из диеты исключить все белки, но полностью сохранить другие компоненты в количествах, обеспечивающих энергетические потребности организма, то азотистый баланс становится отрицательным. Примерно через неделю пребывания на такой диете количество выводимого азота стабилизируется, достигая величины около 4 г за сутки. Такое количество азота соответствует 25 г белка (или аминокислот). Следовательно, при белковом голодании организм ежесуточно расходует около 25 г белков собственных тканей. Практически такой же результат получается при исключении из диеты не всех белков, а только незаменимых аминокислот или даже только одной из них. При полном голодании отрицательный азотистый баланс еще больше, чем при исключении из пищи только белков. Это обусловлено тем, что аминокислоты, образующиеся при распаде тканевых белков, при полном голодании используются также и для обеспечения энергетических потребностей организма. В рационе, достаточном по калорийности, минимальное количество белков, необходимое для поддержания азотистого равновесия, составляет 30-50 г. Однако это количество не обеспечивает оптимума для здоровья и работоспособности. Взрослый человек при средней физической нагрузке должен получать о100коло 100 г белков в сутки.
2. В пищевых продуктах содержание свободных аминокислот очень мало. Подавляющее их количество входит в состав белков, которые гидролизуются
в ЖКТ под действием ферментов протеаз (пептидщцролаз). Субстратная специфичность этих ферментов заключается в том, что каждый из них с наибольшей скоростью расщепляет пептидные связи, образованные определёнными аминокислотами. Протеазы, гидролизующие пептидные связи внутри белковой молекулы, относят к группе эндопептидаз. Ферменты, относящиеся к группе экзопептидаз, гидролизуют пептидную связь, образованную концевыми аминокислотами. Под действием всех протеаз ЖКТ белки пищи распадаются на отдельные аминокислоты, которые затем поступают в клетки тканей.
А. Переваривание белков в желудке
Желудочный сок — продукт нескольких типов клеток. Обкладочные (париетальные) клетки стенок желудка образуют соляную кислоту, главные клетки секретируют пепсиноген. Добавочные и другие клетки эпителия желудка выделяют муцинсодержащую слизь. Париетальные клетки секретируют в полость желудка также гликопротеин, который называют «внутренним фактором» (фактором Касла). Этот белок связывает «внешний фактор» — витамин В12, предотвращает его разрушение и способствует всасыванию.
Источник
50. Декарбоксилирование аминокислот. Биогенные амины, их физиологическое значение. Инактивация биогенных аминов. Нарушения обмена биогенных аминов при патологических состояниях.
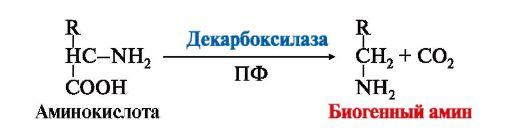
Одним из путей превращения аминокислот в клетках различных органов и тканей является их декарбоксилирование. Известно несколько вариантов декарбоксилирования, встречающихся на разных уровнях организации живых систем. У человека работают два основных варианта декарбоксилирования: альфа-декарбоксилирование аминокислот и декарбоксилирование, связанное с конденсацией двух молекул, одной из которых является аминокислота. Последний вариант декарбоксилирования встречается, например, на одном из этапов синтеза гема.
Отщепление CO2 от аминокислот катализируются ферментами декарбоксилазами, простетическими группами которых является фосфопиридоксаль. В условиях клеток эти реакции необратимы. Декарбоксилированию подвергаются далеко не все аминокислоты, а лишь те из них, при декарбоксилировании которых образуются биологически активные соединения, выполняющие в организме функции или биорегуляторов, или нейромедиаторов. Вся эта группа соединений получила название — биогенные амины.
Общим путем инактивации биогенных аминов является их окислительное дезаминирование с участием ферментов моноаминоксидаз или диаминоксидаз. Образующийся альдегид окисляется до соответствующей кислоты, а перекись водорода разрушается каталазой. Некоторые биогенные амины, например, гистамин могут инактивироваться путем метилирования или ацетилирования.
Например, из аминокислоты гистидина в результате ее декарбоксилирования образуется гистамин:
Гистамин обладает выраженным сосудорасширяющим эффектом, он участвует в развитии воспалительных, в том числе аллергических, реакций. Гистамин стимулирует выделение желудочного сока; в этом качестве он нашел применение в клинической лабораторной диагностике для установления причины нарушения секреции желудочного сока.
Инактивация гистамина идет или за счет его дезаминирования, или путем метилирования c образованием N1-метилгистидина.
Аминокислота триптофан служит предшественником еще одного биологически важного амина — серотонина. Серотонин является нейромедиатором стволовой части мозга. Инактивация серотонина идет или путем его окислительного дезаминирования, или же путем метилирования (ацетилирования) по аминогруппе.
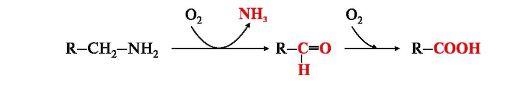
В ходе декарбоксилирования аминокислот орнитина и лизина образуются алифатические диамины путресцин, кадаверин, а в ходе декарбоксилирования S-аденозилметионина образуется S-аденозилгомоцистеамин. Эти соединения используются при синтезе полиаминов спермина и спермидина, которые участвуют в регуляции процессов пролиферации. Алифатические амины инактивируются также путем их окисления под действием соответствующих моноаминоксидаз или диаминоксидаз.
51. Токсичность аммиака. Пути обезвреживания аммиака в организме. Биосинтез мочевины: последовательность реакций, суммарное уравнение. Нарушение процессов обезвреживания. Гипераммониемии.
В организме человека в результате дезаминирования аминокислот, а также некоторых других соединений, например, биогенных аминов или азотистых оснований некоторых нуклеотидов, ежесуточно образуется 15-17 г аммиака. Кроме того, в качестве продукта жизнедеятельности микробной флоры аммиак постоянно образуется в кишечнике; этот аммиак легко всасываясь, поступает во внутреннюю среду организма. Аммиак представляет собой высоко токсичное соединение, средняя концентрация в крови в норме составляет 0,1-0,2 мг/л или 30-40 мкмоль/л.
При повышении концентрации аммиака в крови наблюдаются симптомы аммиачного отравления: своеобразный тремор, повышенная раздражительность, нечленораздельная речь, затуманивание зрения, а в тяжелых случаях отравления развивается коматозное состояние и может наступить смерть.
Токсичность аммиака объясняется его способностью связывать в клетках 2-оксоглутарат за счет обратимости действия глутаматдегидрогеназы. В митохондриях клеток резко падает концентрация 2‑оксоглутарата, что приводит к нарушению работы цикла трикарбоновых кислот и развитию тяжелого гипоэнергетического состояния, порой угрожающего жизни.
Печень является основным органом, в котором происходит обезвреживание аммиака. В гепатоцитах до 80-90% образовавшегося аммиака превращается в мочевину — малотоксичное соединение, которое с током крови поступает из печени в почки и выводится с мочой. В норме в сутки с мочой выводится от 20 до 35 г мочевины. Небольшая часть образующегося в организме аммиака — до 1 г в сутки — выводится почками с мочой в виде аммонийных солей.
Аммиак, поступивший в печень или непосредственно образовавшийся в гепатоцитах вступает в цикл мочевинообразования.
Синтез мочевины начинается в митохондриях гепатоцитов с образования карбамоилфосфата. Образовавшийся карбамоилфосфат взаимодействует с орнитином с образованием цитруллина.
Последующие стадии процесса протекают в цитозоле. Вначале цитруллин взаимодействует с аспартатом с образованием аргининосукцината. Эта реакция энергозависима и сопровождается расщеплением АТФ до АМФ и пирофосфата, причем пирофосфат сразу же расщепляется пирофосфатазой на два остатка фосфорной кислоты и реакция становится необратимой — термодинамический контроль направления реакции и процесса в целом.Далее аргининосукцинат расщепляется до аргинина и фумарата. Образовавшаяся в ходе реакции фумаровая кислота может поступать в цикл трикарбоновых кислот и превращаться в ходе его работы в оксалоацетат. Оксалоацетат, в свою очередь, может путем трансаминирования с глутаматом вновь превращаться в аспартат и повторно использоваться в цикле синтеза мочевины.
В заключительной реакции цикла идет гидролитическое расщепление аргинина на мочевину и орнитин.
Образовавшийся орнитин может повторно использоваться в цикле, а мочевина из гепатоцитов поступает в кровь и выводится из организма через почки. Суммарное уравнение синтеза мочевины:
СО2 + NH3 +аспартат+3АТФ+3Н2О –– Мочевина+Фумарат+2АДФ+АМФ+4Р
На синтез одной молекулы мочевины клетка затрачивает 4 макроэргических эквивалента.
Нарушение процессов обезвреживания аммиака приводит к его накоплению в крови — развивается гипераммониемия. Гипераммониемия может быть первичной т.е. обусловлено врожденной недостаточностью одного из ферментов цикла синтеза мочевины.
Для облегчения состояния таких больных следует уменьшить содержание белков в пище до минимально приемлемых количеств, и поступление пищевых белков должно быть разбито на возможно большее количество порций. Этими мероприятиями предотвращается одномоментное поступление больших количеств аминокислот во внутреннюю среду организма, а, следовательно, и накопление аммиака.
Вторичная гипераммониемия встречается при тяжелых поражениях печени, хотя в принципе печень обладает очень большими резервными возможностями в отношении обезвреживания аммиака: сохранение всего 1/6 части неповрежденной печеночной ткани может полностью обеспечить обезвреживание образующегося в организме аммиака.
52. Патология обмена простых белков и аминокислот: белковая недостаточность, нарушения обмена при недостаточном поступлении витаминов (С, В6, В9 и др). Врожденные нарушения обмена аминокислот, аминоацидурии.
Нарушения обмена простых белков и аминокислот могут быть первичными, т.е. в основе своей иметь генетический дефект, или вторичными (развиваются или в результате какого-либо заболевания, или являются следствием неблагоприятных условий жизни).
Белковая недостаточность может развиваться или вследствие дефицита белка в пищевом рационе, в том числе при недостаточном поступлении с пищей одной или нескольких незаменимых аминокислот, или в результате нарушения усвоения пищевых белков при заболеваниях желудочно-кишечного тракта.
Главными симптомами (признаками) развития этого состояния являются отрицательный азотистый баланс, гипопротеинемия (снижение содержания белков в плазме крови) и развитие отеков. В организме нарушается синтез белков, что приводит к быстрой утомляемости, снижению резистентности организма к воздействию неблагоприятных факторов внешней среды и другим нежелательным явлениям.
В организме нарушается синтез ферментов, принимающих участие в обмене аминокислот, нарушаются процессы дезаминирования и трансаминирования аминокислот. При выраженной белковой недостаточности, например, при длительном голодании, нарушается выработка пищеварительных ферментов желудочно-кишечного тракта, в том числе и протеиназ. Поэтому такие больные нуждаются в парэнтеральном введении аминокислотных гидролизатов для восстановления синтеза ферментов. Особенно тяжело белковую недостаточность переносят дети: у них развивается тяжелое поражение печени, наблюдается остановка роста, падает сопротивляемость организма к воздействию неблагоприятных факторов внешней среды.
Белковая недостаточность может развиваться и при тяжелых заболеваниях, поражающих органы пищеварения, например хронических панкреатитах.
Нарушения обмена при витаминной недостаточности . Производные ряда витаминов выступают в качестве кофакторов ферментов, катализирующих реакции обмена тех или иных аминокислот. Естественно, что при недостатке в организме любого из этих витаминов будут наблюдаться нарушения в ходе того или иного обменного процесса.
При недостатке витамина С гидроксилирование остатков пролина нарушается, в результате чего образуются дефектные коллагеновые волокна, обладающие значительно меньшей плотностью. Последствиями этого являются:во-первых, снижение прочности стенок сосудов, что приводит к кровоизлияниям в органах и тканях; во-вторых, из за снижения прочности коллагеновых волокон происходит также расшатывание и выпадение зубов — характерные признаки С-авитаминоза.
Важную роль в обмене аминокислот играет фосфопиридоксаль, являющийся производным витамина В6, Недостаточность фосфопиридоксаля приводит к нарушению реакций трансаминирования и декарбоксилирования аминокислот, в том числе нарушается распад триптофана и уменьшается уровень эндогенного синтеза витамина В5. Отсюда — развитие при авитаминозе В6 дерматита, похожего на дерматит при пеллагре. При недостаточности витамина В1 в клетках нарушается синтез заменимых аминокислот, в особенности Асп и Глу. Причиной этого является нарушение обмена углеводов с уменьшением содержания в тканях щавелевоуксусной и 2-оксоглутаровой кислот, служащих исходными субстратами для биосинтеза Асп и Глу.Дефицит в организме витаминов В9 и В12 приводит к нарушению функционирования в клетках системы переноса одноуглеродных группировок, тесно связанной с обменом таких аминокислот как Сер, Гли и Мет. В результате нарушается синтез нуклеотидов и нуклеиновых кислот, следствием чего является развитие фолиеводефицитной или В12-дефицитной анемии.
Обмен нуклеотидов и нуклеиновых кислот. Матричные биосинтезы.
Источник