Витамин кофермент фермент процесс
Полагают, что эти ионы заставляют молекулы фермента или субстрата принять форму, способствующую образованию фермент-субстратного комплекса. Тем самым увеличиваются шансы на то, что фермент и субстрат действительно прореагируют друг с другом, а следовательно, возрастает и скорость реакции, катализируемой данным ферментом. Так, например, активность амилазы слюны повышается в присутствии хлорид-ионов.
Простетические группы
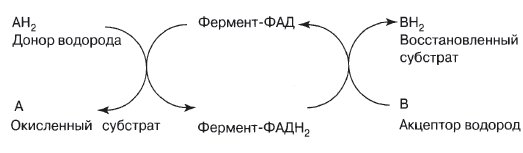
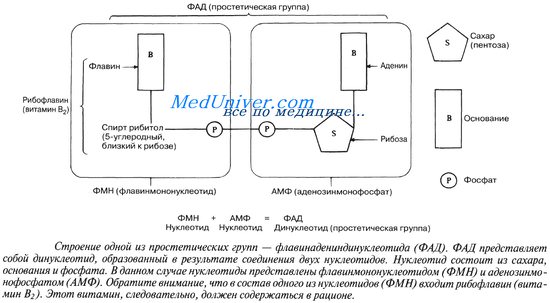
Если кофактор прочно связан с ферментом и остается в этом связанном состоянии постоянно, то его называют простетической группой (от греч. prosthekf — добавление). Роль простети-ческих групп играют органические молекулы. Они помогают ферменту осуществлять его каталитическую функцию, как это видно на примере флавинадениндинуклеотида (ФАД). ФАД содержит рибофлавин (витамин В2), который является водород-акцепторной частью его молекулы.
Функция ФАД связана с окислительными путями клетки, в частности с процессом дыхания, в котором ФАД играет роль одного из переносчиков в дыхательной цепи.
Конечный результат: 2Н переносятся от А к В. В качестве связующего звена между А и В действует один фермент. АНг и В вступают в соединение с активным центром фермента, и ФАД передает Нг от одного субстрата к другому.
Гем — это железосодержащая простетическая группа. Его молекула имеет форму плоского кольца (порфириновое кольцо, такое же, как у хлорофилла), в центре которого находится атом железа. Гем выполняет в организме ряд биологически важных функций.
Перенос электронов. В качестве простетиче-ской группы цитохромов) гем выступает как переносчик электронов. Присоединяя электроны, железо восстанавливается до Fe(II), а отдавая их, окисляется до Fe(III). Гем, следовательно, принимает участие в окислительно-восстановительных реакциях за счет обратимых изменений валентности железа.
Перенос кислорода. Гемоглобин и миоглобин — два гемсодержащих белка, осуществляющих перенос кислорода. Железо находится в них в восстановленной, Fe(II), форме.
Каталитическая функция. Гем входит в состав каталаз и пероксидаз, катализирующих расщепление пероксида водорода до кислорода и воды. Содержится он также и в некоторых других ферментах.
Коферменты (например, НАД, НАДФ, ацетилкофермент А, АТФ)
Коферменты, как и простетические группы, — это органические молекулы, выполняющие функцию кофакторов, но в отличие от простетических групп они сохраняют связь с ферментом только в ходе реакции. Все коферменты представляют собой производные витаминов.
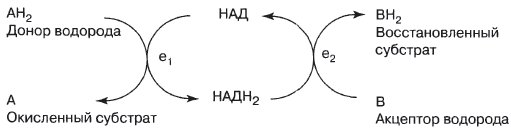
Никотинамидадениндинуклеотид (НАД)
НАД — производное витамина ниацина («никотиновой кислоты») — может существовать как в окисленной, так и в восстановленной форме. В окисленной форме НАД при катализе играет роль акцептора водорода: где ei и е2 — две разные дегидрогеназы.
Конечный результат: 2Н переносятся от А к В. Здесь в качестве связующего звена между двумя различными ферментными системами ei и е2 действует кофермент.
Источник
12. Коферменты и их функции в ферментативных реакциях. Витаминные коферменты. Примеры реакций с участием витаминных коферментов.
КОФЕРМЕНТЫ — низкомолекулярные органические вещества не белковой природы. Они чаще всего содержат в своём составе различные витамины, следовательно, их делят на две группы: 1.Витаминные. 2.Невитаминные.
1.ТИАМИНОВЫЕ в составе витамин В1 (ТИАМИН) — ТМФ – ТИАМИНМОНОФОСФАТ, ТДФ- ТИАМИНДИФОСФАТ, ТТФ — ТИАМИНТРИФОСФАТ. ТПФ связана с ферментами ДЕКАРБОКСИЛАЗАМИ альфа КЕТОКИСЛОТ (ПВК, альфа КГК)
2.ФЛАВИНОВЫЕ содержат витамин В2 — ФМН – ФЛАВИНМОНОНУКЛЕОТИД, ФАД — ФЛАВИИАДЕНИНДИНУКЛЕОТИД.
ФМН и ФАД связанны с ферментами ДЕГИДРОГЕНАЗАМИ. Участвуют в реакциях ДЕГИДРИРОВАНИЯ.
3. ПАНТОТЕИНОВЫЕ (витамин ВЗ) — KOF A (HS-KOA — HS КОЭНЗИМ А) — КОФЕРМЕНТ АЦИЛИРОВАНИЯ.
4. НИКОТИНАМИДНЫЕ содержат витамин РР (НИАЦИН)- НАД (НИКОТИНАМИДАДЕНИНДИНУКЛЕОТИД), НАДФ (НИКОТИНАМИДАДЕНИНДИНУКЛЕОТИДФОСФАТ). Связаны с ДЕГИДРОГЕНАЗАМИ:
5.ПИРИДОКСИНОВЫЕ содержат витамин В6. ПАФ – ПИРИДОКСАМИНОФОСФАТ, ПФ — ПИРИДОКСАЛЬФОСФАТ.:
1.Реакции ПЕРЕАМИНИРОВАНИЯ (ТРАНСАМИНИРОВАНИЕ). Связан с ферментами АМИНОТРАНСФЕРАЗАМИ.
2.РЕАКЦИИ ДЕКАРБОКСИЛИРОВАНИЯ АК.
13. Свойства ферментов. Лабильность конформации, влияние температуры и рН среды. Специфичность действия ферментов, примеры реакций.
1 .Высокая каталитическая активность. УРЕАЗА повышает скорость реакции в 10 раз.
2.Ферменты проявляют ТЕРМОЛАБИЛЬНЫЕ свойства — чувствительность к изменению температуры. При повышении температуры на каждые 10 градусов, скорость ферментативных реакций повышает в 1,5-2 раза (правило ВАНТ — ГОФФА). Уже при 50-60 градусах наблюдается денатурация, а при 100 гр. — полная денатурация с потерей активности. При понижении температуры структура его сохраняется, поэтому при последующем повышении Т. активность восстанавливается. Температура, при которой фермент проявляет максимальную активность, называется ОПТИМАЛЬНОЙ.
3.Ферменты чувствительны к изменениям РН среды. Ферменты с оптимальными значениями РН в нейтральной среде — КАТАЛАЗа РН=7, в кислой среде (пепсин РН=1,5-2,5), в щелочной среде (АРГИНАЗА РН=10-11). Изменение РН приводит к конформационной перестройке не только активного центра, но и всей молекулы фермента. При оптимальном значении РН функциональные группы активного центра находятся в наиболее реакционно-способном состоянии.
4.Специфичность действия ферментов. Различают следующие виды специфичности:
А) Абсолютная специфичность. Ферменты, которые действуют только на 1 субстрат и не действуют на другие субстраты. УРЕАЗА ГИДРОЛИЗУЕТ МОЧЕВИНУ.
В) СТЕРИОСПЕЦИФИЧНОСТЬ. Ей обладают ферменты, действующие на пространственные или стереоизомеры. ЦИС и ТРАНС изомеры; оптические изомеры (ЭНАНТИОМЕРЫ).
С) Групповая специфичность. Ей обладают ферменты, которые катализируют реакции сходных по строению субстратов. Пример: ЛИПАЗА — участвует в расщеплении ЛИПИДОВ. ПЕПТИДАЗЫ действуют на субстраты с ПЕПТИДНЫми связями.
14. Номенклатура и классификация ферментов. Характеристика класса оксидоредуктаз. Примеры реакций с участием оксидоредуктаз
Каждый класс делится на подклассы. Подклассы делятся на ПОДПОДКЛАССЫ.
Ферменты этого класса участвуют в ОВР. Это наиболее многочисленный класс ферментов (более 400 ОКСИДОРЕДУКТАЗ). 1.АЭРОБНЫЕ ДЕГИДРОГЕНАЗЫ. Они участвуют в реакциях ДЕГИДРИРОВАНИЯ.
Некоторые АЭРОБНЫЕ ДЕГИДРОГЕНАЗЫ называют ОКСИДАЗАМИ. Например, ОКСИДАЗЫ АК.
2.АНАЭРОБНЫЕ ДГ. Эти ферменты также участвуют в реакциях ДЕГИДРИРОВАНИЯ, т.е. отнятия Н2 от окисляемого субстрата и транспортировка его на любой др. субстрат, кроме О2.
3.ПЕРОКСИДАЗЫ. Ферменты, которые отнимают Н2 от окисляемого субстрата и транспортируют его на ПЕРОКСИД.
4.ЦИТОХРОМЫ. Они содержат в своем составе ГЕМ. ЦИТОХРОМЫ участвуют в транспорте только электронов.
Тут вы можете оставить комментарий к выбранному абзацу или сообщить об ошибке.
Источник
22.Кофакторы ферментов: ионы металлов и коферменты. Коферментные функции витаминов (на примере витаминов в6, рр, в2).
Большинство ферментов для проявления ферментативной активности нуждается в низкомолекулярных органических соединениях небелковой природы (коферментах) и/или в ионах металлов (кофакторах).
Кофакторывыполняют функцию стабилизаторов молекулы субстрата, активного центра фермента и конформации белковой молекулы фермента, а именно третичной и четвертичной структур. В некоторых случаях ионы металла служат «мостиком» между ферментом и субстратом. Они выполняют функцию стабилизаторов активного центра, облегчая присоединение к нему субстрата и протекание химической реакции. В ряде случаев ион металла может способствовать присоединению кофермента. Перечисленные выше функции выполняют такие металлы, как Mg2+, Mn2+, Zn2+, Co2+, Мо2+. В отсутствие металла эти ферменты активностью не обладают. Такие ферменты получили название «металлоэнзимы». Схематично данный процесс взаимодействия фермента, субстрата и металла можно представить следующим образом:
Кофермент, локализуясь в каталитическом участке активного центра, принимает непосредственное участие в химической реакции, выступая в качестве акцептора и донора химических группировок, атомов, электронов. Кофермент может быть связан с белковой частью молекулы ковалентными и нековалентными связями. В первом случае он называется простетической группой (например, FAD, FMN, биотин, липоевая кислота). Вместе с тем известны примеры, когда кофермент присоединяется к ферменту нековалентными связями настолько прочно, что не диссоциирует от белковой молекулы, например тиаминдифосфат. Во втором случае кофермент взаимодействует с ферментом только на время химической реакции и может рассматриваться в качестве второго субстрата. Примеры — NAD+, NADP+. Апофермент обеспечивает специфичность действия и отвечает за выбор типа химического превращения субстрата. Один и тот же кофермент, взаимодействуя с различными апоферментами, может участвовать в разных химических превращениях субстрата. Например, пиридоксальфосфат в зависимости от того, с каким апоферментом взаимодействует, участвует в реакциях трансаминирования или декарбоксилирования аминокислот.
Химическая природа коферментов, их функции в ферментативных реакциях чрезвычайно разнообразны. Традиционно к коферментам относят производные витаминов, хотя помимо них есть значительный класс небелковых соединений, принимающих участие в проявлении каталитической функции ферментов.
К коферментам относят следующие соединения:
гемы, входящие в состав цитохромов, каталазы, пероксидазы, гуанилатциклазы, NO-синтазы и являющиеся простетической группой ферментов;
нуклеотиды — доноры и акцепторы остатка фосфорной кислоты;
убихинон, или кофермент Q, участвующий в переносе электронов и протонов в ЦПЭ;
фосфоаденозилфосфосульфат, участвующий в переносе сульфата;
S-аденозилметионин (SAM) — донор метильной группы;
глутатион, участвующий в окислительно-восстановительных реакциях.
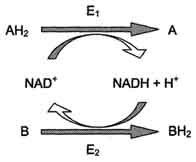
Витамин РРвходит в состав кофермента НАД + и НАДФ + , который принимает участие в ферментативных реакциях по последовательному механизму. Две ферментативные реакции, катализируемые ферментами Е1 и Е2, сопряжены друг с другом посредством кофермента NAD+, служащего в каждом из этих случаев субстратом. Для первого фермента субстратом служит окисленная форма NAD, в качестве второго субстрата выступает донор водорода — пример последовательных реакций, продуктом — восстановленная форма NAD, для фермента Е2 — наоборот.
Витамин В5 – принимает участие в синтезе кофермента А (Ацетил-КоА). Кофермент А (КоА) —коферментацетилирования; один из важнейших коферментов; принимает участие в реакциях переносаацильных групп.МолекулаКоА состоит из остаткаадениловой кислоты, связанной пирофосфатной группой с остаткомпантотеновой кислоты, соединённой пептидной связью с остаткомβ-меркаптоэтаноламина.
С КоА связан ряд биохимических реакций, лежащих в основе окисленияисинтезажирных кислот, биосинтеза жиров, окислительных превращений продуктов распада углеводов. Во всех случаях КоА действует в качестве промежуточного звена, связывающего и переносящего кислотные остатки на другие вещества. При этом кислотные остатки в составе соединения с КоА подвергаются тем или иным превращениям, либо передаются без изменений на определённые метаболиты.
Витамин В2 – принимает участие в формировании кофактора ФАД и ФМН. Флавинадениндинуклеотид —кофактор, принимающий участие во многих окислительно-восстановительных биохимических процессах. FAD существует в двух формах — окисленной и восстановленной, его биохимическая функция, как правило, заключается в переходе между этими формами. FAD может быть восстановлен до FADH2, при этом он принимает два атома водорода. Молекула FADH2 является переносчиком энергии и восстановленныйкоферментможет быть использован каксубстратв реакцииокислительного фосфорилированиявмитохондрии. Молекула FADH2 окисляется в FAD, при этом выделяется энергия, эквивалентная (запасаемая в форме) двум молям ATФ.
Источник
Витамин кофермент фермент процесс
Полагают, что эти ионы заставляют молекулы фермента или субстрата принять форму, способствующую образованию фермент-субстратного комплекса. Тем самым увеличиваются шансы на то, что фермент и субстрат действительно прореагируют друг с другом, а следовательно, возрастает и скорость реакции, катализируемой данным ферментом. Так, например, активность амилазы слюны повышается в присутствии хлорид-ионов.
Простетические группы
Если кофактор прочно связан с ферментом и остается в этом связанном состоянии постоянно, то его называют простетической группой (от греч. prosthekf — добавление). Роль простети-ческих групп играют органические молекулы. Они помогают ферменту осуществлять его каталитическую функцию, как это видно на примере флавинадениндинуклеотида (ФАД). ФАД содержит рибофлавин (витамин В2), который является водород-акцепторной частью его молекулы.
Функция ФАД связана с окислительными путями клетки, в частности с процессом дыхания, в котором ФАД играет роль одного из переносчиков в дыхательной цепи.
Конечный результат: 2Н переносятся от А к В. В качестве связующего звена между А и В действует один фермент. АНг и В вступают в соединение с активным центром фермента, и ФАД передает Нг от одного субстрата к другому.
Гем — это железосодержащая простетическая группа. Его молекула имеет форму плоского кольца (порфириновое кольцо, такое же, как у хлорофилла), в центре которого находится атом железа. Гем выполняет в организме ряд биологически важных функций.
Перенос электронов. В качестве простетиче-ской группы цитохромов) гем выступает как переносчик электронов. Присоединяя электроны, железо восстанавливается до Fe(II), а отдавая их, окисляется до Fe(III). Гем, следовательно, принимает участие в окислительно-восстановительных реакциях за счет обратимых изменений валентности железа.
Перенос кислорода. Гемоглобин и миоглобин — два гемсодержащих белка, осуществляющих перенос кислорода. Железо находится в них в восстановленной, Fe(II), форме.
Каталитическая функция. Гем входит в состав каталаз и пероксидаз, катализирующих расщепление пероксида водорода до кислорода и воды. Содержится он также и в некоторых других ферментах.
Коферменты (например, НАД, НАДФ, ацетилкофермент А, АТФ)
Коферменты, как и простетические группы, — это органические молекулы, выполняющие функцию кофакторов, но в отличие от простетических групп они сохраняют связь с ферментом только в ходе реакции. Все коферменты представляют собой производные витаминов.
Никотинамидадениндинуклеотид (НАД)
НАД — производное витамина ниацина («никотиновой кислоты») — может существовать как в окисленной, так и в восстановленной форме. В окисленной форме НАД при катализе играет роль акцептора водорода: где ei и е2 — две разные дегидрогеназы.
Конечный результат: 2Н переносятся от А к В. Здесь в качестве связующего звена между двумя различными ферментными системами ei и е2 действует кофермент.
Источник