Витамин Е (токоферол)
Токоферолы и токотриены носят собирательное название «витамин Е». Группа объединяет 8 природных изомеров, которые человек получает с пищей. Витамин Е – жирорастворимый, это естественный антиоксидант.
Описание
Слово «токоферол» в переводе с греческого означает «приносящий деторождение». Название отражает историческое понимание биологической роли витамина Е. Вещество тормозит окисление ненасыщенных жирных кислот, из которых состоят мембраны всех клеток человеческого тела.
В организме человека и животных мембраны постоянно подвергаются воздействию свободных радикалов. Такой радикал – это молекула со свободным электроном, который соединяется с мембраной или другой молекулой. От такого соединения изменяется кодирование генов и структура белка. Клеточная мембрана утрачивает целостность и клетка становится беззащитной. Клеточная жидкость выходит в межклеточное пространство, в крови повышает концентрация кальция.
В сумме изменения приводят к бесплодию, полиорганной недостаточности, увяданию кожи и раннему старению.
Свободные радикалы образуются в организме постоянно, количество увеличивается во время курения, стресса, любой нагрузки. Следовательно, мембранам клеток ежедневно нужна защита для сохранения здоровья.
У витамина Е имеется также множество других биологических задач:
- нормальная функция детородных органов обоих полов;
- возможность зачатия и деторождения;
- работа иммунитета;
- ускорение восстановления клеток или регенерации;
- обеспечение работы мышц и нервов;
- участие в свертывании крови;
- поддержание нормального тонуса сосудов, особенно капилляров;
- торможение процессов старения;
- синтез гема – основного белка в составе гемоглобина;
- замедление образования тромба;
- продукция гормонов.
Организм витамин Е не вырабатывает, вещество поступает с пищей. Суточная потребность – от 10 до 30 мг в зависимости от нагрузки. Вещество содержится в растительных маслах, бобах, рыбе, яйцах, орехах, зелени. Всасывание происходит в кишечных петлях, откуда вещество попадает в лимфу и с ней попадает во все ткани на «спине» липопротеидов. Содержание токоферола в тканях неодинаковое, максимум определяется в мышцах, печени, нервной и жировой ткани. Неиспользованный токоферол накапливается.
Недостаточность токоферола развивается по нескольким причинам:
- голодание или жесткие диеты, соблюдаемые длительный срок;
- нарушение усвоения и переваривания жиров в петлях кишечника при многих болезнях – синдроме мальабсорбции, дефектах развития желчеобразующей системы, глубокой недоношенности;
- нарушение транспорта в ткани – бывает при наследственной недостаточности некоторых белков.
Если витамина Е не хватает, страдает работа всего организма, но органы страдают в разной степени. Наибольший ущерб испытывают те ткани, в которых велика протяженность мембран, а окисление проходит на высокой скорости. От этого страдают:
- мышцы;
- нервы;
- внутренний слой, выстилающий органы размножения у мужчин;
- почки;
- печень;
- все ткани плода, особенно на стадии зародыша;
- эритроциты или форменные элементы, переносящие кислород;
- кожа.
При недостатке витамина Е развивается миодистрофия или состояние, при котором мышцы становятся слабыми и понемногу атрофируются. Дистрофия затрагивает все типы мышц — скелета, внутренних органов. На коже появляются пигментные пятна, присущие старикам, увядание, сухость.
Страдает нервная система – нарушается координация, речь, чувствительность. Изменения, касающиеся крови, выражаются в гемолизе или разрушении эритроцитов. Без этого витамина невозможно нормальное зачатие и вынашивание беременности. У мужчин нарушается сперматогенез, у женщин – менструальный цикл. В условиях дефицита токоферола зачатие если и происходит, то беременность прерывается на ранних сроках.
Обсуждается роль токоферола в торможении развитии атеросклероза и рака, считается, что нормальный уровень напрямую связан с продолжительностью жизни.
При передозировке аптечных витаминов может формироваться избыток токоферола. Это ведет к расстройству свертывания, снижению уровня глюкозы, сумеречного зрения.
Однако токоферол не токсичен, его избыток вызывает незначительные расстройства здоровья в виде повышения артериального давления, диспепсии, слабости, головной боли, ослабление потенции, ночные мышечные судороги.
Назначить исследование может врач любой специальности, поскольку расстройство может коснуться каждого органа. Изменить уровень можно при помощи коррекции питания, чтобы предотвратить гиповитаминоз.
Источник
Параграф 93. Две группы гормонов, механизм гидрофо
Автор текста – Анисимова Елена Сергеевна.
Авторские права защищены. Продавать текст нельзя.
Курсив не зубрить.
Замечания можно присылать по почте: exam_bch@mail.ru
https://vk.com/bch_5
Параграф учебника по биохимии 93:
«Две группы гормонов
в зависимости от местонахождения их рецепторов.
Механизм действия гидрофобных гормонов.»
93.1. Местонахождение рецепторов гидрофобных и гидрофильных гормонов.
93.2 Действие Г И Д Р О Ф О Б Н Ы Х Г О Р М О Н О В
и механизм действия стероидных гормонов, ЙТ, витаминов А и Д.
93.3. О действии стероидных гормонов:
Примеры действия гидрофобных гормонов.
93.4. Механизм действия Г И Д Р О Ф И Л Ь Н Ы Х ГОРМОНОВ.
Связывание гормона с рецептором приводит
к изменению КОНФОРМАЦИИ (п.58)
и АКТИВНОСТИ определенных белков клетки.
Изменение активности белков приводит к изменению процессов клетки.
Изменение процессов клетки под влиянием гормона
– это ответ клетки на действие гормона
и то же время это – эффект гормона.
Белки, изменение конформации и активности которых
приводит к изменению процессов клетки
(то есть к ответу клетки на гормональный (или другой) сигнал),
называются эффекторными белками.
93. 1. Местонахождение рецепторов гидрофобных и гидрофильных гормонов.
Липидные гормоны (стероидные, ретиноат) и ЙТ гидрофобны,
а остальные гормоны гидрофильны.
Гидрофобные гормоны способны проходить через мембрану
внутрь клетки,
а гидрофобные – не способны.
Поэтому рецепторы гидрофобных гормонов
могут быть внутри клетки,
а рецепторы гидрофильных – не могут быть внутри
и должны быть на внешней поверхности плазматической мембраны.
93. 2. Действие Г И Д Р О Ф О Б Н Ы Х Г О Р М О Н О В
и механизм действия стероидных гормонов, ЙТ, витаминов А и Д.
Витамины А и Д превращаются в гидрофобные гормоны:
витамин А – в гормона ретиноат,
а витамин Д – в гормон кальцитриол – п.114.
Ретиноат и кальцитриол являются производными витаминов,
их активными формами.
Гидрофобные гормоны
способны проходить через мембраны клеток
внутрь клеток.
Поэтому рецепторы гидрофобных гормонов
могут находиться внутри клеток.
Рецепторы стероидных гормонов находятся в гиалоплазме,
а рецепторы ЙТ, ретиноата и кальцитриола – в ядре.
После связывания гормонов с рецепторами
их комплекс (HR-комплекс)
связывается с участком ДНК,
который называется регуляторным участком ДНК (п.81)
или реактивным элементом,
и усиливает или снижает транскрипцию определенных генов.
Если начинается транскрипция гена,
то это приводит к увеличению или появлению РНК,
кодируемых данным геном.
Появление РНК даёт возможность клетке синтезировать белок,
кодируемый данной РНК.
Появление белка даёт возможность осуществлять какой-то процесс –
например, химическую реакцию, если этот белок фермент.
HR-комплекс связывается одним своим участком с ДНК,
а другим участком HR-комплекс связывается с белком,
который называется коактиватором
и с которым могут связываться еще несколько белков, связанных с ДНК.
Коактиватор влияет на базальный транскрипционный комплекс
и РНК-полимеразу:
«разрешает» или «запрещает» транскрипцию гена.
Усиление транскрипции приводит
к увеличению синтеза и количества РНК.
Увеличение [мРНК] дает возможность
ускорить синтез кодируемого этой мРНК белка
(то есть трансляцию мРНК).
Ускорение синтеза белка приводит к накоплению этого белка в клетке
и дает возможность ускорить процессы, осуществляемые этим белком.
Например, катализировать реакции, если белок является ферментом,
или ускорить транспорт в клетку определенного вещества,
если белок является транспортером этого вещества.
В результате изменяются [веществ] в клетке, т.е. химический состав клетки.
Все перечисленные процессы протекают
в течение нескольких часов или суток,
поэтому эффекты гидрофобных гормонов называются поздними.
Поскольку поздние эффекты связаны с влиянием на ДНК (на геном),
то их еще называют геномными.
93. 3. О действии стероидных гормонов:
уже говорилось, что их рецепторы находятся в гиалоплазме;
когда они образуют HR-комплекс,
то он переходит из гиалоплазмы в ядро.
Усиливая транскрипцию гена
и вследствие этого – накопление белка,
гормон проявляет себя как индуктор,
а снижая транскрипцию – как репрессор.
Примеры действия гидрофобных гормонов.
ГКС (п.108)
способствуют транскрипции генов,
кодирующих ключевые ферменты ГНГ («индуцируют ГНГ»),
что приводит к увеличению [ключевых ферментов ГНГ]
и дает возможность ускорить ГНГ (п.33)
и ускорить образование глюкозы,
которая выйдет в кровь,
что увеличит [глюкозы] в крови (вызовет гипергликемию).
Поэтому ГКС являются гипергликемическими гормонами.
Транскрипцию генов ключевых ферментов гликолиза ГКС подавляют (репрессируют),
не давая возможности увеличить [мРНК] ферментов
и синтезировать ключевые ферменты гликолиза.
Гормон тестостерон
способствует транскрипции генов,
кодирующих белки,
работа которых приводит к формированию мужского фенотипа.
В частности, тестостерон усиливает синтез мышечных белков –
поэтому мышечная масса у мужчин больше, чем у женщин (экз. задача № ).
Кальцитриол (п.114, 19)
(активная форма витамина Д)
способствует синтезу белка,
связывающего ионы кальция в кишечнике –
благодаря этому ионы кальция «усваиваются» в кишечнике
из творога, кунжута и др. продуктов.
При гиповитаминозе Д кальция в организме мало,
и поэтому кости разрушаются, даже если в пище много кальция:
кальций пищи не может усвоиться в кишечнике без помощи кальцитриола
(индуцируемого им белка-транспортёра).
СТС для гидрофобных гормонов
представлена транскрипционным фактором,
который является и рецептором гидрофобного гормона,
и в то же время конечным эффекторным белком.
Гидрофобные гормоны способны действовать и на другие белки –
на ионные каналы, например (п.93).
О липидном гормоне ФАТ далее.
93. 4. Д е й с т в и е Г И Д Р О Ф И Л Ь Н Ы Х ГОРМОНОВ.
См. п.94-98 сначала.
Гидрофильными являются все гормоны, кроме липидных и ЙТ,
т.е. амины,
белково-пептидные,
нуклеозиды (аденозин).
Они не способны проходить через мембраны,
поэтому рецепторы гидрофильных гормонов
находятся на внешней поверхности клетки
(являются мембранными белками).
При связывании гормона с рецептором
образуется гормон-рецепторный (HR) комплекс.
Этот НR комплекс может действовать на белки мембраны:
1) на ионные каналы (при этом рецептор может быть частью ионного канала),
2) на G-белки, регулирующие активность ферментов синтеза вторых посредников или ионные каналы,
3) на ферменты ГЦ или ТК – подробнее в № 94-97.
Действие на ионные каналы приводит (п.94):
1) к открытию каналов (обычно),
2) переходу ионов через открытые каналы,
3) изменению заряда мембраны
4) и изменению активности клетки –
все эти события происходят за миллисекунды,
поэтому их называют быстрыми ответами
клетки на действие гормона,
а эффект гормона – быстрым или ионотропным.
(Но если каналы регулируются не HR-комплексом непосредственно,
а с участием G-белков, ферментов, вторых посредников и ПК,
то ответ клетки оказывается скорее медленным, чем быстрым).
Действие на остальные белки приводит
к изменению активности ферментов или ТФ.
Изменение активности ферментов приводит
к изменению скорости реакций и концентраций метаболитов,
поэтому такие эффекты гомонов называют метаботропными.
Поскольку метаботропные эффекты развиваются за минуты,
то их называют медленными.
Изменение активности ТФ приводит,
как и при действии на ТФ гидрофобных гормонов,
к поздним (геномным) ответам.
Источник
Витамин е гидрофобный или гидрофильный
(1) ГБОУ ВПО «Ивановская государственная медицинская академия» МЗ РФ, Иваново; (2) Российский сотрудничающий центр Института микроэлементов ЮНЕСКО, Москва; (3) ФГБУН «Вычислительный центр им. А.А. Дородницына» РАН, Москва
Введение
Витамин D – жирорастворимый витамин-гормон, влияющий на широкий спектр физиологических процессов, включая формирование структуры кости, иммуномодуляцию, развитие нервной системы, регуляцию сосудистого тонуса и артериального давления. Достаточная обеспеченность витамином D характеризуется противоопухолевым, нейропротекторным и нейротрофическим эффектами [1].
Для осуществления своих разносторонних биологических эффектов жирорастворимый витамин D должен эффективно всосаться из тонкого кишечника, поступить в кровь. Обогащенная биологически активными формами витамина D кровь доставляет витамин ко всем тканям организма, в которых расположены рецепторы витамина D (VDR – vitamin D receptor).
Всасывание и биодоступность
Скорость кишечного всасывания витамина D наиболее высока в проксимальных и средних сегментах тонкой кишки [2]. При этом, как и в случае других жирорастворимых витаминов [3], всасывание витамина D существенно зависит от присутствия других нутриентов [4].
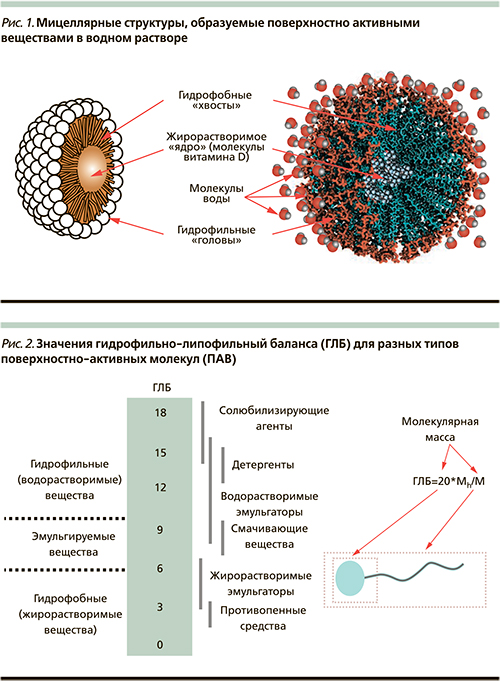
Фармакологические и физико-химические исследования показали, что кишечная абсорбция витамина D наиболее полно происходит из растворов т.н. мицелл [5]. В физической химии мицеллы (от лат. mica – крупинка) – коллоидные наночастицы, образующие мелкодисперсную взвесь в большом объеме растворителя. В случае биологических систем такими растворителями являются водные растворы, образующие внутреннюю среду организма.
Мицеллы – наночастицы (10… 1000 нм в диаметре) с «жировой начинкой» (содержащей витамин D) и гидрофильной оболочкой, которая позволяет наночастицам равномерно распределяться по всему объему водного раствора. Именно за счет образования мицелл и происходит «солюбилизация» витамина D (т.е. переход в водорастворимую форму) [6]. В настоящей работе рассмотрены результаты фармакологических исследований витамина D, указавшие на принципиальное значение мицеллообразования для полноценного всасывания витамина D.
Фундаментальные физико-химические принципы образования мицелл в водных растворах
В водной среде мицеллы образуются особыми амфифильными молекулами (поверхностно активными веществами – ПАВ, или эмульгаторами), т.е. молекулами, имеющими гидрофобный «хвост» (выталкиваемый из водного раствора вследствие сил поверхностного натяжения) и гидрофильную «голову» (наоборот, обладающую повышенным сродством к водному раствору). Такими молекулами являются, например, липиды. Поскольку гидрофобные хвосты амфифильных молекул выталкиваются из водного раствора, энергетически выгодной является такая конфигурация, в которой гидрофобные концы «скрыты» от растворителя, а гидрофильные концы молекул, наоборот, максимально взаимодействуют с молекулами воды.
Мицеллообразование имеет большое значение для усвоения организмом жирорастворимых витаминов и сложных липидов. Соли желчных кислот, образуемые в печени и поступающие из желчного пузыря, стимулируют мицеллообразование жирных кислот (ЖК). Именно за счет этих мицелл и осуществляется всасывание сложных липидов (например, лецитина) и жирорастворимых витаминов (А, D, Е и К) в тонком кишечнике.
Мицелла является энергетически выгодной конфигурацией амфифильных молекул (рис. 1). При образовании мицеллы несколько десятков или сотен амфифильных молекул объединяются так, что гидрофобные концы образуют ядро (внутреннюю область), а гидрофильные группы – поверхностный слой мицеллы, окруженный стабилизирующей оболочкой молекул растворителя и адсорбированных из водного раствора ионов.
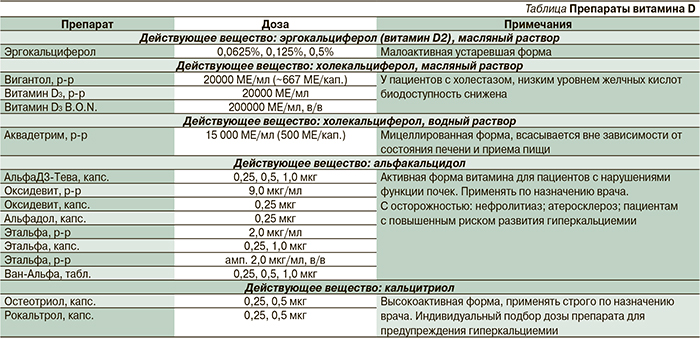
Мицеллы, как правило, имеют сферическую форму, хотя возможно образование эллипсоидов или цилиндров. Форма и размер мицеллы зависят от молекулярной структуры амфифильных молекул ПАВ (в частности, их гидрофильно-липофильного баланса, см. ниже) и таких условий образования раствора, как концентрация ПАВ, температура, рН и ионная сила («соленость»). Мицеллы образуются, только когда концентрация поверхностно-активного вещества больше, чем критическая концентрация мицеллообразования (ККМ), а температура системы превышает критическую температуру мицеллообразования (КТМ, или температура Крафта) [7, 8].
Важнейшим параметром любого ПАВ является гидрофильно-липофильный баланс (ГЛБ), который вычисляется как ГЛБ=20хMh/M, где Mh – молекулярная масса гидрофильной части («головы») молекулы, а M – молекулярная масса всей молекулы. Значение ГЛБ=0 соответствует полностью липофильной (гидрофобной) молекуле (например, бензол, бутан и др.), а значение 20 соответствует полностью гидрофильной (липофобной) молекуле (сама молекула воды, муравьиная кислота и др.) (рис. 2).
Зависимость параметров образуемых мицелл от молекулярной структуры инкапсулируемого в мицелле вещества может быть наглядно проиллюстрирована на примере включения витамина Е (токоферол), витамина D (холекальциферол) и экстракта масла лимона в мицеллы на основе одного и того же ПАВ (Tween-20, 1%-ный раствор) с относительно коротким гидрофобным хвостом (цепь из 11 атомов углерода, около 1,1… 1,3 нм) и очень большой гидрофильной головкой (включает 25 атомов кислорода). Вследствие короткого хвоста даже такие сравнительно небольшие молекулы, как витамины E и D, будут оказывать существенное воздействие на мицеллобразование в данной системе (рис. 3) [9].
Так, молекулы токоферола характеризуются вытянутой формой (гидрофобный «хвост» из 13 атомов, гидрофобная головка бензодигидропиранового ядра), поэтому токоферолы встраиваются, не нарушая структуры ядра.
В результате мицеллы получаются «одна к одной», т.е. имеют небольшой разброс в размерах.
Более «массивная» молекула витамина D (стероидное ядро с разветвленной цепью) вносит дополнительные искажения в процесс мицеллообразования, так что получающиеся мицеллы характеризуются гораздо большей неоднородностью размеров – пик уширяется.
В случае лимонного масла, которое является смесью различных молекул (средняя молекулярная масса порядка 1000 Да), эти компоненты смеси, очевидно, группируются по размерам и образуются мицеллы двух существенно различных размеров (два сравнительно больших пика на рис. 3).
Желчные кислоты, мицеллообразование и биоусвояемость витамина D
Оценка эффективности всасывания различных форм витамина D в эксперименте (моделирование фистул желудочно-кишечного тракта у крыс) указала на различные пути всасывания витамина D3 (1,25-дигидроксивитамина D3, 25-гидроксивитамина D3, холекальциферола) из мицеллярных растворов. При помещении мицеллярных растворов (содержащих 50 нмоль витамина D3 с радиоактивной меткой) в сегменты тощей кишки гидроксилированные формы витамина поступали в первую очередь в венозный кровоток. Средняя скорость венозного транспорта 1,25-(OH)2-D3 составила 1830 нмоль/мин/г, а 25-(OH)-D3 – ниже 900 нмоль/мин/г, а холекальциферола – всего 13 нмоль/мин/г. 25-гидроксилирование холекальциферола и 1-гидроксилирование всосавшегося 25-(OH)-D3 стимулировало транспорт через воротную вену. Без использования мицеллярной формы всасывание витамина D резко снижалось [10].
В норме мицеллы, содержащие витамин D, образуются в кишечном транзите под действием природных эмульгаторов – желчных кислот.
В эксперименте дефицит желчных кислот существенно снижал всасывание витамина D в кишечнике. При лигировании брыжеечных желчных протоков всасывание трех основных метаболитов витамина (витамин D3, 25-гидроксивитамин D3 и 1,25-дигидроксивитамина D3) в лимфу заметно снизилось [11]. Добавление таурохолата достоверно повышало всасывание витамина (рис. 4).
Смешанные мицеллы витамина D, образованные с использованием липидов, характеризуются улучшенным всасыванием витамина D в лимфу. Мицеллы для транспорта витамина D изготавливались с использованием ЖК, моноглицеридов и желчных кислот. Количество витамина D, появляющегося в лимфе экспериментальных животных, было значительно выше при интрадуоденальном введении именно смешанных мицелл на основе линолевой или пальмитиновой кислот по сравнению с мицеллами только на основе желчных кислот (таурохолат). Липиды в составе мицелл для переноса витамина D ускоряли процесс транспорта из слизистой оболочки внутрь эпителиоцитов кишечника [12].
Молекулярная структура ЖК и их концентрация модулируют мицеллообразование и всасывание витамина D. Исследование свойств мицелл, образованных различными ЖК, показало, что длинноцепочечные ЖК в концентрациях порядка 500 мкмоль/л снижают всасывание холекальциферола, а омега(Ω)-9 олеиновая кислота и Ω-3 эйкозапентаеновая кислота (ЭПК) значительно повышают всасывание холекальциферола (рис. 5.) [13]. Продуктами-концентраторами олеиновой кислоты являются орехи (фундук, кешью), папайя, треска, оливковое масло; продукты концентраторы ЭПК – сардины, скумбрия, сельдь.
Помимо мицеллообразования важно отметить и то, что влияние ЖК на всасывание витамина D зависит от воздействия кислот на белки липидного транспорта. Иначе говоря, витамин D (в форме провитамина, холекальциферола) всасывается не просто за счет пассивной диффузии, но и посредством таких белков – транспортеров холестерина, как NPC1 (Niemann-Pick type C proteins, осуществляет внутриклеточный транспорт липидов, предотвращает накопление липидов продуктов в эндосомах и лизосомах), SR-BI рецептор (scavenger receptor class B type I, облегчает всасывание сложных эфиров холестерина в печени из липопротеидов высокой плотности), MTTP (microsomal triglyceride transfer protein, микросомальный транспортный белок триглицеридов, играет центральную роль в сборке частиц липопротеидов), ABCA1 (АТФ-связывающий транспортер, регуляторный белок потока холестерина). Действительно, разные ЖК по-разному воздействуют на экспрессию этих белков (рис. 6) и, соответственно, на усвоение витамина D (рис. 5) [13].
С практической точки зрения результаты этого эксперимента позволяют сделать несколько важных выводов. Во-первых, пища с высоким содержанием олеиновой кислоты будет наиболее эффективно повышать всасывание витамина D из мицелл. В то же время высокое содержание пальмитиновой кислоты в пище (маргарин, твердые растительные жиры, свиной и говяжий жиры) будет затруднять усвоение витамина D (в частности, за счет достоверного снижения экспрессии белков – транспортеров холестерина).
Результаты клинических исследований подтвердили важность солюбилизации и мицеллообразования для усвоения витамина D. Всасывание витамина D3 в тощей кишке оценивалось у здоровых добровольцев после стандартизированного для всех участников завтрака (каша, йогурт, напиток). Изучение кривых концентраций витамина D3 в водной фазе в течение 30 минут после приема пищи показало, что более высокое всасывание коррелировало с более высокими уровнями желчных кислот и свободных ЖК (рис. 7). Существование таких корреляций соответствует образованию смешанных мицелл (витамин D3, липиды, желчные кислоты) в водной фазе [14].
В клиническом исследовании было показано, что эмульгатор d-α-токоферол полиэтиленгликоль-1000 сукцинат (ТПГС) усиливает всасывание витамина D при хроническом холестазе у детей. Сравнение эффектов приема 1000 МЕ/кг витамина D и той же дозы витамина D в смеси с ТПГС (25 МЕ/кг) показало, что у пациентов с холестазом прием только витамина D не приводил к достоверному повышению уровней 25-гидроксивитамина в крови (вследствие существенного снижения секреции желчных кислот). В то же время прием витамина D в смеси с ТПГС показал площадь под кривой на +156±33 нг/мл бóльшую по сравнению с витамином D (р
Источник