Витамин для синтеза гемоглобина
Нарушение созревания, связанное с недостаточным всасыванием витамина В12 из желудочно-кишечного тракта:
а) Пернициозная анемия. Распространенной причиной нарушения созревания красных клеток крови является недостаточное всасывание витамина В12 из желудочно-кишечного тракта. Это часто происходит при заболевании пернициозной анемией, при которой основной патологией является атрофический гастрит, нарушающий нормальную секреторную функцию желудка. Париетальные клетки желудочных желез секретируют гликопротеин, называемый внутренним фактором, который соединяется с витамином В12 пищи и делает этот витамин доступным для всасывания в кишечнике. Это происходит следующим образом: (1) внутренний фактор прочно связывается с витамином B12. В таком связанном состоянии витамин В12 защищается от переваривания желудочно-кишечными секретами; (2) находясь в связанном состоянии, внутренний фактор связывается со специфическими рецепторами на мембранах клеток щеточной каемки слизистой подвздошной кишки; (3) затем в течение следующих нескольких часов витамин В12 транспортируется в кровь путем пиноцитоза; в результате внутренний фактор и витамин вместе переносятся через мембрану. Следовательно, недостаток внутреннего фактора ведет к уменьшению доступности витамина В12 из-за нарушения всасывания витамина.
Сразу после всасывания из желудочно-кишечного тракта витамин B12 сначала накапливается в печени в большом количестве, затем медленно выделяется по мере потребности в нем костного мозга. Минимальное количество витамина B12, необходимое ежедневно для поддержания нормального созревания красных клеток крови, составляет всего 1-3 мкг, а нормальное накопление в печени и других тканях тела примерно в 1000 раз больше этого количества. Следовательно, обычно для развития анемии в связи с нарушением созревания эритроцитов недостаточность всасывания В12 должна продолжаться 3-4 года.
б) Недостаточность созревания, связанная с дефицитом фолиевой кислоты (птероилглутаминовой кислоты). Фолиевая кислота является нормальным компонентом овощей, некоторых фруктов и мяса (особенно, печени). Однако она легко разрушается во время приготовления пищи. Кроме того, люди с нарушением всасывания в желудочно-кишечном тракте, например при часто встречающемся заболевании тонкого кишечника, которое называют спру, обычно имеют серьезные затруднения всасывания и фолиевой кислоты, и витамина B12. Следовательно, во многих случаях причиной нарушений созревания является недостаточность всасывания в кишечнике и фолиевой кислоты, и витамина B12.
Формирование гемоглобина
Синтез гемоглобина начинается в проэритробластах и продолжается даже на стадии ретикулоцита красных клеток крови. Следовательно, когда ретикулоциты оставляют костный мозг и проходят в кровоток, они продолжают формировать минимальные количества гемоглобина в течение примерно следующего дня до тех пор, пока не станут зрелыми эритроцитами.
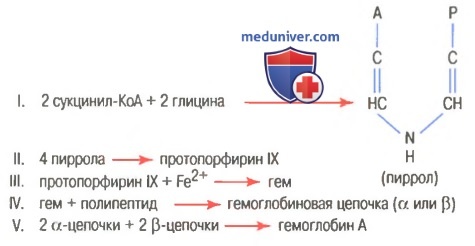
На рисунке выше показаны основные химические этапы формирования гемоглобина. Сначала сукцинил-КоА, формируемый в метаболическом цикле Кребса, связывается с глицином, образуя молекулу пиррола. В свою очередь, четыре молекулы пиррола объединяются, образуя протопорфирин IX, который затем соединяется с железом, формируя молекулу гема. Наконец, каждая молекула гема присоединяется к синтезируемому рибосомами длинному полипептиду глобину, формируя субъединицу гемоглобина, называемую гемоглобиновой цепочкой (для облегчения понимания просим вас изучить рисунок ниже). Каждая цепочка имеет молекулярную массу около 16000; в свою очередь, четыре такие цепочки свободно связываются вместе, формируя целую гемоглобиновую молекулу.
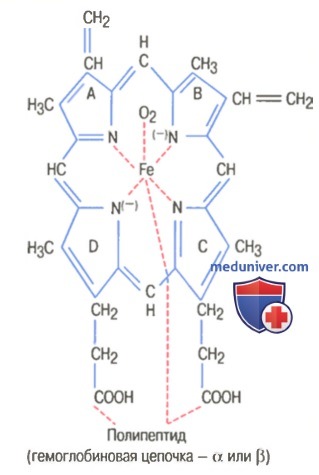
Существуют несколько легких вариаций гемоглобиновых цепочек в зависимости от аминокислотного состава полипептидной части субъединицы. Разные типы цепочек обозначают как альфа, бета, гамма и дельта. Наиболее распространенная форма гемоглобина взрослого человека — гемоглобин А. Он представляет собой комбинацию двух альфа-цепочек и двух бета-цепочек. Гемоглобин А имеет молекулярную массу 64458.
Поскольку каждая гемоглобиновая цепочка имеет простетическую группу в виде гема, содержащего атом железа, ясно, что каждая молекула гемоглобина, состоящая из четырех таких цепочек, содержит четыре атома железа. Каждый из них может свободно связываться с одной молекулой кислорода, обеспечивая возможность транспортировки каждой молекулой гемоглобина четырех молекул (или восьми атомов) кислорода.
Типы гемоглобиновых цепочек в молекуле гемоглобина определяют сродство гемоглобина к кислороду. Патологические изменения цепочек могут менять физические характеристики гемоглобиновой молекулы. Например, при серповидно-клеточной анемии в одном участке каждой из двух бета-цепочек аминокислота валин заменяется глутаминовой кислотой. При низком парциальном давлении кислорода этот тип гемоглобина формирует внутри эритроцитов вытянутые кристаллы, длина которых иногда достигает 15 мкм. Они делают практически невозможным прохождение эритроцитов через многие мелкие капилляры, и острые концы кристаллов, вероятно, разрывают клеточные мембраны, способствуя развитию серповидно-клеточной анемии.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Источник
Параграф 120. Биохимия эритроцитов
Составитель текстов – Анисимова Е.С. Авторские права защищены (продавать текст нельзя). Курсив не зубрить.
ПАРАГРАФ 120. См. сначала 6, 22, 26, 27, 32, 59.
3. Биохимия эритроцитов.
6. Классификация гемопротеинов.
5. Гемоглобин и миоглобин, роль глобина. Гемоглобинопатии. Понятие о синтезе гемоглобина.
4. Роль витаминов и железа. Обмен железа.
1. Транспорт эритроцитами О2 и СО2.
2. Значение антиоксидантной системы для эритроцита.
7. Биохимические свойства нейтрофилов.
120. 1. Транспорт кислорода и углекислого газа в крови.
(Газообмен между тканями и эритроцитами и между лёгкими и эритроцитами).
Транспорт кислорода осуществляется от лёгких к тканям эритроцитами, с током крови.
СО2 транспортируется от тканей к лёгким с участием эритроцитов, но не внутри эритроцитов (см. далее).
О2 нужен клеткам в основном для синтеза АТФ, а также для выработки АФК и ряда реакций.
Поэтому нарушение доставки кислорода в ткани приводит к дефициту кислорола (кислородному голоданию, гипоксии), снижению синтеза АТФ и может закончиться смертью.
Кроме дефицита АТФ, при гипоксии возникает АЦИДОЗ из-за накопления ЛАКТАТА (п.32).
Одной из причин нарушения доставки кислорода в ткани является нарушение работы эритроцитов из-за их дефицита (из-за нарушения образования при гематопоэзе или из-за разрушения (гемолиза)) или из-за дефицита гемоглобина.
СО2 в тканях образуется из разных веществ при их распаде (катаболизме): в ЦТК (п.21), ПДГ, при распаде нуклеотидов (п.71).
В лёгких СО2 выдыхается: поступает из крови в дыхательные пути, затем выдыхается.
Кислород при вдохе поступает из окружающей среды в лёгкие, в альвеолах он поступает в кровь и связывается гемоглобином эритроцитов.
Транспорт кислорода эритроцитами осуществляется с помощью белка ГЕМОГЛОБИНА (Hb).
В лёгких гемоглобин связывается с молекулами кислорода, затем с током крови эритроциты поступают в ткани.
Газообмен между тканями и эритроцитами.
1. В тканях кислород отделяется от гемоглобина и переходит из эритроцитов в клетки.
Отделению кислорода от гемоглобина способствует вещество, которое называется 2,3-БИСФОСФО/ГЛИЦЕРАТ и образуется в особой реакции гликолиза, которая протекает в эритроцитах.
Без 2,3-бФГ поступление кислорода в ткани было бы снижено. 2,3-бФГ способствует отделению кислорода от гемоглобину за счёт связывания с молекулами гемоглобина и изменения их конформации (см. п.58). При изменении конформации гемоглобина молекулы кислорода быстрее отделяются от молекул гемоглобина. Используют выражение «снизилось сродство гемоглобина к кислороду», то есть способность гемоглобина связываться с кислородом.
2. При поступлении кислорода в клетку из клетки в эритроцит поступает молекула СО2.
3. В эритроците СО2 вступает в реакцию с молекулой воды, в результате чего образуется угольная кислота – Н2СО3. Реакция катализируется ферментом карбангидраза (карбонатдегидратаза), которому нужен цинк в качестве кофактора (п.4). Реакция обратимая, в тканях равновесии реакции смещено в сторону образования угольной кислоты.
4. Молекула угольной кислоты диссоциирует на Н+ (протон) и анион НСО3 – (бикарбонат).
5. Протон (Н+) связывается с молекулой гемоглобина, а
бикарбонат выходит из эритроцита в кровяное русло.
Способ транспорта бикарбоната через мембрану эритроцита:
выход бикарбоната из эритроцита происходит в обмен на вход в эритроцит иона хлора (Сl – ) = хлорида = хлорид-аниона. То есть в антипорте с хлоридом.
Благодаря этому антипорту заряд мембраны эритроцитов не меняется.
В итоге от тканей в лёгкие транспортируется не молекула СО2 в эритроцитах, а образованные из неё протон и бикарбонат: протон связан с гемоглобином, а бикарбонат в кровяном русле.
Реакции в эритроцитах при их нахождении в тканях:
СО2 + Н2О ; Н2СО3 (угольная кислота) ; Н+ (протон, связывается с Hb) + НСО3 – (бикарбонат,
выходит из эритроцита в антипорте с входящим в эритроцит хлоридом).
Газообмен между лёгкими и эритроцитами.
Когда кровь проходит через лёгкие, в находящихся в крови эритроцитах происходят процессы, противоположные процессам, которые проткали в тканях (см. выше).
1. Бикарбонат входит в эритроцит в обмен на выходящий хлорид (в антипорте с ним).
2. Бикарбонат соединяется (ассоциирует) с протоном, который был связан с гемоглобином,
в результате чего образуется молекула угольной кислоты.
3. Молекула угольной кислоты распадается на молекулу воды и молекулу углекислого газа, которая выходит из эритроцита, а затем выдыхается.
4. Молекулы кислорода поступают в эритроциты и связываются с гемоглобином;
гемоглобин, связанный с кислородом, называется ОКСИ/ГЕМОГЛОБИНОМ.
Реакции в эритроцитах при их нахождении в лёгких:
Н+ (отсоединяется от Hb) + НСО3 – (бикарбонат, входит в эритроцит в антипорте с выходящим из эритроцита хлоридом) ; Н2СО3 (угольная кислота) ; СО2 + Н2О
Таким образом, участие эритроцитов в транспорте газов не требует затрат АТФ.
2. Значение антиоксидантной системы для эритроцита. См. п.27.
Кратко: из молекул кислорода, транспортируемых эритроцитами, могут образовываться активные формы кислорода – АФК. АФК способны разрушать эритроциты, что может привести к кислородному голоданию тканей и смерти – п.22. Чтобы этого не произошло – эритроцитам нужны средства для обезвреживания АФК и предотвращения разрушения эритроцитов – антиокислительная система.
Окисление иона железа гемоглобина кислородом.
Молекулы кислорода в эритроцитах связаны с гемоглобином. В состав гемоглобина входит гемма, в состав которого входит ион железа Fе2+.
Молекула кислорода способна «забирать» один электрона у Fe2+ гемоглобина, превращая его в Fe3+
и превращаясь сама в молекулу кислорода с одним лишним электроном, которая обозначается как •О2 –, называет супероксидрадикалом (СОР) и относится к АФК.
Гемоглобин с Fe3+ вместо Fe2+ называется МЕТгемоглобином и обозначается как MetHb.
Реакция образования метгемоглобина:
Гемоглобин с Fe2+ + О2 ; метгемоглобин с Fe3+ + •О2 – (супероксидрадикал, АФК).
Восстановление метгемоглобина.
Проблема в том, что MetHb не способен транспортировать кислород, поэтому превращение нормального гемоглобина в метгемоглобин нарушает доставку кислорода в ткани и приводит к гипоксии, дефициту АТФ, ацидозу.
Чтобы не было этих негативных последствий образования метгемоглобина, его нужно превращать в гемоглобин. Для этого нужно присоединить электрон к Fe3+, то есть восстановить Fe3+.
Источником электрона для восстановления метгемоглобина является молекула НАДН, образующаяся при гликолизе в эритроцитах (п.32).
(Это одна из причин, по которым эритроцитам нужна глюкоза, которую добавляют в кровь при её хранении).
Фермент, катализирующий присоединение электрона к метгемоглобину за счёт переноса электрона от НАДН, называется МЕТГЕМОГЛОБИН/РЕДУКТАЗОЙ.
Реакция восстановления метгемоглобина:
Метгемоглобин с Fe3+ + НАДН из гликолиза ; гемоглобин с Fe2+ + НАД+.
Из-за того, что ион железа гемоглобина должен всегда быть в состоянии Fe2+,
говорят, что у иона железа гемоглобина постоянная валентность.
А у ионов железа цитохромов валентность переменная – это означает, что их ион железа в процессе функционирования превращается из Fe2+ в Fe3+ и обратно.
Из-за того, что восстановление метгемоглобина происходит внутри эритроцитах, гемоглобин не может транспортировать кислород вне эритроцитов, если попадает в кровяное русло при разрушении эритроцитов при гемолизе.
Перекисное окисление липидов мембран эритроцитов.
Другая проблема образования метгемоглобина в том, что при этом образуется активная форма кислорода – СОР.
АФК вступают в реакции с липидами мембран эритроцитов (с остатками жирных кислот):
АФК «забирают» электроны у липидов
превращая липиды мембран в окисленные липиды мембран (липиды с группами –О-О-Н, которые относятся к органическим перекисям наряду с другими органическими веществами, в которых образовались перекисные группы)
– эти реакции называются ПЕРЕКИСНЫМ ОКИСЛЕНИЕМ ЛИПИДОВ (ПОЛ)
и бывают не только в эритроцитах, но и в других клетках.
ПОЛ эритроцитов приводит к разрушению мембран и эритроцитов в целом, то есть к ГЕМОЛИЗУ.
Гемолиз приводит к таким последствиям, как гипоксия (а она – к дефициту АТФ и ацидозу) и отравление билирубином (см. 118), а затем к смерти.
Восстановление окисленных молекул липидов мембран эритроцитов.
Чтобы гемолиз не произошёл, липиды мембран, окисленные активными формами кислорода, нужно восстанавливать за счёт присоединения к ним электронов.
При восстановлении окисленных липидов перекисные группы (-О-О-Н) липидов превращаются в СПИРТОВЫЕ (-ОН).
Для восстановления липидов нужны источники электронов и катализаторы переноса электронов (ферменты, антиокислительные).
Источником электронов для восстановления липидов является ГЛУТАТИОН (п.27 и 56):
2 молекулы глутатиона отдают по одному атому водорода (и по одному электрону в их составе) для восстановления липидов мембран;
при этом атом серы одной молекулы глутатиона соединяется с атомом серы другой молекулы глутатиона, в результате чего образуется молекула, которую называют окисленной формой глутатиона, которая обозначается так: GS-SG. Молекула глутатиона до отдачи атома водорода обозначается GSH и называется восстановленной формой глутатиона.
Фермент, который катализирует восстановление органических перекисей
за счёт превращения перекисных групп органических перекисей в спиртовые группы, называется ГЛУТАТИОН/ПЕРОКСИДАЗОЙ (ГПО). Приставка «глутатион» связана с тем, что именно глутатитон является источником электронов для восстановления.
Реакция ГПО:
R-O-O-H + GSH + HSG; R-O-H + Н-ОН + GS-SG.
Количество молекул глутатиона в эритроците ограничено. Поэтому окисленный глутатион нужно постоянно превращать в восстановленный: GSSG в (2)GSH. Для восстановления глутатиона нужно расщепить связь между атомами серы окисленной формы глутатиона и присоединить к обоим атомам серы по одному атому водорода.
Источником 2 атомов водорода для восстановления глутатиона является НАДФН, Н+, как и во многих других процессах – см. п.35.
Фермент, который катализирует присоединение водорода к глутатиону (его окисленной форме), называется ГЛУТАТИОН/РЕДУКТАЗОЙ (ГР).
Реакция глутатионредуктазы:
GS-SG + НАДФН, Н+ ; GSH + HSG + НАДФ+.
Количество молекул НАДФН, Н+ в эритроците ограничено. Поэтому НАДФ+ нужно постоянно превращать в НАДФН, Н+:
это превращение происходит в реакциях пентозофосфатного пути, для которого нужен витамин В1.
Вариант ПФП, который протекает в эритроцитах, называется пентозным циклом.
Исходным субстратом ПФП является молекула глюкозы. Это ещё одна причина, по которой эритроциты должны получать глюкозу.
Из-за того, что продукт ПФП (НАДФН) участвует в предотвращении гемолиза –
нарушение ПФП может стать причиной гемолиза.
Причиной нарушения ПФП может стать сниженная активность ферментов ПФП из-за мутации генов.
Встречаются люди со сниженной активностью ферментов ПФП, которые страдают из-за гемолиза.
Гемолиз приводит к анемии. Такие анемии, причиной которой является гемолиз, называются гемолитическими.
Кроме недостаточной активности ферментов ПФП, причиной гемолиза может быть резус –конфликт у новорожденного, поступление в организм гемолитических ядов, серповидно-клеточная анемия и т.д..
3. Биохимия эритроцитов.
У эритроцитах специфический обмен веществ. В них нет органелл. Есть внешняя мембрана, гемоглобин и ряд ферментов, о некоторых из которых уже шла речь.
Из-за отсутствия ядра в эритроцитах нет репликации и транскрипции,
из-за отсутствия митохондрий в эритроцитах нет ;-окисления жирных кислот, ЦТК, ДЦ, синтеза АТФ способом окислительного фосфорилирования.
Нет синтеза и распада гликогена и многих других процессов.
Из процессов обмена веществ в эритроцитах есть уже упоминавшиеся гликолиз и ПФП (вариант «пентозный цикл»), для которых нужна глюкоза.
ПФП нужен эритроцитам для выработки НАДФН для антиокислительной системы.
Гликолиз нужен эритроцитам для получения НАДН для восстановления метгемоглобина,
для получения 2,3-бисфосфо/глицерата для поступления кислорода в ткани (выше),
для получения АТФ:
2 молекул АТФ способом субстратного фосфорилирования (п.23 и 32) в расчёте на одну молекулу глюкозы.
Окончательным метаболитом гликолиза в эритроцитах является ЛАКТАТ, поскольку в них нет митохондрий, в которых лактат мог бы окисляться.
Такой вариант гликолиза (завершающийся образованием лактата) называется анаэробным гликолизом.
В эритроцитах гликолиз является единственным источником АТФ.
АТФ в эритроцитах используется в качестве источника энергии для работы натрий-клиевой-АТФ-азы.
Эритроциты образуются из клеток красного костного мозга, как и все клетки крови,
в ходе гематопоэза (кроветворения): процесса, при котором клетки красного мозга превращаются в определённые клетки крови. То есть в ходе дифференцировки.
Превращение клеток красного мозга в клетки-предшественники эритроцитов происходит под влиянием определённых гормонов, в том числе под влиянием ЭРИТРОПОЭТИНА – гормона, который вырабатывается ПОЧКАМИ;
при тяжёлой почечной недостаточности эритропоэтина вырабатывается недостаточно, что может привести к дефициту эритроцитов и развитии АНЕМИИ – такая анемия (причиной которой является дефицит эритропоэтина) лечится только эритропоэтином;
эритропоэтин получают генно-инженерным способом, как и инсулин.
Предшественники эритроцитов являются клетками, в которых есть все органеллы: митохондрии, ядро и т.д.
Предшественники эритроцитов, которые образуются из клеток красного костного мозга,
называются ЭРИТРОБЛАСТАМИ (бластами часто называются молодые клетки – например, остеобласты).
В эритробластах есть ещё все органеллы, в том числе ядро.
Наличие в эритробластах ядра даёт им возможность синтезировать РНК. В основном синтезируются РНК, нужные для синтеза гемоглобина, а также других белков эритроцитов.
Затем происходит разрушение ядра, в результате чего эритробласты превращаются в ретикулоциты, поскольку в них пока ещё есть ретикулум (ЭПР) и все остальные органеллы, кроме ядра. Наличие в ретикулоцитах ранее синтезированных РНК позволяет им активно синтезировать гемоглобин.
Затем происходит разрушение всех органелл ретикулоцита, в результате чего ретикулоцит превращается в зрелый эритроцит.
4. Роль витаминов и железа (в синтезе гемоглобина и предотвращении анемии). Обмен железа.
Железо человеку нужно для образования в организме гема для гемопротеинов.
Кроме железа, в состав гема входит органическая часть – порфириновое кольцо.
Кроме гема, железо нужно для железо-серных центров дыхательной цепи.
Недостаточное поступление железа в организм может привести к дефициту гемоглобина.
Форма анемии, причиной которой является дефицит железа, называется железо-дефицитной. Есть другие формы анемий, у которых другие причины.
Избыточное содержание железа в организме тоже вредно.
1. Поступление железа в организм с пищей.
Изначально железо поступает в организм с пищей (гранаты, яблоки, икра, мясо и т.д.).
Поэтому неполноценное питание, при котором в рационе мало продуктов, содержащих железо, приводит к анемии. Такая анемия, причиной которой является дефицит в пище железа, называется железо-дефицитной анемией. Она лечится введением в рацион продуктов, содержащих железо.
В сутки в организм с пищей должно поступать 10-15 мг железа.
В мясе железо содержится в составе гема миоглобина и поэтому называется гемовым;
железо мяса двухвалентное, то есть ион железа в состоянии Fe2+.
В большинстве других продуктов железо трёхвалентное (то есть с ионом Fe3+).
2. Всасывание железа в кишечнике.
В кишечнике может усваиваться только двухвалентное железо, поэтому нужно превращать Fe3+ в Fe2+.
Для превращения Fe3+ в Fe2+ нужно присоединить электрон к Fe3+, то есть восстановить Fe3+.
Источником электронов для восстановления трёхвалентного железа в кишечнике является АСКОРБАТ (витамин С).
Поэтому дефицит витамина С в пище приводит к анемии, которая не вылечивается только лишь железом.
В аптеке есть препараты, в которых сочетаются железо и витамин С.
Железо-дефицитная анемия и анемия, обусловленная дефицитом витамина С, похожи тем, что они обе обусловлены дефицитом в пище нужных организму веществ, то есть нарушением питания, то есть это алиментарные анемии.
Из 10-15 грамм железа, которые должны поступать в сутки в организм, всасывается только 1 грамм. Столько же железа организм теряет в сутки (в основном с калом).
3. Транспорт и хранение железа в организме.
Из кишечника железо поступает в кровь, в которой транспортируется в комплексе с белком-транспортёром железа, который называется ТРАНСФЕРРИНОМ.
Трансферрин транспортирует железо в органы, которые выполняют функцию хранилищ (депо) железа: печень и красный костный мозг.
В клетках органов-хранилищ железо хранится в виде комплексов с белком ФЕРРИТИНОМ.
Из органов-депо железа железо по мере необходимости транспортируется кровотоком (в комплексе с трансферрином) во все клетки, которым нужно железо
(в основном для включения железа в состав ферментов, в работе которых участвует железо в качестве кофактора).
4. Использование железа в организме.
В самой печени железо используется для работы ряда белков: цитохромов дыхательной цепи и цитохрома Р 450, оксидаз и оксигеназ и т.д.
В красном костном мозге железо используется для образования гемоглобина при образовании эритроцитов при кроветворении.
При разрушении эритроцитов в крови их гемоглобин поступает в кровяное русло и связывается с белком ГАПТОГЛОБИНОМ (см. п. 39 и 90), который относится к белкам острой фазы.
Большая часть железа при распаде эритроцитов и гемоглобина используется организмом вновь (это называется ре-утилизацией).
Но 1 мг железа в сутки теряется организмом.
Для восполнения потери этого одного миллиграмма нужно 1 мг железа усвоить.
Чтобы организм усвоил 1 мг железа – в пище должно быть 10-15 мг железа.
5. Гемоглобин и миоглобин, роль глобина. Гемоглобинопатии. Понятие о синтезе гемоглобина.
Гемоглобин – белок, который находится в эритроцитах, синтезируется в клетках-предшественниках эритроцитов. Выполняет функцию транспорта кислорода от лёгких в ткани, а также обеспечивает транспорт углекислого газа от тканей в лёгкие (п. 121.1).
Состоит из четырёх глобул-субъединиц (то есть является тетрамером), которые активируют друг друга, в чём проявляется положительная кооперативность. За счёт взаимность активации субъединиц активность гемоглобина в 400 раз выше, чем активность одной субъединицы и чем активность белка миоглобина, который похож на субъединицу гемоглобина, находится в мышцах и выполняет в них функцию запасания кислорода.
Глобин – это название белкой части гемоглобина и миоглобина, то есть полипептидной цепи.
Есть ;-глобиновые цепи и ;-глобиновые цепи, они кодируются разными генами.
Мутации в генах, которые кодируют глобин, приводят к нарушениям в синтезе гемоглобина, которые называются талассемиями и относятся к гемоглобино/патиям.
Синтез гемоглобина.
Синтез гемоглобина происходит в клетках-предшественниках эритроцитов при кроветворении.
Нарушения синтеза гемоглобина называются гемоглобинопатиями и приводят к дефициту гемоглобина и развития анемий.
Слово гемоглобин состоит из двух частей – гем и глобин.
Гемоглобин состоит из двух компонентов: белковой части (глобиновых цепей) и небелковой части (кофактора),
которая называется гемом и состоит из порфиринового кольца (порфирина) и иона железа.
Глобиновые цепи образуют глобулы, в состав одной молекулы гемоглобина входит 4 глобиновых глобулы, которые образуют 4 суъединицы.
Ион железа должен поступить с пищей, усвоиться с помощью витамина С и транспортироваться трансферрином в красный костный мозг.
Порфирин должен синтезироваться в эритроцитах из аминокислоты глицина и метаболита ЦТК сукцинилКоА, в состав которого входит витамин пантотенат.
Глобиновые цепи синтезируются так же, как все полипептидные цепи – в ходе трансляции на рибосомах (п.82).
Причины нарушений образования гемоглобина и их коррекция.
Снабжение железом может нарушиться из-за дефицита железа в организме, из-за дефицита витамина С, из-за повреждения кишечника, из-за дефектов трансферрина.
Дефицит железа и витамина С в пище исправляется употреблением продуктов, которые содержат железо и витамин С; кишечник лечится.
Синтез порфирина может нарушиться из-за дефицитов витаминов ЦТК (в том числе пантотената) и из-за мутаций в генах, кодирующих ферменты синтеза порфирина.
Дефицит витаминов исправляется употреблением продуктов, содержащих витамины ЦТК.
Мутации в генах, кодирующих ферменты синтеза порфирина, приводят к ПОРФИРИЯМ.
Синтез глобиновых цепей может нарушиться (как и синтез любых белков) из-за дефицита в пище веществ, нужных для синтеза белка, а также из-за мутаций в генах, кодирующих глобиновые цепи.
Для синтеза глобиновых цепей нужны 20 аминокислот и РНК. Для синтеза РНК нужны нуклеотиды, для синтеза которых нужен ряд витаминов (п.72): РР, В2, В6, фолат и т.д.
Дефицит 20 аминокислот исправляется употреблением продуктов, содержащих 20 аминокислот в составе полноценных белков: мяса, рыбы, молочных, яиц.
Дефицит витаминов исправляется употребление продуктов, содержащих названные витамины.
Мутации в генах, кодирующих глобиновые цепи, приводят к талассемиям.
Серповидно-клеточная анемия развивается из-за мутации в гене, который кодирует глобиновую цепь.
При этом синтезируется неправильная глобиновая цепь, что приводит к разрушению эритроцитов.
Гемоглобинопатии – это нарушения, связанные с нарушением работы, структуры и синтеза гемоглобина.
К ним относятся талассемии, порфирии.
6. Классификация гемопротеинов.
Гемопротеины – это соединения гема и протеина (ППЦ).
То есть сложные белки (п.4), в состав которых входит гем в качестве небелкового компонета (кофактора), а также белковая часть (апопротеин).
Примеры гемопротеинов в организме:
гемоглобин, миоглобин (п.59),
цитохромы дыхательной цепи (п.22), цитохром Р 450 (п.119),
все оксигеназы и оксидазы и т.д.
Ион железа некоторых гемопротеинов должен менять валентность (например, у цитохромов),
а у некоторых гемопротеинов ион железа должен оставаться всегда Fe2+ (у гемоглобина, миоглобина). –
Гемопротеины с переменной валентностью и с постоянной валентностью.
Источник