Витамин-B12-дефицитная анемия
Распространённый на севере Европы вид анемии, возникающей из-за нехватки витамина, который есть только в продуктах животного происхождения. Чаще других подвержены веганы.
Что такое В12-дефицитная анемия. Ее причины и факторы риска развития заболевания
Анемией или малокровием называют недостаток красных кровяных телец (эритроцитов) или гемоглобина — белка, из которого эритроциты в основном состоят. Гемоглобин переносит кислород к клеткам и выводит углекислый газ. В12-дефицитная анемия — это разновидность малокровия, вызванная недостатком витамина В12, который принимает участие в формировании новых эритроцитов.
Это заболевание особенно распространено среди жителей Северной Европы. Его основные причины следующие:
- недостаток внутреннего фактора Касла — белка, образующегося в желудке. Только после соединения с ним В12 может всасываться в кровь. Эту разновидность малокровия называют злокачественной анемией. Сегодня зловещее название ничем себя не оправдывает. Оно осталось с тех времен, когда причины патологии были неизвестны. Методы лечения загадочной болезни отсутствовали, и она часто приводила к летальному исходу. Сегодня злокачественная анемия лечится просто и эффективно;
- операция по удалению подвздошной кишки (витамин В12 всасывается в этом отделе кишечника) или удаление части желудка (места синтеза фактора Касла);
- дефицит витамина В12 в рационе. Это вещество содержится только в пище животного происхождения: мясе, молоке, рыбе, моллюсках. Ожидаемо чаще всего от нее страдают веганы. Организм человека способен создавать запасы витамина В12 на 2-4 года. Поэтому может пройти немало времени от момента изменения пищевых привычек до появления первых симптомов;
- некоторые заболевания кишечника (к примеру, болезнь Крона), которые нарушают всасывание питательных веществ;
- прием препаратов, снижающих кислотность желудка (обычно блокаторов протонной помпы);
- функциональная недостаточность витамина В12: его концентрация в крови нормальна, но механизм поступления витамина внутрь клетки нарушен;
- повышенная потребность организма в этом витамине (например, беременность или глисты).
Классификация B12-дефицитной анемии
В зависимости от причин заболевания для В12-дефицитной анемии предусмотрены следующие коды МКБ-10 (международной классификации болезней 10-го пересмотра):
D51.0 – недостаточность фактора Касла;
D51.1 – нарушение всасывания в сочетании с выделением белка с мочой (протеинурия);
D51.2 – недостаточность транскобаламина II;
D51.3 – В12-дефицитные анемии, ассоциированные с пищей;
D51.8 – другие виды недостаточности В12 с анемией;
D51.9 – неуточненная форма В12-дефицитной анемии.
Симптомы и признаки В12-дефицитной анемии
Недостаточное снабжение клеток кислородом проявляется быстрой утомляемостью, слабостью, головокружениями и обмороками, звоном в ушах, бледностью кожи и слизистых. Могут возникать одышка и сердцебиение. Ухудшается аппетит и снижается вес. Всё это — общие симптомы, свойственные любой анемии. В12-дефицитное малокровие может дополнительно проявляться:
- легким желтушным оттенком кожи;
- воспалением языка (глосситом);
- язвами во рту;
- парастезиями – расстройством чувствительности, при котором наблюдается онемение конечностей, чувство покалывания;
- раздражительностью;
- депрессией;
- снижением эффективности мыслительного процесса;
- нарушениями памяти.
Некоторые из этих симптомов могут наблюдаться при дефиците витамина В12, не сопровождающемся анемией.
Диагностика В12-дефицитной анемии
Симптомы В12-дефицитной анемии не специфичны. Для постановки диагноза понадобятся результаты общего анализа крови (оценка снижения количества эритроцитов) и исследование содержания В12 в крови (установление типа малокровия). Анализ на витамин В12 не дает информации о доле его биологически активных форм. Если их мало, то и при нормальном содержании витамина В12 клетки всё равно испытывают дефицит. Существуют тесты, помогающие определить только количество активных форм, но они не получили широкого распространения.
Важно установить причины недостаточности витамина В12. Выбор исследований в этом случае будет зависеть от предполагаемых проблем.
Лечение В12-дефицитной анемии
Лечение В12-дефицитной анемии заключается во внутримышечном введении одной из форм витамина — кобаламина или гидроксикобаламина. Вторая форма предпочтительней, поскольку она дольше сохраняется в организме. Инъекции делают ежедневно в течение двух недель или до момента исчезновения симптомов. Дальнейший курс лечения будет зависеть от причины заболевания. Если дефицит витамина связан с его недостатком в пище, рекомендуется включить в рацион продукты животного происхождения. Когда изменить питание невозможно, то прием витамина В12 должен быть пожизненным. Альтернативным источником витамина могут быть обогащенные им злаки, соевые продукты или дрожжевые пасты.
При злокачественной анемии обогащение диеты витамином В12 не поможет. Ведь проблема состоит в невозможности эффективного всасывания. Таким пациентам назначают инъекции раз в несколько месяцев на протяжение всей жизни.
Осложнения В12-дефицитной анемии
Возникают в запущенных случаях, когда лечение началось поздно.
- тахикардия;
- сердечная недостаточность;
- проблемы со зрением;
- потеря памяти;
- нарушение координации (атаксия); трудности возникают как с передвижением, так и с речью;
- нарушение проводимости нервных импульсов в конечностях, преимущественно в ногах (периферическая нейропатия);
- бесплодие;
- рак желудка (при злокачественной анемии): недостаточное количество внутреннего фактора Касла связано с аутоиммунными процессами, повышающими риск развития рака;
- дефекты нервной трубки плода, если во время беременности мать получала неадекватное количество усвояемых форм витамина.
Профилактика
Зависит от причины заболевания. При недостатке витамина в рационе достаточно включать в него продукты животного происхождения. Веганам рекомендуется обсудить с диетологом альтернативные источники витамина.
Злокачественная анемия профилактике не поддается. Но своевременная диагностика и лечение помогают уверенно контролировать симптомы и не допускать осложнений.
Прогноз при В12-дефицитной анемии
При своевременном выявлении заболевания и адекватном лечении прогноз очень хороший. Если дефицит витамина В12 не связан с его недостатком в рационе, может потребоваться пожизненный прием препаратов, но качество жизни не пострадает. Когда лечение начинают слишком поздно, на этапе выраженных неврологических проблем, устранить их невозможно. К счастью, такое случается крайне редко.
Источник
Анемия, вызванная дефицитом витамина B 12 — Vitamin B12 deficiency anemia
| Анемия, вызванная дефицитом витамина B 12 | |
|---|---|
| Другие имена | Пагубная анемия, анемия Бирмера, анемия Аддисона, анемия Аддисона – Бирмера |
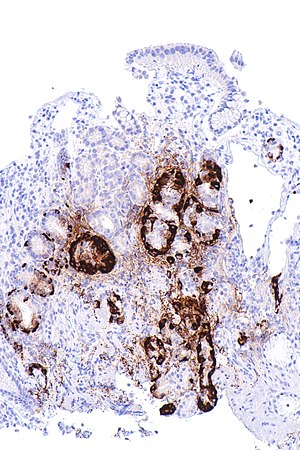 | |
| Микрофотография, показывающая узловую гиперплазию энтерохромаффиноподобных клеток, продемонстрированную иммуноокрашиванием хромогранином А , в теле желудка . Париетальные клетки не сразу видны. Эти изменения соответствуют аутоиммунному метапластическому атрофическому гастриту, гистологическому корреляту анемии, вызванной дефицитом витамина B 12 . | |
| Специальность | Гематология |
| Симптомы | Чувство усталости, одышка , бледность кожи, онемение рук и ног, плохие рефлексы , спутанность сознания |
| Обычное начало | > 60 лет |
| Причины | Недостаточно витамина B 12 |
| Диагностический метод | Анализы крови , тесты костного мозга |
| Уход | Витамин B 12 таблеток или инъекций |
| Прогноз | При лечении нормальная жизнь |
| Частота | 1 на 1000 человек |
Витамин B 12 дефицитной анемии , из которых злокачественная анемия ( ПА ) представляет собой тип, это болезнь , в которой не хватает красных кровяных клеток образуются из — за дефицита витамина B 12 . Самый частый начальный симптом — чувство усталости. Другие симптомы могут включать одышку , бледность кожи, боль в груди, онемение рук и ног, нарушение равновесия, гладкий красный язык, плохие рефлексы , депрессию и спутанность сознания. Без лечения некоторые из этих проблем могут стать постоянными.
Пагубная анемия относится к анемии, которая возникает из-за отсутствия внутреннего фактора . Отсутствие внутреннего фактора чаще всего происходит из-за аутоиммунной атаки на клетки, которые его создают в желудке . Это также может произойти после хирургического удаления части желудка или в результате наследственного заболевания. Другие причины низкого уровня витамина B 12 включают недостаточное потребление пищи (что может быть опасным при веганской диете ), целиакию или инфекцию ленточного червя . При подозрении на него диагноз ставится на основе анализа крови и, иногда, анализа костного мозга. Анализы крови могут показать меньшее количество эритроцитов большего размера , меньшее количество молодых эритроцитов , низкий уровень витамина B 12 и антител к внутреннему фактору.
Поскольку пагубная анемия возникает из-за отсутствия внутреннего фактора, ее нельзя предотвратить. Дефицит витамина B 12 по другим причинам можно предотвратить с помощью сбалансированной диеты или добавок. Пагубную анемию можно лечить инъекциями витамина B 12 . Если симптомы серьезны, обычно сначала рекомендуются инъекции. Для тех, у кого есть проблемы с глотанием таблеток, доступен назальный спрей. Часто лечение длится всю жизнь.
Пагубная анемия из-за аутоиммунных проблем встречается примерно у одного человека на 1000 человек. Среди лиц старше 60 лет около 2% страдают этим заболеванием. Чаще страдают люди североевропейского происхождения. Женщины страдают чаще, чем мужчины. При правильном лечении большинство людей живут нормальной жизнью. Из-за более высокого риска рака желудка людям с пагубной анемией следует регулярно проверяться на это. Первое четкое описание было дано Томасом Аддисоном в 1849 году. Термин «пагубный» означает «смертельный», и этот термин вошел в употребление, потому что до доступности лечения болезнь часто была фатальной.
Содержание
Признаки и симптомы
Симптомы злокачественной анемии появляются медленно. Без лечения это может привести к неврологическим осложнениям, а в серьезных случаях — к смерти. Многие признаки и симптомы связаны с самой анемией, когда анемия присутствует. Симптомы могут состоять из триады: покалывания или других кожных ощущений ( парестезия ), болезненности языка ( глоссит ), утомляемости и общей слабости. Он проявляется рядом других общих симптомов, включая депрессивное настроение , субфебрильную лихорадку , диарею , диспепсию , потерю веса, невропатическую боль , желтуху , язвы в углу рта ( угловой хейлит ), вид истощения с бледностью и бледностью. обезвоженные или потрескавшиеся губы и темные круги под глазами, а также ломкие ногти, истончение и раннее поседение волос. Поскольку ПА может влиять на нервную систему, симптомы могут также включать трудности с проприоцепцией , изменения памяти, легкие когнитивные нарушения (в том числе трудности с концентрацией внимания и вялые реакции, в просторечии называемые мозговым туманом ) и даже психоз, нарушение мочеиспускания, потерю чувствительности стопы, шаткая походка, затруднения при ходьбе, мышечная слабость и неуклюжесть. Анемия может также привести к тахикардии (учащенному сердцебиению), сердечным шумам, желтой восковой бледности , изменению артериального давления ( низкому или высокому ) и одышке (известной как «вздохи»). Дефицит также может проявляться при заболеваниях щитовидной железы. В тяжелых случаях анемия может вызвать застойную сердечную недостаточность. Осложнением тяжелой хронической ПА является подострая комбинированная дегенерация спинного мозга , которая приводит к потере чувствительности в дистальном отделе (задний столбец), отсутствию рефлекса голеностопного сустава, усилению рефлекторного ответа коленного сустава и подошвенного разгибателя. Помимо анемии, гематологические симптомы могут включать цитопению , интрамедуллярный гемолиз и псевдотромботическую микроангиопатию. Пагубная анемия может способствовать задержке физического роста у детей, а также может быть причиной задержки полового созревания у подростков.
Причины
Витамин B 12 не может вырабатываться человеческим организмом и должен поступать с пищей. Когда едят продукты, содержащие B 12 , витамин обычно связывается с белком и высвобождается протеазами, выделяемыми поджелудочной железой в тонкой кишке. После высвобождения большая часть B 12 абсорбируется организмом в тонкой кишке ( подвздошной кишке ) после связывания с белком, известным как внутренний фактор . Внутренний фактор производятся париетальными клетками в желудке слизистой оболочки (слизистая желудка) и внутреннего фактор-B 12 комплекса поглощается cubilin рецепторы на подвздошных эпителиальные клетки . PA характеризуется дефицитом B 12 , вызванным отсутствием внутреннего фактора.
ПА можно рассматривать как конечную стадию иммунного гастрита , заболевания, характеризующегося атрофией желудка и наличием антител к париетальным клеткам и внутреннему фактору. Специфическая форма хронического гастрита, гастрит типа А или атрофический гастрит тела, тесно связана с ПА. Это аутоиммунное заболевание локализовано в теле желудка, где расположены париетальные клетки. Антитела к внутреннему фактору и париетальным клеткам вызывают разрушение оксинтной слизистой оболочки желудка, в которой расположены париетальные клетки, что приводит к последующей потере синтеза внутреннего фактора. Без внутреннего фактора подвздошная кишка больше не может поглощать B 12 .
Хотя точная роль хеликобактерной инфекции в ПЕ остается спорной, данные свидетельствуют о H.pylori , участвуют в патогенезе заболевания. Давняя инфекция H. pylori может вызвать аутоиммунитет желудка с помощью механизма, известного как молекулярная мимикрия . Антитела, продуцируемые иммунной системой, могут быть перекрестно реактивными и могут связываться как с антигенами H. pylori, так и с антигенами, обнаруженными в слизистой оболочке желудка . Антитела вырабатываются активированными В-клетками, которые распознают как патоген, так и пептиды собственного происхождения. В аутоантигены полагают, причиной аутореактивность являются альфа и бета субъединицы H + / K + -АТФазы. В исследовании дефицит B12, вызванный Helicobacter pylori, положительно коррелировал с положительностью CagA и воспалительной активностью желудка, а не с атрофией желудка.
Реже H. pylori и синдром Золлингера-Эллисона могут также вызывать форму неаутоиммунного гастрита, которая может привести к злокачественной анемии.
Нарушение всасывания B 12 может также произойти после удаления желудка ( гастрэктомия ) или операции обходного желудочного анастомоза. Во время этих операций либо удаляются части желудка, которые производят желудочный секрет, либо их обходят. Это означает, что внутренний фактор, а также другие факторы, необходимые для абсорбции B 12 , недоступны. Однако дефицит B 12 после операции на желудке обычно не становится клинической проблемой. Это, вероятно , потому , что стоит тело хранит многолетнему B 12 в печени и хирургии желудка пациентов адекватно дополнена с витамином.
Хотя никаких специфических генов восприимчивости к PA не было идентифицировано, генетический фактор, вероятно, вовлечен в заболевание. Пагубная анемия часто встречается в сочетании с другими аутоиммунными заболеваниями, что позволяет предположить, что общие гены аутоиммунной предрасположенности могут быть причинным фактором. Несмотря на это, предыдущие семейные исследования и отчеты о случаях, посвященных ПА, предполагают, что существует тенденция генетического наследования, в частности, ПА, и у близких родственников пациентов с ПА, по-видимому, выше частота ПА и связанных с ней состояний. Более того, дополнительно было указано, что образование антител к клеткам желудка было определено аутосомно-доминантным геном, и наличие антител к клеткам желудка не обязательно могло быть связано с возникновением атрофического гастрита, связанного с ПА.
Патофизиология
Хотя здоровый организм сохраняет в печени от трех до пяти лет B 12 , обычно не обнаруживаемая аутоиммунная активность в кишечнике в течение длительного периода времени приводит к истощению B 12 и, как следствие, анемии. B 12 требуется ферментам для двух реакций: превращения метилмалонил-КоА в сукцинил-КоА и превращения гомоцистеина в метионин . В последней реакции, то метильная группа из 5-метилтетрагидрофолата передается гомоцистеин для получения тетрагидрофолата и метионина. Эта реакция катализируется ферментом метионинсинтазой с B 12 в качестве важного кофактора. При дефиците B 12 эта реакция не может протекать, что приводит к накоплению 5-метилтетрагидрофолата. Это накопление истощает другие типы фолиевой кислоты, необходимые для синтеза пурина и тимидилата , которые необходимы для синтеза ДНК. Подавление репликации ДНК в созревающих эритроцитах приводит к образованию крупных хрупких мегалобластных эритроцитов . Считается, что неврологические аспекты заболевания возникают из-за накопления метилмалонил-КоА из-за потребности в B 12 в качестве кофактора фермента метилмалонил-КоА мутазы.
Диагностика
Заподозрить ПА можно, если в мазке крови пациента обнаруживаются большие, хрупкие, незрелые эритроциты, известные как мегалобласты . Диагноз ПА в первую очередь требует демонстрации мегалобластной анемии путем проведения общего анализа крови и мазка крови, который оценивает средний корпускулярный объем (MCV), а также среднюю концентрацию корпускулярного гемоглобина (MCHC). PA идентифицируется с высоким MCV ( макроцитарная анемия ) и нормальным MCHC ( нормохромная анемия). Овалоциты также обычно видны в мазке крови, а патогномоничным признаком мегалобластных анемий (в том числе ПА и других) являются гиперсегментированные нейтрофилы.
Уровни витамина B 12 в сыворотке крови используются для выявления его дефицита, но не определяют его причины. Уровни витамина B 12 могут быть ложно высокими или низкими, а данные о чувствительности и специфичности сильно различаются. Нормальные уровни сыворотки могут быть обнаружены в случаях дефицита, когда присутствуют миелопролиферативные нарушения , заболевания печени , дефицит транскобаламина II или избыточный бактериальный рост кишечника . Низкий уровень витамина B 12 в сыворотке может быть вызван другими факторами, помимо дефицита B 12 , такими как дефицит фолиевой кислоты , беременность , использование оральных контрацептивов , дефицит гаптокоррина и миелома .
При ПА часто встречаются антитела к париетальным клеткам желудка и внутреннему фактору. Антитела к париетальным клеткам обнаруживаются при других аутоиммунных заболеваниях, а также у 10% здоровых людей, что делает тест неспецифичным. Однако около 85% пациентов с ПА имеют антитела к париетальным клеткам, что означает, что они являются чувствительным маркером заболевания. Антитела к внутреннему фактору намного менее чувствительны, чем антитела к париетальным клеткам, но они гораздо более специфичны. Они обнаруживаются примерно у половины пациентов с ПА и очень редко встречаются при других заболеваниях. Эти тесты на антитела могут различать между ПА и пищевой B 12 мальабсорбции. Комбинация обоих тестов на антитела к внутреннему фактору и антитела к париетальным клеткам может улучшить общую чувствительность и специфичность диагностических результатов.
При дефиците B 12 происходит накопление определенных метаболитов из-за его роли в клеточной физиологии. Метилмалоновая кислота (ММА) может быть измерена как в крови, так и в моче, тогда как гомоцистеин измеряется только в крови. Увеличение как ММА, так и гомоцистеина отличает дефицит B 12 от дефицита фолиевой кислоты, потому что уровень одного гомоцистеина увеличивается в последнем.
Повышенный уровень гастрина может быть обнаружен примерно в 80-90% случаев ПА, но он также может быть обнаружен при других формах гастрита. Также могут быть обнаружены пониженные уровни пепсиногена I или пониженное соотношение пепсиноген I к пепсиногену II, хотя эти данные менее специфичны для PA и могут быть обнаружены при мальабсорбции пищи-B 12 и других формах гастрита.
Диагноз атрофического гастрита типа А необходимо подтвердить с помощью гастроскопии и пошаговой биопсии. Около 90% людей с ПА имеют антитела к париетальным клеткам; однако только 50% всех людей в общей популяции с этими антителами страдают злокачественной анемией.
При дифференциальной диагностике мегалобластной анемии необходимо учитывать другие формы дефицита витамина B 12, кроме PA . Например, состояние дефицита B 12, которое вызывает мегалобластную анемию и которое может быть ошибочно принято за классическую PA, может быть вызвано инфекцией ленточным червем Diphyllobothrium latum , возможно, из-за конкуренции паразита с хозяином за витамин B 12 .
Классический тест на PA, тест Шиллинга , больше не используется широко, поскольку доступны более эффективные методы. Этот исторический тест состоял на первом этапе из перорального приема радиоактивно меченого витамина B 12 с последующим количественным определением витамина в моче пациента в течение 24-часового периода посредством измерения радиоактивности . На втором этапе теста повторяется режим и процедура первого этапа с добавлением орального внутреннего фактора. У пациента с ПА представлен более низкий, чем обычно, уровень внутреннего фактора; следовательно, добавление внутреннего фактора на втором этапе приводит к увеличению абсорбции витамина B 12 (по сравнению с исходным уровнем, установленным на первом этапе). Тест Шиллинга отличал PA от других форм дефицита B 12 , в частности, от синдрома Имерслунда-Грасбека (IGS), дефицита витамина B12, вызванного мутациями кубилина рецептора кобаламина.
Лечение ПА зависит от страны и региона. Мнения разнятся относительно эффективности введения (парентерального / перорального), количества и временного интервала доз или форм витамина B 12 (например, цианокобаламина / гидроксокобаламина). По-прежнему необходимы более всесторонние исследования, чтобы подтвердить применимость конкретного терапевтического метода лечения ПА в клинической практике. Постоянного излечения от ПА не существует, хотя следует ожидать , что восполнение B 12 приведет к прекращению симптомов, связанных с анемией, остановке неврологического ухудшения, а в случаях, когда неврологические проблемы не продвинуты, неврологическому выздоровлению и полной и стойкой ремиссии. всех симптомов при добавлении B 12 . Восполнение B 12 может осуществляться разными способами.
Внутримышечные инъекции
Стандартным лечением ПА являются внутримышечные инъекции кобаламина в форме цианокобаламина (CN-Cbl), гидроксокобаламина (OH-Cbl) или метилкобаламина .
Пероральные дозы
Пероральная форма витамина B 12 в высоких дозах 1000 мкг (1 мг) также оказывается столь же эффективной и более дешевой, чем парентеральная форма.
Прогноз
Человек с хорошо леченным ПА может вести здоровый образ жизни. Однако несвоевременная диагностика и лечение может привести к необратимому неврологическому повреждению, чрезмерной усталости, депрессии, потере памяти и другим осложнениям. В тяжелых случаях неврологические осложнения злокачественной анемии могут привести к смерти — отсюда и название « пагубный », что означает смертельный.
Была обнаружена связь между злокачественной анемией и некоторыми видами рака желудка, но причинно-следственная связь не установлена.
Эпидемиология
По оценкам, ПА поражает 0,1% населения в целом и 1,9% людей старше 60 лет, что составляет 20–50% дефицита B 12 у взрослых. Обзор литературы показывает, что распространенность ПА выше в Северной Европе, особенно в скандинавских странах, и среди лиц африканского происхождения, и что повышение осведомленности о болезни и более совершенные диагностические инструменты могут сыграть роль в явно более высоких показателях заболеваемости.
История
Симптомы впервые описаны в 1822 году доктором Джеймсом Скартом Комбом в « Трудах Медико-хирургического общества Эдинбурга» под названием « История случая анемии» .
Однако это не было исследовано более глубоко до 1849 года британским врачом Томасом Аддисоном , от которого оно получило общее название анемии Аддисона. В 1871 году немецкий врач Майкл Антон Бирмер (1827–1892) заметил особую характеристику анемии у одного из своих пациентов; позже он ввел термин «прогрессирующая злокачественная анемия». В 1907 году Ричард Кларк Кэбот сообщил о 1200 пациентах с ПА; их средняя выживаемость составляла от одного до трех лет. Уильям Босуорт Кастл провел эксперимент, в котором он проглотил сырое мясо гамбургера и через час срыгнул его, а затем скормил группе из 10 пациентов. Необработанное сырое мясо гамбургеров скармливали контрольной группе. Первая группа показала реакцию болезни, тогда как вторая группа — нет. Это не было устойчивой практикой, но она продемонстрировала существование «внутреннего фактора» желудочного сока.
Пагубная анемия была смертельным заболеванием примерно до 1920 года, когда Джордж Уиппл предложил в качестве лечения сырую печень . Первое действенное лечение злокачественной анемии началось, когда Уиппл в ходе экспериментов сделал открытие, в котором он брал у собак кровь, чтобы вызвать у них анемию, а затем кормил их различными продуктами, чтобы посмотреть, что поможет им быстрее выздороветь (он искал способы лечения анемии. от кровотечения, а не при злокачественной анемии). Уиппл обнаружил, что употребление большого количества печени, по-видимому, излечивает анемию от кровопотери, и попробовал проглатывание печени в качестве лечения пагубной анемии, сообщив об улучшении этого состояния в статье в 1920 году. Затем Джордж Майнот и Уильям Мерфи приступили к частичной изоляции целебное свойство печени, и в 1926 году показали, что он содержится в сыром соке печени (в процессе также было показано, что именно железо в ткани печени, а не растворимый фактор в соке печени, излечивает анемию от кровотечения у собак); таким образом, открытие фактора печеночного сока для лечения злокачественной анемии было случайным. Фрида Робшейт-Роббинс тесно сотрудничала с Уипплом, соавтором 21 статьи с 1925 по 1930 год. За открытие лекарства от ранее смертельной болезни неизвестной причины Уиппл, Майнот и Мерфи разделили Нобелевскую премию по медицине 1934 года .
После того, как Майнот и Мерфи подтвердили результаты Уиппла в 1926 году, жертвы злокачественной анемии ели или пили по крайней мере полфунта сырой печени или пили сок сырой печени каждый день. Так продолжалось несколько лет, пока не стал доступен концентрат печеночного сока. В 1928 году химик Эдвин Кон приготовил экстракт печени, который был в 50-100 раз более мощным, чем натуральная пища (печень). Экстракт можно было даже вводить в мышцу, а это означало, что пациентам больше не нужно было есть большое количество печени или сока. Это также значительно снизило стоимость лечения.
Активный ингредиент печени оставался неизвестным до 1948 года, когда он был выделен двумя химиками, Карлом А. Фолкерсом из Соединенных Штатов и Александром Р. Тоддом из Великобритании. Вещество представляло собой кобаламин , который первооткрыватели назвали витамином B 12 . Новый витамин в соке печени был в конечном итоге полностью очищен и охарактеризован в 1950-х годах, и были разработаны другие методы его получения из бактерий. Его можно вводить в мышцу с еще меньшим раздражением, что позволяет лечить ПА с еще большей легкостью. В конечном итоге злокачественную анемию лечили инъекциями или большими пероральными дозами B 12 , обычно от 1 до 4 мг в день.
Один писатель выдвинул гипотезу, что Мэри Тодд Линкольн , жена американского президента Авраама Линкольна , десятилетиями страдала пагубной анемией и умерла от нее.
Исследование
Комплекс SNAC
Хотя пероральные мегадозы и внутримышечные инъекции являются наиболее распространенными методами лечения, доступными в настоящее время, в настоящее время проходят испытания несколько новых методов, с большой надеждой на их включение в основные методы лечения в будущем. Поскольку инъекции являются неблагоприятным средством доставки лекарств, текущие исследования включают улучшение пассивной диффузии через подвздошную кишку при пероральном приеме производных кобаламина. Исследователи недавно воспользовались преимуществами нового соединения N- [8- (2-гидроксибензоил) амино] каприлата натрия (SNAC), которое значительно увеличивает как биодоступность, так и метаболическую стабильность. SNAC может образовывать нековалентный комплекс с кобаламином, сохраняя при этом его химическую целостность. Этот комплекс намного более липофильный, чем водорастворимый витамин B 12 , поэтому он может легче проходить через клеточные мембраны.
Рекомбинантный внутренний фактор
Другой метод увеличения абсорбции через подвздошную кишку — проглатывание комплекса Cbl, с которым IF уже связан. Отсутствие внутреннего фактора, продуцируемого организмом пациента, может быть восполнено использованием синтетического человеческого IF, полученного из рекомбинантов растений гороха . Однако в случаях, когда IF- антитела являются причиной мальабсорбции через подвздошную кишку, это лечение было бы неэффективным.
Сублингвальная доставка
Также постулируется, что сублингвальное лечение более эффективно, чем пероральное лечение. Исследование 2003 года показало, что хотя этот метод эффективен, доза цианокобаламина в 500 мкг, вводимая перорально или сублингвально, одинаково эффективна для восстановления нормальных физиологических концентраций кобаламина.
Источник