СТИМУЛЯТОРЫ ЛЕЙКОЦИТОПОЭЗА
СТИМУЛЯТОРЫ ЛЕЙКОЦИТОПОЭЗА (лат. stimulare погонять, возбуждать; лейкоцит[ы] + греч. poiesis творение) — лекарственные средства, применяемые для лечения лейкопений, связанных с нарушениями собственно системы кроветворения или обусловленных различными соматическими и инфекционными заболеваниями.
В качестве С. л. используют препараты нек-рых витаминов — фолиевую кислоту (см.), цианокобаламин (см.), пиридоксин (см.); средства, усиливающие синтез нуклеиновых к-т,— пентоксил (см.), метилурацил (см.), натрия нуклеинат и лейкоген (см.); препараты нек-рых стероидных гормонов — глюкокортикоиды, андрогенные препараты; соли лития.
Фолиевая к-та как С. л. эффективна в основном при лейкопениях (см.), развивающихся на фоне фолиеводефицитной анемии (см.). Механизм развития этой патологии следующий. Недостаток тетрагидрофолиевой к-ты (коэнзимной формы фолиевой к-ты) в клетке приводит к торможению синтеза ДНК, обусловленному дефицитом тимидилатов. Последнее вызывает угнетение митотической активности кроветворных клеток, вследствие чего развивается фолиево-дефицитная анемия и сопутствующая лейкопения. Назначение в данном случае фолиевой к-ты нормализует картину крови. Цианокобаламин обеспечивает процесс трансаминирования и перенос водорода, нормализует синтез белков и нуклеиновых к-т. В связи с этим он эффективен при лейкопении, развивающейся на фоне B12-дефицитной (мегалобластической) анемии. Т. о., цианокобаламин и фолиевую к-ту можно рассматривать как специфические С. л., действие к-рых направлено на устранение расстройств, являющихся причинными факторами развития нек-рых видов лейкопений.
Прочие препараты относятся к числу неспецифических С. л., т. к. при лейкопениях различного генеза они действуют по патогенетическому принципу. Пиридоксин, превращаясь в пиридоксальфосфат, участвует в процессах азотистого обмена (трансаминировании, дезаминировании и декарбоксилировании аминокислот, а также в превращениях триптофана, серосодержащих аминокислот и оксиаминокислот). В связи с этим он норхмализует лейкоцитопоэз при лейкопениях, обусловленных разными причинами. Пентоксил и метил урацил ускоряют рост и размножение клеток костного мозга, но не влияют на процесс их созревания. Натрия нуклеинат и лейкоген стимулируют созревание клеток костного мозга. Указанные С. л. обладают минимальной способностью усиливать лейкоцитопоэз. Их используют только при легких (транзиторных) формах лейкопений, к-рые обычно проходят самопроизвольно. При выраженной гипоплазии кроветворной ткани и лейкопениях иммунного генеза эти препараты неэффективны.
Стимулирующее влияние преднизолона, дексаметазона и других глюкокортикоидов на лейкоцитопоэз связано с ускорением созревания и выхода нейтрофилов из костного мозга в кровь. Стабилизирующее влияние глюкокортикоидов на мембраны клеток обусловливает уменьшение внутрикостномозговой деструкции гранулоцитов (так наз. неэффективного гранулоцитопоэза). Глюкокортикоиды вызывают также перераспределение циркулирующих нейтрофилов, связанное с перемещением последних из пула маргинальных в пул циркулирующих нейтрофилов. Препараты этой группы высокоэффективны при иммунных лейкопениях. Однако они обладают выраженным побочным действием, заключающимся в нарушении электролитного баланса, отеках, повышении АД, развитии гипокалиемии, гипергликемии, изъязвлении слизистой оболочки жел.-киш. тракта, остеопорозе, психических расстройствах, нарушении менструального цикла у женщин и др. Стимулирующее влияние андрогенных препаратов (тестостерона, тестэната и др.) на лейкоцитопоэз, возможно, связано с их анаболическим эффектом. Кроме того, они ускоряют пролиферацию и дифференцировку полипотентных стволовых клеток, увеличивают количество грануломоноцитарных предшественников. Отмечено прямое стимулирующее влияние андрогенных препаратов на клетки—предшественники гранулоцитопоэза. Кроме того, при действии этих препаратов грануломоноцитопоэз, по-видимому, усиливается также за счет увеличения синтеза колониестимулирующего фактора моноцитами. Латентный период в действии андрогенных препаратов на лейкоцитопоэз составляет несколько недель. В связи с этим в качестве С. л. их применяют при хрон. формах лейкопений.
Для стимуляции лейкоцитопоэза используют также соли лития, в частности, лития карбонат. Литий увеличивает продукцию нейтрофилов, устраняет нарушения их миграции и не подавляет их миграционную способность у соматически здоровых лиц. Соли лития высокоэффективны при лейкопениях, вызванных цитостатиками, наследственной нейтропении, синдроме Фелти, а также при лейкопении, развивающейся на фоне апластической анемии. У больных с выраженными явлениями лейкопении литий увеличивает общее число нейтрофилов, количество циркулирующих и маргинальных нейтрофилов, удлиняет время полураспада нейтрофилов и их оборот. Механизм стимулирующего действия препаратов лития на лейкоцитопоэз окончательно не выяснен. Показано, что in vitro литий увеличивает число и стимулирует рост гранулоцитарных колоний колониеобразующих клеток. Кроме того, иод влиянием лития возрастает продукция моноцитов-макрофагов, к-рые являются основным источником колониестимулирующего фактора. Действие лития на колониеобразующие клетки in vitro не обнаруживают в тех случаях, когда колониестимулирующий фактор полностью отсутствует или содержится в оптимальном количестве. Перечисленные эффекты лития связывают с его угнетающим влиянием на аде-нилатциклазу, вследствие чего уменьшается внутриклеточное содержание циклического АМФ. Литий усиливает пролиферацию лимфоцитов в ответ на стимуляцию фитогемагглютинином, увеличивает число розеткообразующих клеток и секрецию IgM В-лимфоцитами в реакции бляшкообразования. Считают, что литий подавляет функцию Т-лимфоцитов-супрессоров. Побочное действие препаратов лития проявляется снижением концентрационной способности почек, повышенной жаждой, тошнотой, рвотой, диареей, тремором, атаксией, нарушениями сердечного ритма, явлениями гипотиреоза, увеличением массы тела. Препараты лития противопоказаны при нарушении выделительной функции почек, сердечно-сосудистых заболеваниях с явлениями декомпенсации, беременности и лактации. Выбор С. л. производят с учетом патогенеза лейкопенией и особенностей механизма действия отдельных препаратов данной группы.
Библиография: Алмазов В. А. и др. Лейкопении, с. 32, Л., 1981; Истаманова Т. С. и Алмазов В. А. Лейкопении и агранулоцитозы, с. 151, Л., 1961; Машковский М. Д. Лекарственные средства, ч. 1, М., 1977; Яворковский Л. Л. Литий как стимулятор нейтропоэза, Пробл. гематол. и перелив, крови, т. 27, .N» 11, с. 50, 1982; R о s e n t h’a 1 N. E. a. Goodwin F. К. The role of the lithium ion in medicine, Ann. Rev. Med., v. 33, p. 555, 1982.
Источник
Угнетают пролиферацию клеток костного мозга витамины
Масса костного мозга у взрослого человека составляет 4,6 % от массы тела, или 3,4 кг, в том числе масса красного костного мозга — 1,7 кг. Общее количество ядросодержащих клеток достигает в среднем 8,1 • 109 на кг от массы тела, а занимаемый ими объем колеблется от 1320 до 4192 мл.
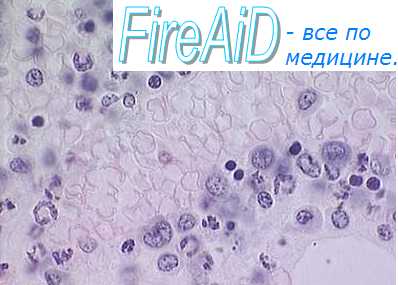
Клетки костного мозга представляют одну из наиболее пролиферирую-щих тканей организма. Для осуществления митоза клеток используется энергия макроэргических соединений, образующихся в процессе окислительного фосфорилирования. Энергообмен в ткани костного мозга усиливается при повышении пролиферативной активности. Например, усиление эритропоэза после кровопотери активирует в костном мозге процессы аэробного окисления, увеличивает скорость потребления кислорода клетками, интенсивность дыхания и окислительного фосфорилирования в их митохондриях. Одновременно раскрываются нефункционирующие синусоиды и увеличивается кровоток в костном мозге, что укорачивает путь диффузии кислорода от отдельного сосуда к клетке.
При активации гемопоэза в костном мозге возрастает интенсивность синтеза ядерных и митохондриальных ДНК, РНК и белков, увеличивается количество и площадь поверхности митохондрий, растет общее число рибосом и потребление свободных аминокислот. Например, усиление регенерации эритроцитов увеличивает потребление в ткани костного мозга лизина, серосодержащих, ароматических аминокислот, глутаминовой кислоты. При их дефиците регенерация красной крови замедляется. Усиление пролиферации гемопо-этических клеток требует повышения проницаемости их мембран, что обеспечивается нарастанием интенсивности перекисного окисления липи-дов. Активации гранулопоэза и, особенно, эритропоэза предшествует резорбция жировой ткани костного мозга. Высвобождающиеся из нее гемопоэтические цитокины — КСФгм, КСФг активируют гемопоэз, а полиненасыщенные жирные кислоты используются в ходе гемопоэза для формирования клеток крови.
Источник
Витамины и микроэлементы, участвующие в регуляции системы кроветворения (Fe, Ca, Mg, Co, Cu, Zn, Mo, витамины B9, B12, K, B6, B5, D, E, омега-3, омега-6 жирные кислоты)
Комплексный анализ основных витаминов и микроэлементов, необходимых для нормального гемопоэза, используемый для диагностики заболеваний крови, в том числе анемии.
Основные микронутриенты гемопоэза, дефицит микронутриентов при анемии, анализы при анемии.
Hemopoiesis, vitamins and trace elements, Micronutrients in anemia, Nutrient status in anemia.
Высокоэффективная жидкостная хроматография.
Какой биоматериал можно использовать для исследования?
Как правильно подготовиться к исследованию?
- Не принимать пищу в течение 8 часов до исследования, можно пить чистую негазированную воду.
- Не курить в течение 30 минут до исследования.
Общая информация об исследовании
Гемопоэз – комплексный процесс, включающий формирование и последовательное созревание клеток трех основных гемопоэтических ростков (эритроцитов, лейкоцитов и тромбоцитов). В норме у взрослого человека и ребенка функцию кроветворения выполняет красный костный мозг, сосредоточенный преимущественно в плоских костях и эпифизах трубчатых костей. Часть соединений, необходимых для гемопоэза, человеческий организм способен вырабатывать самостоятельно (АТФ, глицин, фосфолипиды). Однако значительную роль в процессе гемопоэза играют соединения, которые в естественных условиях организмом не синтезируются, – витамины и микроэлементы. Их поступление полностью зависит от качества питания.
Организации, занимающиеся разработкой рекомендаций по диетологии, периодически пересматривают и публикуют рекомендованные суточные нормы потребления витаминов и микроэлементов, рассчитанные для среднестатистического здорового человека определенной возрастной группы. Так, например, норма железа составляет 11 мг/сутки для младенца женского или мужского пола, 8 мг/сутки – для взрослого мужчины и 18 мг – для взрослой женщины, а беременные женщины должны получать не менее 27 мг железа в сутки. Дефицит или, наоборот, избыток этих соединений может оказывать негативное влияние на процесс гемопоэза.
Наибольшее клиническое значение имеет анемия, обусловленная дефицитом железа, фолиевой кислоты (витамин В9), витамина В12 (цианокобаламин) и В6 (пиридоксаль-5-фосфат). Несмотря на разную этиологию, различные формы анемии, однако, имеют схожую симптоматику в виде повышенной утомляемости, одышки и учащенного сердцебиения. По этой причине диагностика анемий и других нарушений кроветворения носит комплексный характер. Очень информативным является комплексное исследование, включающее витамины и микроэлементы, нарушение метаболизма которых может быть причиной заболевания.
Железо и витамин B6 необходимы для синтеза гема молекулы гемоглобина, а их дефицит приводит к нарушению созревания эритроцитов. Железодефицитная анемия (ЖА) – это самая частая форма анемии как среди взрослого населения, так и у детей. Причинами ЖА могут быть алиментарный дефицит железа (например, вегетарианство), кровопотеря (например, обильные менструации, частые носовые кровотечения), хроническое кровотечение пищеварительного тракта (язвенная болезнь желудка, геморрой), инфекционные заболевания (глистные инвазии), заболевания тонкой кишки (целиакия) и прием лекарственных средств (холестирамин, омепразол), затрудняющие всасывание железа. ЖА можно заподозрить при выявлении у пациента микроцитарной (MCV менее 80 мкм 3 ) анемии, а также некоторых других клинико-лабораторных характеристик крови: анизоцитоза (увеличение RDW) и гипохромии эритроцитов, а также тромбоцитоза.
Изолированный дефицит витамина В6 встречается достаточно редко, однако он является распространенным осложнением лечения изониазидом, циклосерином и пеницилламином. Клинико-лабораторные признаки анемии, обусловленной дефицитом витамина В6, напоминают таковые при железодефицитной анемии – характерны микроцитоз и гипохромия, – показатели обмена железа при этом, однако, в норме.
Другой причиной анемии является дефицит витаминов B12 (цианокобаламина) и B9 (фолиевой кислоты). Эти витамины необходимы для нормального синтеза ДНК и последующего деления клеток. Их дефицит приводит к развитию макроцитарной анемии (MCV более 100). Клинические и лабораторные изменения, наблюдаемые при дефиците фолиевой кислоты и витамина В12, очень похожи друг на друга, поэтому чаще эти формы анемии рассматривают вместе. Причинами дефицита В12 могут являться веганская диета, заболевания поджелудочной железы (хронический панкреатит), желудка (атрофический гастрит) и подвздошной кишки (болезнь Крона), препятствующие нормальному всасыванию этого витамина, и редко дифиллоботриоз,; причинами дефицита фолиевой кислоты — хронический алкоголизм, беременность, применение некоторых лекарственных препаратов (метотрексат, триметоприм, фенитоин). В отличие от других макроцитарных анемий, обусловленных, например, гипотиреозом, анемия, вызванная дефицитом витамина В12 или фолиевой кислоты, также является мегалобластической анемией – то есть в мазке крови наблюдаются гиперсегментированные нейтрофилы и ядросодержащие эритроциты.
Железо, фолиевая кислота и витамины В12 и В6 являются ключевыми компонентами кроветворения. Роль других микронутриетов также важна, однако не является определяющей. Так, например:
- кальций участвует в переключении кроветворения с печеночного на костномозговое, что происходит после рождения;
- медь выступает в роли кофактора фермента, окисляющего ионы железа до двухвалентного состояния Fe 2+ — именно в окисленной форме железо связывается с белком-переносчиком трансферрином и попадает в костный мозг;
- витамин Е (токоферол) препятствует воздействию оксидативного стресса на мембраны эритроцитов;
- омега-3 и омега-6 жирные кислоты регулируют пролиферацию клеток миелоидного ростка.
Дефицит этих, а также некоторых других микронутриентов может сопровождаться нарушением кроветворения.
Таким образом, к нарушению кроветворения, и в первую очередь к анемии, может приводить дефицит достаточно широкого спектра соединений. Комплексное исследование позволяет заподозрить причину заболевания. В некоторых случаях, однако, могут потребоваться дополнительные исследования, в том числе морфологическое исследование костного мозга.
Для чего используется исследование?
- Для диагностики заболеваний крови, в первую очередь анемии.
Когда назначается исследование?
- При наличии симптомов анемии: повышенной утомляемости, одышки, учащенного сердцебиения.
- При наличии факторов риска анемии: хронического кровотечения ЖКТ, обильных менструаций, хронических инфекционно-воспалительных заболеваний (глистные инвазии, туберкулез), приема некоторых лекарственных средств (омепразол, фенитоин, метотрексат), хронического алкоголизма и др.
- При обнаружении у пациента лабораторных признаков анемии (снижения уровня эритроцитов и/или гемоглобина).
Что означают результаты?
Магний: 12.15 — 31.59 мг/л
Железо: 270.00 — 2930.00 мкг/л
Цинк: 650.00 — 2910.00 мкг/л
Витамин В5 (пантотеновая кислота): 0.2 — 1.8 мкг/мл
Витамин D, 25-гидрокси (кальциферол): 3.0 — 49.6 нг/мл
Витамин К (филлохинон): 0.1 — 2.2 нг/мл
Кобальт: 0.10 — 0.40 мкг/л
Кальций: 86.00 — 102.00 мг/л
Молибден: 0.10 — 3.00 мкг/л
Медь: 575.00 — 1725.00 мкг/л
Хром: 0.05 — 2.10 мкг/л
Витамин Е: 5.00 — 18.00 мкг/мл
Витамин B9 (фолиевая кислота): 2.5 — 15.0 нг/мл
Витамин В12 (цианокобаламин): 189.0 — 833.0 пг/мл
Витамин В6 (пиридоксаль-5-фосфат): 8.70 — 27.20 нг/мл
Причины понижения показателей:
- алиментарный дефицит (вегетарианство, веганские диеты);
- период активного роста (подростки), беременность, лактация;
- заболевания кишечника, препятствующие нормальному всасыванию витаминов/микроэлементов (целиакия, болезнь Крона);
- хронический алкоголизм;
- прием некоторых лекарственных препаратов (фенитоин, пероральные контрацептивы, метотрексат, триметоприм и другие);
- наследственные нарушения метаболизма.
Причины повышения показателей:
- гемохроматоз (избыток железа);
- гиперпаратиреоз, злокачественные заболевания, саркоидоз, длительная иммобилизация (избыток кальция);
- гипервитаминоз витаминов D и E.
Что может влиять на результат?
- Возраст;
- характер питания;
- физиологическое состояние организма (беременность, лактация, реконвалесценция, интенсивные физические нагрузки);
- прием лекарственных препаратов;
- наличие сопутствующих заболеваний.
Кто назначает исследование?
Терапевт, врач общей практики, педиатр, гематолог.
Литература
- Varney ME, Buchanan JT, Dementieva Y, Hardman WE, Sollars VE. A high omega-3 fatty acid diet has different effects on early and late stage myeloid progenitors. Lipids. 2011 Jan;46(1):47-57. doi: 10.1007/s11745-010-3491-3. Epub 2010 Oct 31.
- Fauci et al. Harrison’s Principles of Internal Medicine/A. Fauci, D. Kasper, D. Longo, E. Braunwald, S. Hauser, J. L. Jameson, J. Loscalzo; 17 ed. — The McGraw-Hill Companies, 2008.
Источник