Трансаминирование, химизм. Трансаминазы, их специфичность. Роль витамина в6 в трансаминировании.
Трансаминирование – процесс переноса аминогруппы с α-аминокислоты на кетокислоту при участии ферментов трансаминаз (В6 – фосфопиридоксаль). Этому процессу подвергаются все аминокислоты, кроме лизина, треонина и пролина.
Реакцию трансаминирования катализируют высокоактивные аминотрансферазы: аланинаминотрансфераза (АЛТ) и аспартатаминотрансфераза (АСТ), которые обладают субстратной специфичностью.
АЛТ и АСТ – органоспецифические ферменты, в норме в крови их активнрсть равна 5-40 ЕД/л, т.е. активность трансаминаз сравнительно низкая. При заболеваниях, сопровождающихся деструкцией (некрозом) клеток, происходит выход ферментов в кровь и повышение их активности. Определение активности АЛТ и АСТ имеет большое диагностическое значение. Для дифференциальной диагностики заболеваний печени и сердца определяют соотношение активности АСТ/АЛТ в сыворотке крови – «коэффициент де Ритиса», который в норме составляет 1,33±0,42.
При гепатитах активность АЛТ увеличивается в 6-8 раз по сравнению с нормой, а АСТ – в2-4 раза. «Коэффициент де Ритиса» уменьшается примерно до 0,6. Особенно важное значение для диагностики имеет повышение активности АЛТ при безжелтушных формах вирусного гепатита. У детей при гепатитах активность АЛТ возрастает еще в дожелтушный период развития болезни. Однако, при церрозе печени «Коэффициент де Ритиса» приближается к 1,0, что свидетельствует о некрозе клеток, при котором в кровь выходят обе фракции (цитоплазматическая и митохондриальная).
При инфаркте миокарда активность АСТ увеличивается в 8-10 раз, а АЛТ – в 1,5 -2,0 раза. Значение «Коэффициента де Ритиса» резко возрастает. Инфекционные и токсические миокардиты характеризуются повышением АСТ, это же самое наблюдается при операциях на сердце.
При стенокардии, пороках сердца, инфаркте легкого активность аминотрансфераз в крови не возрастает.
ОСОБАЯ РОЛЬ ГЛУТАМАТА В РЕАКЦИЯХ ТРАНСАМИНИРОВАНИЯ.
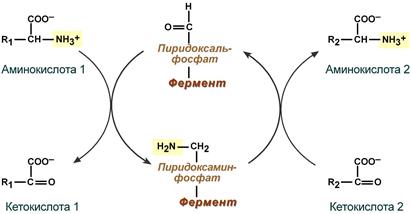
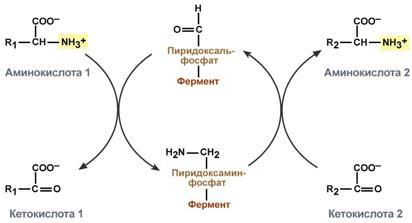
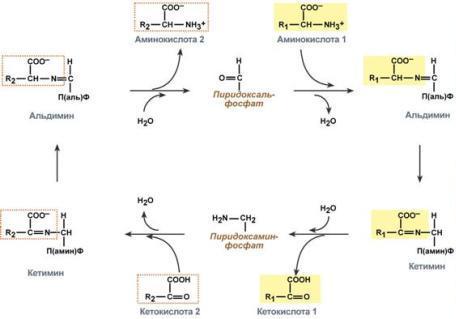
Чаще всего в реакциях трансаминирования участвуют аминокислоты, содержание которых в тканях значительно выше остальных — глу-тамат, аланин, аспартат и соответствующие им кетокислоты — α-кетоглутарат, пируват и оксалоацетат. Основным донором аминогруппы служит глутамат.
Акцептором аминогруппы любой аминокислоты, подвергающейся трансаминированию (аминокислота 1), служит α-кетоглутарат. Принимая аминогруппу, он превращается в глутамат, который способен передавать эту группу любой α-кетокислоте с образованием другой аминокислоты (аминокислота 2).
Биологическая роль реакций трансаминирования
Путь синтеза заменимых аминокислот
Путь перераспределения азота без образования токсичного аммиака
Путь пополнения энергетического материала (образование субстратов окислительного декарбоксилирования ПВК и ЦТК)
Определение трансаминаз в сыворотке крови.
Аминотрансферазы – ферменты, катализирующие межмолекулярный перенос аминогруппы с аминокислоты на кетокислоту без образования свободного аммиака. Аминотрансферазы также называют трансаминазами, а реакцию — трансаминированием. Для аминотрансфераз донором аминогрупп являются аминокислоты, а акцептором — кетокислоты: AK1 + KK2 ↔ KK1 + AK2
Наибольшее значение имеет определение активности 2-х ферментов: аспартатаминотрансфе-разы (АсАТ) и аланинаминотрансферазы (АлАТ). Эти ферменты обладают высокой каталитической активностью, широко распространены в различных органах и тканях: сердечная мышца, печень, почки, скелетная мускулатура, т.п.
Определение активности АсАТ и АлАТ используется для диагностики болезней печени и заболеваний сердца. При болезни Боткина значительно возрастает активность АлАТ. Изменения активности, как правило, отражают тяжесть поражения печеночной паренхимы. Увеличивается активность АлАТ при обострении хронического гепатита, при токсическом поражении паренхимы печени. Изменение активности аспартатаминотрансферазы характеризует поражение сердечной мышцы. При инфаркте миокарда активность повышается уже через 4-6 часов и держится высокой в течение 3-7 дней. (Это особенно важно при инфарктах, не диагносцируемых на ЭКГ). Повышается активность АсАТ при гипертонических кризах.
Источник
Для трансаминирования необходим витамин В6
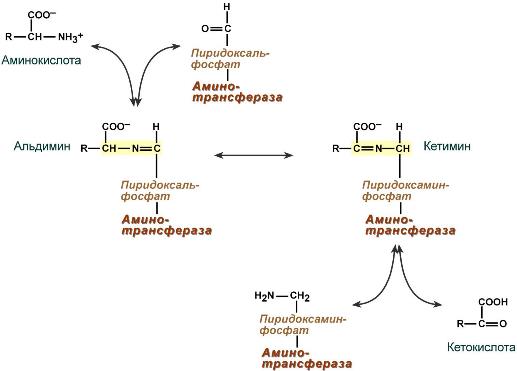
Механизм реакции трансаминирования непрост и протекает по типу «пинг-понг». Катализируют реакцию ферменты аминотрансферазы , Они являются сложными ферментами, в качестве кофермента имеют пиридоксальфосфат (активная форма витамина В6).
В тканях насчитывают около 10 аминотрансфераз, обладающие групповой специфичностью и вовлекающие в реакции все аминокислоты, кроме пролина, лизина, треонина, которые не подвергаются трансаминированию.
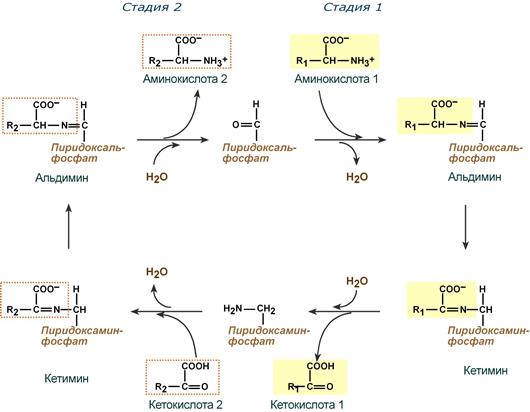
Весь перенос аминогруппы совершается в две стадии:
- к пиридоксальфосфату сначала присоединяется первая аминокислота, отдает аминогруппу, превращается в кетокислоту и отделяется. Аминогруппа при этом переходит на кофермент и образуется пиридоксаминфосфат .
- на второй стадии к пиридоксаминфосфату присоединяется другая кетокислота, получает аминогруппу, образуется новая аминокислота и пиридоксальфосфат регенерирует.
Схема реакции трансаминирования
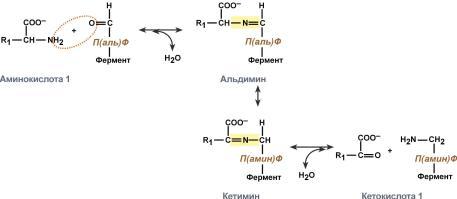
Роль и превращение пиридоксальфосфата сводится к образованию промежуточных соединений – шиффовых оснований (альдимин и кетимин). В первой реакции после отщепления воды образуется иминовая связь между остатком аминокислоты и пиридоксальфосфатом. Полученное соединение называется альдимин. Перемещение двойной связи приводит к образованию кетимина, который гидролизуется по месту двойной связи. От фермента отщепляется готовый продукт – кетокислота.
Превращение пиридоксальфосфата в пиридоксаминфосфат
при переносе аминогруппы от аминокислоты на кофермент
После отщепления кетокислоты к комплексу пиридоксамин-фермент присоединяется новая кетокислота и процесс идет в обратном порядке: образуется кетимин, затем альдимин, после чего отделяется новая аминокислота.
Реакции полного цикла трансаминирования
Чаще всего аминокислоты взаимодействуют со следующими кетокислотами:
- пировиноградной с образованием аланина,
- щавелевоуксусной с образованием аспартата,
- α-кетоглутаровой с образованием глутамата.
Однако аланин и аспартат в дальнейшем все равно передают свою аминогруппу на α-кетоглутаровую кислоту. Таким образом, в тканях осуществляется поток избыточных аминогрупп на один общий акцептор – α-кетоглутаровую кислоту. В итоге образуется большое количество глутаминовой кислоты .
Далее глутаминовая кислота может вовлекается в процессы связывания аммиака (синтез глутамина) либо в прямое окислительное дезаминирование.
Источник
Трансаминирование нуждается в витамине в6
Механизм реакции трансаминирования непрост и протекает по типу «пинг-понг». Катализируют реакцию ферменты аминотрансферазы, Они являются сложными ферментами, в качестве кофермента имеют пиридоксальфосфат (активная форма витамина В6).
В тканях насчитывают около 10 аминотрансфераз, обладающие групповой специфичностью и вовлекающие в реакции все аминокислоты, кроме пролина, лизина, треонина, которые не подвергаются трансаминированию.
Весь перенос аминогруппы совершается в две стадии:
к пиридоксальфосфату сначала присоединяется первая аминокислота, отдает аминогруппу, превращается в кетокислоту и отделяется. Аминогруппа при этом переходит на кофермент и образуетсяпиридоксаминфосфат.
на второй стадии к пиридоксаминфосфату присоединяется другая кетокислота, получает аминогруппу, образуется новая аминокислота и пиридоксальфосфат регенерирует.
Схема реакции трансаминирования
Роль и превращение пиридоксальфосфата сводится к образованию промежуточных соединений –шиффовых оснований (альдимин и кетимин). В первой реакции после отщепления воды образуется иминовая связь между остатком аминокислоты и пиридоксальфосфатом. Полученное соединение называется альдимин. Перемещение двойной связи приводит к образованию кетимина, который гидролизуется водой по месту двойной связи. От фермента отщепляется готовый продукт – кетокислота.
Механизм реакции трансаминирования
После отщепления кетокислоты к комплексу пиридоксамин-фермент присоединяется новая кетокислота и процесс идет в обратном порядке: образуется кетимин, затем альдимин, после чего отделяется новая аминокислота.
Реакции полного цикла трансаминирования
Чаще всего аминокислоты взаимодействуют со следующими кетокислотами:
пировиноградной с образованием аланина,
щавелевоуксусной с образованием аспартата,
α-кетоглутаровой с образованием глутамата.
Однако аланин и аспартат в дальнейшем все равно передают свою аминогруппу на α-кетоглутаровую кислоту. Таким образом, в тканях осуществляется поток избыточных аминогрупп на один общий акцептор – α-кетоглутаровую кислоту. В итоге образуется большое количество глутаминовой кислоты.
Далее глутаминовая кислота может вовлекается в процессы связывания аммиака (синтез глутамина) либо в прямое окислительное дезаминирование.
Аминотрансферазы имеют клиническое значение
В медицине нашло практическое применение определение активности двух ферментов трансаминирования – аланинаминотрансферазы (АЛТ, АлАТ) и аспартатаминтрансферазы (АСТ).
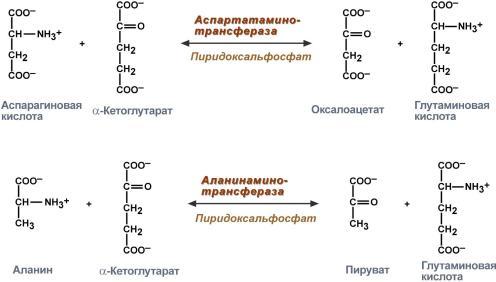
Оба фермента обратимо взаимодействуют с α-кетоглутаровой кислотой и переносят на нее аминогруппы от соответствующих аминокислот с образованием глутаминовой кислоты и кетокислот.
Реакции, катализируемые аланинаминотрансферазой и аспартатаминотрансферазой
Хотя активность обоих ферментов значительно возрастает при заболеваниях сердечной мышцы и печени, при поражении клеток миокарда наибольшая активность в сыворотке крови обнаруживается для АСТ, при гепатитах – для АЛТ.
В клинической практике определение активности АЛТ и АСТ используется для дифференциальной диагностики болезней печени и миокарда, глубины поражения и контроля эффективности их лечения.
Тут вы можете оставить комментарий к выбранному абзацу или сообщить об ошибке.
Источник
Билет №3
Трансаминирование аминокислот, значение реакций. Роль витамина b6, Аминотрансферазы АлАт, АсАт, диагностическое значение определения в биологических жидкостях (кровь, слюна).
Трансаминирование – реакции переноса — аминогруппы с аминокислоты на -кетокислоту, в результате чего образуются новая кетокислота и новая аминонокислота. Реакции катализируют ферменты аминотрансферазы,. Это сложные ферменты, коферментом которых является производное витамина В6 (пиридоксальфосфат). Реакции трансаминирования обратимы, и могут проходить как в цитоплазме, так и в митохондриях клеток.
Биологическое значение трансаминирования
Трансаминирование – первая стадия дезаминирования большинства аминокислот, т.е. начальный этап их катаболизма. Образующиеся при этом кетокислоты окисляются в ЦТК или используются для синтеза глюкозы и кетоновых тел. Поскольку этот процесс обратим, ферменты аминотрансферазы функционируют как в процессах катаболизма, так и биосинтеза аминокислот. Трансаминирование – заключительный этап синтеза заменимых аминокислот из соответствующих кетокислот, если они необходимы в данный момент клеткам. В результате происходит перераспределение аминнного азота в тканях. При трансаминированиии общее количество аминокислот в клетке не меняется.
Аминотрансферазы имеют клиническое значение
В медицине нашло практическое применение определение активности двух ферментов трансаминирования – аланинаминотрансферазы (АЛТ, АлАТ) и аспартатаминтрансферазы (АСТ).
Оба фермента обратимо взаимодействуют с α-кетоглутаровой кислотой и переносят на нее аминогруппы от соответствующих аминокислот с образованием глутаминовой кислоты и кетокислот (оксалоацетат и пируват).
Реакции, катализируемые аланинаминотрансферазой и аспартатаминотрансферазой
Хотя активность обоих ферментов значительно возрастает при заболеваниях сердечной мышцы и печени, при поражении клеток миокарда наибольшая активность в сыворотке крови обнаруживается для АСТ, при гепатитах – для АЛТ.
В клинической практике определение активности АЛТ и АСТ используется для дифференциальной диагностики болезней печени и миокарда, глубины поражения и контроля эффективности их лечения
Наиболее часто активность аминотрансфераз исследуют с целью дифференциальной диагностики патологии печени и миокарда. Для этого определяют показатель, который называется коэффициент де Ритиса:
КдР = АсАТ / АлАТ = 1,33
Увеличение активности аминотрансфераз наблюдается при:
Инфаркте миокарда и поражениях скелетных мышц. Коэффициент де Ритиса АсАТ/АлАТ более 1,33.
Остром вирусном гепатите (АлАТ и АсАТ более чем в 100 раз). Коэффициент де Ритиса менее 1,33.
Быстрое снижение активности аминотрансфераз одновременно с возрастанием гипербилирубинемии свидетельствует об обширных некротических изменениях в ткани печени.
Терминология
Азотурия — ненормально увеличенное выделение мочою азота, который содержится в моче главным образом в виде мочевины. При нормальных условиях временная Азотурия бывает после обильного потребления азотистой пищи; ненормальная же бывает при большинстве лихорадочных болезней и при отравлениях ядами, которые вызывают увеличенное распадение белков;
Цитруллинурия — наследственная болезнь, обусловленная нарушением обмена цитруллина; Цитруллин является промежуточным веществом в орнитиновом цикле, необходимом для превращения аминогрупп и аммиака в мочевину.
Заболевание характеризуется задержкой психического развития, нарушением формирования костного скелета, гепатомегалией, гипотиреозом, атрофией головного мозга.
Охроноз— наследственное заболевание, обусловленное избыточным отложением в различных тканях гомогентизиновой кислоты в связи с отсутствием фермента гомогентизиназы; Гомогентизиновая кислота (продукт метаболизма фенилаланина и тирозина) в большом количестве выводится из организма с мочой и потом, а также откладывается в тканях (преимущественно в хряще), где она полимеризуется и, накапливаясь, окрашивает ткани в желто-коричневатый, охрянистый (отсюда название болезни) и иногда даже в черный цвет. Пигментация обнаруживается также в склере и роговице глаза, и внутренних органах.
Источник