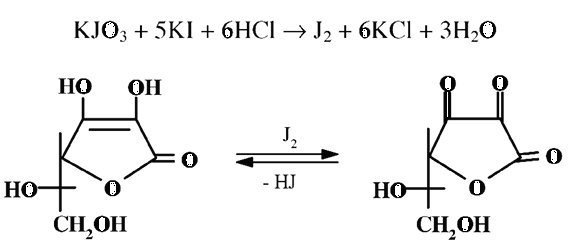Пищевая химия: учебник для студентов вузов
Лабораторная работа 35. Титриметрические методы определения витамина С
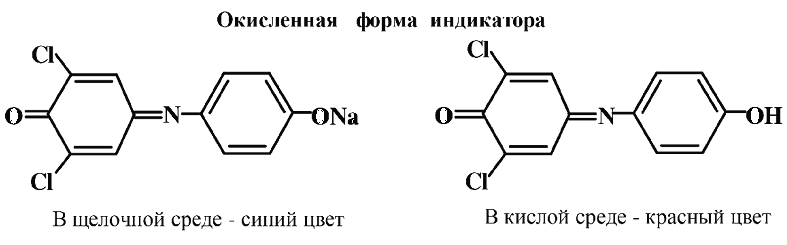
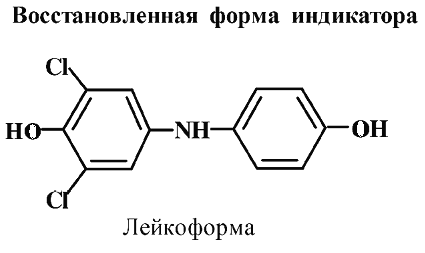
Сущность титриметрического метода заключается в том, что 2, 6-дихлорфенолиндофенол выступает не только как окислитель, но и как индикатор, по которому определяют окончание титрования. Окраска раствора 2, 6-дихлорфенолиндофенола зависит от рН среды, а при восстановлении он переходит в лейкоформу.
Количественное определение ведут путем добавления к подкисленному раствору, содержащему витамин С, щелочного раствора краски Тильманса. Пока в титруемом растворе содержится витамин С, добавляемый раствор 2, 6-дихлорфенолиндофенола, имеющий глубокий синий цвет, обесцвечивается с образованием лейкоформы (индикатор), за счет присутствия восстановленной формы АК. Как только все количество АК в анализируемом растворе окислится до ДАК, раствор приобретает красную окраску, характерную для окисленной формы 2, 6-дихлорфенолиндофенола в кислой среде. Метод стандартизирован (ГОСТ 30627.2–98 – Методы измерений массовой доли витамина С (аскорбиновой кислоты).
Ход анализа . Точную навеску (около 5–10 г) предварительно измельченного исследуемого материала поместить в фарфоровую ступку. Небольшими порциями добавить 20 мл 1%-го раствора соляной кислоты, тщательно растирая пробу до получения однородной кашицы. Смесь количественно перенести в мерную колбу вместимостью 100 мл (общий объем соляной кислоты не должен превышать 50 мл). Ступку и пестик ополоснуть 1%-м раствором щавелевой кислоты и собрать смывы в ту же мерную колбу. Объем раствора довести до метки раствором щавелевой кислоты.
Содержимое колбы перемешать и через 5 минут отфильтровать через складчатый фильтр в сухую колбу или центрифугировать. Полученный фильтрат или фугат в количестве 1–10 мл (в зависимости от содержания витамина) отобрать пипеткой в коническую колбу и довести объем раствора дистиллированной водой до 15 мл. Анализируемый раствор оттитровать из микробюретки 0,001 н раствором 2, 6-дихлор-фенолиндофенола до появления розового окрашивания, не исчезающего в течение 30–60 с.
Контрольный опыт . Для оценки поправки на присутствие других редуцирующих веществ в используемых реагентах к 10 мл фильтрата или фугата прилить 0,1 мл 10%-го раствора сернокислой меди и выдержать при температуре 110 0 С в течение 10 минут для разложения АК. После охлаждения добавить 5 мл дистиллированной воды и оттитровать анализируемый раствор из микробюретки 0,001 н раствором 2, 6-дихлорфенолиндофенола. Для титруемого объема в 15 мл объем титранта, пошедшего на контрольный опыт, обычно составляет 0,04–0,06 мл. Эту поправку необходимо вычесть из объема титранта, пошедшего на титрование опытного образца. Рассчитать массовую долю аскорбиновой кислоты ( С АК , мг %) в анализируемом материале по формуле
C A K = T × V 1 × V 2 m × V 3 × 100 ,
где Т – титр 0,001 н раствора 2, 6-дихлорфенолиндофенола по аскорбиновой кислоте, 0,088 мг/мл;
V 1 – объем 0,001 н раствора 2, 6-дихлорфенолиндофенола, пошедшего на титрование экстракта с учетом поправки на реагенты, мл;
V 2 – общий объем экстракта, 100 мл;
V 3 – объем экстракта, взятого на титрование, 15 мл;
m – масса навески исследуемого материала, г;
100 – коэффициент пересчета на 100 г.
Определение витамина С в окрашенных растворах
Многие растительные материалы дают окрашенные экстракты, что затрудняет определение АК путем прямого титрования краской Тильманса. В этом случае титрование ведут в присутствии растворителей, которые сами нерастворимы в воде, но растворяют краску и не растворяют пигменты экстракта, таких как хлороформ или смесь толуола и изобутилового спирта (1:1).
Ход анализа . Точную навеску (около 5–10 г) растительного материала растереть в фарфоровой ступке в 20 мл 1%-ной соляной кислоты. Полученный гомогенат количественно перенести в мерную колбу вместимостью 100 мл и довести объем до метки 1%-ным раствором щавелевой кислоты. Соотношение соляной и щавелевой кислот должно составить 1:5. Содержимое колбы перемешать и через 5 минут отфильтровать через складчатый фильтр в сухую колбу.
В пробирку вместимостью 20 мл отмерить пипеткой 5 мл отфильтрованного окрашенного экстракта, добавить мерным цилиндром 5 мл хлороформа и оттитровать 0,001 н раствором 2, 6-дихлор-фенолиндофенола при осторожном перемешивании, наклоняя пробирку. Титрование прекратить при появлении красного окрашивания в слое хлороформа.
Для оценки поправки на реагенты приготовить контрольный раствор. В качестве контрольного раствора использовать 5 мл смеси из 1%-ных растворов соляной и щавелевой кислот (в соотношении объемов 1:5) и 5 мл хлороформа. Объем титранта, пошедший на контрольный опыт, необходимо вычесть из объема титранта, пошедшего на титрование опытного образца. Рассчитать массовую долю аскорбиновой кислоты ( С АК , мг %) по формуле
C A K = T × V 1 × V 2 m × V 3 × 100 ,
где Т – титр 0,001 н раствора 2, 6-дихлорфенолиндофенола по аскорбиновой кислоте, 0, 088 мг/мл;
V 1 – объем 0,001 н раствора 2, 6-дихлорфенолиндофенола, пошедшего на титрование экстракта с учетом поправки на контрольный опыт, мл;
V 2 – общий объем экстракта, 100 мл;
V 3 – объем экстракта, взятого на титрование, 5 мл;
m – масса навески исследуемого материала, г;
100 – коэффициент пересчета на 100 г.
Определение содержания витамина С в молочных продуктах
Содержание витамина С в сыром молоке зависит от времени года, индивидуальных особенностей животного и колеблется в интервале 0,3–2 мг%. В свежем молоке 67–68% приходится на восстановленную форму витамина С (АК) и 22–33% на окисленную (ДАК). Окисление витамина С в молоке катализирует аскорбатоксидаза и ускоряется в присутствии металлов (железа, меди), света, воздуха. Прямому определению АК в молоке препятствуют белки, способные связывать 2, 6-дихлорфенолиндофенол. В связи с этим определение АК ведут в безбелковом фильтрате. Белки осаждают с помощью насыщенного раствора хлорида натрия или раствора кислоты (метафосфорной, щавелевой, соляной).
Ход анализа . Навеску анализируемого молочного продукта (10 г) растворить 15–25 мл 6%-го раствора метафосфорной кислоты, количественно перенести в мерную колбу вместимостью 50 мл и довести объем смеси до метки тем же раствором кислоты (вместо метафосфорной кислоты можно использовать 2%-ный раствор соляной кислоты). Полученную смесь перемешать и отфильтровать. В коническую колбу для титрования отобрать пипеткой 1 мл фильтрата, довести объем до 15 мл дистиллированной водой и оттитровать из микробюретки 0,001 н раствором 2,6-дихлорфенолиндофенола до появления слаборозового окрашивания, не исчезающего в течение 30–60 с.
Рассчитать массовую долю аскорбиновой кислоты ( С АК , мг %) в анализируемом молоке по формуле
C A K = T × V 1 × V 2 m × V 3 × 100 ,
где Т – титр 0,001 н раствора 2, 6-дихлорфенолиндофенола по аскорбиновой кислоте, 0,088 мг/мл;
V 1 – объем 0,001 н раствора 2, 6-дихлорфенолиндофенола, пошедшего на титрование анализируемого образца с учетом поправки на реагенты, мл;
V 2 – общий объем раствора, 50 мл;
V 3 – объем раствора, взятого на титрование, 1 мл;
m – масса навески исследуемого материала, г;
100 – коэффициент пересчета в проценты.
Упрощенный йодатный метод определения витамина С в молоке
В основе йодатного метода лежит реакция окисления АК йодноватокислым калием до ДАК.
Определение витамина С упрощенным йодатным методом не применяют для анализа жидких концентратов из плодов шиповника, консервированных продуктов, свежеотжатых соков, свежих плодов, овощей, сушенных продуктов, витаминизированных чаев.
Ход анализа . Экстракцию витамина С провести с использованием 2%-го раствора соляной кислоты по методике, указанной выше. На анализ отобрать 1–5 мл экстракта (в зависимости от содержания витамина С) в коническую колбу вместимостью 100 мл, куда заранее добавить 0,5 мл 1%-го раствора йодистого калия, 1 мл 1%-го раствора крахмала и воды (3,5–7,5мл) с таким расчетом, чтобы общий объем смеси составил 10 мл. Полученный раствор оттитровать из микробюретки 0,001 н раствором йодноватокислого калия до появления устойчивого слабо синего окрашивания. Рассчитать содержание аскорбиновой кислоты ( С АК , мг %) в анализируемом молоке по формуле
C A K = T × V 1 × V 2 m × V 3 × 100 ,
где Т – титр 0,001 н раствора йодноватокислого калия по аскорбиновой кислоте, 0,088 мг/мл;
V 1 – объем 0,001 н раствора йодноватокислого калия, пошедшего на титрование анализируемого образца с учетом поправки на контрольный раствор, мл;
V 2 – общий объем экстракта, 1–5 мл;
V 3 – объем раствора, взятого на титрование, 10 мл;
m – масса навески исследуемого материала, г;
100 – коэффициент пересчета в проценты
Контрольный опыт . В коническую колбу отмерить 0,5 мл 1%-го раствора йодистого калия, 1 мл 1%-го раствора крахмала, 1 мл 2%-го раствора соляной кислоты и воды с таким расчетом, чтобы общий объем жидкости составил 10 мл, и оттитровать из микробюретки 0,001 н раствором йодноватокислого калия до появления устойчивого слабо синего окрашивания.
Необходимые реактивы, посуда, оборудование :
§ 1-, 2%-ные растворы соляной кислоты, 1%-ный раствор щавелевой кислоты, 6%-ный раствор метафосфорная кислота (Н n P n O 3n ), 10%-ный раствор сульфата меди, 2%-ный раствор серной кислоты, аскорбиновая кислота кристаллическая, 1%-ный раствор крахмала, 0,001 н раствор 2,6-дихлор-фенолиндофенола, аскорбиновая кислота кристаллическая, хлороформ, 1%-ный раствор йодистого калия, 0,001 н раствор йодноватокислого калия ( KJO 3 ), кристаллический йодид калия;
§ колбы для титрования, пипетки, микробюретки, фарфоровые ступки с пестиком, мерные колбы вместимостью 50 мл, 100 мл, делительные воронки, воронки для фильтрования, мерные цилиндры, пробирки;
§ аналитические весы, центрифуга, термостат на 110 0 С.
1%-ный раствор соляной кислоты . В мерную колбу вместимостью 1000 мл отмерить 23 мл соляной кислоты плотностью 1,185 г/мл, развести 300 мл дистиллированной воды и довести объем раствора до метки.
0,001 н раствор йодноватокислого калия ( KJO 3 ) . Навеску йодата калия 0,03568 г растворить в небольшом количестве дистиллированной воды в мерной колбе вместимость 1 л и довести объем раствора до метки.
0,001 н раствор 2,6-дихлорфенолиндофенола ( краска Тильманса ) . Навеску краски около 0,2 г растворить в 300 мл свежепрокипяченной теплой дистиллированной воды, добавить 20–30 капель 0,01 н раствора гидроксида калия или натрия и количественно перенеси в колбу вместимостью 1000 мл. Объем раствора довести до метки и отфильтровать. Титр раствора определить по йодноватокислому калию.
Определение титра раствора 2,6-дихлорфенолиндофенола по йодноватокислому калию. В мерной колбе вместимостью 50 мл растворить 1 мг кристаллической аскорбиновой кислоты в 30 мл раствора 2%-ной серной кислоты и довести объем до метки тем же раствором кислоты. В две конические колбы для титрования отобрать по 5 мл приготовленного раствора аскорбиновой кислоты. Раствор в одной колбе оттитровать 0,001 н раствором 2,6-дихлорфенолиндофенолом до появления розового окрашивания, не исчезающего в течение 30 с. Во вторую колбу добавить несколько кристалликов йодида калия (около 1–2 мг), 5 капель 1%-го раствора крахмала и оттитровать 0,001 н раствором йодноватокислого калия до появления едва заметного синего окрашивания.
Исходя из того, что 1 мл 0,001 н раствора йодноватокислого калия, а следовательно, и 2,6-дихлорфенолиндофенола, эквивалентен 0,088 мг аскорбиновой кислоты, рассчитать титр раствора 2,6–дихлор-фенолиндофенола ( Т, мг/мл) по аскорбиновой кислоте по формуле
T = 0 , 088 × V 1 V 2 ,
где 0,088 – количество аскорбиновой кислоты, соответствующее 1 мл 0,001 н раствора йодноватокислого калия, мг/мл;
V 1 – объем 0,001 н раствора йодата калия, израсходованного на титрование раствора аскорбиновой кислоты, мл;
V 2 – объем раствора 2,6-дихлорфенолиндофенола, израсходованное на титрование, мл.
Источник
Исследовательская работа
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ УДМУРТСКОЙ РЕСПУБЛИКИ
Исследовательская работа
Тема: Количественное определение аскорбиновой
кислоты в различных растворах методом
йодометрического титрования
Выполнил Бельтюков Иван
ученик 11 А класса
Руководитель Машковцева
Ижевск 2013
Содержание:
2.1. История аналитической химии …………………………………. …4
2.2. Методика йодометрического титрования ………………. ………. 6
2.3. Витамин С – общая характеристика…………………………. …. 8
3. Экспериментальная часть ………………………………. …. 10
3.1 Методика определения содержания витамина С в растворах….10
3.2. Анализ содержания витамина С в соке мандарин……………. 12
1.Введение
Всем нам было интересно узнать из чего состоят продукты и как определить их состав. В настоящее время для определения количественного состава растворов придумано огромное множество методик, одной из которых является титрование. Существует огромное множество методов титрования, но основаны они на одном принципе – это расчет массы или объема исследуемого вещества благодаря реактивам, количественный состав которых известен.
В своей работе я собираюсь осветить метод йодометрического титрования с помощью которого возможно определить объем витамина С в продуктах, а так же крахмала и нескольких других добавок.
Потребность в витаминах зависит от его возраста, состояния здоровья, условий жизни, характера его деятельности, времени года, содержания в пище основных компонентов питания. Существует огромное количество витаминов, но остановим наше внимание на витамине С. Для нормального функционировании организма необходимо постоянное присутствие в нем витаминов, но не все они вырабатываются нашим телом.
Витамин С один главнейших витаминов, он является витамином над витаминами. При разных объемах аскорбиновой кислоты в теле она проявляет разные функции именно по этому нужно знать точную массу потребляемого витамина, но как же точно подсчитать массу? Об этом я расскажу в своем реферате.
Объект исследования:Расчет аскорбиновой кислоты.
Предмет исследования: Методика йодометрического титрования.
Гипотеза:Если в продуктах есть витамин С, то его можно количественно обнаружить при помощи метода йодометрического титрования.
Цель работы: Изучить метод йодометрического титрования и экспериментально выявить методику количественного определения витамина С.
Для реализации поставленной цели были поставлены следующие задачи:
1. Изучить литературу по данному вопросу;
2. Изучить методику йодометрического титрования;
3. Провести эксперимент, выявляющий количественное содержание витамина С;
4. Проанализировать результаты и выработать наиболее доступный способ йодометрического анализа;
5. Разработать практическую работу и комплекс рекомендаций по применению методики йодометрического титрования.
2. Основная часть
2.1. История аналитической химии.
Количественный анализ — это определение содержания составных частей сложного материала, результаты которого выражают в массовых долях (%), например, химически чистый сульфат меди CuSO4X5H2O содержит массовую долю меди 25,44%, а фосфоритная мука — промышленное удобрение — массовую долю Р2О5 от 20 до 30%. Исследования вещества всегда начинаются с его качественного анализа, т. е. из определения того из каких компонентов (или ионов) состоит это вещество. Если состав вещества известен, то сразу приступают к количественному анализу, предварительно выбрав наиболее подходящий метод.
Теоретические основы химического анализа составляют следующие законы и теоретические положения: периодический закон Д.И. Менделеева; закон действующих масс; теория электролитической диссоциации; химическое равновесие в гетерогенных системах; комплексообразование; амфотерность гидроксидов; автопротолиз (водородный и гидроксидный показатели); ОВР. Характеристику основных методов аналитической химии мы будем давать в процессе их изучения в разделе количественного анализа. Как мы уже говорили, в аналитической химии используются различные методы: химические, физические и физико-химические. Коротко дадим характеристику каждому типу методов. Химические методы основаны на превращениях, протекающих в растворах с образованием осадков, окрашенных соединений или газообразных веществ. Химические процессы, используемые в целях анализа, называют аналитическими реакциями. Аналитическими являются реакции, которые сопровождаются каким-нибудь внешним эффектом, позволяющим установить, что химический процесс связан с выпадение или растворением осадка, изменением окраски анализируемого раствора, выделением газообразных веществ. Требования к аналитическим реакциям и их особенности можно свести к следующим положениям:
Аналитическая реакция должна протекать быстро и полно при соблюдении определенных условий: температуры, реакции среды и концентрации обнаруживаемого иона. При выборе реакции обнаружения ионов руководствуются законм действующих масс и представлениями о химическом равновесии в растворах. При этом выделяются следующие характеристики аналитических реакций: селективность или избирательность; специфичность; чувствительность. Последняя характеристика связана с концентрацией обнаоуживаемого иона в растворе и если реакция удается при низкой концентрации иона, то говорят о высокочувствительной реакции.
Дробный и систематический анализ. Обнаружение ионов с помощью селективных и специфических реакций в отдельных порциях раствора, производимое в любой последовательности называют дробным анализом. Такой тип анализа широко применяется в агрохимических и заводских лабораториях. Когда состав анализируемого вещества хорошо известен и требуется проверить отсутствие или присутствие тех или иных примесей. Если же используемые реакции не селективны, а мешающее действие посторонних ионов устранить не удается, то в этом случае применяют т. н. систематический ход анализа т. е. определенную последовательность выполнения аналитических реакций, при которой каждый ион обнаруживают после того, как будут обнаружены и удалены мешающие ионы. В таком анализе применяются не только реакции обнаружения отдельных ионов, но и реакции отделения их друг от друга, используя различия в их растворимости или летучести. Полноту удаления мешающего иона проверяют в каждом случае специальной пробой.
Уже в древности могли проводить анализы лекарственных препаратов, металлических руд. Однако, как наука анал. химия начала складываться значительно позже — по мере развития производства. Английский ученый Роберт Бойль (1627 — 1691) считается основоположником качественного анализа, а гениальный русский ученый М.В. Ломоносов (1711-1765) является основателем химической науки в России, основоположником количественного анализа. Для аналитической химии важное значение имеет закон сохранения массы (1748), который гласит: «общая масса продуктов реакции равна общей массе веществ, вступивших в реакцию» — как частный случай закона сохранения материи — один из основных законов аналитической химии (в частности для расчетов в количественном анализе). Например, если из 100 г исходных продуктов получается 120 г новых продуктов, значит в реакции участвует ещё 20 г веществ из окружающей среды. Закон сохранения массы — основа стехиометрии и многих количественных законов химии, научное объяснение которой привело к созданию атомно-молекулярной теории. Стехиометрия включает вывод химических формул, составление уравнений химических реакций, расчеты, применяемые в химическом анализе. Термин ввел И. Рихтер (1792 — 94), обобщивший результаты своих определений масс кислот и оснований при образовании солей. Правила стехиометрии лежат в основе всех расчётов, связанных с уравнениями химических реакций. Бергман Торнберн Улаф, Клаус Карл Карлович, Севергин В. М.
2.2. Метод йодометрического титрования.
Титрование (от франц. titre – качество, характеристика) – один из методов количественного анализа, основанный на измерении количества реагента, который полностью реагирует с анализируемым веществом. Например, если точно известно, какое количество гидроксида калия (в граммах или молях) израсходовано в реакции с соляной кислотой, то по уравнению реакции
KOH + HCl = KCl + H2O
легко рассчитать, сколько граммов (или молей) хлороводорода было в анализируемом растворе.
Все реакции, которые используются в количественном анализе, обязательно должны быть стехиометрическими. Для этих реакций коэффициенты, стоящие перед формулами реагентов, показывают, в каких количественных соотношениях находятся реагенты и продукты. Например, соотношение реагентов в реакции окисления щавелевой кислоты перманганатом калия в кислой среде в точности соответствует уравнению
5H2C2O4 + 2KMnO4 + 3H2SO4 = 2MnSO4 + K2SO4 + 10CO2 + 8H2O.
Поэтому эту реакцию можно использовать для точного определения концентрации перманганата в растворе, если известно количество израсходованной щавелевой кислоты (и наоборот). А вот рассчитать точно количество прореагировавшего с перманганатом калия алкена невозможно, так как эта реакция нестехиометрическая: при окислении из алкена образуется диол:
R-CH=CH-R + 2[O] = R-CH(OH)-CH(OH)-R,
который может окисляться далее с разрывом углерод-углеродной связи и образованием двух молекул с карбонильной группой (кислоты или кетона). При этом разные опыты, даже проведенные в одинаковых условиях, дадут немного разное количество продуктов и их соотношение; в органической химии выход реакции очень редко бывает в точности равным 100,00%.
Чтобы анализ был точным, необходимо, помимо полного протекания реакции, чтобы реагент добавлялся к анализируемому веществу малыми порциями (например, по одной капле разбавленного раствора), а также чтобы можно было надежно определить момент, когда реакция закончилась. Для выполнения второго условия применяют различные индикаторы.
Индикаторы бывают самые разные. Рассмотрим реакцию питьевой соды с уксусом:
NaHCO3 + CH3COOH = CH3COONa + CO2 + H2O.
Из этого уравнения следует, что 1 моль соды (84 г) полностью реагируют с 60 г уксусной кислоты. При этом выделяются пузырьки углекислого газа, которые и могут служить индикатором. Если к гидрокарбонату натрия известной массы добавлять по каплям уксус, пока не перестанет выделяться газ, то, измерив объем добавленного раствора и зная его плотность, легко рассчитать количество чистой уксусной кислоты в добавленном растворе и, следовательно, концентрацию уксуса.
Титрование на глаз выделяется далеко не во всех химических реакциях, да и заметить последний пузырек газа непросто, особенно если газ частично растворяется, а раствор имеет темную окраску. Поэтому обычно используют специальные индикаторы, изменение цвета которых свидетельствует о достижении конца реакции – так называемой точки эквивалентности.
Одни из самых распространенных индикаторов – кислотно-щелочные. Они применяются в тех случаях, когда в ходе титрования, т.е. постепенного добавления реагента к анализируемому раствору изменяется рН среды. Это происходит, например, если к анализируемому раствору щелочи добавляют раствор кислоты (или наоборот). Анализируемый раствор готовят по объему или по навеске (ее взвешивают на точных аналитических весах обычно до 0,1 мг), которую растворяют в мерной колбе точно известного объема (такие колбы могут иметь объем 10, 25, 50, 100, 200, 250, 500 или 1000 мл). Небольшой объем анализируемого раствора отбирают из мерной колбы с помощью специальных мерных пипеток (их объем также определен с высокой точностью и составляет обычно 10, 20, 25 и 50 мл) и помещают в коническую колбочку для титрования. В эту колбочку по каплям при непрерывном перемешивании добавляют раствор реагента из бюретки до достижения точки эквивалентности.
Йодометрия — представляет один из изящных приемов объемного (титрования) анализа. Сюда отнесены все те приемы анализа которые так или иначе сводятся к количественному определению йода объемным путем. Вещества, анализ которых входит в круг этого рода определений, вообще говоря, можно разделить на две категории:
1) Работа с растворами I- содержащих веществ: йод и те вещества, которые выделяют его из KIили непосредственно, как, например, хлор, бром, или косвенным путем, как, напр., К 2 СrO 4 с HJО 4 или КСlO 3 с НCl и пр.; 2) соединения, которые окисляются в присутствии йода: SO 2, Аs 2O3 и прочие.
Йодометрический анализ витамина С относится к окислительному методу титрования, и, поэтому, выполняется по общим правилам выполнения подобных методов.
2.3. Витамин С – общая характеристика
Аскорбиновая кислота по вкусу напоминает лимонную кислоту и по своему внешнему виду представляет бесцветные кристаллы, растворимые в воде и спирте и нерастворимые в жирах и их растворителях. По химическому строению аскорбиновая кислота имеет родственную связь с сахаром. Существует несколько форм аскорбиновой кислоты, одна из которых, наиболее биологически активная, и является витамином С.
Рис. 1 Молекула и химическая формула аскорбиновой кислоты.
Аскорбиновая кислота хорошо растворяется в воде, но крайне нестойка и легко разрушается на свету кислородом воздуха, а также в присутствии железа и меди; более устойчива в кислотной среде, чем в щелочной.
Аскорбиновая кислота весьма чувствительна к повышению температуры, при нагревании ее раствора до 50оС при доступе воздуха она очень быстро разрушается. В сухом виде аскорбиновая кислота устойчива.
Впервые в чистом виде витамин С был выделен в 1928 году, а в 1932 году было доказано, что именно отсутствие аскорбиновой кислоты в пище человека вызывает такое заболевание, как цинга.Тяжкие страдания мореплавателей и путешественников, гибель полярных экспедиций были результатом дефицита аскорбиновой кислоты. Но лишь в 30-хгг. XXв. удалось выяснить, каково строение антицинготного фактора, который получил название «витамин С».
Витамин С, пожалуй, самый известный из витаминов. Он стимулирует рост, участвует в процессах тканевого дыхания, обмене аминокислот, способствует усвоению углеводов. Аскорбиновая кислота повышает сопротивляемость организма к инфекциям, интоксикациям химическими веществами, перегреванию, охлаждению, кислородному голоданию, одна из важнейших функций витамина С — синтез и сохранение коллагена — белка, который «цементирует» клетки и тем самым служит основой образования соединительных тканей. Коллаген скрепляет сосуды, костную ткань, кожу, сухожилия, зубы. Витамин С нормализует уровень холестерина в крови, способствует усвоению железа из пищи, требуется для нормального кроветворения, влияет на обмен многих витаминов. Важнейшая функция витамина С — антиоксидантная. Он противодействует токсическому действию свободных радикалов — агрессивных элементов, образующихся в организме при многих отрицательных воздействиях и заболеваниях. Аскорбиновая кислота участвует в выработке адреналина — гормона «боеготовности», увеличивающего частоту пульса, кровяное давление, приток крови к мускулам.
В организме человека аскорбиновая кислота не образуется. Суточная потребность в витамине С — 70-100 мг. Потребность в аскорбиновой кислоте повышается в условиях неблагоприятного климата. Так, в Антарктиде человеку нужно ежедневно принимать 250мг витамина С. При большой мышечной нагрузке, стрессовых ситуациях, большинстве заболеваний нужно увеличить его потребление.
3.Экспериментальная часть
3.1. Методика исследования и подготовка растворов
Перед началом эксперимента необходимо выбрать способ йодометрического титрования, собрать титровальную установку и приготовить растворы.
Для отладки способа используем вещества, содержание витамина С в которых нам известно. Для этого я использовал медицинскую аскорбиновую кислоту, содержание витамина С в которой 75 мг/таблетка.
Раствор для анализа был приготовлен из 0,56% таблетки и 100 мл дисцилированной воды, а раствор йода – 1 мл 5% настойки на 40 мл воды. При проведении титрования будет необходимо замерять объемы «уходящих» на титрование веществ. Рассмотрим методики (результаты см, в таблице №1):
1 методика (самый простой и доступный ист. 10):
Определение ведется главным образом при помощи серноватисто-натриевой соли Na 2S2O3, причём индикатором служит крахмал, который, как известно, дает со свободным йодом синее окрашивание.
На практике, данный способ оказался достаточно сложным к применению, так как легко пропустить точку титрования (точки, при которой происходит взаимодействие витамина С с йодом).
2 метод (ист. 10 доработанный):
Исключим из опыта крахмал.
Приготовим новую смесь с первоначальными отношениями и в раствор с витамином С прильем йод и дальнейшее титрование проведем до обесцвечивания раствора аскорбиновой кислоты с йодом при помощи тиосульфата натрия.
После обесцвечивания определим среду при помощи индикаторной бумаги, приготовленной Ерохиным Сергеем. Она показала кислотную среду. Разберемся почему.
При добавлении йода к аскорбиновой кислоте произошла окислительно-восстановительная реакция(1):
C6H8O6 + I2 = C6H6O6 + 2HI
C6H8O6 – 2e = C6H6O6
При добавлении тиосульфата так же произошла окислительно-востановительная реакция, протекающая по уравнению (2):
I2 + 2Na2S2O3 = Na2S4O6 + 2NaI
Na2S2O3 – e = Na2S4O6
Следовательно после обесцвечивания раствора в нем отсутствует йод в чистом виде, а значит теперь мы можем провести щелочное титрование, используя индикатор приготовленный Ерохиным Сергеем.
В итоге происходит полная нейтрализация йодоводородной кислоты щелочью:
NaOH+ HI= NaI+ H2O
Сокращенное ионное уравнение:
Индикатор не подвел и показал изменения среды. Необходимые данные получены, дальнейшие просчеты будут в таблице для сравнения.
3 способ, родившийся во время проведения 2 опыта:
Использования в титровании лишь раствора витамина С и раствора йода в первоначальных отношениях.
Производим титрование раствора аскорбиновой кислоты раствором йода. Происходит обесцвечивание титрирующей смеси. Когда капля йода упавшая в колбу с анализируемой жидкостью и окрасит ее, то точка титрования будет достигнута.
Реакции будут происходить по уравнению 1.
Таблица №1, результаты использования методик 1-3.
Источник