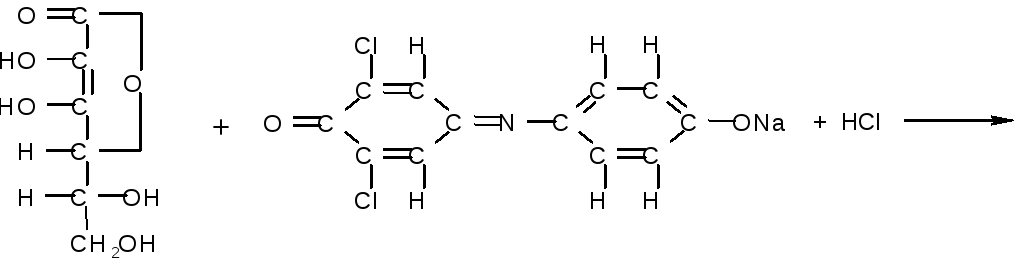
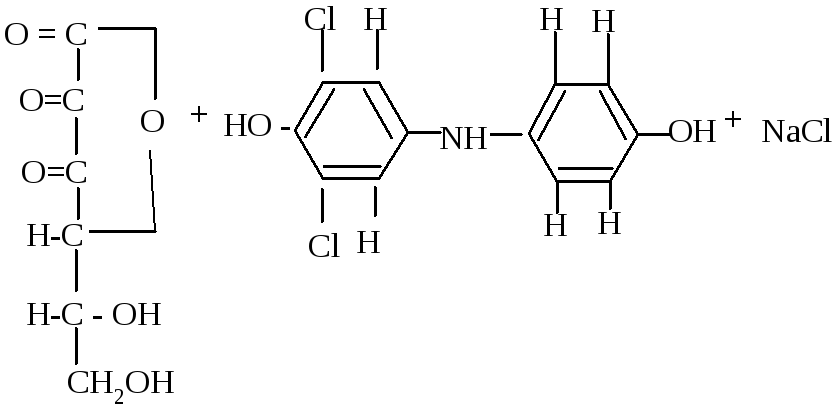
Лабораторная работа № 4 Количественное определение витамина с (аскорбиновой кислоты) в пищевых продуктах и в моче по методу Тильманса
В настоящее время существуют методы определения витамина С и его производных в крови, тканях, слюне, пищевых продуктах и фармакопейных препаратах.
Может быть использовано спектрофотометрическое определение, использование капиллярного электрофореза, поточно-флюоресцентного метода и определение с помощью высокоэффективной жидкостной хроматографии.
Одним из наиболее широко распространенных методов количественного определения витамина С является оксидометрический метод, основанный на способности аскорбиновой кислоты (АК) восстанавливать 2,6-дихлорфенол, который при этом переходит в бесцветную лейкоформу. Этот метод определяет только восстановленную форму АК. С его помощью можно получить сведения о содержании витамина С в пищевых продуктах, а также в к сыворотке крови и других биологических тканях, и на основе полученных данных судить об обеспеченности им организма .
В гигиенических исследованиях использование данного метода позволяет контролировать сохранность витамина С в пищевых продуктах в зависимости от способов и сроков хранения, характера технологической и, в частности, кулинарной обработки пищи, позволяет выявить изменения в обмене витамина С при воздействии химических веществ на организм в производственных условиях .
Исследуемый материал: 1. Хвоя; 2. Картофель сырой и варёный; 3. Капуста квашеная и свежая; 4. Моча.
Реактивы и оборудование: 1. Натриевая соль 2,6-дихлорфенолиндофенол 0,001 Н раствор; 2. Хлороводород 10% раствор; 3. Весы и разновесы; 4. Мер-ные цилиндры на 50 и 10 мл; 5. Пипетки на 1 мл; 6. Фарфоровые ступки с
пестиками; 7. Микробюретки; 8. Стеклянные палочки; 9. Колбочка или широкие пробирки; 10. Бюретки; 11. Скальпель; 12. Воронки; 13. Вата.
Принцип метода: определение витамина С основано на его сильной редуцирующей способности.
При определении используют окислительно-восстановительную реак-цию между аскорбиновой кислотой и 2,6-дихлорфенолиндофенолом (2,6-ДХФИФ) — краской Тильманса в кислой среде. Раствор 2,6-ДХФИФ в нейт-ральной среде окрашен в синий цвет. Пока в растворе есть аскорбиновая кис-лота, названный реактив восстанавливается ею и при этом обесцвечивается. После окисления им всей аскорбиновой кислоты избыток реактива окраши-вает раствор в кислой среде в слабо розовый цвет. При появлении окраски титрование прекращают и замечают количество раствора 2,6-ДХФИФ, затра-ченного на титрование.
Витамин С (восстанов- 2,6 -ДХФИФ
ленная форма) (окисленная форма)
Витамин С (окисленная форма) 2,6-ДХФИФ (восстановленная форма)
Определение содержания витамина «с» в хвое и свежей капусте.
Хвоя и капуста содержат большое количество витамина С, поэтому для его определения нужно брать лишь небольшую часть исследуемого материала.
Приготовление вытяжки: Хвою или свежую капусту отвешивают на весах в количестве 1,0 г и тщательно измельчают в фарфоровой ступке с 2 мл 10% раствора хлорводорода. Растертую массу осторожно, без потерь (палочкой) переносят в мерный цилиндр (на 40 мл для хвои и на 10 мл для капусты, ступку и пестик обмывают 10% раствором соляной кислоты и промывную жидкость присоединяют к общей порции вытяжки. Объем жидкости в цилиндре доводят дистиллированной водой до метки 40 мл для хвои и до метки 10 мл для свежей капусты. Содержимое цилиндра перемешивают и оставляют стоять 10 мин. Не встряхивая, вытяжки филь-труют через ватный фильтр и 1 мл фильтрата употребляют для титрования.
Титрование: в колбочку отмеривают пипеткой 1 мл фильтрата и прибавляют к нему 19 мл воды. Содержимое титруют из микробюретки
0,001 Н раствором 2,б-ДХФИФ до появления слабо розового окрашивания, не исчезающего в течение 30 с. Вычисляют содержание витамина С в 100 г хвои или свежей капусты.
Расчет: молекулярная масса аскорбиновой кислоты равна 176. Находят грамм-эквивалент аскорбиновой кислоты. В реакции с 2,6-ДХФИФ она двухосновная, следовательно, грамм-эквивалент равен М/2=176/2=88 г, а 1 мл 0,001 Н раствора 2,6-ДХФИФ соответственно равен 0,088 г аскорбиновой кислоты. Количество миллилитров 2,6-ДХФИФ, затраченного на титрование исследуемого раствора, эквивалентно содержанию витамина С в титруемой жидкости. Расчет содержания витамина С (Х) в 100 г хвои или капусты проводится по следующей формуле:
Х==0,088 . а . с . 100/(b . d),
где а — объем раствора 2,6-ДХФИФ, пошедшего на титрование; d – взятая навеска хвои или свежей капусты; с — общий объем вытяжки; b — объем водной вытяжки, взятой для титрования (1 мл).
Источник
БЕССЕЯ МЕТОДЫ
БЕССЕЯ МЕТОДЫ (О. A. Bessey) — количественные методы определения содержания витамина A и каротиноидов в сыворотке крови, витамина C — в лейкоцитах, а также активности щелочной и кислой фосфатаз в сыворотке крови.
Определение витамина A и каротиноидов в сыворотке крови
Определение витамина А и каротиноидов в сыворотке крови (в модификации А. А. Анисовой). Метод основан на щелочном гидролизе эфиров витамина, экстракции витамина А и каротина с последующим спектрофотометрическим измерением поглощения света раствором до и после разрушения витамина А ультрафиолетовыми лучами.
В норме содержание витамина А в сыворотке крови колеблется от 30 до 70 мкг%, а каротина — от 80 до 230 мкг%. Понижение содержания витамина А в крови описано при гипертиреозе, язвенной болезни желудка и двенадцатиперстной кишки. Оно сочетается с нормальным или несколько повышенным уровнем каротина (обычно чем ниже уровень витамина А, тем выше уровень каротина в крови). Эта каротинемия, по некоторым сведениям, связана с вовлечением в патологический процесс печени и является признаком, указывающим на тяжесть заболевания. При тяжелых общих заболеваниях (рак, туберкулез, инфекции) нарушается способность печени депонировать витамин А, увеличивается проницаемость почек и усиливается уже имеющийся гиповитаминоз.
Содержание витамина в крови понижается также при паренхиматозных поражениях печени и не меняется при обтурационной желтухе. Повышение уровня витамина А в крови обычно имеет место при гипотиреозе, болезни Иценко — Кушинга и некоторых других состояниях.
Техника определения. В центрифужную пробирку берут 1 мл крови (из пальца) и центрифугируют 10 мин. при 3000 об/мин; 0,12 мл сыворотки крови переносят в пробирку, добавляют такое же количество 1 н. спиртового раствора едкого кали, перемешивают и ставят для гидролиза в водяную баню на 20 минут при t° 60 °. Пробирки охлаждают в течение 5—10 минут (на льду), добавляют в каждую по 0,12 мл кси-лол-лигроиновой или ксилол-октановой смеси (1 : 1) для экстрагирования витамина. Затем пробирки вновь охлаждают и центрифугируют 8—10 мин. Верхний слой (ксилол-лигроиновый или ксилол-октановый экстракт, содержащий витамин А и каротиноиды) переносят в кварцевую микрокю-вету; в контрольную микрокювету наливают чистую ксилол-лигроиновую или ксилол-октановую смесь. Определение каротиноидов проводят при длине волны 460 нм, определение витамина А — путем двукратного измерения оптической плотности раствора при длине волны 328 нм (до и после облучения проб ультрафиолетовыми лучами). Исследуемые пробы облучают ультрафиолетовым светом с длиной волны 310—410 нм в течение 45—60 минут.
Расчет. Содержание каротиноидов вычисляют по формуле:
где X — искомое содержание каротиноидов в микрограмм-процентах; 480 — коэффициент Бессея для каротина; E460 — оптическая плотность раствора каротина.
Содержание витамина А вычисляют по формуле:
где X — искомая величина (в мик-рограмм-процентах); 637 — коэффициент Бессея для витамина А; E1— оптическая плотность раствора витамина А до облучения, а Е2 — после облучения.
Определение витамина С в лейкоцитах
Определение витамина С в лейкоцитах (в модификации А. А. Анисовой). Метод основан на выделении лейкоцитов и экстракции из них витамина С с последующим спектрофотометрическим определением содержания последнего.
В норме в лейкоцитах содержится от 20 до 30 мг% аскорбиновой кислоты.
При оценке получаемых значений аскорбиновой кислоты следует учитывать, что снижение ее содержания в лейкоцитах при недостаточном поступлении с пищей наступает позднее, чем в моче и плазме крови. Высокий уровень витамина С в лейкоцитах сохраняется при содержании его в крови не ниже 0,2 мг%. Клиническое значение витамина С — см. Аскорбиновая кислота.
Техника определения. В коническую пробирку с 0,5 мл 3,8% раствора цитрата натрия вносят 0,2 мл крови (из пальца), перемешивают и ставят на 5—7 минут на холод. Затем центрифугируют в течение 1,5—2 часов при 150—200 об/мин. Пастеровской пипеткой осторожно отсасывают верхний жидкий (мутный) слой, содержащий взвесь элементов крови, переносят в другую пробирку и центрифугируют 10 минут при 2500—3000 об/мин. Надосадочную жидкость удаляют, а к осадку, состоящему из лейкоцитов, прибавляют 0,04 мл 5% раствора трихлор-уксусной к-ты и замораживают. Через 5—7 минут пробирку вынимают, размораживают в струе холодной воды (для разрушения стромы лейкоцитов и более полной экстракции витамина С) и центрифугируют 10 мин. при 2500—3000 об/мин. Отбирают микропипеткой 0,03 мл раствора, содержащего витамин С, добавляют 0,01 мл комбинированного реактива (100 объемных частей 2,2% раствора динитрофенилгидразина в 10 н. растворе серной кислоты, 5 частей 5% водного раствора тиомочевины и 5 частей 0,6% раствора CuSo4·5H2O в 0,1 н. растворе серной кислоты). Пробирку (закрытую притертой пробкой) помещают на 4 часа в термостат при t° 38°, затем в пробирку вносят 0,05 мл охлажденного 65% раствора серной кислоты и через 20 минут фотометрируют на спектрофотометре при длине волны 520 нм.
Расчет содержания аскорбиновой кислоты производят по калибровочным кривым, составленным для чистой аскорбиновой кислоты.
Определение активности фосфатаз в сыворотке крови
Определение активности щелочной (К.Ф.3.1.3.1) и кислой (К. Ф. 3.1.3.2) фосфатаз в сыворотке крови [по Бессею — Лаури — Броку (О. A. Bessey, О. Н. Lowry, М. J. Brock, 1946)]. В основу метода положена способность фосфатаз гидролизовать эфирную связь в п-нитрофенилфосфате, с освобождением п-нитрофенола, дающего в щелочной среде желтое окрашивание. Интенсивность последнего характеризует степень активности ферментов.
Определение активности фосфатаз успешно применяют для дифференциальной диагностики заболеваний печени, костной системы и предстательной железы. Значительное повышение активности щелочной фосфатазы в случаях заболевания печени отмечено при механических желтухах, при острых гепатитах, холангитах, циррозах и особенно при желтой атрофии печени. Умеренная гиперфосфатаземия является одним из ранних спутников метастазов злокачественных новообразований. Увеличение фосфатазной активности характерно для рахита, причем степень активности обычно соответствует тяжести заболевания. Значительное повышение активности щелочной фосфатазы обнаруживается при остеомаляции, при болезни Педжета, при гиперпаратиреоидизме и других заболеваниях костной системы.
Определение активности кислой фосфатазы в сыворотке крови используется для диагностики заболеваний предстательной железы, и в частности рака, когда происходит резкое повышение ее активности. Кроме того, по изменению активности кислой фосфатазы можно судить об эффективности терапевтического применения эстрогенов.
Техника определения. В пробирки вносят по 1 мл соответствующих субстратно-буферных растворов (0,05 М глициновый буфер и 5,5·10 -3 М раствор п-нитрофенилфосфата, pH 10,5 — для щелочной фосфатазы и 0,05 М цитратный буфер, 5,5·10 -3 М раствор п-нитрофе-нилфосфата, pH 4,8 — для кислой фосфатазы). Затем содержимое пробирок прогревают в термостате 5—10 минут при t° 37°; в опытные пробирки добавляют сыворотку (в пробу на щелочную фосфатазу 0,1 мл, на кислую 0,2 мл), перемешивают и инкубируют 30 минут при t 37°. После инкубации в пробу на щелочную фосфатазу добавляют 10 мл 0,02 н. раствора едкого натра, а в пробу на кислую фосфатазу — 4 мл 0,1 н. раствора NaOH; перемешивают и фотоколориметрируют при длине волны 405 нм (390—420 нм) в кювете с толщиной слоя 1 см против соответствующего контроля. Контроль ставят для каждой сыворотки. Расчет. Активность фермента выражают либо количеством микромолей п-нитрофенола, освободившихся под влиянием 1 мл сыворотки крови за 1 минуту при t° 37°, либо в условных единицах (количество фермента, которое освобождает 0,05 микромолей п-нитрофенола в условиях опыта).
Библиография: Биохимия и физиология витаминов, Методы определения витаминов, пер. с англ., под ред. H. М. Сисакяна и др., сб. 4, М., 1951; Биохимические методы исследования в клинике, под ред. А. А. Покровского, с. 162 и др., М., 1969.
Источник
АСКОРБИНОВАЯ КИСЛОТА
Аскорбиновая кислота (Acidum ascorbinicum; синоним витамин C) — органическое соединение, относящееся к витаминам и содержащееся в большинстве растений. Отсутствие его в пище вызывает развитие специфического заболевания — цинги (см.), а недостаточность приводит к развитию гиповитаминоза.
В 1923—1927 годы Зильва (S. S. Zilva) впервые выделил из лимонного сока вещество с сильным антискорбутным свойством. Он же установил основные свойства этого вещества. В 1930—1933 годы Тилльманс (J. Tillmans) показал обратимое окисление этого вещества. В 1928—1933 годы Сент-Дьёрдьи (А. Szent-Györgyi) выделил в кристаллическом виде из надпочечников быка, а также из капусты и паприки вещество, названное им «гексуроновой кислотой», получившей затем название «аскорбиновая кислота». Оно оказалось идентичным с антискорбутным веществом Зильвы.
Аскорбиновая кислота является производным L-гулоновой кислоты (2-3-эндиол-L-гулоно-1,4-лактон). Наиболее активной формой является L-аскорбиновая кислота. Эмпирическая формула C6H8O6, структурная формула:
Молекулярный вес аскорбиновой кислоты —176,1. Удельное вращение в воде —[а]20D + 23°; t°пл 192°. Это одноосновная кислота с константой диссоциации pKa —4,25 в воде. В сильно кислой среде аскорбиновая кислота обладает максимумом поглощения при 245 нм, сдвигающимся к 365 нм в нейтральной среде и к 300 нм в щелочной. В чистом виде аскорбиновая кислота представляет собой белые кристаллы кислого вкуса, стойкие в сухом виде и быстро разрушающиеся в водных растворах.
1 г аскорбиновой кислоты растворяется в 5 мл воды, 25 мл этилового спирта или 100 мл глицерина. Аскорбиновая кислота нерастворима в бензоле, хлороформе, эфире, петролейном эфире и жирах. Аскорбиновая кислота реагирует с катионами металлов, образуя аскорбинаты с общей формулой C6H7O6M. Аскорбиновая кислота легко окисляется кислородом воздуха. Окисление аскорбиновой кислоты ускоряется в нейтральных и щелочных растворах. Оно катализируется светом, ионами меди, железа, серебра и ферментами растений: аскорбиноксидазой и полифенолоксидазой. При окислении аскорбиновая кислота переходит в дегидроаскорбиновую кислоту, обладающую столь же высоким С-витаминным действием, что и аскорбиновая кислота. Дегидроаскорбиновая кислота быстро восстанавливается в тканях. Она не содержит конъюгированной системы и не обнаруживает поглощения в ультрафиолете. Наряду с аскорбиновой кислотой и дегидроаскорбиновой кислотой в растительных продуктах встречается связанная с белком форма Аскорбиновая кислота — аскорбиген,— устойчивая к окислению. При необратимом окислении дегидроаскорбиновая кислота после раскрытия лактонового кольца при pH более 4 переходит в 2,3-дикетогулоновую кислоту, а затем в щавелевую и омгреоновую кислоту. Окисление аскорбиновой кислоты задерживается тиосульфатом, тиомочевиной, тиоацетатами, флавоноидами, о-дифенолами, метафосфорной кислотой, кислыми полисахаридами и др. Большинство белков и аминокислот также задерживает окисление аскорбиновой кислотой путем образования комплексов либо с самой аскорбиновой кислотой, либо с медью. Аскорбиновая кислота легко восстанавливает азотнокислое серебро, растворы брома, йода и 2,6-дихлорфенолин-дофенола. Аскорбиновая кислота настолько эффективна в качестве восстановителя, что нашла широкое применение в аналитической химии при определении ряда минеральных элементов и в полярографических исследованиях большого числа веществ, в частности урана и других соединений. Аскорбиновая кислота широко распространена в природе (см. таблицу). Она содержится в растениях, главным образом в восстановленной форме. Из органов животных богаты аскорбиновой кислотой надпочечники, гипофиз, хрусталик, печень. При кулинарной обработке теряется в среднем до 50% аскорбиновой кислоты. Еще больше теряется при стоянии готовых блюд. Ряд стабилизаторов, находящихся в белке яиц, мясе, печени, крупах, твороге, крахмале, поваренной соли, способствует сохранению аскорбиновой кислоты при приготовлении пищи. Длительному сохранению аскорбиновой кислоты способствуют: квашение, замораживание, дегидратация, баночное консервирование, варка ягод и фруктов с сахаром (см. также Витаминизация пищевых продуктов).
Аскорбиновую кислоту получают синтетически из D-глюкозы, восстанавливаемой в D-сорбит, который затем переводится с помощью бактериального синтеза в D-сорбозу, 2-оксо-L-гулоновую к-ту и L-аскорбиновую кислоту. Хорошим стабилизатором аскорбиновой кислоты является сульфит натрия, используемый при приготовлении ампульных растворов. Единственным антагонистом аскорбиновой кислоты является глюкоаскорбиновая кислота.
Все растения и многие животные синтезируют аскорбиновую кислоту, за исключением человека, обезьяны, морской свинки, индийской плодовой летучей мыши (Pteropus medius) и краснозадого бульбуля (Pycnonotus cafer Linn.) — птицы из отряда Passeriformes, вследствие отсутствия у них ферментов D-глюкуроноредуктазы и L-гулоно-гамма-лактон-O2-оксидоредуктазы, возможно, из-за врожденного генетического дефекта.
Поступившая в организм человека аскорбиновая кислота всасывается в тонком кишечнике. Общее количество аскорбиновой кислоты в организме здорового человека 3— 6 г. В плазме крови содержится 0,7—1,2 мг% , в лейкоцитах 20—30 мг% . Ряд оксидаз (аскорбиноксидаза, цитохромоксидаза, Пероксидаза, лак-таза и др.) прямо или косвенно катализирует окисление аскорбиновой кислоты. Синтез аскорбиновой кислоты в животном организме происходит из D-глюкуронолакто-на. Механизм действия аскорбиновой кислоты окончательно еще не расшифрован. Она играет важную роль в гидроксилировании пролина в оксипролин коллагена, участвует в окислении аминокислот ароматического ряда (тирозина и фенилаланина), а также в гидроксилировании триптофана в 5-окситриптофан в присутствии ионов меди. Аскорбиновая кислота участвует в биогенезе кортикостероидов, оказывает защитное действие на пантотеновую и никотиновую кислоты и способствует ферментативному превращению фолиевой кислоты в фолиновую. У видов, не синтезирующих аскорбиновую кислоту (человек, морская свинка), как и у способных к его биосинтезу, аскорбиновая кислота оказывает экономизирующее действие в отношении витаминов B1, B2, A, E, фолиевой кислоты, пантотеновой кислоты, уменьшая расходование, то есть снижает потребность в них. Этот эффект, по-видимому, связан с редуцирующими и антиоксидатными свойствами аскорбиновой кислоты.
Суточная потребность человека в аскорбиновой кислоте — см. Витамины.
Препараты аскорбиновой кислоты применяют для профилактики и лечения C-витаминной недостаточности, а также при повышенной физиологической потребности организма в аскорбиновой кислоте (во время беременности и лактации, при повышенной физической нагрузке, усиленном умственном и эмоциональном напряжении).
В лечебных целях аскорбиновую кислоту используют в комплексной терапии инфекционных заболеваний и разного вида интоксикаций, при заболеваниях печени, нефропатии беременных, при болезни Аддисона, при вяло заживающих ранах и переломах костей, при заболеваниях желудочно-кишечного тракта (ахилия, язвенная болезнь и др.), при атеросклерозе. Аскорбиновую кислоту назначают для профилактики кровотечений при лечении антикоагулянтами.
Назначают аскорбиновую кислоту внутрь (после еды), внутримышечно и внутривенно. Лечебные дозы для взрослых составляют при приеме внутрь 0,05—0,1 г 3— 5 раз в день; парентерально аскорбиновую кислоту вводят в виде 5% раствора от 1 до 5 мл. Детям назначают внутрь по 0,05—0,1 г 2—3 раза в день; парентерально 1—2 мл 5% раствора. Сроки лечения зависят от характера и течения заболевания.
При длительном применении высоких доз аскорбиновой кислоты следует следить за функцией поджелудочной железы, почек, а также за артериальным давлением, так как имеются отдельные наблюдения, свидетельствующие о том, что продолжительный прием значительных количеств аскорбиновой кислоты вызывает угнетение инсулярного аппарата поджелудочной железы, способствует развитию почечного диабета и может повышать артериальное давление.
Необходимо соблюдать осторожность при назначении максимальных доз аскорбиновой кислоты при внутривенном введении в случаях повышенной свертываемости крови, при тромбофлебитах и склонности к тромбозам.
Формы выпуска: порошок, драже по 0,05 г, таблетки по 0,025 г с глюкозой, таблетки по 0,05 г и по 0,1 г; ампулы, содержащие 1 и 5 мл 5% раствора. Кроме того, аскорбиновая кислота входит в состав различных поливитаминных препаратов.
Сохраняют в хорошо укупоренной таре, предохраняющей от действия света и воздуха.
Методы определения аскорбиновой кислоты
Методы определения аскорбиновой кислоты зависят от объекта исследования, концентрации аскорбиновой кислоты в объекте, наличия в объекте веществ, мешающих определению, и пр. Объектами исследования могут быть органы и ткани животных, биологические жидкости (кровь, моча и др.), растительные продукты (овощи, фрукты и пр.), готовая пища, медицинские препараты аскорбиновой кислоты. В перечисленных объектах аскорбиновой кислоты находится как в восстановленной, так и в окисленной форме (дегидроаскорбиновая кислота), которая может образоваться, например, при обработке и хранении пищевых продуктов. Поэтому ее также необходимо определять.
Основные этапы определения аскорбиновой кислоты следующие:
1) получение материала;
2) хранение полученного материала;
3) экстрагирование аскорбиновой кислоты из образца;
4) освобождение полученного экстракта от примесей, мешающих определению аскорбиновой кислоты;
5) определение количества аскорбиновой кислоты.
Аскорбиновая кислота легко разрушается, и поэтому обеспечение ее сохранности весьма существенно для любого метода исследования. Разрушение аскорбиновой кислоты усиливается под влиянием солнечного освещения, аэрации, повышения температуры и увеличения pH среды. Чем меньше содержание аскорбиновой кислоты в анализируемом объекте, тем больше трудностей при ее определении. Некоторые из методов, например, определение аскорбиновой кислоты в крови и моче, имеют ценность для распознавания степени обеспеченности организма человека аскорбиновой кислотой. При взятии материала из исследуемого объекта необходимо создать условия для максимального сохранения аскорбиновой кислоты в полученной пробе.
Например, исследуя кровь, нужно взять ее без гемолиза. При необходимости нужно создать такие условия хранения материала, которые уменьшают или исключают инактивацию аскорбинвой кислоты (холод, добавление консервантов и т. д.). Экстрагирование проводят при pH не менее 4, предварительном связывании ионов металлов, катализирующих окисление аскорбиновой кислоты, и инактивации ферментов, окисляющих аскорбиновую кислоту. Для экстрагирования применяют растворы уксусной, трихлоруксусной, щавелевой и метафосфорной кислот. Наиболее предпочтительна 5—6% метафосфорная кислота, хорошо стабилизирующая
Аскобиновая кислота, осаждающая белки и инактивирующая в сырых растительных объектах фермент аскорбиназу. Освобождение от примесей, мешающих определению, проводят с помощью осаждения последних, а также с использованием различных методов хроматографии (на бумаге тонкослойной, ионообменной).
Для количественного определения содержания аскорбиновой кислоты в биологических материалах предложен ряд методов. Так, определение аскорбиновой кислоты в моче проводят методом Тилльманса, в основе которого лежит способность аскорбиновой кислоты восстанавливать некоторые вещества, в частности 2,6-дихлорфенолиндофенол. Для этого анализируемую пробу титруют 0,001 н. раствором натриевой соли 2,6-дихлорфенолиндофенола до прекращения обесцвечивания окраски раствора. Этот же принцип лежит в основе определения аскорбиновой кислоты в плазме крови (см. Фармера-Абт метод). При количественном определении в лейкоцитах применяют метод Бессея (см. Бессея методы). Метод достаточно точен и требует для анализа крайне незначительного количества биологического материала (0,2 мл цельной крови).
При исследовании продуктов, содержащих так называемые редуктоны, которые вступают в соединение с 2,6-дихлорфенол индофенол ом (сиропы, компоты, сушеные овощи, фрукты и др.), лучше всего применять обработку экстракта формальдегидом [Шиллингер (A. Schillinger), 1966]. При анализе объектов, содержащих естественные пигменты (красители), чаще применяют титрование 2,6-дихлорфенолиндофенолом в присутствии органического растворителя (хлороформа, ксилола, изоамил ацетата и др.), экстрагирующих избыток красителя. При определении аскорбиновой кислоты в окрашенных фруктовых и ягодных соках применяют амперометрическое титрование. Конечную точку титрования аскорбиновой кислоты 2,6-дихлорфенолиндофенолом определяют по изменению потенциала — потенциометрически [Харрис, Марсон (L. J. Harris, L. W. Marson) и др., 1947] либо по появлению поляризационного тока — амперометрически [Харлампович, Возньяк (Z. Charlampowicz, W. Woznjak) и др., 1969]. Этот метод достаточно точен.
Для определения дегидроаскорбиновой кислоты ее восстанавливают в аскорбиновую кислоту с последующим титрованием 2,6-дихлорфенол индофенолом. Для восстановления применяют сероводород [Тилльманс (J. Tillmans) и др., 1932]. Однако сероводород не полностью восстанавливает дегидроаскорбиновую кислоту. Лучшие результаты получают при ее восстановлении сульфгидрильными соединениями (гомоцистеин, цистеин, 2,3-димеркаптопропанол).
Кроме биологического и окислительно-восстановительных методов определения аскорбиновой кислоты, используют методы, которые основаны на цветных реакциях с аскорбиновой кислотой или продуктами ее окисления.
Этими методами проводят определение аскорбиновой кислоты, дегидроаскорбиновой и дикетогулоновой кислот. Наиболее распространен метод, предложенный в 1948 году Роу (J. Н. Roe) и другими, с применением 2,4-динитрофенил гидразина. Дикетогулоновая кислота, получаемая в ходе анализа при окислении дегидроаскорбиновой кислоты, образует озазоны, имеющие оранжевую окраску. Озазоны растворяют в кислотах (серной, уксусной и смесях соляной и фосфорной кислот) и с помощью фотоколориметрирования измеряют оптическую плотность растворов. Наилучшие условия: температура раствора 37°, время проведения реакции — 6 часов.
Определение аскорбиновой кислоты проводится также с использованием меченых изотопов, флюориметрическим методом и др.
Аскорбиновая кислота в синтетических препаратах определяется титрованием 0,1 н. раствора йодата калия, 1 мл которого эквивалентен 0,0088 г аскорбиновой кислоты.
Библиография: Витамины в питании и профилактика витаминной недостаточности, под ред. В. В. Ефремова, М., 1969; Гигиена питания, под ред. К. С. Петровского, т. 1, с. 89, М., 1971; Покровский А. А. К вопросу о потребностях различных групп населения в энергии и основных пищевых веществах, Вестн. АМН СССР, № 10, с. 3, 1966, библиогр.; Modern nutrition in health and disease, ed. by M.G. Wohl a.R.S. Goodhart, p. 346, Philadelphia, 1968; The vitamins, ed. by W. H. Sebrell a. R. S. Harris, v. 1, N. Y.— L., 1967; Wagner A. F. a. Fоlkers K. A. Vitamins and coenzymes, N. Y., 1964.
Методы определения А. κ.— Биохимические методы исследования в клинике, под ред. А. А. Покровского, с. 469, М., 1969; Методическое руководство по определению витаминов A, D, E, B1, B2, B6, PP, C, P и каротина в витаминных препаратах и пищевых продуктах, под ред. Б. А. Лаврова, с. 99, М., 1960; Степанова E. Н. и Григорьева М. П. Методы определения аскорбиновой кислоты в пищевых продуктах, Вопр. пит., т. 30, № 1, с. 56, 1971; Harris L. J. a. Mapson L. W. Determination of ascorbic acid in presence of interfering substances by «continuousflow» method, Brit. J. Nutr., v. 1, p. 7, 1947; Rоe J. H. a. o. The determination of diketo-l-gulonic acid, dehydro-l-ascorbic acid, and l-ascorbic acid in the same tissue extract by the 2,4-dinitrophenylhydrazine method, J. biol. Chem., v. 174, p. 201,1948; T i 1 1-mansJ., Hirsch P. a. SiebertF. Das Reduktionsvermögen pflanzlicher Lebensmittel und seine Beziehung zum Vitamin C. Z. Lebensmitt.-Untersuch., Bd 63, S. 21, 1932.
В. В. Ефремов; В. M. Авакумов (фарм.).
Источник