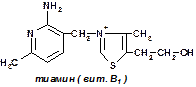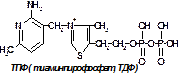77.Коферменты и их связь с витаминами
Коферменты, или коэнзимы — малые молекулы небелковой природы, специфически соединяющиеся с соответствующими белками, называемыми апоферментами, и играющие рольактивного центра или простетической группы молекулы фермента.
Комплекс кофермента и апофермента образует целостную, биологически активную молекулу фермента.
Роль коферментов нередко играют витамины или их метаболиты (чаще всего — фосфорилированные формы витаминов группы B). Например, коферментом фермента карбоксилазы являетсятиаминпирофосфат, коферментом многих аминотрансфераз — пиридоксаль-6-фосфат.
В роли кофактора могут выступать витамины. Например, кофактором АлАТ и АсАТ является витамин В6. витамин В1 –входит в состав мультиферментного комплекса, таким образом участвует в реакции окислительного декарбоксилирования ПВК и альфакетоглутарата. Витамин РР входит в состав НАД – никотинамидалениндинуклеотида, а витамин В2 в состав ФМН – флавин6мононуклеотида.
78. Регуляция действия ферментов: 1) частичный протеолиз – пепсиноген в пепсин под действием HCl, трипсиноген в трипсин под действием энтерокиназы, химотрипсиноген в химотрипсин под действием трипсина 2) ковалентная модификация – фосфорилирование (присоединение остатка фосфорной кислоты) и дефосфорилирование – пример – 2 фосфорилаза Б не активная + 4 АТФ 1 фосфорилаза А – Рн + 4 АДФ. И может быть все наоборот. Гликогенсинтетаза активная + АТФ гликогенсинтетаза – Рн не активная + АДФ. Адреналин повышает уровень глюкозы в крови и активируется фосфорилаза и расщепляется гликоген.
79.Активаторы ферментов: ионы Ме с 19 по 30 в системе Менделеева, восстановленные формы соединений НАДН2 ФАДН2, аллостерические активаторы, гормоны – адреналин, инсулин.
Ингибирование ферментов: 1) обратимое: а) конкурентное – когда ингибитор похож на субстрат (аллопуринол) б) не конкурентное – аллостерическое (ретроингибирование) и уменьшение доли субстрата
2) необратимое: а) специфическая – СО на цитохромы б) не специфическая – денатурация при t 0 С.
80. Классификация ферментов 1961 год – 5 международный конгресс в Москве: 1) оксидоредуктазы (имеют 5 подклассов) в основе ОВР; 2) трансферазы –перенос амино и метильной групп; 3) гидролазы – все ферменты пищеварительного тракта; расщепление с участием воды; 4) лиазы – расщепление связей без участия воды; 5) изомеразы – превращение глюкозо6фосфат в фруктозо6фосфат — реакции изомеризации; 6) лигазы (синтетазы) – синтез органических веществ с затратой энергии распада АТФ.
КФ 1: Оксидоредуктазы, катализирующие окисление или восстановление. Пример: каталаза, алкогольдегидрогеназа
КФ 2: Трансферазы, катализирующие перенос химических групп с одной молекулы субстрата на другую. Среди трансфераз особо выделяют киназы, переносящие фосфатную группу, как правило, с молекулы АТФ.
КФ 3: Гидролазы, катализирующие гидролиз химических связей. Пример: эстеразы, пепсин, трипсин, амилаза, липопротеинлипаза
КФ 4: Лиазы, катализирующие разрыв химических связей без гидролиза с образованием двойной связи в одном из продуктов.
КФ 5: Изомеразы, катализирующие структурные или геометрические изменения в молекуле субстрата.
КФ 6: Лигазы, катализирующие образование химических связей между субстратами за счет гидролиза АТФ. Пример: ДНК-полимераза
81. Энергетический обмен, катаболизм, источники восстановленных эквивалентов. Совокупность окислительных реакций, происходящих в живых организмах и обеспечивающих их энергией и метаболитами, необходимыми для осуществления процессов жизнедеятельности, называется биологическим окислением. Функции биологического окисления: 1) энергетический обмен, поддержание t тела, мышечная активность, осмотическая работа, транспорт, биосинтез 2) окисление ксенобиотиков 3) окисление токсических продуктов обмена 4) синтез ключевых метаболитов. Основными источниками энергии для организма являются белки, липиды и углеводы, поступающие с пищей. Три стадии катаболизма: 1) специфическое превращение в мономеры – аминокислоты, моносахариды, глицерин, жирные кислоты. 2) образование унифицированных продуктов – ПВК и АцКоА (моносахариды через ПВК). 3) АцКоА в ЦТК образуется СО2, вода; 3НАДН, которые в дых цепи дают воду и 3 АТФ; ФАД Н2, который в дых цепи дает воду и 2 АТФ. Источники восстановленных эквивалентов это ЦТК, все окислительно-восстановительные реакции, бета-окисление жирных кислот. В дых цепь поступает 3НАДН и ФАДН2, они образуются в следующих реакциях: НАДФН+НАДНАДФ+НАДН (трансдегидрогеназа).
82.Митохондриальная цепь окисления водорода. трансмембранный электрохимический потенциал. Перенос 2х протонов из матрикса в межмембранное пространство сопряжен с образованием градиента концентраций протонов водорода (дельта МюН). Именно в этом месте возникает пункт сопряжения, окисления и фосфорилирования. Трансмембранный электрохимический потенциал – это разница протонов между матриксом и наружной частью. Образуется АТФ (АДФ+Фн) путем фосфорилирования с использованием энергии окисления водорода.
83. НАД-зависимые дегидрогеназы – это сложные ферменты, относящиеся к классу оксидоредуктаз и состоящие из белковой и небелковой части. Небелковая часть представлена коферментами НАД или НАДФ. НАД – никотинамидадениндинуклеотид, в его структуре два мононуклеотида, соединенные фосфоэфирной связью. В состав одного мононуклеотида входит амид никотиновой кислоты (витамин ниацин), рибоза и остаток фосфорной кислоты. Второй мононуклеотид представлен аденином, Д-рибозой и также остатком фосфорной кислоты. НАД-зависимые дегидрогеназы акцептируют от субстрата два атома водорода, первый присоединяется к НАД с образованием НАДН, второй выделяется в виде протона. Изоцитрат под действием изоцитратдегидрогеназы образуется альфа-кетоглуторат СО2 НАДН+Н + . Источники НАДН: изоцитратдегидрогеназа, малатдегидрогеназа, мультиферментный комплекс окислительного декарбоксилирования альфа-кетоглутората, бета-окисление жирных кислот.
84. Флавиновые ферменты – это сложные ферменты, состоящие из белковой и небелковой части, небелковой частью представлена простерическая группа ФМН – флавинмононуклеотид или ФАД – флавинадениндинуклеотид. ФМН состоит из витамина В2, пятиатомного спирта ретибола, остатка фосфорной кислоты; в структуре ФАД два мононуклеотида, соединенных фосфоэфирной связью. В состав одного мононуклеотида входит витамин В2, пятиатомный спирт ретибол, остаток фосфорной кислоты. Второй мононуклеотид представлен АМФ – Аденин, рибоза, остаток фосфорной кислоты.
85. Дыхательная цепь, железо-серопротеины, цитохромы. Железо-серопротеины относят к негемовым железопротеинам. Известно три вида FeS-белков: 1) один атом железа тетраэдрически связан с сульфгидрильными группами четырех остатков цистеина; 2) (Fe2S2) содержит 2 атома железа и 2 неорганических сульфида, присоединенных к четырем остаткам цистеина; 3) (Fе4S4) содержит четыре атома железа, четыре сульфгидридные группы и четыре остатка цистеина. Атом железа в этих комплексах может находиться в восстановленном (Fe ++ ) и окисленном (Fe +++ ) состояниях. НАДН-дегидрогеназа содержит второй и третий типы железо-серопротеинов. Цитохромы – это ферментные гемопротеины, транспортирующие только электроны. В качестве простетической группы они содержат гем. В дых цепи располагаются 5 цитохромов, отличающихся по строению простетических групп и имеющих разные спектры поглощения. В цитохроме b гем нековалентно связан с белковой частью, в то время как в цитохромах с и с1 – связь с белковой частью ковалентная. Цитохромы а и а3 имеют иную простетическую группу, называемую гемом-а. Она отличается от простетической группы цитохромов с и с1 наличием формильной группы вместо одной из метильных групп и углеводородной цепью вместо одного из остатков винила. В составе цитохромов а и а3 находятся два атома меди. Простетической группой цитохромов в, с1 и с служит протопорферин 1Х. Цитохром с имеет ковалентно связанный гем и выполняет челночные функции – передает электроны цитохрома с1 к цитохромоксидазе.
86. образование макроэргических связей в дыхательной цепи. Коэффициент Р/О. Разобщение дыхания и фосфорилирования в дыхательной цепи. Коэффициент Р/О – это количество АТФ, которое образовалось в дых цепи. Р/О может быть равно 3 или 2 АТФ. Три АТФ образуется при участии НАДН, две АТФ при участии ФАДН2. В окислительном фосфорилировании не образуется дельта МюН, т.к. есть вещества, которые принимают протоны на себя. В окислительном фосфорилировании не происходит образования АТФ и энергия выделяется в виде тепла.
87. Окислительное субстратное фосфорилирование в процессе биологического окисления. Образование АТФ в процессе метаболизма идет двумя путями – окислительного и субстратного фосфорилирования. Основными источниками поставляющими энергию являются: 1) дых цепь 2) ЦТК 3) гликолиз. Возникновение макроэргической связи в момент окисления субстрата с дальнейшей активацией неорганического фосфата и его переносом на АДФ с образованием АТФ называют субстратным фосфорилированием. В данном случае окисление субстрата связано с фосфорилированием АДФ. Примерами реакций субстратного фосфорилирования являются две реакции гликолиза – окисление 3-фосфоглицеринового альдегида в 1,3-дифосфоглицериновую кислоту, и окисление 2-фосфоглицериновой кислоты в 2-фосфоэнолпировиноградную кислоту; а также одна реакция ЦТК — окисление сукцинил-КоА в янтарную кислоту.Основная масса АТФ образуется путем окислительного фосфорилирования. В процессе окислительного фосфорилирования окисляемый субстрат участия не принимает, а активирование неорганического фосфата сопряжено с переносом электронов и протонов водорода с коферментов дегидрогеназ (принимающих участие в окислении субстрата) к молекулярному кислороду. Сопряжение окисления с фосфорилированием АДФ и последующим образованием АТФ называют окислительным фосфорилированием. Процессы сопряжения окисления и фосфорилирования идут в дых цепи.
88. Образование СО2 в процессе биологического окисления. СО2 в организме образуется двумя путями – путем прямого и окислительного декарбоксилирования. Основная масса СО2 образуется в ЦТК. Первая молекула СО2 образуется путем прямого декарбоксилирования изоцитрата, при этом изоцитратдегидрогеназа обладает декарбоксилирующим эффектом. Вторая молекула СО2 путем окислительного декарбоксилирования альфа-кетоглутората. Одна молекула СО2 образуется в результате окислительного декарбоксилирования ПВК. Человек за сутки выделяет около 500 мл СО2.
89. Виды декарбоксилирования в ЦТК. В ЦТК есть только два типа декарбоксилирования – прямое и окислительное. 1) Прямое декарбоксилирование изоцитрата под действием изоцитратдегидрогеназы, которая обладает декарбоксилирующим эффектом, превращается в альфа-кетоглуторат и НАДН, который является источником водорода для дыхательной цепи, окисление которого приводит к образованию 3х АТФ и воды. Кроме того в этой реакции образуется СО2. 2) Окислительное декарбоксилирование альфа-кетоглутората происходит под действием альфа-кетоглуторатдегидрогеназного комплекса, который включает три фермента и пять кофакторов – ТДФНSКоА, НАД, ФАД, липоевая кислота. Продуктом реакции является образование макроэргического соединения – сукцинил-КоА. В результате этой реакции образуется еще одна молекула восстановительного эквивалента НАДН и СО2.
90. Микросомальное окисление также как митохондриальное, происходит в митохондриях. Но в микросомальном окислении кислород используется с пластической целью, он включается в субстрат. Примерами микросомального окисления являются – окисления ксенобиотиков, синтез стероидных гормонов, активных форм витаминов, жирных кислот, холестерина. Источником водорода в микросомальном окислении служит НАДФН. При микросомальном окислении энергии не образуется.
91. Пути использования, токсичность кислорода, механизмы защиты. 1) митохондриальные окисления – образование воды – оксидазный способ. 2) в микросомальным окислением с пластической целью – оксигеназный способ. 3) для образования Н2О2 – пероксидазный способ. Токсичность кислорода связано с тем, что в ходе окислительных реакций кислород может принимать дополнительный электрон и превращаться в супероксидный радикал (анион). Присоединение двух дополнительных электронов к супероксидному аниону (О2 — ) ведет к образованию пероксидных анионов (О2 -2 ). О2 — +е+2Н + Н2О2; О2 — е+О2. В результате реакции дисмутации, катализируемой супероксиддисмутазой (СОД), образуется перикись водорода: О2 — +О2 — +2Н + Н2О2+О2. Такие формы кислорода имеют высокую химическую активность, реагируют со многими веществами в организме, в том числе с нуклеиновыми кислотами, белками, липидами, оказывая повреждающее действие. Активные формы кислорода запускают цепные реакции перекисного окисления липидов. В процессе ПОЛ образуются органические перекиси. ПОЛ приводит к повреждающему воздействию мембран клеток. Активные формы кислорода образуются в организме и в реакциях неферментативного окисления ряда веществ. В связи с тем, что образование активных форм кислорода ведет к повреждающему эффекту, можно говорить о токсичности кислорода и механизмах защиты. Имеется два способа защиты: 1) ферментативные пути – активируют пероксидаза и каталаза. Пероксиды выступают в роли акцепторов водорода, донорами которых являются органические субстраты. 2Н2О22Н2О+О2 (катализирует каталаза). 2) неферментативные пути – используются препараты-ловушки активных форм О2 – витамин Е, К, различные хиноны.
Источник
Коферменты . Их роль. связь с витаминами
Коферменты в каталитических реакциях осуществляют транспорт различных групп атомов, электронов или протонов. Коферменты связываются с ферментами: ковалентными связями; ионными связями; гидрофобными взаимодействиями и т.д. Один кофермент может быть коферментом для нескольких ферментов. Многие коферменты являются полифункциональными (например, НАД, ПФ). В зависимости от апофермента зависит специфичность холофермента. Все коферменты делят на две большие группы: витаминные и невитаминные.
Коферменты витаминной природы – производные витаминов или химические модификации витаминов.
Сюда относят:флавинмононуклеотид (ФМН); флавинадениндинуклеотид (ФАД).Ребитол и изоалоксазин образуют витамин В2. Витамин В2 и остаток фосфорной к-ты образуют ФМН
ФМН в соединении с АМФ образуют ФАД.
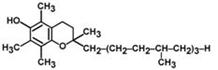
Витамин Е
антистерильный витамин, антиоксидантный энзим.
В химическом плане это альфа-, бета-, гамма- и дельта-токоферолы, но преобладающим является альфа-токоферол.
Витамин Е устойчив к нагреванию.
Роль витамина Е в обмене веществ
1. регулирует интенсивность свободно-радикальных реакций. Препятствует перекисному окислению липидов биомембран;
2. повышает активность витамина А.
Суточная потребность витамина Е 20-25 мг. Источники витамина Е: растительные масла (!), а также печень, желток яиц, проросшие зерна; масло облепихи.
Гемоглобин
Гемоглобин входит в состав группы белков гемопротеины, которые сами являются подвидом хромопротеинов и подразделяются на неферментативные белки (гемоглобин, миоглобин) и ферменты (цитохромы, каталаза, пероксидаза). Небелковой частью их является гем – структура, включающая в себя порфириновое кольцо (состоящее из 4 пиррольных колец) и иона Fe2+. Железо связывается с порфириновым кольцом двумя координационными и двумя ковалентными связями.
№15
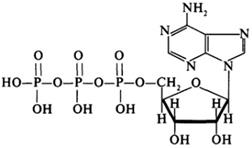
АДФ,АТФ
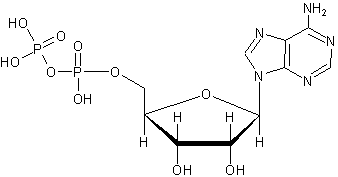
АТФ (Аденозинтрифосфа́т)
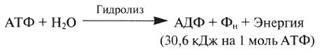
Значение АТФ При расщеплении АТФ на АДФ и неорганический фосфат (Фн) высвобождается энергия:
Помимо энергетической АТФ выполняет в организме ещё ряд других не менее важных функций:
-Вместе с другими нуклеозидтрифосфатами АТФ является исходным продуктом при синтезе нуклеиновых кислот.
-Кроме того, АТФ отводится важное место в регуляции множества биохимических процессов. Являясь аллостерическим эффектором ряда ферментов, АТФ, присоединяясь к их регуляторным центрам, усиливает или подавляет их активность.
-АТФ является также непосредственным предшественником синтеза циклического аденозинмонофосфата — вторичного посредника передачи в клетку гормонального сигнала.
-Также известна роль АТФ в качестве медиатора в синапсах и сигнального вещества в других межклеточных взаимодействиях (пуринергическая передача сигнала
Аденозиндифосфат (АДФ) — нуклеотид, состоящий из аденина, рибозы и двух остатков фосфорной кислоты. АДФ образуется в результате переноса концевой фосфатной группы АТФ. АДФ участвует в энергетическом обмене во всех живых организмах.
Дата добавления: 2016-06-18 ; просмотров: 3710 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Источник