Специфичность трансаминаз коферментная функция витамина в6
Название работы: Трансаминирование: аминотрансферазы; коферментная функция витамина В6. Специфичность аминотрансфераз
Предметная область: Биология и генетика
Описание: Из реакции переноса NH2 наиболее важны реакции трансаминирования . 346 относится к альдиминам или шиффовым основаниям во время реакции аминокислота 1 вытесняет остаток лизина и образуется новый альдимин 2. На второй частиреакции те же стадии протекают в противоположном направлении: пиридоксаминфосфат и вторая 2кетокислота образуют кетимин который иэомеризуется в альдимин. Механизм реакции трансаминирования открыт в 1937 году советскими учеными А.
Дата добавления: 2015-02-20
Размер файла: 144.39 KB
Работу скачали: 3 чел.
Трансаминирование: аминотрансферазы; коферментная функция витамина В6. Специфичность аминотрансфераз.
Из реакции переноса NH2 наиболее важны реакции трансаминирования . Они катализируются трансаминазами и участвуют в катаболических и анаболических процессах с участием аминокислот . При трансаминировании аминогруппа аминокислоты ( аминокислота 1) переносится на 2-кетокислоту ( кетокислота 2). Из аминокислоты при этом образуется 2-кетокислота (а), а из первоначальной кетокислоты аминокислота (b). Переносимая NH2-группа временно присоединяется к связанному с ферментом пиридоксальфосфату , который вследствие этого переходит в пиридоксаминофосфат.
Механизм трансаминирования . В отсутствие субстратов альдегидная группа пиридоксальфосфата ковалентно связана с остатком лизина трансаминазы (1). Этот тип соединения, найденный также в родопсинах (см. с. 346 ), относится к альдиминам или шиффовым основаниям , во время реакции аминокислота 1 вытесняет остаток лизина и образуется новый альдимин (2). Затем за счет изомеризации происходит перемещение двойной связи . Полученный кетимин (3) гидролизуется до 2-кетокислоты и пиридоксаминфосфата (4). На второй части реакции те же стадии протекают в противоположном направлении: пиридоксаминфосфат и вторая 2-кетокислота образуют кетимин , который иэомеризуется в альдимин . Наконец, отщепляется вторая аминокислота и регенерируется кофермент .
Аминотрансфера́зы (трансаминазы) ферменты из группы трансфераз , переносящие аминогруппы без образования свободного аммиака . Аминотрансферазы также называют трансаминазами, а реакцию трансаминированием . Для аминотрансфераз донором аминогрупп являются аминокислоты , а акцептором кетокислоты :
AK1 + KK2 ↔ KK1 + AK2
В составе простетической группы аминотрансферазы содержат производные витамина B6 . Во время переноса аминогруппы простетическая группа переходит из пиридоксаль-5-фосфатной формы в пиридосамино-5-фосфатную форму. Механизм реакции трансаминирования открыт в 1937 году советскими учеными А.Е. Браунштейном и М.Г.Крицман. Процесс протекает в две стадии. Альдегидная группа пиридоксальфостфата (-СНО) взаимодействует с аминогруппой аминокислоты с образованием иминной связи в основании Шиффа : сначала α-аминогруппа аминокислоты-донора замещает ε-аминогруппу апофермента , а затем происходит перегруппировка через кетимин и в результате гидролиза образуется пиридосамино-5-фосфат и α-кетокислота. Реакции повторяются в обратном порядке
Аминотрансферазы являются каталитически совершенными ферментами . Аминотрансферазы содержаться практически во всех органах, но наиболее активно реакции трансаминирования идут в печени. К этой группе ферментов относятся такие важные для клинической лабораторной диагностики ферменты, как АСТ и АЛТ .
П иридоксальфосфат является простетической группой аминотранс-фераз, катализирующих обратимый перенос аминогруппы (NH2-группы) от аминокислот на α-кетокислоту, и декарбоксилаз аминокислот , осуществляющих необратимое отщепление СО2 от карбоксильной группы аминокислот с образованием биогенных аминов . Установлена кофер-ментная роль пиридоксальфосфата в ферментативных реакциях неокислительного дезаминирования серина и треонина , окисления триптофана , кинуренина, превращения серосодержащих аминокислот , взаимопревращения серина и глицина , а также в синтезе δ-аминолевулиновой кислоты , являющейся предшественником молекулы гема гемоглобина . В последние годы число вновь открытых пиридокса-левых ферментов быстро увеличивалось. Так, для действия гликогенфос-форилазы существенной оказалась фосфорильная, а не альдегидная группа пиридоксальфосфата . Вследствие широкого участия пиридоксальфосфата в процессах обмена при недостаточности витамина В6 отмечаются разнообразные нарушения метаболизма аминокислот .
Источник
АМИНОТРАНСФЕРАЗЫ
АМИНОТРАНСФЕРАЗЫ (синоним трансаминазы; устаревшее название аминоферазы) — ферменты из класса трансфераз, катализирующие реакцию трансаминирования, то есть перенос аминогруппы (—NH2) и атома водорода от одной молекулы субстрата к другой; играют важную роль в азотистом обмене. Общая схема реакции:
Реакция протекает без промежуточного образования аммиака. Ферментативное трансаминирование было открыто в 1937 году А. Е. Браунштейном и М. Г. Крицман, которые показали, что препараты из грудной мышцы голубя катализируют обратимую реакцию образования глутаминовой кислоты (см.) и α-кетокислоты (см. Кетокислоты) из α-кетоглутарата и различных аминокислот.
Аминотрансферазы обнаружены во всех исследованных тканях растений и животных и в клетках микроорганизмов. Известно около 50 аминотрансферазы, которые действуют избирательно на природные α-аминокислоты и многие β-, γ- и δ-аминокислоты. Наиболее активные и самые распространенные аминотрансферазы используют глутаминовую и α-кетоглутаровую кислоты в качестве одной из донорно-акцепторных пар; остальные аминокислоты трансаминируются менее активными аминотрансферазами, обычно проявляющими групповую специфичность (см. Ферменты) к нескольким субстратам сходного строения, например к аминокислотам с разветвленной цепью или ароматическим аминокислотам. В органах высших животных (мышцы, сердце, печень) наиболее активны аспартат-кетоглутарат-аминотрапсферазы и аланин-кетоглутаратамино-трансферазы.
Все очищенные аминотрансферазы, выделенные из тканей животных, высших растений и многих микроорганизмов, стерео-специфичны. Они катализируют, как правило, трансаминирование аминокислот (см.) только L-ряда. Однако известны аминотрансферазы некоторых бактерий, которые действуют только на D-аминокислоты и не действуют на их L-изомеры.
Донорами аминогрупп служат не только α-аминокислоты. Так, в тканях животных и у микроорганизмов обнаружены аминотрансферазы, осуществляющие трансаминирование β-аланина, γ-аминомасляной и некоторых других аминокислот с α-кетоглутаровой (реже с пировиноградной) кислотой. Одним из основных путей метаболизма γ-аминомасляной кислоты в мозге является ее трансаминирование с α-кетоглутаратом, в результате чего образуется глутамат и янтарный полуальдегид (аналогичная реакция имеет место у бактерий). δ-Аминогруппа орнитина и аминолевулиновой кислоты также может переноситься аминотрасферазы на кетокислоты. Глутамин и аспарагин реагируют (при участии аминотрасферазы) с различными кетокислотами с образованием соответствующих аминокислот и амидов (см.) кетоглутаровой и щавелево-уксусной кислот.
За немногими исключениями аминотрасферазы имеют широкий рН-оптимум с максимумом в области 8—9. Коферментами аминотрасферазы являются производные витамина В6 — пиридоксальфосфат и пиридоксаминфосфат. Согласно теории А. Е. Браунштейна и М. М. Шемякина, аминокислоты реагируют с пиридоксальфосфатом (соединенным с белковой частью молекулы А.) с образованием промежуточных альдиминов пиридоксальфосфата (оснований Шиффа) и таутомерных им кетпмпнов пиридоксаминфосфата:
Образовавшийся таким образом кетимин затем гидролизуется с освобождением кетокислоты. соответствующей исходной аминокислоте, и пиридоксаминфосфата:
Далее пиридоксаминфосфат взаимодействует с другой кетокислотой, и все стадии реакции повторяются, протекая в обратном направлении. В результате образуется исходная форма протеида пиридоксальфосфата и новая аминокислота. Суммируя, получаем: фермент-пиридоксальфосфат + аминокислота1ферментпиридоксаминфосфат + кетокислота1 фермент-пиридоксаминфосфат + кетокислота2 фермент-пиридоксальфосфат + аминокислота2.
Спектральные исследования аминотрасферазы показали, что пиридоксальфосфат, связанный с белком,существует не в виде свободного альдегида, а в виде основания Шиффа (см. Шиффа основание).
Образование основания Шиффа между пиридоксальфосфатом и апоферментом объясняет тот факт, что пиридоксальфосфат труднее диссоциирует от аминотрасферазы, чем пиридоксаминфосфат.
Аминотрасферазы участвуют в следующих превращениях: образование аминокислот из кетокислот и обратное превращение (окислительный распад аминокислот); биосинтез γ-аминомасляной кислоты, мочевины, пуриновых и пиримидиновых оснований, порфиринов, флавинов, птеридинов, кобаламина.
Обратимое образование аланина, аспартата и глутамата из соответствующих кетокислот является важным звеном, непосредственно связывающим обмен углеводов с обменом аминокислот.
Аминотрасферазы играют основную роль в азотистом обмене (см.). Окислительное дезаминирование аминокислот (за исключением глутамата) в животном организме осуществляется через реакции трансаминирования с учетом ос-кетоглутаровой кислоты в качестве переносчика аминогрупп. Сначала аминокислоты трансаминируются с кетоглутаровой кислотой. Образующаяся при этом глутаминовая кислота дезаминируется под действием глутаматдегидрогеназы с образованием свободного аммиака и освобождением кетоглутаровой кислоты. Обратимость описанных реакций обеспечивает возможность синтеза аминокислот из аммиака и кетокислот путем непрямого аминирования последних. После перехода азота глутаминовой кислоты в аспарагиновую кислоту под действием аминотрасферазы азот аспартата используется в различных процессах биосинтеза, диссимилируется в других ферментативных превращениях до конечных азотистых продуктов (аммиак, мочевина, мочевая кислота). Определение активности аминотрасферазы в крови и других биологических жидкостях имеет определенное диагностическое значение. Так, содержание аминотрасферазы в плазме крови больных резко возрастает при некоторых патологических состояниях, в частности сопровождающихся деструктивными процессами в паренхиматозных органах. Так, например, содержание аминотрасферазы (и в первую очередь аспарат-кетоглутарат-аминотрансферазы) в плазме крови больного увеличивается многократно при инфаркте миокарда, достигая максимума на вторые и третьи сутки. Это позволяет проводить дифференциальный диагноз (в частности, от приступа стенокардии, при котором активность аминотрасферазы в плазме не повышается). Аналогичным образом при вирусном гепатите из пораженных клеток печени в плазму крови поступает большое количество аминотрасферазы, в особенности аланин-кетоглутарат-аминотрансферазы, чего не наблюдается при иных формах желтухи (например, обструкционной). При вирусном гепатите и других поражениях паренхимы печени определение аминотрасферазы в плазме крови имеет не только диагностическое, но и прогностическое значение.
Библиография: Молекулярные основы действия и торможения ферментов, Труды 5-го Международного биохим. конгресса, Симпозиум 4, М., 1962; Guirard В. М. а. Snell Е. Е. Vitamin B6 function in trans-amination and decarboxylation reactions, Cpmprehens. Biochem., v. 15, p. 138, 1964, bibliogr.
Источник
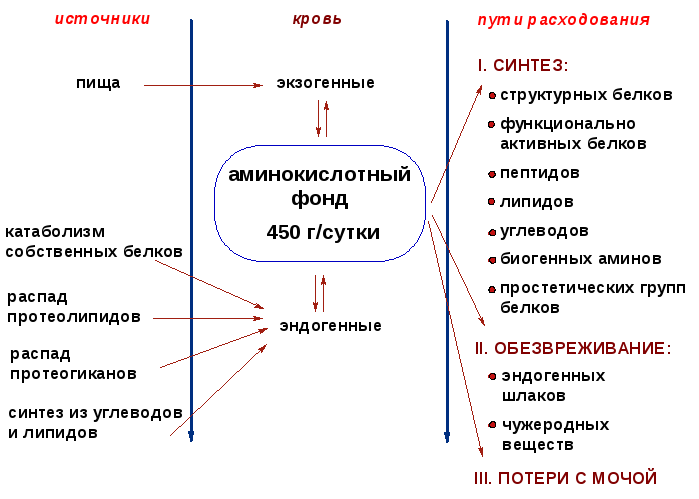
13. Общая схема источников и путей расходования аминокислот (с лекций)
14. Трансаминирование аминокислот, химизм, ферменты. Ак участвующие в трансаминировании
Трансаминирование – р-ции межмолекулярного переноса аминогруппы от ак на L-кетокислоту без промежуточного образования аммиака. Является обратимой, донорно-акцепторная связь (донор-любая кислота, акцептор L-кк)
Р-ции протекают при участии специфических ферментов, названных А.Е. Браунштейном аминоферазами ( по соврем классификации- аминотрансферазы или аминотрансаминазы)
Все трансаминазы сод-т один и тот же кофермент – пиридоксальфосфат (ПФ- производноеvit B6 )
Ферменты трансаминирования переносят NH2-группу не на L-кк, а сначала на кофермент ПФ. Реакции трансаминирования идут в 2 стадии: в первой — к ПФ присоединяется NH2 гр от первого субстрата- аминокислоты, образуется комплекс фермент-пиридоксаминфосфат и кетокислота- первый продукт р-ции. Этот процесс включает промежуточное образование 2 шиффовых оснований; на второй стадии комплекс фермент-пиридоксаминфосфат соединяется с кетокислотой (второй субстрат) и снова через промежуточное образование 2 шиффовых оснований передают аминогруппу на кетокислоту, в результате фермент возвращается в свою нативную форму, и образуется новая аминокислота- второй продукт реакции. В р-ции вступают все ак, кроме лизина, треонина, пролина
15. Специфичность трансаминаз, коферментная функция вит в6
Трансаминазы- специфические ферменты, которые сод-т один и тот же кофермент – пиридоксальфосфат (ПФ- производное vitB6 ). Трансаминаза специфична только к донорно-акцепторной связи. ПФ-источник трансаминазы и дезаминирования.Чаще всего в реакциях трансаминирования участвуют аминокислоты, содержание которых в тканях значительно выше остальных — глутамат, аланин, аспартат и соответствующие им кетокислоты — α-кетоглутарат, пируват и оксалоацетат. Основным донором аминогруппы служит глутамат.
Суммарно эти реакции можно представить в виде схемы:
Акцептором аминогруппы любой аминокислоты, подвергающейся трансаминированию (аминокислота 1), служит α-кетоглутарат. Принимая аминогруппу, он превращается в глутамат, который способен передавать эту группу любой α-кетокислоте с образованием другой аминокислоты (аминокислота 2).
Аминотрансферазы обладают субстратной специфичностью к разным аминокислотам. В тканях человека обнаружено более 10 разных аминотрансфераз. Наиболее распространёнными ферментами в большинстве тканей млекопитающих являютсяаланинаминотрансфераза (АЛТ), по обратной реакции — глутамат-пируватаминотрансфераза(ГПТ) и аспартатаминотрансфераза (ACT), по обратной реакции — глутамат-оксалоацетатаминотрансфераза (ГОТ).
АЛТ (АлАТ) катализирует реакцию транса-минирования между аланином и α-кетоглутаратом. Локализован этот фермент в цитозоле клеток многих органов, но наибольшее его количество обнаружено в клетках печени и сердечной мышцы.
ACT (АсАТ) катализирует реакцию трансами-нирования между аепартатом и α-кетоглутаратом аналогично предыдущей. В результате образуются оксалоацетат и глутамат. ACT имеет как цитоплазматическую, так и митохондриальную формы. Наибольшее его количество обнаружено в клетках сердечной мышцы и печени. Так как наибольшее количество АЛТ и ACT сосредоточено в печени и миокарде, а содержание в крови очень низкое, можно говорить об органоспецифичности этих ферментов.
В результате работы аминотрансфераз аминный азот многих аминокислот переходит в состав глутамата. Есть основания считать, что накопление аминогрупп в форме глутаминовой кислоты происходит в цитозоле. Затем глутамат с помощью транслоказ попадает в митохондрии, где активна специфическая ACT. В результате действия этого фермента глутамат снова превращается в α-кетоглутарат. Последний используется для непрямого дезаминирования аминокислот, содержащихся в митохондриях. Это очень важно, так как только глутамат в тканях млекопитающих наиболее быстро может подвергаться окислительному дезаминированию (см. ниже).
Источник