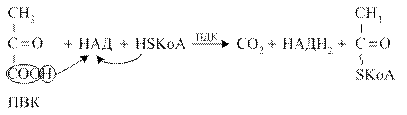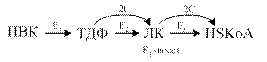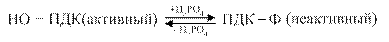Пируватдегидрогеназный комплекс
Пируватдегидрогеназный комплекс (ПДК) молекулярной массой 6*10 6 д., включает в себя три вида ферментов (Е1-Е3) и пять видов коферментов. При этом 2 кофермента (НАД и HS-КоА) находятся в свободном состоянии и входят в состав комплекса только в момент реакции. Общий вид реакции окислительного декарбоксилирования пирувата:
Ферменты пируватдегидрогеназного комплекса
Е1 – пируватдегидрогеназа декарбоксилирующая;
Е2 – дигидролипоилацетилтрансфераза (трансацетилаза);
Коферменты пируватдегидрогеназного комплекса
- Тиаминдифосфат (ТДФ, ТПФ), содержащий витамин В1, кофактор пируватдегидрогеназы.
- Липоевая кислота, кофактор трансацетилазы.
- Кофермент ФАД, содержащий витамин В2, кофактор дегидрогеназы дигидролипоевой кислоты.
- Кофермент НАД, содержащий витамин РР.
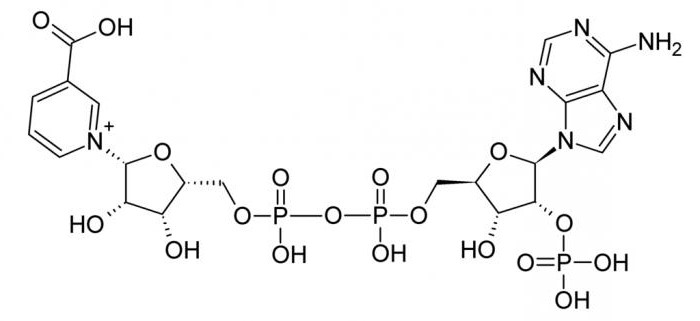
- Кофермент НS-КоА, содержащий аденин, рибозу, два остатка фосфорной кислоты, пантотеновую кислоту (витамин В3).
Окислительное декарбоксилирование ПВК протекает в несколько стадий, в процессе которых двухуглеродный фрагмент, образующийся из ПВК, переносится на липоевую кислоту, а затем на HS-КоА.
Витамины, входящие в состав пируватдегидрогеназного комплекса
В состав ПДК входит пять витаминов (РР. В2, липоевая кислота, В1, пантотеновая кислота).
Липоевая кислота
Липоевая кислота — витаминоподобное вещество, представляет собой восьмиуглеродную жирную кислоту с двумя -SH группами. Биологическая роль:является коферментом ПДК, участвует в окислении α — кетокислот.
Пантотеновая кислота, витамин В3
Пантотеновая кислота является витамином, который, в свою очередь, включает β — аланин и производное масляной кислоты. Она распространена в животных и растительных продуктах. Суточная потребность в пантотеновой кислоте составляет до 10 мг. Биологическая роль: входит в состав НS- КоА и участвует в окислительном декарбоксилировании α — кетокислот, участвует в активации жирных кислот. Авитаминоз проявляется дерматитом, депигментацией волос, поражением нервной системы.
Витамин В1, тиамин, антиневритный витамин
Витамин В1 включает в свой состав пиримидиновое кольцо, содержит аминогруппу. Суточная потребность в нём составляет 2 мг. Тиамин содержится в злаках, дрожжах. Биологическая роль: входит в состав кофермента ТДФ и участвует в окислительном декарбоксилировании α — кетокислот, а также является коферментом транскетолазной реакции в пентозофосфатном пути окисления глюкозы. Авитаминоз проявляется полиневритами (болезнь бери-бери).
Регуляция пируватдегидрогеназного комплекса осуществляется путём фосфолирирования — дефосфолирирования пируватдегидрогеназы
Активаторами ПДК служат АДФ и НАД окисленный. Ингибиторами этого комплекса являются АТФ и НАДН2..
5.1.2. Биологическая роль окислительного декарбоксилирования пирувата Биологическое значение процесса окислительного декарбоксилирования пировиноградной кислоты заключается в том, что оно является важным этапом катаболизма, позволяющим включаться в цикл Кребса тем веществам, при распаде которых образуется ПВК. Образовавшаяся молекула НАДН2 окисляется в длинной дыхательной цепи с образованием 3-х молекул АТФ. Окислительное декарбоксилирование пирувата протекает внутри митохондрий.
Дата добавления: 2016-09-26 ; просмотров: 9029 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Источник
Пируватдегидрогеназный комплекс
Пируватдегидрогеназный комплекс (ПДК) молекулярной массой 6*10 6 д., включает в себя три вида ферментов (Е1-Е3) и пять видов коферментов. При этом 2 кофермента (НАД и HS-КоА) находятся в свободном состоянии и входят в состав комплекса только в момент реакции. Общий вид реакции окислительного декарбоксилирования пирувата:
Ферменты пируватдегидрогеназного комплекса
Е1 – пируватдегидрогеназа декарбоксилирующая;
Е2 – дигидролипоилацетилтрансфераза (трансацетилаза);
Коферменты пируватдегидрогеназного комплекса
- Тиаминдифосфат (ТДФ, ТПФ), содержащий витамин В1, кофактор пируватдегидрогеназы.
- Липоевая кислота, кофактор трансацетилазы.
- Кофермент ФАД, содержащий витамин В2, кофактор дегидрогеназы дигидролипоевой кислоты.
- Кофермент НАД, содержащий витамин РР.
- Кофермент НS-КоА, содержащий аденин, рибозу, два остатка фосфорной кислоты, пантотеновую кислоту (витамин В3).
Окислительное декарбоксилирование ПВК протекает в несколько стадий, в процессе которых двухуглеродный фрагмент, образующийся из ПВК, переносится на липоевую кислоту, а затем на HS-КоА.
Витамины, входящие в состав пируватдегидрогеназного комплекса
В состав ПДК входит пять витаминов (РР. В2, липоевая кислота, В1, пантотеновая кислота).
Липоевая кислота
Липоевая кислота — витаминоподобное вещество, представляет собой восьмиуглеродную жирную кислоту с двумя -SH группами. Биологическая роль:является коферментом ПДК, участвует в окислении α — кетокислот.
Пантотеновая кислота, витамин В3
Пантотеновая кислота является витамином, который, в свою очередь, включает β — аланин и производное масляной кислоты. Она распространена в животных и растительных продуктах. Суточная потребность в пантотеновой кислоте составляет до 10 мг. Биологическая роль: входит в состав НS- КоА и участвует в окислительном декарбоксилировании α — кетокислот, участвует в активации жирных кислот. Авитаминоз проявляется дерматитом, депигментацией волос, поражением нервной системы.
Витамин В1, тиамин, антиневритный витамин
Витамин В1 включает в свой состав пиримидиновое кольцо, содержит аминогруппу. Суточная потребность в нём составляет 2 мг. Тиамин содержится в злаках, дрожжах. Биологическая роль: входит в состав кофермента ТДФ и участвует в окислительном декарбоксилировании α — кетокислот, а также является коферментом транскетолазной реакции в пентозофосфатном пути окисления глюкозы. Авитаминоз проявляется полиневритами (болезнь бери-бери).
Регуляция пируватдегидрогеназного комплекса осуществляется путём фосфолирирования — дефосфолирирования пируватдегидрогеназы
Активаторами ПДК служат АДФ и НАД окисленный. Ингибиторами этого комплекса являются АТФ и НАДН2..
5.1.2. Биологическая роль окислительного декарбоксилирования пирувата Биологическое значение процесса окислительного декарбоксилирования пировиноградной кислоты заключается в том, что оно является важным этапом катаболизма, позволяющим включаться в цикл Кребса тем веществам, при распаде которых образуется ПВК. Образовавшаяся молекула НАДН2 окисляется в длинной дыхательной цепи с образованием 3-х молекул АТФ. Окислительное декарбоксилирование пирувата протекает внутри митохондрий.
Источник
Состав пируватдегидрогеназного комплекса



Окислительное декарбоксилирование пировиноградной кислоты
Пировиноградная кислота является продуктом окисления глюкозы. Ее судьба различна в зависимости от доступности кислорода в клетке. В анаэробных условиях она восстанавливается до молочной кислоты. В аэробных условиях происходит ее окислительное декарбоксилирование до уксусной кислоты, переносчиком которой служит коэнзим А.
Превращение, состоящее из пяти реакций, осуществляется полиферментным комплексом, прикрепленным к внутренней митохондриальной мембране со стороны матрикса. В составе комплекса насчитывают 3 фермента и 5 коферментов.
Пируватдегидрогеназа (Е1), ее коферментом является тиаминдифосфат, катализирует 1-ю реакцию.
Дигидролипоамид-ацетилтрансфераза (Е2), ее коферментом является липоевая кислота, катализирует 2-ю и 3-ю реакции.
Дигидролипоат-дегидрогеназа (Е3), кофермент – ФАД, катализирует 4-ю и 5-ю реакции.
Помимо указанных коферментов, которые прочно связаны с соответствующими ферментами, в работе комплекса принимают участие коэнзим Аи НАД.
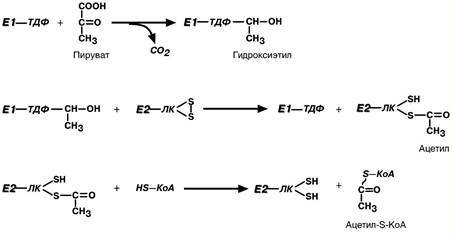
Суть первых трех реакций сводится к декарбоксилированию пирувата (пируватдегидрогеназа), окислению его до ацетила и переносу на коэнзим А (дигидролипоамид-ацетилтрансфераза).
Источник
В состав коферментов пируватдегидрогеназного комплекса входят витамины
Пируватдегидрогена́зный ко́мплекс, ПДК (англ. Pyruvate dehydrogenase complex, PDH, PDC) — белковый комплекс, осуществляющий окислительное декарбоксилирование пирувата. Он включает в себя три фермента и два вспомогательных белка, а для его функционирования необходимы пять кофакторов (СоА, NAD+, тиаминпирофосфат (ТРР), FAD и липоевая кислота (липоат)). PDH локализован у бактерий в цитозоле, а у эукариот — в митохондриальном матриксе. Суммарное уравнение катализируемой реакции таково[1]:
Детально механизм этого процесса, а также его регуляция обсуждаются в статье Окислительное декарбоксилирование пирувата. Ниже рассмотрены особенности собственно ферментного комплекса.
Коферменты[править | править код]
Комбинированное дегидрирование и декарбоксилирование пирувата до ацильной группы[en], которая в дальнейшем войдёт в ацетил-СоА, осуществляется тремя различными ферментами, для функционирования которых необходимы пять различных коферментов или простетических групп: тиаминпирофосфат (ТРР), FAD, кофермент А (СоА), NAD и липоат. Четыре из них являются производными витаминов: тиамина, или витамина В1 (ТРР), рибофлавина, или витамина В2 (FAD), ниацина, или витамина РР (NAD), и пантотеновой кислоты, или витамин В5 (СоА)[2].
FAD и NAD являются переносчиками электронов, а ТРР известен также как кофермент пируватдекарбоксилазы[en], участвующей в брожении[2].
Кофермент А имеет активную тиольную группу (—SH), которая имеет критическое значение для функционирования СоА в качестве переносчика ацильной группы в ряде метаболических реакций. Ацильные группы при этом ковалентно связываются с тиольной группой, образуя тиоэфиры. Из-за их относительно высокой стандартной свободной энергии гидролиза тиоэфиры обладают высоким потенциалом для переноса ацильных групп к различным молекулам-акцепторам. Поэтому ацетил-СоА иногда также называют «активированной уксусной кислотой»[2][3].
Пятый кофактор пируватдегидрогеназного комплекса, липоат, имеет две тиольные группы, которые могут подвергаться обратимому окислению с образованием дисульфидной связи (—S—S—), подобно тому, как это происходит между двумя остатками аминокислоты цистеина в белке. Из-за своей способности подвергаться окислению и восстановлению липоат может служить как в качестве переносчика электронов (или H+), так и ацильных групп[2].
Ферменты[править | править код]
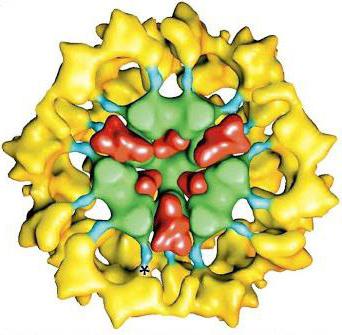
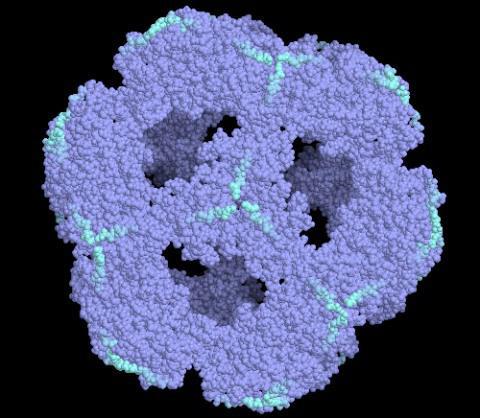
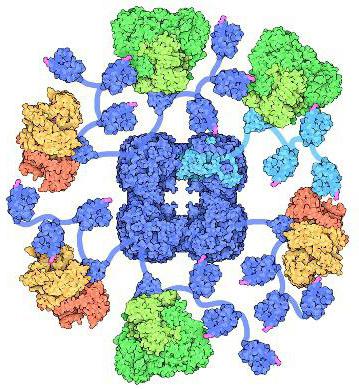
Пируватдегидрогеназный комплекс (PDH)
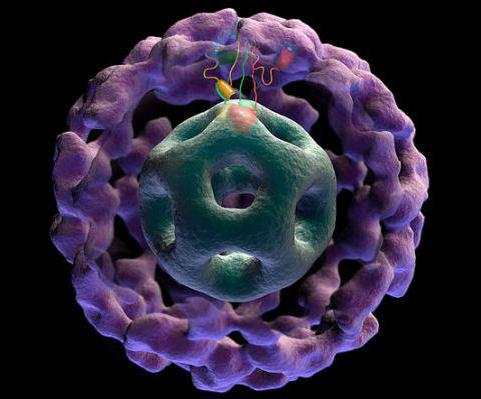
Трёхмерная модель PDH
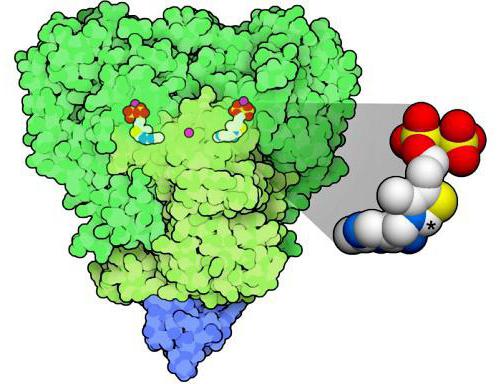
Схематическое изображение PDH с указанием ферментов (Е1, Е2, Е3). Зелёным цветом выделена коровая часть, синим — липоильный домен Е2, который продолжается вперёд до соприкосновения с активными центрами молекул Е1 (жёлтый цвет). С кором также связано несколько субъединиц Е3 (красный), и, раскачиваясь, «рука» Е2 может достать до их активных центров
Пируватдегидрогеназный комплекс (PDH) включает 3 фермента: пируватдегидрогеназу[en] (Е1), дигидролипоилтрансацетилазу (Е2) и дигидролипоилдегидрогеназу[en] (Е3). Каждый из этих ферментов присутствует в комплексе во множестве копий. Количество копий каждого фермента, а следовательно, и размер комплекса варьирует среди различных видов. Комплекс PDH млекопитающих достигает около 50 нм в диаметре, что более чем в 5 раз превышает диаметр целой рибосомы; эти комплексы достаточно велики, чтобы быть различимыми в электронный микроскоп. В PDH коровы и грамположительной бактерии Bacillus stearothermophilus[en][4] входят 60 идентичных копий Е2, которые формируют пентагональный додекаэдр (коровая часть[en] комплекса) диаметром около 25 нм. В кубический[5] кор PDH у грамотрицательной бактерии Escherichia coli входит 24 копии Е2. К Е2 присоединяется простетическая группа липоат, которая связывается амидной связью к ε-аминогруппе остатка лизина, входящего в состав Е2. Е2 состоит из трёх функционально различных доменов: аминотерминального липоильного домена, содержащего остаток лизина, связывающийся с липоатом; центрального Е1- и Е3-связывающего домена; внутреннего корового ацилтрансферазного домена, содержащего активные центры ацилтрансферазы. У дрожжей в PDH имеется единственный липоильный домен, у млекопитающих — два, а у E. coli — три. Домены Е2 разделяются линкерными последовательностями аминокислот, состоящими из 20—30 аминокислотных остатков, причём в них остатки аланина и пролина перемежаются с заряженными аминокислотыми остатками. Такие линкеры обычно принимают протяжённую форму, тем самым отделяя друг от друга три домена[6].
С активным центром Е1 связывается ТРР, а с активным центром Е3 — FAD. У человека фермент Е1 представляет собой тетрамер, состоящий из 4 субъединиц: двух Е1α и двух Е1β[7]. Также в состав комплекса PDH входят два регуляторных белка — протеинкиназа и фосфопротеинфосфатаза. Такая основная структура из Е1-Е2-Е3 оставалась консервативной в ходе эволюции. Комплексы такого устройства принимают участие и в других реакциях, например, окислении α-кетоглутарата в ходе цикла Кребса и окислении α-кетокислот, образующихся при катаболической утилизации разветвлённых аминокислот: валина, изолейцина, лейцина. У изученных видов Е3 PDH идентичен Е3 двух вышеупомянутых комплексов. Примечательное сходство структур белков, кофакторов и механизмов реакций, осуществляемых этими комплексами, свидетельствует об общности их происхождения[1]. При прикреплении липоата к лизину Е2 образуется длинная, гибкая «рука», которая может перемещаться с активного центра Е1 в активные центры Е2 и Е3, то есть на расстояния предположительно 5 нм и более[8].
Установлено, что у эукариот в состав пируватдегидрогеназного комплекса также входит 12 субъединиц некаталитического E3-связывающего белка[en] (E3BP). Точное его расположение неизвестно, однако криоэлектронная микроскопия показала, что он связывается с каждой из граней кора PDH дрожжей. Было высказано предположение, что этот белок заменил собой несколько субъединиц E2 в PDH коровы[9].
Пируватдегидрогеназный комплекс имеется и у некоторых анаэробных бактерий, например, Zymonomonas mobilis. У этой бактерии до 98 % пирувата участвует в спиртовом брожении, и лишь малая его часть окисляется до ацетил-СоА, СО2 и NADH. PDH Z. mobilis состоит из 4 ферментов: E1α массой 38,6 кДа, Е1β массой 49,8 кДа, Е2 массой 48 кДа и Е3 массой 50 кДа. Уникальной особенностью PDH этой бактерии является наличие в субъединице Е1β липоильного домена. Так же, как и у коровы, кор комплекса представлен субъединицей Е2, а сам комплекс организован в виде пентагонального додекаэдра. Гены, кодирующие субъединицы PDH этой бактерии, собраны в два различных кластера. Поскольку у Z. mobilis отсутствует ряд ферментов цикла трикарбоновых кислот, то PDH у этой бактерии выполняет исключительно анаболические функции[10].
Гены[править | править код]
У человека гены, кодирующие ферменты PDH, расположены следующим образом. Ген E1α — PDHA1 — локализован на X-хромосоме. Известно более 30 мутантных аллелей этого гена, приводящих к развитию пируватдегидрогеназной недостаточности[en] — заболеванию, симптомы которого могут варьировать от слабовыраженного лактатацидоза до серьёзных пороков развития[11]. Накопление лактата в этом случае происходит из-за того, что PDH не может превращать пируват в ацетил-СоА, и из-за накопления пирувата лактат не может в него превращаться. Мужчины, чья Х-хромосома несёт мутантную аллель, обычно погибают в раннем возрасте, однако женщины тоже в некоторой степени подвержены этому заболеванию из-за инактивации одной из Х-хромосом. В клетках семенников имеется особая копия E1α — PDHA2, этот ген локализован на хромосоме 4[12].
Ген E1β — PDHB — расположен на хромосоме 3. Известно только 2 мутантные аллели этого гена, в гомозиготном состоянии приводящие к смерти в течение первого года жизни из-за пороков развития. Возможно, существуют и другие мутантные аллели, приводящие к смерти ещё до рождения. Ген E2 — DLAT (от англ. dihydrolipoamide s-acetyltransferase) — локализован на 11-й хромосоме. Известны две аллели этого гена, в гомозиготе приводящие к проблемам, компенсируемым правильной диетой; вполне вероятно, что другие мутантные аллели приводят к смерти на внутриутробном этапе. Ген E3 — DLD — расположен на хромосоме 7. Этот ген имеет множество аллелей, многие из которых приводят к появлению генетических болезней, однако, связанных не с PDH, а с α-кетоглутаратдегидрогеназным комплексом[en] и проявляющихся в нарушении обмена аминокислот[7][12].
Примечания[править | править код]
- ↑ 12 Nelson, Cox, 2008, p. 616.
- ↑ 1234 Nelson, Cox, 2008, p. 617.
- ↑ Нетрусов, Котова, 2012, с. 123.
- ↑ Henderson C. E., Perham R. N. Purificaton of the pyruvate dehydrogenase multienzyme complex of Bacillus stearothermophilus and resolution of its four component polypeptides. (англ.) // The Biochemical journal. — 1980. — Vol. 189, no. 1. — P. 161—172. — PMID 7458900. [исправить]
- ↑ Izard T., Aevarsson A., Allen M. D., Westphal A. H., Perham R. N., de Kok A., Hol W. G. Principles of quasi-equivalence and Euclidean geometry govern the assembly of cubic and dodecahedral cores of pyruvate dehydrogenase complexes. (англ.) // Proceedings of the National Academy of Sciences of the United States of America. — 1999. — Vol. 96, no. 4. — P. 1240—1245. — PMID 9990008. [исправить]
- ↑ Nelson, Cox, 2008, p. 618.
- ↑ 12Olson S., Song B. J., Huh T. L., Chi Y. T., Veech R. L., McBride O. W. Three genes for enzymes of the pyruvate dehydrogenase complex map to human chromosomes 3, 7, and X. (англ.) // American journal of human genetics. — 1990. — Vol. 46, no. 2. — P. 340—349. — PMID 1967901. [исправить]
- ↑ Nelson, Cox, 2008, p. 618—619.
- ↑ Stoops J. K., Cheng R. H., Yazdi M. A., Maeng C. Y., Schroeter J. P., Klueppelberg U., Kolodziej S. J., Baker T. S., Reed L. J. On the unique structural organization of the Saccharomyces cerevisiae pyruvate dehydrogenase complex. (англ.) // The Journal of biological chemistry. — 1997. — Vol. 272, no. 9. — P. 5757—5764. — PMID 9038189. [исправить]
- ↑ Martin Dworkin, Stanley Falkow et al. The Prokaryotes: A Handbook on the Biology of Bacteria.. — Third edition. — Springer Science & Business Media, 2006. — Vol. 5. — P. 211—212. — 919 p. — ISBN 978-0387-25495-1.
- ↑ Zhilwan Rahim. Pyruvate Dehydrogenase Complex Deficiency (PDCD). // Undergraduate Research Journal for the Human Sciences. — 2011. — Vol. 10.
- ↑ 12 Laurence A. Moran. Human Genes for the Pyruvate Dehydrogenase Complex (2007).
Литература[править | править код]
- David L. Nelson, Michael M. Cox.Lehninger Principles of biochemistry. — Fifth edition. — New York: W. H. Freeman and company, 2008. — 1158 p. — ISBN 978-0-7167-7108-1.
- Нетрусов А. И., Котова И. Б. Микробиология. — 4-е изд., перераб. и доп.. — М.: Издательский центр «Академия», 2012. — 384 с. — ISBN 978-5-7695-7979-0.
Пируватдегидрогеназный комплекс (ПДК) молекулярной массой 6*106 д., включает в себя три вида ферментов (Е1-Е3) и пять видов коферментов. При этом 2 кофермента (НАД и HS-КоА) находятся в свободном состоянии и входят в состав комплекса только в момент реакции. Общий вид реакции окислительного декарбоксилирования пирувата:
Ферменты пируватдегидрогеназного комплекса
Е1 – пируватдегидрогеназа декарбоксилирующая;
Е2 – дигидролипоилацетилтрансфераза (трансацетилаза);
Коферменты пируватдегидрогеназного комплекса
- Тиаминдифосфат (ТДФ, ТПФ), содержащий витамин В1, кофактор пируватдегидрогеназы.
- Липоевая кислота, кофактор трансацетилазы.
- Кофермент ФАД, содержащий витамин В2, кофактор дегидрогеназы дигидролипоевой кислоты.
- Кофермент НАД, содержащий витамин РР.
- Кофермент НS-КоА, содержащий аденин, рибозу, два остатка фосфорной кислоты, пантотеновую кислоту (витамин В3).
Окислительное декарбоксилирование ПВК протекает в несколько стадий, в процессе которых двухуглеродный фрагмент, образующийся из ПВК, переносится на липоевую кислоту, а затем на HS-КоА.
Витамины, входящие в состав пируватдегидрогеназного комплекса
В состав ПДК входит пять витаминов (РР. В2, липоевая кислота, В1, пантотеновая кислота).
Липоевая кислота
Липоевая кислота — витаминоподобное вещество, представляет собой восьмиуглеродную жирную кислоту с двумя -SH группами. Биологическая роль: является коферментом ПДК, участвует в окислении α — кетокислот.
Пантотеновая кислота, витамин В3
Пантотеновая кислота является витамином, который, в свою очередь, включает β — аланин и производное масляной кислоты. Она распространена в животных и растительных продуктах. Суточная потребность в пантотеновой кислоте составляет до 10 мг. Биологическая роль: входит в состав НS- КоА и участвует в окислительном декарбоксилировании α — кетокислот, участвует в активации жирных кислот. Авитаминоз проявляется дерматитом, депигментацией волос, поражением нервной системы.
Витамин В1, тиамин, антиневритный витамин
Витамин В1 включает в свой состав пиримидиновое кольцо, содержит аминогруппу. Суточная потребность в нём составляет 2 мг. Тиамин содержится в злаках, дрожжах. Биологическая роль: входит в состав кофермента ТДФ и участвует в окислительном декарбоксилировании α — кетокислот, а также является коферментом транскетолазной реакции в пентозофосфатном пути окисления глюкозы. Авитаминоз проявляется полиневритами (болезнь бери-бери).
Регуляция пируватдегидрогеназного комплекса осуществляется путём фосфолирирования — дефосфолирирования пируватдегидрогеназы
Активаторами ПДК служат АДФ и НАД окисленный. Ингибиторами этого комплекса являются АТФ и НАДН2..
5.1.2. Биологическая роль окислительного декарбоксилирования пирувата Биологическое значение процесса окислительного декарбоксилирования пировиноградной кислоты заключается в том, что оно является важным этапом катаболизма, позволяющим включаться в цикл Кребса тем веществам, при распаде которых образуется ПВК. Образовавшаяся молекула НАДН2 окисляется в длинной дыхательной цепи с образованием 3-х молекул АТФ. Окислительное декарбоксилирование пирувата протекает внутри митохондрий.
5.2. Цикл трикарбоновых кислот (цикл Г. Кребса)
Ацетил-КоА окисляется в цикле трикарбоновых кислот — цикле Кребса.
5.2.1. Химизм цикла Кребса (цикла трикарбоновых кислот)
В данном цикле происходит полное окисление ацетил-КоА. Цикл начинается с взаимодействия ацетил-КоА с щавелевоуксусной кислотой (ЩУК), а заканчивается образованием щавелевоуксусной кислоты. Цикл трикарбоновых кислот (ЦТК) протекает внутри митохондрий.
Пируватдегидрогеназный комплекс (ПДК) молекулярной массой 6*106 д., включает в себя три вида ферментов (Е1-Е3) и пять видов коферментов. При этом 2 кофермента (НАД и HS-КоА) находятся в свободном состоянии и входят в состав комплекса только в момент реакции. Общий вид реакции окислительного декарбоксилирования пирувата:
Ферменты пируватдегидрогеназного комплекса
Е1 – пируватдегидрогеназа декарбоксилирующая;
Е2 – дигидролипоилацетилтрансфераза (трансацетилаза);
Коферменты пируватдегидрогеназного комплекса
- Тиаминдифосфат (ТДФ, ТПФ), содержащий витамин В1, кофактор пируватдегидрогеназы.
- Липоевая кислота, кофактор трансацетилазы.
- Кофермент ФАД, содержащий витамин В2, кофактор дегидрогеназы дигидролипоевой кислоты.
- Кофермент НАД, содержащий витамин РР.
- Кофермент НS-КоА, содержащий аденин, рибозу, два остатка фосфорной кислоты, пантотеновую кислоту (витамин В3).
Окислительное декарбоксилирование ПВК протекает в несколько стадий, в процессе которых двухуглеродный фрагмент, образующийся из ПВК, переносится на липоевую кислоту, а затем на HS-КоА.
Витамины, входящие в состав пируватдегидрогеназного комплекса
В состав ПДК входит пять витаминов (РР. В2, липоевая кислота, В1, пантотеновая кислота).
Липоевая кислота
Липоевая кислота — витаминоподобное вещество, представляет собой восьмиуглеродную жирную кислоту с двумя -SH группами. Биологическая роль:является коферментом ПДК, участвует в окислении α — кетокислот.
Пантотеновая кислота, витамин В3
Пантотеновая кислота является витамином, который, в свою очередь, включает β — аланин и производное масляной кислоты. Она распространена в животных и растительных продуктах. Суточная потребность в пантотеновой кислоте составляет до 10 мг. Биологическая роль: входит в состав НS- КоА и участвует в окислительном декарбоксилировании α — кетокислот, участвует в активации жирных кислот. Авитаминоз проявляется дерматитом, депигментацией волос, поражением нервной системы.
Витамин В1, тиамин, антиневритный витамин
Витамин В1 включает в свой состав пиримидиновое кольцо, содержит аминогруппу. Суточная потребность в нём составляет 2 мг. Тиамин содержится в злаках, дрожжах. Биологическая роль: входит в состав кофермента ТДФ и участвует в окислительном декарбоксилировании α — кетокислот, а также является коферментом транскетолазной реакции в пентозофосфатном пути окисления глюкозы. Авитаминоз проявляется полиневритами (болезнь бери-бери).
Регуляция пируватдегидрогеназного комплекса осуществляется путём фосфолирирования — дефосфолирирования пируватдегидрогеназы
Активаторами ПДК служат АДФ и НАД окисленный. Ингибиторами этого комплекса являются АТФ и НАДН2..
5.1.2. Биологическая роль окислительного декарбоксилирования пирувата Биологическое значение процесса окислительного декарбоксилирования пировиноградной кислоты заключается в том, что оно является важным этапом катаболизма, позволяющим включаться в цикл Кребса тем веществам, при распаде которых образуется ПВК. Образовавшаяся молекула НАДН2 окисляется в длинной дыхательной цепи с образованием 3-х молекул АТФ. Окислительное декарбоксилирование пирувата протекает внутри митохондрий.
В этой статье мы постараемся доступно объяснить, что представляет собой пируватдегидрогеназный комплекс и биохимию процесса, раскрыть состав ферментов и коферментов, обозначить роль и значение данного комплекса в природе и жизни человека. Кроме того, будут рассмотрены возможные последствия нарушения функционального предназначения комплекса и время их проявления.
Ознакомление с понятием
Пируватдегидрогеназный комплекс (PDH) – это комплекс белкового типа, роль которого заключается в осуществлении окисления пирувата в результате декарбоксилирования. Данный комплекс содержит в себе 3 фермента, а также два белка, необходимых для осуществления вспомогательных функций. Чтобы пируватдегидрогеназный комплекс мог функционировать, необходимо наличие определенных кофакторов. Их пять: СоА, никотинамидадениндинуклеотид, флавинадениндинуклеотид, тиаминпирофосфат и липоат.
Локализация PDH у бактериальных организмов сосредоточена в цитоплазме, эукариотические клетки хранят его в матриксе на митохондриях.
Связь с декарбоксилированием пирувата
Значение пируватдегидрогеназного комплекса заключается в реакции окисления пирувата. Рассмотрим суть этого процесса.
Механизм окисления пирувата под воздействием декарбоксилирования представляет собой процесс биохимической природы, в котором происходит отщепление молекулы CO2 в единственном числе, а далее следует присоединение этой молекулы к пирувату, подвергнутому декарбоксилированию и принадлежащему коферменту А (КоА). Так создается ацетил-KoA. Это явление занимает промежуточное место между процессами гликолиза и цикла кислот трикарбонового типа. Процесс дикарбоксилирования пирувата осуществляется с участием сложного ПДК, который заключает в себе, как было ранее сказано, три фермента и два белка вспомогательного типа.
Роль коферментов
Для пируватдегидрогеназного комплекса ферменты играют важнейшую роль. Однако они могут начать свою работу лишь в присутствии пяти коферментов либо групп простетического типа, которые были перечислены выше. Сам процесс приведет в конечном итоге к тому, что ацильная группа будет входить в СоА-ацетил. Говоря о коферментах, необходимо знать, что четыре из них принадлежат к производным витаминам: тиамин, рибофлавин, ниацин и пантотеновая кислота.
Флавинадениндинуклеотид и никотинамидадениндинуклеотид занимаются переносом электронов, а тиаминпирофосфат, многим известный как пируватдекарбоксильный кофермент, вступает в реакции брожения.
Активация тиольной группы
Кофермент ацетилирования (А) – содержит в себе группу тиольного типа (-SH), которая очень активна, она критически важна и необходима, для того чтобы СоА функционировала в роли вещества, которое сможет переносить ацильную группу в тиольную и образовывать тиоэфир. Сложные эфиры тиолов (тиоэфиры) – имеют достаточно высокий показатель гидролизной энергии свободного характера, потому им присущ высокий потенциал переноса ацильной группы к разнообразным акцепторным молекулам. Именно поэтому ацетил СоА периодически называют активированной СН3СООН.
Перенесение электронов
Помимо четырех кофакторов, имеющих природу производных витаминов, существует 5-й кофактор пируватдегидрогеназного комплекса, именуемый липоатом. Ему присущи 2 группы тиольного типа, способные подвергаться воздействию обратимого окисления, в результате которого образуется связь дисульфидного характера (-S-S-), что схоже с тем, как этот процесс протекает между аминокислотыцистеинными остатками в белках. Умение окисляться и восстанавливаться дает липоату возможность быть переносчиком не только ацильной группы, но и электронов.
Ферментативный набор
Из ферментов пируватдегидрогеназный комплекс включает в себя три основных компонента. Первым ферментом является пируватдегидрозеназа (Е1). Второй фермент – это дигидролипоилдегидрогеназа (Е3). Третий – дигидролипоилтрансацетилаза (Е2). Пируватдегидрогеназный комплекс включает в себя данные ферменты, храня их в большом количестве копий. Количество копий каждого фермента может быть разным, а потому и размеры комплекса могут сильно варьироваться. PDH комплекс у млекопитающих достигает около 50 нанометров в диаметре. Это больше диаметра рибосомы в 5-6 раз. Такие комплексы очень большие, поэтому их можно различить в электронном микроскопе.
Грамположительная бактерия bacillus stearothermophilus в своем PDH имеет шестьдесят одинаковых копий дигидролипоилтрансацетилазы, которые, в свою очередь, создают додекаэдр пентагонального типа, диаметром, приблизительно равным 25 нанометрам. Грамположительная бактерия Escherichia coli содержит в себе двадцать четыре копии Е2, кот. присоединяет к себе простетическую группу липоата, а она устанавливает связь амидного типа с аминогруппой остатка лизина, входящего в Е2.
Дигидролипоилтрансацетилаза строится при взаимодействии 3 доменов, имеющих функциональные различия. Это: аминотерминальный липоильный домен, содержащий в себе лизина остаток и связанный с липоатом; связывающий домен (центральный Е1- и Е3-); внутренний ацилтрасферазный домен, включающий в себя ацилтрансферазные центры активного типа.
Пируватдегидрогеназный комплекс дрожжей имеет в себе только один домен липоильного типа, млекопитающие таких доменов имеют два, а бактерия кишечной палочки – три. Линкерная последовательность аминокислот, которые состоят из двадцати-тридцати аминокислотных остатков, разделяет Е2, при этом остатки аланинов и пролинов перемежаются с остатками аминокислот, которые заряжены. Эти линкеры чаще всего имеют протяженные формы. Такая особенность влияет на то, что они разделяют 3 домена.
Взаимосвязь происхождения
Е1 своим активным центром устанавливает связь с ТТР, а активный центр E3 – с FAD. Человеческий организм фермент Е1 содержит в форме тетрамера, который складывается из четырех субъединиц: двух E1альфа и двух E1бета. Регуляторные белки представлены в виде протеинкиназы и фосфопротеинфосфатазы. Этот тип структуры (Е1-Е2-Е3) остается элементом консерватизма в эволюционном учении. Комплексы с подобным строением и устройством могут участвовать в разнообразных реакция, отличных от стандартных, например, при подвергании окислению α-кетоглутарата на протяжении действия цикла Кребса, также окисляется и α-кетокислота, что образовалась из-за катаболических утилизаций аминокислот разветвленного типа: валина, лейцина и изолейцина.
Пируватдегидрогеназный комплекс имеет фермент E3, встречающийся и в других комплексах. Сходство белковой структуры, кофакторов и также реакционных механизмов указывает на общее происхождение. Липоат прикрепляется к лизину E2, и создается подобие «руки», что способна передвигаться от активного центра Е1 до активных центров Е2 и Е3, что составляет приблизительно 5 нм.
Эукариоты в пируватдегидрогеназном комплексе содержат по двенадцать субъединиц Е3ВР (Е3 – связывающего белка некаталитической природы). Местоположение этого белка точно не известно. Есть гипотеза о том, что этот протеин заменяет некоторое подмножество субъед. E2 в коровьем PDH.
Связь с микроорганизмами
Рассматриваемый комплекс присущ некоторым видам бактерий анаэробного типа. Однако количество бактериальных организмов, имеющих в своем строении PDH, невелико. Функции, выполняемые комплексом у бактерий, как правило, сводятся к общим процессам. Например, роль пируватдегидрогеназного комплекса у бактерии Zymonomonas mobilis заключается в брожении спиртового характера. Пируват бактерии в размере до 98% израсходуется именно на подобные цели. Оставшиеся несколько процентов подвергаются окислению до углекислого газа, никотинамидадениндинуклеотида, ацетил-СоА и т. д. Интересно строение пируватдегидрогеназного комплекса у Зимомонас мобилис. У данного микроорганизма в него входит четыре фермента: E1альфа, Е1бета, Е2 и Е3. В PDH этой бактерии находится липоильный домен внутри Е1бета, что делает ее уникальной. Кор комплекса представляется Е2, а организация самого комплекса принимает вид додекаэдра пентагонального типа. Зимомонас мобилис не имеет целые ряды ферментов цикла трикарбоновых кислот, а потому ее PDH занимается только анаболическими функциями.
PDH в человеке
Человек, как и другие живые организмы, имеет гены, занимающиеся кодированием PDH. В Х-хромосоме локализируется ген E1альфа – PDHA 1. Механизм действия пируватдегидрогеназного комплекса чрезвычайно важен, что следует из того, что существует больше тридцати аллелей мутантного типа у вышеуказанного гена, и каждая из мутаций приводит к PDH-недостаточности. Симптоматика заболевания может сильно варьироваться от лактатацидозовых проблем слабовыраженного характера до летальных пороков в развитии организма. Мужчин, у которых Х-хромосома включает подобную аллель, ждет скорая гибель в совсем юном возрасте. Женские особи тоже подвергаются этому заболеванию, но в меньшей степени, а сама проблема заключается в инактивации какой-либо Х-хромосомы.
Проблематика мутаций
Е1бета – PDHB – располагается на третьей хромосоме. Известны лишь две аллели мутантного типа у данного гена, которые, находясь в гомозиготном положении, приводят к летальному исходу на протяжении года, что связанно с пороками развития.
Вероятно, есть и другие подобные аллели, которые могут вызвать смерть до полноценного развития организма. Е2 – DLAT – сосредоточен на одиннадцатой хромосоме. Человечеству известно о двух аллелях данного гена, которые создадут проблемы в будущем, однако правильная диета может это компенсировать. Существует большая вероятность того, что плод погибнет внутри утробы из-за других мутаций этого гена. E3 – dld – располагается на седьмой хромосоме и включает в себя большое количество аллелей. Довольно большой их процент приводит к возникновению болезней генетического характера, которые будут связаны с нарушением аминокислотного обмена.
Заключение
Мы рассмотрели, насколько важен для живых организмов пируватдегидрогеназный комплекс. Реакции, в нем происходящие, направлены, в первую очередь, на декарбоксилирование пирувата путем окисления, а сам PDH узкоспециализирован, но в разных условиях, при наличии определенных причин может выполнять и функции другого характера, например, участвовать в брожении. Также мы выяснили, что комплексы белкового типа, которые занимаются пируватным окислением, состоят из пяти ферментов, которые сохраняют работоспособность лишь при наличии пяти кофакторов. Любые изменения в алгоритме сложного механизма декарбоксилирования могут вызвать серьезные патологии и даже привести к смерти индивида.
Источник