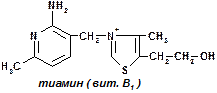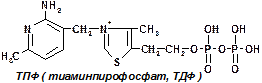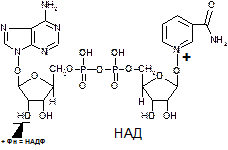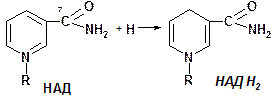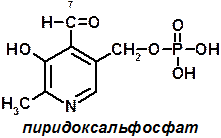Витамин B2 (ФАД)
Определение концентрации флавинадениндинуклеотида (ФАД), являющегося коферментом витамина В2, в образце венозной крови для изучения и оценки обменных процессов и реакций, протекающих с участием этого витамина, и выявления возможных нарушений в них.
Рибофлавин, лактофлавин, флавинадениндинуклеотид (ФАД).
Синонимы английские
Riboflavin, Vitamin B2, Lactoflavin, flavin adenine dinucleotide (FAD).
Высокоэффективная жидкостная хроматография с тандемным масс-спектрометрическим детектированием (ВЭЖХ-МС/МС)
Нмоль/л (наномоль на литр).
Какой биоматериал можно использовать для исследования?
Как правильно подготовиться к исследованию?
- Детям в возрасте до 1 года не принимать пищу в течение 30-40 минут до исследования.
- Не принимать пищу в течение 2-3 часов до исследования, можно пить чистую негазированную воду.
- Не курить в течение 30 минут до исследования.
Общая информация об исследовании
Витамин В2, или рибофлавин, — один из важнейших участников множества биохимических процессов в организме. Он необходим для жизнедеятельности клеток и тканевого дыхания, обменных и окислительно-восстановительных реакций.
Флавинадениндинуклеотид (ФАД), наряду с флавинмононуклеотидом, — важнейшее производное рибофлавина, определяет его биологическую роль. ФАД является коферментом, то есть активным центром, играющим непосредственную роль в протекании тех или иных реакций. Входит в состав ферментов, участвующих в окислении жирных кислот, цикле Кребса, транспорте необходимых веществ для энергетических процессов в мозге и скелетных мышцах и т. д. Все эти процессы происходят на клеточном уровне, от таких реакций зависит нормальное функционирование каждого органа и всего организма в целом.
Суточная потребность рибофлавина меняется в зависимости от возраста. В среднем для взрослого человека она составляет около 1,7-1,8 мг в день и несколько выше в период полового созревания, беременности, при усиленных физических нагрузках и в пожилом возрасте. Витамин В2 содержится в продуктах растительного (ячмень, овощи, какао) и животного происхождения (молоко, яйца, печень, почки).
Рибофлавин играет важнейшую роль в образовании эритроцитов, компонентов иммунной системы, гормональном контроле роста и половой функции. Также необходим для нормального состояния кожи, ногтей и волос.
При недостаточности рибофлавина повышается риск развития анемии, неврологических нарушений, ухудшения состояния волос, ногтей, кожи, воспалительных и дегенеративно-дистрофических заболеваний глаз. Клинические проявления дефицита витамина В2: дерматит, хейлит (поражение слизистой губ), ангулярный стоматит (трещины в углах рта), глоссит (болезненный язык), конъюнктивит, кератит и в некоторых случаях катаракта. Неврологические нарушения могут быть представлены мышечным напряжением, болями в ногах.
Определение концентрации флавинадениндинуклеотида витамина В2 проводится методом жидкостной хроматографии с тандемным масс-спектрометрическим детектированием. Суть его заключается в выделении нужного вещества на основании физико-химических свойств из образца венозной крови, его ионизации и сортировке полученных ионов в зависимости от массы с последующим их анализом. Метод является одним из самых современных, обладает высокой чувствительностью, позволяет анализировать большое количество веществ без ограничения по их физико-химическим свойствам за относительно небольшой промежуток времени.
Для чего используется исследование?
- Для диагностики недостаточности, дефицита или возможности передозировки витамина B2 в организме.
- Для контроля эффективности заместительной терапии препаратами витаминов группы В.
Когда назначается исследование?
- При клинических проявлениях недостаточности рибофлавина: покраснении и трещинах в углах рта, себорейном дерматите, болезненном красном языке, ухудшении состояния волос и ногтей, развитии воспалительных заболеваний глаз неясной этиологии, некоторых неврологических нарушениях.
- При хронических заболеваниях желудочно-кишечного тракта и нарушении всасывания поступающих с пищей веществ.
- При длительном приеме лекарственных препаратов, снижающих уровень витамина В2 (например, антидепрессантов, барбитуратов и др.).
Что означают результаты?
— В цельной крови 116,0 — 393,0 нмоль/л
— В плазме 56,0 — 97,00 нмоль/л
Причины повышения уровня витамина В2 (ФАД):
- применение заместительной терапии препаратами рибофлавина – как парентерально, так и внутрь.
Причины понижения уровня витамина В2 (ФАД):
- недостаточное употребление продуктов, содержащих рибофлавин;
- хронические заболевания желудочно-кишечного тракта с нарушением всасывания поступающих с пищей веществ.
Что может влиять на результат?
- Уровень витамина В2 (ФАД) может снижаться при употреблении алкоголя и некоторых лекарственных препаратов (барбитураты, антидепрессанты, тиреоидные гормоны и др.).
- Антихолинергические препараты могут увеличивать всасывание рибофлавина из кишечника в кровь.
- Дефицит витамина B2 нередко сочетается с дефицитом других водорастворимых витаминов и редко встречается изолированно.
- Определение уровня витамина B2 в форме ФАД в плазме крови рассматривается как вспомогательный лабораторный маркер для оценки достаточности уровня витамина B2. В качестве базового маркера для оценки уровня витамина B2 рекомендовано определение витамина B2 в форме ФАД в цельной крови.
Кто назначает исследование?
Терапевт, невролог, офтальмолог, дерматовенеролог, гастроэнтеролог, врач общей практики, эндокринолог.
Литература
- Pinto JT, Zempleni J. Riboflavin. Adv Nutr. 2016 Sep 15;7(5):973-5.
- Powers HJ, Corfe BM, Nakano E. Riboflavin in development and cell fate. Subcell Biochem. 2012;56:229-45.
- Kuppuraj G, Kruise D, Yura K. Conformational behavior of flavin adenine dinucleotide: conserved stereochemistry in bound and free states. J Phys Chem B. 2014 Nov 26;118(47):13486-97.
- Robbins JM, Souffrant MG, Hamelberg D, Gadda G, Bommarius AS. Enzyme-Mediated Conversion of Flavin Adenine Dinucleotide(FAD) to 8-Formyl FAD in Formate Oxidase Results in a Modified Cofactor with Enhanced Catalytic Properties. Biochemistry. 2017 Jul 25;56(29):3800-3807.
Источник
Строение коферментов



Коферменты в каталитических реакциях осуществляют транспорт различных групп атомов, электронов или протонов. Коферменты связываются с ферментами:
— гидрофобными взаимодействиями и т.д.
Один кофермент может быть коферментом для нескольких ферментов. Многие коферменты являются полифункциональными (например, НАД, ПФ). В зависимости от апофермента зависит специфичность холофермента.
Все коферменты делят на две большие группы: витаминные и невитаминные.
Коферменты витаминной природы– производные витаминов или химические модификации витаминов.
1 группа: тиаминовые – производные витамина В1. Сюда относят:
— тиаминдифосфат (ТДФ) или тиаминпирофосфат (ТПФ) или кокарбоксилаза;
ТПФ имеет наибольшее биологическое значение. Входит в состав декарбоксилазы кетокислот: ПВК, a-кетоглутаровая кислота. Этот фермент катализирует отщепление СО2.
Кокарбоксилаза участвует в транскетолазной реакции из пентозофосфатного цикла.
2 группа: флавиновые коферменты, производные витамина В2. Сюда относят:
Ребитол и изоалоксазин образуют витамин В2. Витамин В2 и остаток фосфорной к-ты образуют ФМН. ФМН в соединении с АМФ образуют ФАД.
[рис. изоалоксазиновое кольцо соединено с ребитолом, ребитол с фосфорной к-той, а фосфорная к-та – с АМФ]
ФАД и ФМН являются коферментами дегидрогеназ. Эти ферменты катализируют отщепление от субстрата водорода, т.е. участвуют в реакциях окисления–восстановления. Например СДГ – сукцинатдегидрогеназа – катализирует превращение янтарной к-ты в фумаровую. Это ФАД-зависимый фермент. [рис. COOH-CH2-CH2-COOH® (над стрелкой – СДГ, под – ФАД и ФАДН2) COOH-CH=CH-COOH]. Флавиновые ферменты (флавинзависимые ДГ) содержат ФАД, который в них является первоисточником протонов и электронов. В процессе хим. реакций ФАД превращается в ФАДН2. Рабочей частью ФАД является 2 кольцо изоалоксазина; в процессе хим. реакции идет присоединение двух атомов водорода к азотам и перегруппировка двойных связей в кольцах.
3 группа: пантотеновые коферменты, производные витамина В3 – пантотеновой кислоты. Входят в состав кофермента А, НS-КоА. Этот кофермент А является коферментом ацилтрансфераз, вместе с которой переносит различные группировки с одной молекулы на другую.
4 группа: никотинамидные, производные витамина РР — никотинамида:
Коферменты НАД и НАДФ являются коферментами дегидрогеназ (НАДФ-зависимых ферментов), например малатДГ, изоцитратДГ, лактатДГ. Участвуют в процессах дегидрирования и в окислительно-восстановительных реакциях. При этом НАД присоединяет два протона и два электрона, и образуется НАДН2.
Рис. рабочей группы НАД и НАДФ: рисунок витамина РР, к которому присоединяется один атом Н и в результате происходит перегруппировка двойных связей. Рисуется новая конфигурация витамина РР + Н + ]
5 группа: пиридоксиновые, производные витамина В6. [рис. пиридоксаля. Пиридоксаль+ фосфорная к-та= пиридоксальфосфат]
Эти формы взаимопревращаются в процессе реакций. При взаимодействии пиридоксаля с фосфорной кислотой получается пиридоксальфосфат (ПФ).
ПФ является коферментом аминотрансфераз, осуществляет перенос аминогруппы от АК на кетокислоту – реакция переаминирования. Также производные витамина В6 входят как коферменты в состав декарбоксилаз АК.
Коферменты невитаминной природы – вещества, которые образуются в процессе метаболизма.
1) Нуклеотиды – УТФ, УДФ, ТТФ и т.д. УДФ-глюкоза вступает в синтез гликогена. УДФ-гиалуроновая к-та используется для обезвреживания различных веществ в трансверных реакциях (глюкоуронил трансфераза).

2) Производные порфирина (гем): каталаза, пероксидаза, цитохромы и т.д.
3) Пептиды. Глутатион – это трипептид (ГЛУ-ЦИС-ГЛИ), он участвует в о-в реакциях, является коферментом оксидоредуктаз (глутатионпероксидаза, глутатионредуктаза). 2GSH«(над стрелкой 2Н) G-S-S-G. GSH является восстановленной формой глутатиона, а G-S-S-G – окисленной.
4) Ионы металлов, например Zn 2+ входит в состав фермента АлДГ (алкогольдегидрогеназы), Cu 2+ — амилазы, Mg 2+ — АТФ-азы (например, миозиновой АТФ-азы).
Могут участвовать в:
-присоединении субстратного комплекса фермента;
-стабилизация оптимальной конформации активного центра фермента;
Источник
Кофермент — витамин, необходимый для функционирования фермента

 | Коферменты (коэнзимы) — органические соединения небелковой природы, необходимые для осуществления каталитического действия многих ферментов. Многие коферменты легко отделяются от ферментного белка и служат переносчиками электронов, отдельных атомов или групп атомов субстрата, превращение которого катализирует данный фермент, т.е. функционируют в качестве промежуточных акцепторов. Наиболее распространенную группу составляют соединения нуклеотидной природы, а также коферменты, содержащие остатки фосфорной кислоты. Адениловые нуклеотиды — аденозин-5-трифосфат (АТФ), аденозин-5-дифосфат (АДФ), Р1,Р5 –ди(аденозин -5-) пентафосфат (АП5А) и аденозин-5-монофосфорной кислоты (АМФ) наряду с их ключевой ролью в обмене энергии участвуют в реакциях переноса и активации орто- и пирофосфатных остатков, аминоацильных групп, остатков неорганических кислот.
N-Ацетил-L-Цистеин — это модифицированная форма цистеина, которая была присоединена к ацетил группе. Было доказано, что N-Ацетил-L-Цистеин способен увеличивать уровень антиоксиданта глутатиона. Свойства N-Ацетил-L-Цистеин главным образом связаны с его тиоловой группой, которая делает его эффективным в большинстве биохимических путей, где задействован трипептидглутатион. Цистеин находится среди трех аминокислот, содержащих трипептидглутатион, так что N-Ацетил-L-Цистеин считается предшественником трипептидглутатиона с его деацетилированным цистеином. Ацетил-L-Цистеин использовался и по-прежнему широко используется в качестве муколитического агента, когда способ действия в целом относится к окислительно-восстановительному разрушению чувствительных дисульфидных мостиков цистеина в белках слизи. Источник ➤ Adblockdetector |