Содержит кольцо тиазола витамин
Витамин B1 (тиамин)
В конце прошлого века тысячи моряков на японских судах страдали, а многие из них умирали мучительной смертью от таинственной болезни, называвшейся «бери-бери». Одной из загадок бери-бери было то, что моряки на судах других стран этой болезнью не болели.
В 1882 г. японский морской врач Канегиро Такаки в своей работе, вполне заслуживающей названия «медицинского детектива», показал, что решение проблемы борьбы с этой болезнью заключается в правильном питании. Он обнаружил, что замена очищенного риса, составлявшего в основном рацион питания японских моряков, неочищенным не только помогает излечиться от болезни, но и предотвращает ее появление. Такаки предположил, что в рисовой шелухе содержатся какие-то важные белки, которых недоставало в пище болевших матросов.
Последующая работа показала, что такое предположение правильно лишь отчасти. В рисовой шелухе действительно находится существенно важный для правильного питания фактор, однако вещество это не является белком. Это небольшая органическая молекула, называемая тиамином, который служит коферментом, т. е. действует вместе с ферментом (являющимся белком), катализируя специфические обменные химические реакции.
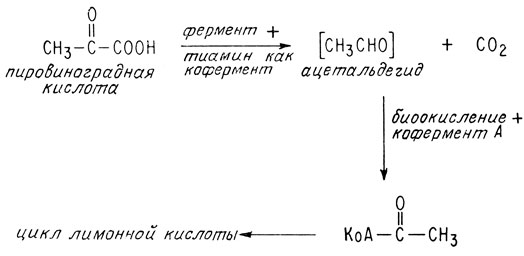
Одной из важных обменных реакций, требующих участия тиамина, является реакция декарбоксилирования пировиноградной кислоты
В гл. 2 было показано, что эта реакция «питает» цикл образования лимонной кислоты — очень важную последовательность реакций, которая служит источником энергии для живых систем, ведущих аэробный образ жизни. Не удивительно, что недостаток тиамина приводит к сильнейшему клеточному истощению * .
* ( Тиамин — единственный из известных коферментов, для которого диагноз надвигающегося недостатка витамина можно поставить химическим путем, до того как разовьется болезнь бери-бери.)
Растения могут синтезировать тиамин, а животные и человек такой способностью не обладают; некоторые бактерии и грибы также не способны синтезировать тиамин. Таким образом, и животные, и человек должны получать тиамин с пищей, и, поскольку соединение это не относится ни к белкам, ни к углеводам, ни к жирам, его назвали витамином и произвольно обозначили как витамин B1. Большое количество этого витамина содержат яйца, мясо, горох и бобы. Суточная потребность человека составляет 1-3 мг витамина В1.
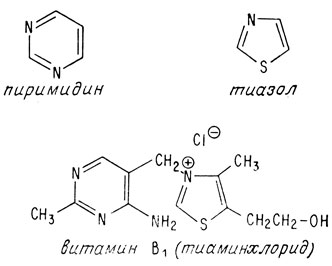
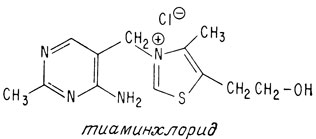
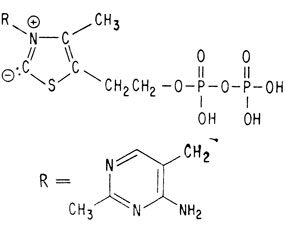
Впервые витамин B1 был выделен в 1926 г. из рисовой шелухи. Спустя десять лет была установлена его структура и осуществлен синтез. Молекула этого витамина состоит из двух циклических компонентов, соединенных мостиком из одного атома углерода. В этом смысле она напоминает молекулу хинина. Однако циклические компоненты тиамина отличаются от компонентов хинина. Тиамин содержит пиримидиновое кольцо (которое уже встречалось, когда речь шла о нуклеиновых кислотах) и кольцо тиазола. Тиазольное кольцо содержит атом серы и атом азота.
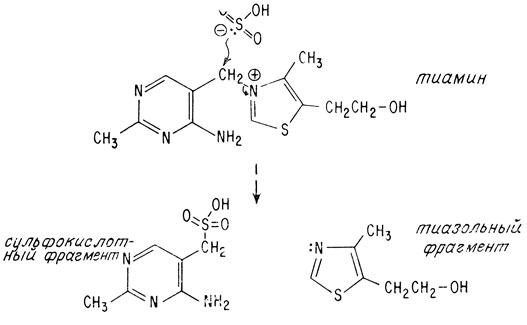
Установление структуры витамина B1 не представляло особых трудностей еще и потому, что его молекулу можно расщепить на две части в очень мягких условиях. Сульфит-ион в почти нейтральном водном растворе атакует мостиковый атом углерода, в результате чего освобождается тиазольное кольцо
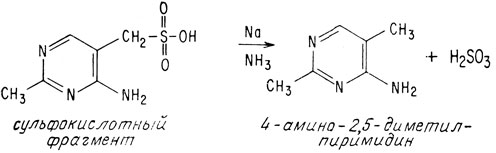
Мостиковый углеродный атом тиамина подвержен нуклеофильной атаке вследствие мощного электроноакцепторного воздействия положительно заряженного атома азота. Сульфогруппу можно удалить действием раствора металлического натрия в безводном жидком аммиаке
Ультрафиолетовые спектры как сульфокислотного производного, так и продукта его восстановления показали, что эти соединения могли бы быть пиримидинами; такая их структура впоследствии была подтверждена синтезом.
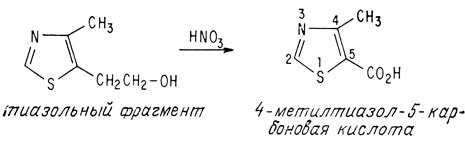
На основании ультрафиолетовых спектров также предположили, что другая часть молекулы, получаемая в результате разложения молекулы под действием сульфита, может содержать тиазольное кольцо. При окислении этого фрагмента азотной кислотой получилось известное производное тиазола 4-метилтиазол-5-карбо-новая кислота
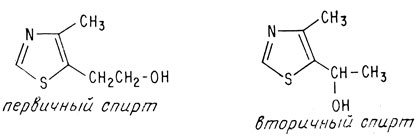
Тиазольный фрагмент до окисления азотной кислотой не содержит карбоксильной группы, а потому атом углерода, входящий в карбоксильную группу, должен изменяться в процессе этой реакции. Согласно данным элементного анализа, до окисления этот фрагмент содержал шесть атомов углерода и лишь один атом кислорода. Известно, что этот атом кислорода входит в гидроксильную группу, поскольку он может образовать сложный эфир. Все эти данные указывают на две возможные структуры тиазольного фрагмента — одну с первичной спиртовой группой, другую со вторичной спиртовой группой.
Первичные и вторичные спирты можно легко различить при помощи простых химических реакций. Эти реакции показали, что в тиазольном фрагменте содержится первичная спиртовая группа. Структура, включающая вторичную спиртовую группу, имеет также асимметричный углеродный атом, а потому ее можно было бы разделить на оптически активные фракции. Однако тиазольный фрагмент на оптически активные антиподы не разделяется. Синтез структуры, содержащей первичную спиртовую группу, подтвердил ее идентичность с тиазольным фрагментом.
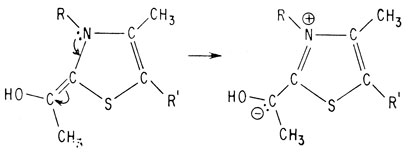
Этим завершается установление структуры обоих фрагментов молекулы тиамина, однако вопрос о том, как же эти фрагменты связаны друг с другом, остается без ответа. На характер соединения этих фрагментов друг с другом указывают следующие данные. Во-первых, молекула тиамина не содержит сульфогруппы, поэтому атом углерода, сульфируемый сульфит-ионом, должен участвовать в соединении фрагментов. Во-вторых, издавна известно, что тиамин является четвертичным аммониевым соединением, т. е. существует в виде соли. Единственным атомом азота, который может отвечать этим требованиям и способен связать оба фрагмента, является атом азота тиазола. Следовательно, мостиковый атом углерода должен быть присоединен к атому азота тиазола, как показано ниже:
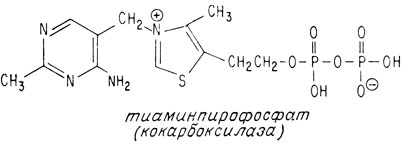
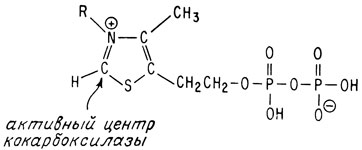
Теперь, когда структура тиамина установлена, интересно узнать, как он действует в организме в роли витамина. Мы уже говорили о том, что он представляет собой кофермент, участвующий в реакции декарбоксилирования пировиноградной кислоты, питающей важнейший цикл лимонной кислоты. В качестве кофермента тиамин присутствует во всех живых клетках в виде эфира пирофосфорной кислоты
Этот кофермент называется кокарбоксилазой, поскольку он действует совместно с ферментом карбоксилазой, катализирующей декарбоксилирование пировиноградной кислоты. Полностью ферментативная система состоит из белка с молекулярным весом около 150000, одной молекулы кофермента и пяти атомов магния.
Активным центром кофермента считают атом углерода, расположенный между атомом серы и четвертичным атомом азота
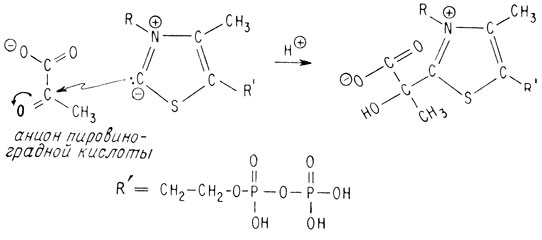
Этот атом углерода сначала теряет протон и становится отрицательно заряженным нуклеофилом
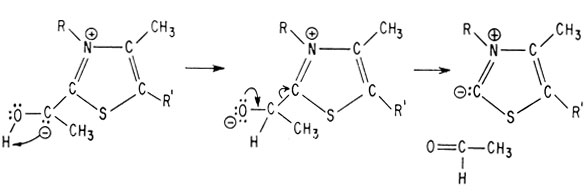
В качестве нуклеофила он может атаковать входящий в кетогруппу углеродный атом аниона пировиноградной кислоты (R-радикал, изображенный выше)
Мощное электроноакцепторное воздействие положительно заряженного четвертичного атома азота облегчает в этом случае декарбоксилирование аниона пировиноградной кислоты
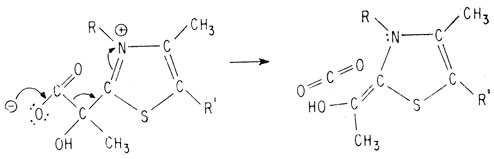
Восстановление системы сопряженных двойных связей тиазольного кольца приводит к образованию стабильного карбаниона
В этой молекуле возможен сдвиг протона и высвобождение продукта декарбоксилирования, в результате чего вновь получается исходный тиазол, являющийся нуклеофилом
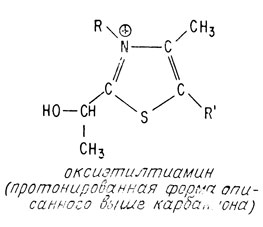
В пользу такого механизма действия витамина B1 свидетельствуют два факта. Во-первых, было синтезировано одно из приведенных выше промежуточных соединений — оксиэтилтиамин, которое по биологической активности почти не отличается от самого витамина B1
Во-вторых, это промежуточное соединение было выделено из микроорганизмов.
Как показано в суммарной реакции цикла лимонной кислоты в гл. 2, образующийся ацетальдегид затем окисляется и включается в цикл.
Источник
Витамин B1
Исторические сведения
Первые упоминания о заболевании (какке, бери-бери), известном сейчас как проявление недостаточности тиамина, встречаются в древних медицинских трактатах, дошедших до нас из Китая, Индии, Японии. К концу 19-го столетия клинически уже различали несколько форм этой патологии, но только Takaki (1887) связал заболевание с какой-то, как он тогда полагал, недостаточностью азотсодержащих веществ в пищевом рационе. Более определенные представления были у голландского врача С. Eijkman (1893—1896), обнаружившего в рисовых отрубях и в некоторых бобовых растениях неизвестные тогда факторы, предупреждавшие развитие или излечивавшие бери-бери. Очисткой этих веществ занимались затем Funk (1924), впервые предложивший сам термин «витамин», и ряд других исследователей. Извлеченное из естественных источников активное вещество только в 1932 г. было охарактеризовано общей эмпирической формулой, а затем в 1936 г. успешно синтезировано Williams с соавторами. Еще в 1932 г. высказывалось предположение о роли витамина в одном из конкретных процессов обмена веществ — декарбоксилировании пировиноградной кислоты, но лишь в 1937 г. стала известна коферментная форма витамина — тиаминдифосфат (ТДФ). Коферментные функции ТДФ в системе декарбоксилирования альфа-кетокислот долгое время представлялись почти единственными биохимическими механизмами реализации биологической активности витамина, однако уже в 1953 г. круг ферментов, зависящих от присутствия ТДФ, был расширен за счет транскетолазы, а сравнительно недавно и специфической декарбоксилазы гамма-окси-альфа-кетоглютаровой кислоты. Нет оснований думать, что перечисленным исчерпывается перспектива дальнейшего изучения витамина, так как эксперименты на животных, данные, получаемые в клинике при лечебном применении витамина, анализ фактов, иллюстрирующих известную нейро- и кардиотропность тиамина, с несомненностью указывает на наличие еще каких-то специфических связей витамина с другими биохимическими и физиологическими механизмами.
Химические и физические свойства витамина В1
Тиамин или 4-метил-5-бета-оксиэтил-N- (2-метил-4-амино-5-метилпиримидил) -тиазолий, получается синтетически обычно в виде хлористо- или бромистоводородной соли.
Тиаминхлорид (М-337,27) кристаллизуется в воде в виде бесцветных моноклинических игл, плавится при 233—234° (с разложением). В нейтральной среде его спектр поглощения имеет два максимума — 235 и 267 нм, а при рН 6,5 один — 245—247 нм. Витамин хорошо растворяется в воде и уксусной кислоте, несколько хуже в этиловом и метиловом спиртах и нерастворим в хлороформе, эфире, бензоле, ацетоне. Из водных растворов тиамин может быть осажден фосфорно-вольфрамовой или пикриновой кислотой. В щелочной среде тиамин подвергается многочисленным превращениям, которые, в зависимости от природы добавленного окислителя, могут завершаться образованием тиаминдисульфида или тиохрома.
В кислой среде витамин разлагается только при длительном нагревании, образуя 5-гидрокси-метилпиримидин, муравьиную кислоту, 5-аминометилпиримидин, тиазоловый компонент витамина и З-ацетил-3-меркапто-1-пропанол. Среди продуктов распада витамина в щелочной среде идентифицированы тиотиамин, сероводород, пиримидодиазепин и др. Получены также сульфат и мононитрат витамина. Известны соли тиамина с нафталенсульфоновой, арилсульфоновой, цетилсерной и эфиры с уксусной, пропионовой, масляной, бензойной и другими кислотами.
Особое значение имеют эфиры тиамина с фосфорной кислотой, в частности ТДФ, являющийся коферментной формой витамина. Получены также гомологи тиамина путем различных замещений у второго (этил-, бутил-, оксиметил-, оксиэтил-, фенил-, оксифенил-, бензил-, тиоалкил-), четвертого (окситиамин) и шестого (метил-, этил) атомов углерода пиримидина метилированием аминогруппы, замещением тиазолового цикла на пиридиновой (пири-тиамин), имидозоловый или оксазоловый, модификациями заместителей у пятого углерода тиазола (метил-, оксиметил-, этил, хлорэтил-, оксипропил- и др.) . Отдельную большую группу соединений витамина составляют S-алкильные и дисульфидные производные. Среди последних наибольшее распространение как витаминный препарат получил тиаминпропилдисульфид (ТПДС).
Методы определения витамина В1
В чистых водных растворах количественное определение тиамина легче всего проводить по поглощению при 273 нм, что соответствует изобестической точке спектра витамина, хотя некоторые авторы предпочитают работать в области 245 нм, в которой изменения экстинкции наиболее заметны. При рН 7,3 в фосфатном буфере тиамин еще в концентрации 1 мкг/мл дает отчетливую водородную полярографическую каталитическую волну, а в щелочной среде образует анодную волну, обусловленную взаимодействием тиолтиамина со ртутью и образованием меркаптида. Обе полярографические характеристики можно применить для количественного определения витамина. Если необходимо исследовать различные производные витамина, то приходится прибегать к предварительному их разделению путем электрофореза или хроматографии.
Наиболее удачным общим принципом колориметрического определения витамина являются реакции его взаимодействия с различными диазосоединениями, среди которых наилучшие результаты дает диазотированный р-аминоацетофенон. Образующееся ярко окрашенное соединение легко экстрагируется из водной фазы в органический растворитель, в котором оно легко подвергается количественному фотометрированию. В фосфатном буфере рН 6,8 тиамин при нагревании взаимодействует также с нингидрином, давая желтую окраску, пропорциональную концентрации витамина в интервале 20—200 мкг.
Наибольшее распространение получили различные варианты флюо-риметрического определения витамина, основанные на окислении тиамина в тиохром в щелочной среде. Предварительная очистка исследуемого материала от мешающих последующему флюориметрированию примесей достигается кратковременным кипячением проб с разбавленными минеральными кислотами, удалением примесей экстракцией бутиловым или амиловым спиртами или выделением витамина на соответствующих адсорбентах. Как показали исследования японских авторов, в качестве окислителя вместо феррицианида калия предпочтительнее применять бромциан, дающий больший выход тиохрома и снижающий образование других мешающих определению соединений. Для удовлетворительного определения тиамина требуется 100—200 мг ткани или 5—10 мл крови. Учитывая, что основной формой витамина, присутствующей в тканях, является ТДФ или протеидизированные дисульфидные производные тиамина, всегда необходима предварительная обработка исследуемых образцов (слабый кислотный гидролиз, фосфатаза, восстанавливающие агенты) для выделения свободного тиамина, так как другие формы витамина не образуют тиохрома, экстрагируемого затем для флюориметрии в органический растворитель.
Количественное определение коферментной формы витамина производится путем рекомбинации содержащегося в исследуемом растворе ТДФ с дружжевой апокарбоксилазой. В обоих случаях в присутствии ионов магния и пирувата происходит специфическое декарбоксилирование кетокислоты, а количество выделяющейся углекислоты (в аппарате Варбурга) пропорционально внесенному в пробу количеству ТДФ (0,02— 1 мкг). Еще выше чувствительность (0,005—0,06 мкг ТДФ) метода, основанного на ферментативном определении ацетальдегида, образующегося в первой реакции. Внесение в инкубационную среду наряду с апокарбоксилазой и специфическим субстратом еще и алкогольдегидрогеназы позволяет очень быстро (5—7 минут) вести учет реакции по изменению экстинкции раствора при 340 нм в области, соответствующей НАДН2.
Другие фосфаты тиамина определяются количественно после элек-трофоретического или хроматографического разделения их, последующей элюции, дефосфорилирования фосфатазами и флюориметрии полученного путем окисления в щелочной среде тиохрома. Микробиологические методы определения тиамина основываются на подборе соответствующих культур микроорганизмов, чувствительных к недостатку витамина. Наиболее точные и воспроизводимые результаты дает применение для этих целей Lactobacillus fermenti-36.
Распространение витамина В1 в природе
Содержание тиамина в некоторых продуктах питания
| Продукт | Содержание тиамина в мкг % | Продукт | Содержание тиамина в мкг % |
| Пшеница | 0,45 | Томаты | 0,06 |
| Рожь | 0,41 | Говядина | 0,10 |
| Горох | 0,72 | Баранина | 0,17 |
| Фасоль | 0,54 | Свинина | 0,25 |
| Крупа овсяная | 0,50 | Телятина | 0,23 |
| Крупа гречневая | 0,51 | Ветчина | 0,96 |
| Крупа манная | 0,10 | Куры | 0,15 |
| Рис шлифованный | Яйца куриные | 0,16 | |
| Макароны | следы | Рыба свежая | 0,08 |
| Мука пшеничная | 0,2-0,45 | Молоко коровье | 0,05 |
| Мука ржаная | 0,33 | Фрукты разные | 0,02-0,08 |
| Хлеб пшеничный | 0,10-0,20 | Дрожжи пивные сухие | 5,0 |
| Хлеб ржаной | 0,17 | Орехи грецкие | 0,48 |
| Картофель | 0,09 | Орехи земляные | 0,84 |
| Капуста белокачанная | 0,08 |
Тиамин распространен повсеместно и обнаруживается у разных представителей живой природы. Как правило, количество его в растениях и микроорганизмах достигает величин значительно более высоких, чем у животных. Кроме того, в первом случае витамин представлен преимущественно свободной, а во втором — фосфорилированной формой. Содержание тиамина в основных продуктах питания колеблется в довольно широких пределах в зависимости от места и способа получения исходного сырья, характера технологической обработки полупродуктов и т. п. Величины, приводимые по этому поводу в литературе , характеризуют, как правило, уровень витамина до кулинарной обработки, которая сама по себе значительно разрушает тиамин. В среднем можно считать, что обычное приготовление пищи разрушает около 30% витамина. Некоторые виды обработки (высокая температура, повышенное давление и наличие больших количеств глюкозы), разрушают до 70—90% витамина, а консервация продуктов путем обработки их сульфитом может полностью инактивировать витамин. В злаковых и семенах других растений тиамин, подобно большинству водорастворимых витаминов, содержится в оболочке и зародыше. Переработка растительного сырья (удаление отрубей) всегда сопровождается резким снижением уровня витамина в полученном продукте. Шлифованный рис, например, совсем не содержит витамина.
Обмен тиамина в организме
Витамин поступает с пищей в свободном, эстерифицированном и частично связанном виде. Под влиянием пищеварительных ферментов происходит почти количественное его превращение в свободный тиамин, который всасывается из тонкого кишечника. Значительная часть поступившего в кровь тиамина быстро фосфорилируется в печени, часть его в виде свободного тиамина поступает в общий кровоток и распределяется по другим тканям, а часть снова выделяется в желудочно-кишечный тракт вместе с желчью и экскретами пищеварительных желез, обеспечивая постоянную рециркуляцию витамина и постепенное, равномерное усвоение его тканями. Почки активно экскретируют витамин в мочу. У взрослого человека за сутки выделяется от 100 до 600 мкг тиамина. Введение повышенных количеств витамина с пищей или парентерально увеличивает выделение витамина с мочой, но по мере повышения доз пропорциональность постепенно исчезает. В моче наряду с тиамином начинают в возрастающих количествах появляться продукты его распада, которых при введении витамина свыше 10 мг на человека может быть до 40—50% исходной дозы. Опыты с меченым тиамином показали, что наряду с неизмененным витамином в моче обнаруживается некоторое количество тиохрома, ТДС, пиримидиновый, тиалозовый компоненты и различные углерод- и серусодержащие осколки, в том числе меченые сульфаты.
Таким образом, разрушение тиамина в тканях животных и человека происходит достаточно интенсивно, но попытки обнаружить в животных тканях ферменты, специфически разрушающие тиамин, пока не дали убедительных результатов.
Суммарное содержание тиамина во всем организме человека, нормально обеспеченного витамином, составляет примерно 30 мг, причем в цельной крови его находится 3—16 мкг%, а в других тканях значительно больше: в сердце — 360, печени — 220, в мозге — 160, легких — 150, почках — 280, мышцах — 120, надпочечнике — 160, желудке — 56, тонком кишечнике — 55, толстом кишечнике — 100, яичнике — 61, яичках — 80, коже — 52 мкг%. В плазме крови обнаруживается преимущественно свободный тиамин (0,1 — 0,6 мкг%), а в эритроцитах (2,1 мкг на 1011 клеток) и лейкоцитах (340 мкг на Ю11 клеток) — фосфорилированный. Почти половина витамина находится в мышцах, 40%—во внутренних органах, причем 15—20% в печени. Основное количество тиамина тканей представлено ТДФ, хотя кожа и скелетные мышцы содержат довольно много дисульфидов витамина.
Свободный тиамин в норме легко определяется в кишечнике и почках, что может быть связано и с недостатками чисто методического порядка, так как эти ткани обладают исключительно высокой фосфатазной активностью и к моменту взятия материала на исследование уже может происходить частичное дефосфорилирование эфиров витамина. С другой стороны, эти же механизмы могут играть определенную роль в удалении витамина из крови в мочу или кал. Количество витамина в кале у человека составляет примерно 0,4—1 мкг и практически не зависит от биосинтеза витамина кишечной микрофлорой.
Некоторое представление о динамике обмена тканевых запасов витамина дают опыты, проведенные с S35-тиамином . Обновление тиамина происходит в разных тканях с различной скоростью и практически полная замена нерадиоактивного витамина на радиоактивный (вводимый ежедневно) осуществляется к 8-му дню опыта лишь в печени, почках, селезенке и скелетных мышцах. В сердце, поджелудочной железе и ткани мозга к указанному сроку процесс этот не завершается. Эти данные показывают, что количество витамина, находящегося в тканях, во много раз выше того уровня, который необходим для обеспечения специфических ферментных систем ТДФ. По-видимому, значительные количества витамина присутствуют в тканях, особенно в сердце и печени, в виде его производных, осуществляющих какие-то другие некоферментные функции.
Механизмы депонирования тиамина в организме
Фиксация витамина в тканях связана в основном с образованием ТДФ, который составляет не менее 80—90% всего тиамина, обнаруживаемого в организме. Некоторая неопределенность представлений по этому вопросу связана с обнаружением наряду с ТДФ, особенно в короткие промежутки после введений витамина, других ТФ и смешанных тиаминдисульфидов. При определенных условиях от 10 до 30% витамина может быть представлено ТМФ и ТТФ. Кроме того, ТТФ легко превращается в ТДФ в ходе обработки биологического материала перед исследованием. Подобно другим фосфорилированным коферментам, ТДФ фиксируется на белках по свой пирофосфатной группировке. Однако, и другие участки молекулы витамина играют при этом, не менее активную роль.
Образование тиаминфосфатов (тф)
Реакция фосфорилирования тиамина происходит за счет АТФ по общему уравнению: тиамин +АТФ—> ТДФ+АМФ.
Закономерности этой реакции были подтверждены на частично очищенном препарате тиаминкиназы из растворимой фракции гомогената печени. Оптимум рН для образования ТДФ этим ферментным препаратом лежал в пределах 6,8—6,9. Фосфорилирование тиамина подавлялось АМФ и АДФ. В присутствии АМФ образовывались лишь следы, а в присутствии АДФ — весьма незначительные количества ТДФ. Если в среду вместо тиамина вносился ТМФ, то образование ТДФ тормозилось. Очищенный примерно в 600 раз препарат тиамикиназы был применен для изучения механизма фосфорилирования витамина с использованием меченой гамма-Р32-АТФ. Оказалось, что тиамин получает от АТФ целиком пирофосфатную группировку.
В серии работ по изучению тиаминкиназы, выделенной из дрожжей и животных тканей, установлено, что ионы марганца, магния и кобальта активировали, а кальция, никеля, рубидия и железа — в широком диапазоне концентраций не угнетали фермент. В этих же работах показана возможность фосфорилирования тиамина за счет других нуклеотидтрифосфатов (ГТФ, ИТФ, УТФ и др.) и то, что основным продуктом реакции является ТДФ и небольшое количество ТМФ. Применением Р32-АТФ, как и в исследованиях предыдущих авторов, подтвержден механизм переноса на тиамин сразу пирофосфатной группировки.
Однако результаты, полученные in vitro, не нашли полного подтверждения при изучении фосфорилирования тиамина в организме и в опытах с митохондриями. С одной стороны, после внутривенного введения тиамина уже через 30—60 минут в крови животных обнаруживались меченные по фосфору ТДФ и ТТФ, но не ТМФ, т.е. подтверждался механизм пирофофорилирования. С другой стороны, после внутривенного введения ТМФ кокарбоксилазная и транскетолазная активность крови нарастала быстрее, чем после введения свободного тиамина. Некоторые микроорганизмы легче образуют ТДФ из ТМФ, чем из свободного витамина, а тиаминкиназа, найденная ранее в печени, не обнаружена в митохондриях почек, в которых фосфорилирование тиамина идет другим путем. Механизм фосфорилирования витамина с участием только АТФ не всегда укладывается в простую схему переноса пирофосфатной группировки в целом хотя бы потому, что наряду с ТДФ в различном биологическом материале обнаруживаются в значительных количествах и другие ТФ, в том числе даже Т-полифосфаты.
Ряд исследований касается вопроса о локализации систем, ответственных за фосфорилирование тиамина. Печень уже через час после введения тиамина захватывает 33—40% витамина, накапливая различные его фосфорные эфиры. Фосфорилирование меченого витамина в разных органах происходит в порядке убывающей активности: печень, почки, сердце, семенники, головной мозг. При этом радиоактивность фосфорных эфиров тиамина убывает в ряду: ТТФ, ТДФ, ТМФ. Фосфорилирование тиамина идет активно в митохондриях , микросомах и гиалоплазме.
Из изложенных выше фактов нетрудно сделать вывод, что общая интенсивность процессов эстерификации витамина в организме или в отдельных тканях должна в значительной степени коррелировать с активностью процессов, поставляющих АТФ. Первые экспериментальные наблюдения в этом плане, проведенные на гомогенатах печени или клеточных элементах крови, получили в дальнейшем полное подтверждение. Все ингибиторы дыхания и гликолиза или соединения, конкурирующие с Т за АТФ, как правило, снижают уровень ТДФ в крови и в тканях.
Роль отдельных группировок в молекуле тиамина для его связывания в тканях
К настоящему времени синтезировано больщое количество новых производных тиамина (смешанные дисульфиды, О-бензоильные производные и др.), широко внедряемых в лечебную и профилактическую практику. Преимущества новых витаминных препаратов, как правило, выявлялись чисто эмпирически в связи с тем, что до настоящего времени мы не располагаем достаточными сведениями о молекулярных механизмах ассимиляции тиамина, о характере его взаимодействия со специфическими (ферменты) и неспецифическими (осуществляющими транспорт витамина) белками. Необходимость точных представлений в этом вопросе диктуется и широкими перспективами использования антивитаминов тиамина (ампрол, хлоротиамин, деокситиамин) для лечебных целей (см. ниже).
Работы по синтезу новых производных тиамина с заранее заданными физико-химическими свойствами, обусловливающими возможности целенаправленного воздействия на обменные процессы в организме, немыслимы без конкретных представлений о роли отдельных групп атомов витамина и его производных в этой области. Значение пирофосфатного радикала для специфической протеидизации ТДФ в составе соответствующих ферментов уже отмечалось выше. Появилось большое количество данных, доказывающих участие тиамина в других реакциях, не имеющих ничего общего с коферментными функциями витамина. Можно допустить, что разнообразию активных группировок в молекуле тиамина соответствуют особые формы претеидизации, при которых блокируются одни и открываются одновременно другие, важные для соответствующей функции, участки молекулы витамина . Действительно, первый тип протеидизации (через пирофосфатный радикал) отвечает коферментной функции и оставляет свободными, доступными для субстрата 2-й углерод тиазола и аминогруппу пиримидинового компонента. С другой стороны, очевидно, что участие витамина в окислительно-восстановительных реакциях или в процессах перефосфорилирования должно сочетаться с исключением возможности одновременного функционирования его как кофермента, так как в первом случае необходима деполяризация и раскрытие тиазолового цикла, а во втором — свободное положение фосфорилированного оксиэтильного радикала. Поскольку 80—90% тиамина, присутствующего в тканях, освобождается лишь при кислотном и ферментативном гидролизе, можно считать, что все связанные формы витамина находятся в протеидизированном, т. е. связанном с белками, состоянии.
Представление о значении отдельных участков молекулы тиамина в этом процессе легко получить, определяя степень связывания тканями меченного по сере (S35) витамина и некоторых его производных, лишенных тех или иных активных центров, например аминогруппы — окситиамин (окси-Т), аминогруппы и оксиэтильного радикала — хлорокситиамин (ХОТ), четвертичного азота в тиазоловом цикле — тетрагидротиамин (ТТ). Не касаясь деталей затронутого вопроса, можно с достаточной уверенностью утверждать, что модификации структуры хотя бы одного участка в молекуле витамина резко нарушают (см.таблицу) условия его_связывания тканями: через 24 часа все введенные меченые производные тиамина связываются хуже, чем витамин.
Содержание меченных S35 производных тиамина в тканях крыс через 24 часа после подкожного введения 100 мкг каждого из препаратов.
| Ткани | Содержание в мкг % | |||
| Т | ОТ | ХОТ | ТТ | |
| Печень | 138 | 28 | 34 | 9 |
| Почка | 97 | 19 | 43 | 13 |
| Сердце | 80 | 10 | 20 | 4 |
| Селезенка | 44 | 14 | 10 | 7 |
| Мышцы | 20 | 9 | 10 | 4 |
| Мозг | 45 | 6 | 4 | |
| Подкожная клетчатка | 150 | 80 | 148 | 264 |
| Кровь | 3,4 | 1,4 | 4,2 | 0,5 |
| Моча (%) | 31 | 50 | 38 | 65 |
Сам по себе этот факт говорит о том, что при взаимодействии тиамина с белками играет роль не одна—две, а, по-видимому, несколько группировок.
Коферментные функции тиаминдифосфата
Известно значительное количество различных реакций, катализируемых ТДФ. Однако все их можно свести к нескольким типичным вариантам: простое и окислительное декарбоксилирование альфа-кетокислот, ацилоиновая конденсация, фосфорокластическое расщепление кетосахаров. Ферментные системы, принимающие участие в этих реакциях, по-видимому, едины в основных принципах своего действия; различна лишь последующая судьба «активного альдегидного осколка», возникающего на первых этапах процесса. Исследования превращений альфа-кетокислот позволили четко представить как роль собственно декарбоксилирующего фрагмента полиферментного комплекса дегидрогеназы, содержащего ТДФ, так и последовательность всех других, связанных с ним реакций.
В системе транскетолазы (ТК) «активный альдегидный» осколок, очевидно, будет представлен гликолевым радикалом, переносимым от соответствующих источников (ксилулозо-5-фосфат, фруктозо-6-фосфат, оксипируват и др.) на различные акцепторы (рибозо-5-фосфат, эритрозо-4-фоофат, глюкозо-6-фосфат). В фосфокетолазной реакции «активный гликолевый» радикал превращается непосредственно в ацетилфосфат.
Значительные успехи в выяснении механизма каталитического действия ТДФ были достигнуты в результате исследований, проведенных в двух основных направлениях: создание модельных неферментативных систем и введение в ферментные системы различных аналогов или антагонистов тиамина. Используя первый путь, удалось показать, что витамин В1 и в нефосфорилированном виде способен при определенных условиях в отсутствие белка катализировать реакции декарбоксилирования, образования ацетона, дисмутации диацетила. Различными вариантами опытов, в которых коферментная активность ТДФ сравнивалась с активностью антиметаболитов витамина или изучалась с добавлением соли Рейнеке, бромацетата, пара-хлор-меркурий-бензоата и других соединений, показано, что каталитически наиболее важными группами в молекуле тиамина являются: сера, четвертичный азот тиазолового кольца, аминогруппа в положении 4 пиримидинового кольца, второй углеродный атом тиазола (2-С-Тз), метиленовый мостик. Некоторые активные центры (сера, азот, метиленовый мостик) необходимы только для поддержания определенной структуры и создания соответствующей электронной плотности у второго углеродного атома тиазола (2-С-Тз), который является главным каталитическим центром. Спорными и неопределенными пока являются представления о значении аминогруппы пиримидинового компонента.
Значение второго углерода тиазола
Впервые каталитические свойства тиазолиевых солей были показаны на примере бензоиновой конденсации. Затем было установлено, что от 2-С-Тз в обычных, близких к физиологическим условиям легко отщепляется протон, а из тиамина образуется двойной ион, для которого легко было постулировать механизмы взаимодействия с альфа-кетокислотами и образование промежуточного соединения оксиэтилтиамина (ОЭТ), соответствующего представлениям об «активном ацетальдегиде».
Синтетические препараты ОЭТ, испытанные как ростовые факторы для микробов, обладали 80% активности по сравнению с витамином. Образование ОЭТ как естественного продукта обмена было показано для некоторых микроорганизмов. Представления о решающей роли 2-С-Тз в осуществлении коферментных функций оказались в достаточной мере плодотворными, так как за относительно короткий промежуток времени были выделены и некоторые производные ТДФ, соответствующие другим известным промежуточным продуктам ферментативных реакций: дигидроксиэтил-ТДФ («активный гликолевый альдегид» в транскетолазной и фосфокетолазной реакции), альфа-гидрокси- гамма-карбокси-пропил-ТДФ («активный янтарный полуальдегид») и оксиметил-ТДФ, играющий роль в обмене глиоксилата и образовании активных формильных радикалов.
Значение пиримидинового компонента
Даже незначительные замещения в аминопиримидиновом компоненте тиамина резко снижают витаминную активность новых соединений. Особое внимание в этом плане уже давно уделяется аминогруппе, замена которой на оксигруппу вызывает образование известного антиметаболита витамина — окси-Т, способного после фосфорилирования до дифосфата подавлять активность как ПД, так и ТК. Потеря коферментной активности наблюдается и в случае незначительных изменений структуры аминогруппы (метилирование) или простого ее удаления из ТДФ.
Критическое рассмотрение обширного экспериментального материала, касающегося изучения каталитической активности тиамина или его производных в модельных и ферментных системах, заставляет по-новому обратить внимание на некоторые особенности строения катализатора и обменивающихся при его участии субстратов.
Такой особенностью, общей для кофермента и субстратов, является строгая зависимость рассматриваемых реакций одновременно от двух активных центров — на субстрате и, по-видимому, на катализаторе. Действительно, все разнообразие субстратов, принимающих участие в реакциях, катализируемых ТДФ, может быть легко сведено к принципиально единому типу, особенностью которого является смежное расположение у соседних углеродных атомов карбонильной и гидроксильной групп. Только между такими углеродными атомами происходит разрыв (тиаминолиз) связи при участии ТДФ.При этом всегда один и тот же осколок становится в дальнейшем «активным», способным к различным конденсациям, а второй — «пассивным», конечным метаболитом реакции. Определенное расположениекарбонильной и гидроксильной групп абсолютно необходимо для осуществления каталитического механизма.
Некоферментная активность тиамина и некоторых его производных
Наряду с выяснением механизма основных реакций, в которых каталитическую роль играет ТДФ, имеются многочисленные данные о высокой биологической активности других некоферментных производных тиамина. Отчетливо наметились два направления исследований: возможное участие различных фосфорных эфиров витамина в активном переносе богатых энергией фосфатных групп (ангидридная связь в ТДФ макроэргическая) и вероятность вмешательства тиамина в окислительно-восстановительные реакции. В связи с тем, что неизвестны специфические тиаминсодержащие ферментные системы, причастные к регуляции упомянутых выше процессов, наблюдаемые в этой сфере обмена эффекты витамина можно рассматривать как проявление его неспецифических функций.
Тиаминофосфаты (тф)
После разработки доступных методов получения ТДФ его стали широко испытывать при различных заболеваниях в клинических условиях. Внутривенное введение 100—500 мг ТДФ при диабетическом ацидозе увеличивало количество пирувата, образующегося из глюкозы. Эффект аналогичного характера наблюдался при диабете после введения АТФ или фосфокреатина. В мышцах при утомлении и отдыхе распад и ресинтез ТДФ происходят примерно по тем же закономерностям, которые известны для АТФ и фосфокреатина. Характерными были изменения во время отдыха, когда количество ТДФ превышало исходный уровень до утомительной работы. Причины усиленного распада ТДФ во время сократительной деятельности мышц вряд ли возможно объяснить с позиции известных коферментных функций ТДФ. Установлено, что введение животным больших доз ТДФ уже через несколько часов значительно (иногда в 2 раза) повышает в тканях содержание лабильных фосфорных соединений.
Свободный тиамин и его производные
Введение животным антиме-таболитов витамина — окси-Т и ПТ — вызывает различную картину нарушений в обмене и в физиологических функциях, что позволило предположить вероятность существования у тиамина нескольких различных или даже независимых друг от друга функций. Различие между этими антиметаболитами с химической точки зрения сводится к исключению тиолдисульфидных превращений у ПТ и трициклических по типу тиохрома (Тх) у окси-Т. Возможность каталитического действия тиамина на уровне окислительно-восстановительных реакций в обмене давно допускают и критикуют разные авторы. Действительно, различная обеспеченность витамином сильно влияет на активность ряда окислительных ферментов или содержание в крови восстановленных форм глютатиона. Витамин обладает антиоксидантными свойствами в отношении аскорбиновой кислоты, пиридоксина и легко взаимодействует с оксигруппами полифенолов. Дигидро-Т частично окисляется в тиамин дрожжами и бесклеточными экстрактами, кристаллическими препаратами пероксидазы, тирозиназы и неферментативно при взаимодействии с кристаллическим убихиноном, пластохиноном, менадионом.
Тиол-дисульфидные превращения
ТДС обнаружен в тканях животных, моче, крови, оттекающей от перфузируемой витамином печени, дрожжах и др. Легкость взаимодействия ТДС с цистеином и глютатионом явилась поводом к предположению о вероятности непосредственного участия витамина в форме тиола в окислительно-восстановительных реакциях в организме. Также показано, что в щелочной среде и в биологических системах витамин легко реагирует с различными тиоловыми соединениями, образуя парные дисульфиды. При взаимодействии с гидрохиноном, рутином и катехинами тиамин превращается в ТДС. Эта реакция может иметь особую роль в обратимых превращениях хинонов в дифенолы, например в меланогенезе на одном из этапов превращения тирозина в меланин.
Участие тиамина в обмене веществ
Декарбоксилирование альфа-кетокислот у микроорганизмов протекает без сопряженного окисления, и типичный для указанного действия фермент карбоксилаза осуществляет распад пирувата до углекислоты и ацетальдегида.
СН3—СО—СООН ——> СН3—СНО + С02
Тот же фермент принимает участие в обмене других сходным образом построенных кетокислот и может катализировать конденсацию образующихся альдегидов до соответствующих ацилоинов. Неокислительные превращения альфа-кетокислот при определенных условиях имеют место и в тканях животных. Но для животных тканей основным типичным путем превращения альфа-кетокислот является их окислительное декарбоксилирование. Процесс этот касается нескольких соединений (пируват, кетоглутарат, глиоксилат, гамма-окси-альфа-кетоглутарат) и связан с различными специфическими ферментами.
1. Дегидрогеназа пировиноградной кислоты (ПД) осуществляет де-карбоксилирование и окисление пирувата (ПК) через промежуточные этапы, которые можно суммировать общим уравнением:
СН3—СО—СООН + КоА + НАД СН3—СО—КоА + С02 + НАД.Н2.
Таким образом, реакция контролирует процесс аэробного окисления углеводов и занимает ключевую позицию на путях превращения углеводов в липиды и катаболизма глюкозы через цикл лимонной кислоты. Фермент весьма чувствителен к недостатку тиамина в целом организме, в связи с чем авитаминоз и гиповитаминоз В1, как правило, сопровождаются торможением процесса распада ПК и соответствующим накоплением кетокислоты в крови и в моче. Последнее обстоятельство широко используется как биохимический показатель недостаточности тиамина. Большое значение ПД-реакция имеет и в поддержании определенного равновесия в обмене аминокислот, так как ПК является участником многих реакций трансаминирования, в результате которых она превращается в аминокислоту аланин.
2. Дегидрогеназа альфа-кетоглютаровой кислоты (КГД) в основной последовательности своего действия и участвующих в реакции кофакторов не отличается от ПД. Однако сам фермент построен из более крупных субъединиц белка, а ТДФ в нем более прочно связан с декарбоксилирующим фрагментом, чем с аналогичным белком в ПД. Указанное обстоятельство уже само по себе в значительной мере объясняет большую устойчивость фермента к недостаточности тиамина в организме и подчеркивает важность для процессов жизнедеятельности реакции катализируемой КГД. Действительно, фермент, являясь компонентом циклофоразной системы, участвует в окислительном превращении альфа-кетоглютаровой кислоты (КГК) в сукцинил-КоА.
НООС-СН2 СН2 СО- СООН + КоА + НАД —— > НООС-СН2 СН2 СО- КоА + СО2 + НАД-Н2.
Уровень КГК, контролируемый КГД, важен, кроме того, для осуществления постоянной связи лимоннокислого цикла с белковым обменом, в частности с реакциями трансаминирования и аминирования, в результате которых образуется глутаминовая кислота.
3. Дегидрогеназа гамма-окси-альфа-кетоглютаровой кислоты обнаружена в 1963 г. Соединение это образуется в тканях в заметных количествах из оксипролина или из ПК и глиоксилата. После окислительного декарбоксилирования гамма-окси-альфа-КГК превращается в яблочную кислоту — один из промежуточных субстратов цикла лимонной кислоты. При недостаточности тиамина фермент быстро теряет активность, а наблюдающийся в этих условиях замедленный обмен ПК способствует избыточному образованию гамма-окси-альфа-КГК. Последнее соединение, как выяснилось, является мощным конкурентным ингибитором аконитазы, изоцитратдегидрогеназы и дегидрогеназы альфа-КГК, т. е. сразу трех ферментов лимоннокислого цикла. Указанное обстоятельство достаточно хорошо объясняет казавшийся ранее противоречивым факт, когда количество КГД при авитаминозе B1 остается почти нормальным при явном торможении цикла лимонной кислоты.
4. Окислительное декарбоксилирование глиоксиловой кислоты с образованием активного формильного остатка, который, по-видимому, может широко использоваться в соответствующих обменных реакциях, например при синтезе азотистых оснований нуклеиновых кислот.
5. Фосфорокластическое расщепление кетосахаров, в частности ксилулозо-5-фосфата у некоторых микроорганизмов, осуществляет содержащий ТДФ фермент фосфокетолаза.
Ксилулозо-5-фосфат + Н3Р04 —— > фосфоглицериновый альдегид + ацетилфосфат.
Отсутствие в составе указанного фермента известных специфических акцепторов водорода дает основание предположить, что образующийся в ходе реакции ДОЭТДФ подвергается внутримолекулярному окислению с образованием ацетильного остатка сразу на ТДФ, после чего готовый ацетил снимается с кофермента при участии фосфорной кислоты. В связи с тем что аналогичным образом реакция протекает с фруктозо-6-фосфатом, предполагается, что у микроорганизмов существует особый «фосфокетолазный» шунт в обмене углеводов, который при участии трансальдолазы, транскетолазы, изомеразы и эпимеразы пентозофосфатов, альдолазы и фруктозодифосфатазы обеспечивает укороченный путь ассимиляции фруктозы с возможным образованием 3 молекул АТФ и ацетата.
Фруктозо-6-фосфат + 2Н3РО4 —— > 3-ацетилфосфат.
Сходные с фосфокетолазой ферменты, катализирующие образование ацетилфосфата из пирувата, обнаружены также у отдельных видов микроорганизмов.
6. Транскетолаза катализирует реакции переноса гликольальдегидного радикала от кетосахаров на альдосахара. Типичным и, пожалуй, имеющим наиболее важное значение примером подобного рода является взаимодействие ксилулозо-5-фосфата с рибозо-5-фосфатом или с эритрозо-4-фосфатом в пентозном цикле. При участии транскетолазы протекают реакции неокислительного образования пентозофосфатов из гексозофосфатов или реакции ассимиляции пентозофосфатов, когда речь идет о функционировании глюкозо-монофосфатного окислительного шунта. Очевидно, что таким образом с транскетолазой оказываются тесно связанными процессы обеспечения организма пентозофосфатами (синтез нуклеотидов, нуклеиновых кислот) и НАДФН2, являющегося важнейшим поставщиком водорода при большинстве восстановительных биосинтезов (жирные кислоты, холестерин, гормоны и др.). Та же транскетолазная реакция служит одним из промежуточных этапов в процессах фотосинтеза, зависящих от постоянной регенерации рибулозо-1,5-дифосфата. Интересно отметить, что ДОЭТДФ, возникающий в ходе транскетолазной реакции, оказался соединением, которое подвергается окислению до гликолил-КоА в системе дегидрогеназ альфа-кетокислот. Таким путем может возникать остаток гликолевой кислоты, используемой затем при синтезе N-гликолил-нейраминовой кислоты и других гликолевых соединений.
Антитиаминные факторы
В эту категорию входят соединения, которые можно разделить на две группы:
- антиметаболиты витамина
- вещества, по-разному инактивирующие витамин путем непосредственного с ним взаимодействия.
Первая группа охватывает ряд искусственно полученных аналогов тиамина с различными химическими модификациями строения его молекулы. Интерес к подобным соединениям объясняется тем, что некоторые из них оказались мощными антипротозойными препаратами, а другие вызывают сдвиги в организме животных, представляющие интерес для коррекции отдельных обменных нарушений у человека.
Ко второй группе относятся ферменты, специфически разрушающие витамин (тиаминазы), и весьма разнообразные природные соединения (термостабильные антивитаминные факторы), инактивирующие тиамин. Антивитамины второго типа в ряде случаев выступают как патогенетические агенты в развитии гипо- и авитаминозных состояний у человека или животных и, возможно, играют определенную роль в качестве естественных регуляторов действия тиамина. Рассмотрение вопроса в таком плане представляется обоснованным в связи с тем, что избыток витамина в организме приводит к отчетливым метаболическим отклонениям от нормы, а некоторые заболевания у человека сопровождаются накоплением тиамина не только в крови, но и во внутренних органах.
Антиметаболиты тиамина
Выше подробно рассмотрены значение пиримидинового и тиазолового компонентов в ферментативных реакциях и роль оксиэтильного радикала для фиксации ТДФ в тканях или для участия в реакциях перефосфорилирования. Все три перечисленные группировки оказались теми участками молекулы витамина, видоизменения которых резко меняют биологические свойства всего соединения. Из производных с измененной структурой тиазола подробнее всего изучен аналог, у которого тиазол замещен пиридином — ПТ. Антивитаминные свойства этого соединения в отношении нервной ткани можно усилить примерно в 10 раз, если одновременно заменить 2′-метильную группу в пиримидине на этильную. Самым мощным антивитамином В1 среди модифицированных по пиримидину производных тиамина является окси-Т и примерно в 8 раз слабее 2′-бутил-Т. К получению антиметаболитов с измененным 5-оксиэтильным радикалом исследователи пришли окольным путем. Вначале был получен 1-(4-амино-2-п-пропил-5-пиримидинил)-2-пиколин хлорид или ампрол, оказавшийся весьма эффективным антикокцидиозным препаратом. Затем выяснилось, что его лечебное действие обусловлено нарушением ассимиляции (скорее всего фосфорилирования) тиамина у простейших. Полученные вслед за этим производные витамина, лишенные гидроксила в 5-этильном радикале, стали новой группой антиметаболитов, выпускаемых в промышленных масштабах для лечебных целей.
Естественные антивитаминные факторы
Тиаминаза. Симптомы, напоминающие паралитическую форму бери-бери и появляющиеся у лисиц при преимущественном кормлении их сырым карпом, впервые описаны в 1936 г. Вскоре было установлено, что причиной заболевания животных являлась недостаточность тиамина, вызываемая присутствием во внутренних органах карпа и других тканях некоторых морских рыб, моллюсков, растений и микроорганизмов фермента, специфически разрушающего тиамин, — тиаминазы. Позже стали различать две формы фермента: тиаминазу I, расщепляющую витамин с одновременным замещением тиазола на какое-нибудь азотистое основание, и тиаминазу II, разрушающую витамин гидролитически на пиримидиновый и тиазоловый компоненты. Вторая форма тиаминазы пока обнаружена только у микроорганизмов (Вас. aneurinolyticus), но последние нередко являются причиной тиаминазной болезни у человека, протекающей по типу хронического гиповитаминоза В1.
Термостабильные факторы, инактивирующие тиамин, обнаружены у рыб и очень многих растений, особенно папоротниковых. Часто эти факторы сопутствуют тиаминазам. Известно, что термостабильный фактор из внутренностей карпа разрушает витамин, подобно тиаминазе, и сам является веществом геминовой природы, а фактор, содержащийся в папоротнике, является 3,4-дигидроксициннамовой кислотой, которая образует с тиамином неактивные комплексы.
Как антиметаболиты тиамина, так и естественные антивитаминные факторы нашли широкое применение для экспериментального воспроизведения авитаминоза B1 у животных, а некоторые из них (ампрол, хлоротиамин) — как лечебные препараты в ветеринарной практике.
Потребность в тиамине и способы определения обеспеченности организма витамином В1
Трудности определения потребности человека или животных в тиамине связаны в основном с невозможностью поставить для этих целей соответствующие балансовые опыты, так как значительная доля поступающего в организм витамина подвергается многочисленным превращениям, которые до сих пор мало изучены. В связи с этим единственным критерием, являющимся контролем витаминной полноценности рациона, являются косвенные показатели, определяемые при анализе мочи и крови у людей или еще и тканей у животных. Значительная часть рекомендаций о потребности в тиамине дается и на основании оценки общего состояния обследуемых: отсутствие клинических признаков гиповитаминоза, устранение дополнительным введением витамина некоторых видов функциональной недостаточности и т. п. Для населения России с учетом поправок на индивидуальные колебания рекомендуется норма в 0,6 мг тиамина на 1000 кал суточного пищевого рациона. Эту дозу следует рассматривать как наиболее полно учитывающую потребность человека в витамине в условиях средних климатических зон и средних физических нагрузок. В определенных пределах профессиональные особенности рационов питания (увеличение калорийности) при таком подходе обеспечиваются набором различных продуктов в потребленной за сутки пище. Однако необходимо помнить, что преобладание жиров в рационе (в 4 раза против обычного) снижает потребность в тиамине примерно на 15-20%, а избыточное потребление углеводов, напротив, повышает расход витамина.
Известно, что потребность в тиамине относительно калорийности пищи возрастает при физическом и нервно-психическом напряжении, в период беременности и лактации, при воздействии на организм некоторых химических (медикаменты, промышленные яды) или физических (охлаждение, перегревание, вибрация и др.) факторов, а также при многих инфекционных и соматических заболеваниях . Так, потребность в тиамине в условиях Крайнего Севера выше на 30—50%. При старении организма, когда заметно ухудшаются условия всасывания и внутритканевой ассимиляции витамина, расчет потребности должен быть увеличен на 25—50% по отношению к калорийности пищи. Резко (в l,5—2,5 раза) возрастает расход витамина у рабочих горячих цехов, летного персонала современной сверхскоростной авиации. При физиологическом напряжении, вызванном эндогенными факторами (беременность, лактация), потребность в тиамине повышается на 20—40%. При многих интоксикациях и заболеваниях рекомендуется ежедневное введение тиамина в дозах, во много раз превышающих физиологическую потребность (10—50 мг). Вряд ли в последних случаях речь идет о специфическом витаминном действии вводимого соединения, так как особую роль при этом могут играть некоторые свойства тиамина как химического соединения.
Рекомендуемые дозы витамина В1 приведены в таблице.
Суточная потребность в тиамине различных групп населения в городах с развитым коммунальным обслуживанием
(В городах и селах с менее развитым коммунальным обслуживанием потребность возрастает примерно на 8—15%)
по интенсивности труда
| Потребность в тиамине в мкг | |||||
| Группы | Возраст в годах | Мужчины | Женщины | ||
| в обычных условиях | при дополнительной физической нагрузке | в обычных условиях | при дополнительной физической нагрузке | ||
| Первая | 18 — 40 | 1,7 | 1,9 | 1,4 | 1,6 |
| 40 — 60 | 1,6 | 1,7 | 1,3 | 1,4 | |
| Вторая | 18 — 40 | 1,8 | 2,0 | 1,5 | 1,7 |
| 40 — 60 | 1,7 | 1,8 | 1,4 | 1,5 | |
| Третья | 18 — 40 | 1,9 | 2,1 | 1,5 | 1,8 |
| 40 — 60 | 1,7 | 1,9 | 1,6 | 1,6 | |
| Четвертая | 18 — 40 | 2,2 | 2,4 | 2,0 | 2,0 |
| 40 — 60 | 2,0 | 2,2 | 1,7 | 1,8 | |
| Юноши | 14 — 17 | 1,9 | |||
| Девушки | 14 — 17 | 1,7 | |||
| Пожилые | 60 — 70 | 1,4 | 1,5 | 1,2 | 1,3 |
| Старые | 70 | 1,3 | 1,1 | ||
| Дети (без разделения по полу) | |||||
| Дети | 0,5 — 1,0 | 0,5 | |||
| Дети | 1 — 1,5 | 0,8 | |||
| Дети | 1,5 — 2 | 0,9 | |||
| Дети | 3 — 4 | 1,1 | |||
| Дети | 5 — 6 | 1,2 | |||
| Дети | 7 — 10 | 1,4 | |||
| Дети | 11 — 13 | 1,7 | |||
Для наиболее часто используемых в эксперименте лабораторных животных можно ориентироваться на следующие величины потребности в тиамине: для голубя — 0,125 мг на 100 г корма, для собаки — 0,027—0,075 мг, для мыши — 5—10 мкг, для крысы — 20—60 мкг, для кошки — 50 мкг на 100 г в сутки.
Таким образом, решающим критерием обеспеченности организма тиамином является достоверность определения наличия или отсутствия витаминной недостаточности у обследуемых. Важными показателями наряду с определением самого витамина в данном случае являются метаболиты (альфа-кетокислоты), обмен которых зависит от ТДФ-содержащих ферментов или сами ферменты (дегидрогеназы, транскетолаза). Учитывая специфику клинических и экспериментальных исследований, рассмотрим кратко ценность перечисленных показателей в приложении к некоторым конкретным условиям и характеру материала, подвергаемого анализу.
Исследование мочи
Как уже отмечалось, у людей содержание витамина в суточной моче меньше 100 мкг принимается большинством авторов как свидетельство недостаточности тиамина. Однако при нормальном поступлении витамина с пищей его выведение с мочой зависит еще от характера медикаментозного лечения (если речь идет о больном) и состояния выделительной функции почек. Отдельные лечебные препараты могут резко снижать, а другие усиливать выведение витамина. Повышенная экскреция тиамина не всегда может восприниматься как свидетельство насыщенности витамином, так как причиной может быть нарушение механизмов реабсорбции в канальцевом аппарате почек или недостаточное депонирование витамина вследствие нарушения процессов его фосфорилирования. С другой стороны, низкое содержание тиамина в моче больных людей может быть обусловлено не его недостатком, а результатом частичного ограничения приема пищи, содержащей соответственно меньшее количество витамина. В связи с этим с целью получения дополнительных сведений о состоянии внутритканевого обмена тиамина довольно широко распространен метод исследования мочи после парентеральных нагрузок. Удобно проводить трехкратную нагрузку, исходя из дозы в 0,5 мг витамина на 1 кг веса больного, округляя вес до десятков килограммов.
Все методы определения тиамина обязательно должны проверяться на воспроизводимость получаемых с их помощью величин в случае присутствия в моче больных медикаментозных средств. Известно, например, что салицилаты, хинин и другие препараты могут вызывать дополнительную флюоресценцию, мешая правильной интерпретации данных флюориметрии, а ПАСК, взаимодействуя непосредственно с феррициа-нидом, резко снижает выход тиохрома. В экспериментальных условиях удобным показателем обеспеченности тиамином является определение уровня пирувата (ПК) в моче. Необходимо помнить, что лишь выраженные формы гиповитаминоза В1 сопровождаются отчетливым накоплением этой кетокислоты, которая определяется чаще всего как бисульфитсвязывающие вещества (БСВ). При патологических состояниях, особенно когда речь идет о больных людях, уровень БСВ, как и количество самой ПК в моче, варьирует в весьма широких пределах в зависимости от интенсивности протекания углеводного обмена, а последний контролируется большим количеством различных факторов, прямо не связанных с тиамином. Показатели уровня БСВ или ПК в моче в подобных ситуациях должны использоваться лишь как дополнительные данные.
Исследование крови
Основной присутствующей в крови формой витамина является ТДФ. Определения, произведенные у здоровых людей различными методами, дают в среднем одни и те же величины, но с колебаниями в довольно широких пределах (4—12 мкг%). Как достоверный признак недостаточности витамина, если ориентироваться только на этот показатель, можно считать лишь величины ниже 2—4 мкг%. Менее приемлемо определение только общего тиамина. В норме это не вносит существенной ошибки, так как свободного витамина очень мало— 0,3—0,9 мкг%. Количество его в сыворотке крови может резко возрастать при ухудшении выделительной функции почек при гипертонической болезни или в связи с нарушением процесса фосфорилирования витамина. Если упомянутые ограничения отсутствуют, то можно считать, что уровень тиамина в крови достаточно адекватно отражает обеспеченность им организма.
При исследовании крови, как и мочи, широко используется определение концентрации ПК. Важно применять для этих целей более специфический метод (ферментативный, хроматографический), так как реакции с бисульфитом или салициловым альдегидом дают завышенные результаты. Если ПК определяют для характеристики обмена витамина у больных, необходимо считаться с большим количеством факторов, не связанных с этим витамином, но активно влияющих на обмен, а следовательно, и уровень ПК в организме. Так, увеличение уровня ПК крови наблюдается при введении адреналина, АКТГ, при физической нагрузке, электрическом и инсулиновом шоке, недостаточности витаминов А и D, многих инфекционных и других заболеваниях, когда часто трудно заподозрить недостаточность тиамина. В эксперименте показано, что в ряде случаев уровень ПК крови больше коррелирует с гиперфункцией системы гипофиз — кора надпочечников, чем с обеспеченностью организма витамином.
Поскольку имеются трудности выявления истинного состояния тиаминового обмена по содержанию в крови самого витамина или уровню кетокислот, можно использовать для этих целей определение активности ТДФ-содержащих ферментов, в частности транскетолазы (ТК) эритроцитов. Для этого фермента даже незначительные сдвиги в концентрации кофермента заметно сказываются на активности всей системы. Наблюдения в клинике и при профилактических осмотрах населения, эксперименты на животных подтверждают весьма высокую чувствительность ТК даже к легкой недостаточности витамина. Фермент реагирует даже тогда, когда изменения со стороны уровня ПК или самого витамина в крови не показательны. Для блльщей точности сейчас используется метод дополнительной активации ТК добавляемой in vitro к гемолизату эритроцитов ТДФ. Стимуляция ТК до 15% исходной активности принимается соответствующей норме, от 15 до 25%—гиповитаминозу, более 20—25% — авитаминозу.
Нарушение витаминного равновесия и обмена тиамина
Повсеместно распространенное в XIX и в начале XX столетия в странах Дальнего Востока заболевание (бери-бери), являющееся классической формой авитаминоза В1, встречается сейчас значительно реже . Различают три формы бери-бери, соответствующие наиболее ярко выраженным проявлениям болезни:
- сухую, или паралитическую (преобладают неврологические поражения — парезы, параличи и др.);
- отечную (нарушения наблюдаются в основном со стороны циркуляторного аппарата крови);
- острую, или сердечную (быстро заканчивается смертью на фоне тяжелой правожелудочковой недостаточности).
Практически перечисленные формы в чистом виде встречаются редко, а наблюдаются частичные их взаимопереходы. В современных условиях чаще всего встречаются различные по глубине гиповитаминозы B1. Симптоматика последних носит, как правило, довольно общий характер (одышка, сердцебиение, боли в области сердца, слабость, быстрая утомляемость, потеря аппетита, понижение общей сопротивляемости к другим заболеваниям и т. п.) и не может быть полностью признана типичной для недостаточности только тиамина, так как встречается и при многих других гиповитаминозах. По существу следует еще раз констатировать, что перечисленные симптомы отнести на счет гиповитаминоза В1 окончательно можно только на основании специальных биохимических исследований (см. выше). Отдельного рассмотрения требуют вторичные гиповитаминозы В1, возникающие как результат нарушения баланса или обмена витамина. К первой группе следует отнести случаи повышенного, расходования витамина при обычном его поступлении с пищей (тиреотоксикоз и некоторые другие заболевания, избыток углеводов в диете), нарушение процессов всасывания из желудочно-кишечного тракта или приводящее к тем же конечным результатам усиленное выведение витамина в мочу после длительного применения диуретических средств. Вторая группа нарушений связывается большинством авторов с ослаблением процессов внутритканевого фосфорилирования тиамина или eго протеидизации, как при лечебном применении гидразидов изоникотиновой кислоты или при белковом голодании.
Разнообразие перечисленных выше причин (по существу эндогенного порядка) обусловливает развитие недостаточности тиамина, которая в значительной степени устраняется в первой группе нарушений дополнительным введением витамина в повышенных дозах. Гиповитаминозы второго типа часто не поддаются прямой витаминотерапии и требуют предварительного устранения исходных основных нарушений в обмене собственно тиамина или введения в организм коферментных производных.
Объединение столь различных по этиологии форм нарушения обеспеченности организма тиамином в одну группу так называемых эндогенных гиповитаминозов представляется не совсем удачным. Для нарушений обменного порядка более подходящим является термин «дисвитаминоз», т. е. просто констатация факта нарушения обмена витамина при нормальном, достаточном его поступлении в организм. Нечто подобное наблюдается при конкуренции витаминов друг с другом, когда избыточное поступление одного из витаминов тормозит обмен и протеидизацию другого.
Профилактическое и лечебное применение тиамина и его производных
Показания и противопоказания к тиаминотерапии
При обосновании главных принципов лечебного применения витамина или его производных приходится исходить из нескольких предпосылок. В случае, когда речь идет о недостаточности по типу авитаминоза или гиповитаминоза, лечение ведется по обычным правилам заместительной терапии. Сложнее обстоит дело с дисвитаминозами, возникающими на фоне какого-либо патологического процесса или в результате воздействия на обмен тиамина различных экзогенных факторов (лечебные препараты, химические яды, физические агенты и др.), когда успех в значительной мере зависит от этиотропной терапии или применения соответствующих препаратов витамина (кокарбоксилаза, дисульфидные производные). Анализируя имеющиеся данные, можно считать, что предпосылки к лечебному применению тиамина имеются при различных по этиологии поражениях желудочно-кишечного тракта, печени, нервно-психических заболеваниях, сердечно-сосудистой недостаточности, гипотонии, ревматизме. Практический опыт оправдывает применение витамина при рахите, хроническом тонзиллите, многих кожных и инфекционных заболеваниях, сахарном диабете, гипертиреозе, туберкулезе . Достаточно обосновано профилактическое введение тиамина спортсменам, летчикам накануне ожидаемых перегрузок, рабочим, имеющим дело с производственными ядами (окись углерода, аммиак, окислы азота и др.), в акушерской практике накануне родов и в других случаях.
Вторым направлением в обосновании тиаминотерапии может быть учет известных биохимических функций этого витамина. В таком случае вопрос надо решать, исходя из конкретных данных о нарушении в организме больного тех обменных процессов, которые мы можем корригировать введениями витамина. По существу речь должна идти о коферментной и некоферментной активности тиамина, т. е. о тех его функциях, которые детально рассмотрены выше. Изначально основными показаниями к применению тиамина при различных заболеваниях были симптомы, типичные для бери-бери: невриты, невралгии, параличи, боли различной этиологии, расстройства нервной и сердечной деятельности. В настоящее время при обосновании необходимости в витаминотерапии в основном исходят из обменных нарушений (ацидоз, диабетическая кома, пируватемия, токсемия беременных).
Тиамин применяется при периферических невритах, общих расстройствах в связи с недостаточностью питания, анорексии, энцефалопатии Вернике, витаминной недостаточности, хроническом алкоголизме, алкогольных невритах, сердечно-сосудистой недостаточности, нарушении деятельности желудочно-кишечного тракта.
При всех перечисленных заболеваниях (кроме энцефалопатии Вернике) тиамин примерно в равной степени используется энтерально и парентерально в дозах, колеблющихся от 5 до 100 мг в сутки. В настоящее время широко внедрены в клиническую практику некоторые лечебные препараты витамина: тиамин-фосфаты (ТФ) и дисульфидные производные. После разработки простого метода синтетического получения ТФ как лечебный препарат быстро завоевала популярность так называемая кокарбоксилаза (ТДФ). Поводом к внедрению ТДФ в лечебную практику явился хорошо известный факт коферментной активности именно этого производного витамина. Кроме того, токсичность ТФ в 2,5—4 раза меньше, чем таковая у свободного тиамина. Есть и еще одно существенное преимущество у ТФ — более полная усвояемость. Так у людей после эквимолярных внутримышечных введений тиамина, ТМФ и ТДФ количество витамина, оказавшееся в моче за 24 часа, составило соответственно 33, 12 и 7% от введенной дозы.
Применение ТФ наиболее результативно в тех случаях, когда необходимо проводить витаминотерапию у больных с ослабленными процессами фосфорилирования. Так, при туберкулезе легких инъекции тиамина оказываются малоэффективными: за сутки с мочой может выводиться до 70% витамина. Если больные получали эквивалентные дозы ТДФ, то выведение витамина из организма было меньшим — 11%. При парентеральном введении, особенно внутривенном, ТДФ дает эффекты обменного порядка, которые не наблюдается после инъекций свободного витамина. Очень часто ТДФ вызывает сдвиги, аналогичные наблюдаемым при применении АТФ или фосфокреатина.
Наиболее многочисленны данные, касающиеся применения ТДФ при сахарном диабете и сердечно-сосудистой недостаточности. Назначение ТДФ (по 50—100 мг внутривенно) резко снизило смертность от диабетической комы и оказалось весьма эффективным средством при лечении ацидотических состояний. ТДФ не только усиливает действие инсулина, но и снимает инсулинорезистентность у некоторых больных. Наряду с нормализацией традиционных показателей, характеризующих тяжесть сахарного диабета (гликемия, глюкозурия, кетоз), ТДФ оказывает отчетливое нормализующее действие в отношении уровня холестерина и фосфолипидов корви. При сердечно-сосудистой недостаточности даже однократные инъекции ТДФ быстро нормализуют повышенный в крови больных уровень пирувата и молочной кислоты.
ТДФ заметно активирует потребление миокардом питательных веществ из крови, быстро улучшая показатели электрокардиограммы. Подобное действие ТДФ широко используется при лечении различных функциональных аномалий со стороны сердца (экстрасистолия, некоторые формы аритмий). Описаны выраженные положительные изменения показателей электрокардиограммы при артеросклерозе, гипертонической болезни, некоторых эндокринных и почечных заболеваниях, при инфарктах миокарда, пороках сердечных клапанов в тех случаях, когда ведущим фактором патологии являлось нарушение трофики сердца. Также показано, что ТДФ эффективнее тиамина при заболеваниях периферической и центральной нервной системы, при рассеянном склерозе, бронхиальной астме и многих других заболеваниях.
Широкое распространение получили также различные дисульфидные производные витамина, эффективность которых объясняется лучшей усвояемостью дисульфидных форм в кишечном тракте. Одним из преимуществ этих производных считается их значительно меньшая токсичность по сравнению с тиамином.
Автор статьи: доцент кафедры биохимии МБФ РГМУ, к.м.н. Адрианов Николай Владимирович.
Специально для ООО «Электронная Медицина».
Источник