РОДОПСИН
Родопсин (син. зрительный пурпур) — один из зрительных пигментов фоторецепторов сетчатки глаза. Патология, связанная с Родопсином и фоторецепторной мембраной, может быть причиной тяжелых глазных заболеваний — различных форм абиотрофии сетчатки глаза (см. Тапеторетинальные дистрофии).
Родопсин представляет собой хромогликопротеид, прочно связанный с мембраной фоторецепторной клетки (см. Фоторецепторы). Молекула Родопсина состоит из белковой части — опсина, хромофорной и углеводной частей; его мол. вес (масса) ок. 38 000. Полипептидная цепь опсина включает ок. 350 остатков аминокислот, первичная структура опсина не установлена. Хромофорной группой в молекуле Р. является ретиналь (ранее называвшийся ретиненом) — альдегид витамина А (см. Ретинол), к-рый ковалентно связан с 8-аминогруппой остатка лизина белковой части молекулы. В молекуле Р. ретиналь находится в 11-цис-форме (см. Изомерия). Родопсины позвоночных и беспозвоночных животных содержат один и тот же хромофор — 11-цис-ретиналь, но белок (опсин) у них видоспецифичен. Углеводная часть молекулы Р. представляет собой две олигосахаридные цепи, связанные ковалентной связью с NH2-концом полипептидной цепи Р. Полипептидная цепь молекулы Р., несколько раз изгибаясь, «прошивает» насквозь фоторецепторную мембрану. Расположен Р. в мембране асимметрично; в диске наружного сегмента палочки позвоночных животных и, вероятно, человека COOH-концевой участок полипептидной цепи расположен на гидрофильной поверхности цитоплазматической мембраны, NH2-концевая часть молекулы Р. находится на противоположной поверхности, во внутридисковом пространстве; большая часть самой полипептидной цепи Р. погружена в гидрофобную часть липидного бимолекулярного слоя мембраны (см. Мембраны биологические). Такое трансмембранное расположение молекулы Р., по всей вероятности, принципиально важно для осуществления одной из его функций, связанной с повышением проницаемости мембраны для ионов при освещении. Мембрана фоторецепторов обладает исключительно низкой вязкостью, и молекула Р., погруженная в нее, подвергается броуновскому движению, претерпевая быструю вращательную и более медленную латеральную диффузию, в ходе к-рой может обеспечиваться взаимодействие молекулы Р. в темновом или обесцвеченном состоянии с другими молекулами белков в фоторецепторной мембране.
Максимум поглощения Родопсина находится в видимой части спектра при длине волны ок. 500 нм и определяет максимум спектральной чувствительности палочек сетчатки (см.) глаза (см.) и соответственно максимум кривой видимости ночного или сумеречного, т. е. скотопического, зрения (см.). Чистый ретиналь имеет желтый цвет, его максимум поглощения находится при 370 нм.
К Р. относят и зрительный пигмент красночувствительных колбочек сетчатки человека и других позвоночных — йодопсин, хромофорной группой к-рого также является 11-цис-ретиналь.
Зрительные пигменты, содержащие в качестве хромофорной группы 11-цис-3-дегидроретиналь, названы порфиропсинами (см. Зрительные пигменты). В бактериях обнаружен еще один ретинальсодержащий белок, бактериальный аналог родопсина, так наз. бактериородопсин. Это хромопротеид, состоящий из гидрофобного белка и ретиналя в 13-цис-или транс-форме. Бактериородопсин, как и Р., является трансмембранным белком. Основная функция бактериородопсина биоэнергетическая. Энергия света, поглощенного ретиналем, используется бактериородопсином для активного переноса протона через так наз. пурпурную мембрану солелюбивых бактерий, в результате чего на ней создается электрохим. потенциал, энергия к-рого, в свою очередь, используется для синтеза АТФ. Это простейшая, древняя бесхлорофильная форма фотосинтеза (см.).
Собственно фотохимической реакцией в зрении (см. Фотохимические реакции) является реакция фотоизомеризации ретиналя Р.: при поглощении кванта света молекулой Родопсина последний полностью переходит из 11 -цис- в транс-форму. Эта реакция инициирует серию конформационных изменений Р., что в конечном счете приводит к изменению проницаемости мембраны фоторецептора для ионов и генерации на ней рецепторного потенциала (фоторецепторного сигнала). Сложный механизм сопряжения между фотохимической реакцией в Р. и генерацией рецепторного потенциала остается пока не выясненным.
В процессе регенерации молекул Родопсина у позвоночных большую роль играет ферментативная изомеризация транс-ретиналя снова в цис-форму. Однако непосредственных характеристик этого процесса и участвующих в нем ферментов пока нет.
Библиография: Островский М. А. Проблема зрительного пигмента родопсина и бактериородопсина, Вестн. АН СССР, № 9, с. 120, 1979; он же, Зрительная рецепция — проблема на стыке наук, Наука в СССР, № 1, с. 71, 1981; Островский М. А. и Федорович И. Б. Фотоиндуцированные изменения фоторецепторной мембраны, в кн.: Структура и функции биол. мембран, под ред. А. С. Трошина и др., с. 224, М., 1975, библиогр.; они же, Фотохимические превращения зрительного пигмента — родопсина, Квантовая электроника, т. 5, № 10, с. 2263,1978; Hub bell W. L. а. Вownds M. D. Visual transduction in vertebrate photoreceptors, Ann. Rev. Neurosci., v. 2, p. 17,1979; Montal M. Rhodopsin in model membranes, Biochim. biophys. Acta (Amst.), v. 559, p. 231, 1979; Ostroy S. E. Rhodopsin and the visual process, ibid., v. 463, p. 91, 1977.
Источник
Синтез зрительного пурпура витамин
а) Фотохимия зрения. И палочки, и колбочки содержат вещества, которые распадаются под действием света, в результате возбуждаются нервные волокна, выходящие из глаза. Светочувствительное вещество в палочках называют родопсином; состав светочувствительных веществ в колбочках, называемых пигментами колбочек, или цветными пигментами, лишь немного отличается от родопсина.
В статьях по физиологии на сайте мы обсудим в основном фотохимию родопсина, но те же явления приложимы и к пигментам колбочек.
б) Родопсин-ретиналевый зрительный цикл и возбуждение палочек. Родопсин и его распад под действием световой энергии. Наружный сегмент палочки, погруженный в пигментный слой сетчатки, примерно на 40% состоит из светочувствительного пигмента родопсина, или зрительного пурпура. Это вещество представляет собой соединение белка скотопсина и каротиноидного пигмента ретиналя (или ретинена). Важно, что ретиналь представлен в особой форме — 11 -цис-ретиналь, поскольку только эта цис-форма может связываться со скотопсином для синтеза родопсина.
После поглощения световой энергии родопсин в течение незначительной доли секунды начинает распадаться (для облегчения понимания просим вас изучить рисунок ниже).
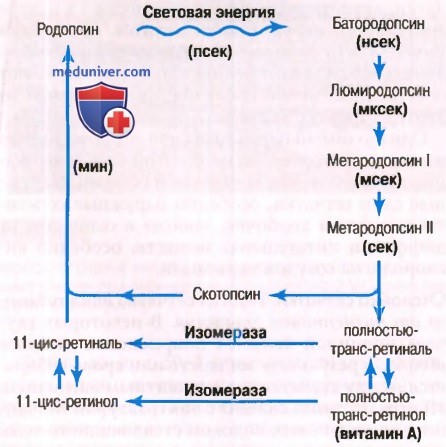
Причиной этого является фотоактивация электронов в ретинальной части родопсина, что ведет к немедленному превращению цис-формы ретиналя в полностью-транс-форму, которая имеет ту же химическую структуру, что и цис-форма, но другую физическую структуру — прямую, а не изогнутую молекулу. Поскольку трехмерная ориентация реактивных участков полностью-транс-ретиналя больше не сходится с ориентацией реактивных участков белка скотопсина, эта форма ретиналя начинает отделяться от скотопсина.
Непосредственный продукт реакции — батородопсин (прелюмиродопсин) — представляет собой частично расщепленную комбинацию полностью-транс-ретиналя и скотопсина.
Батородопсин — весьма нестабильное вещество, которое распадается в течение наносекунд до люмиродопсина. Последний, в свою очередь, распадается в течение микросекунд до метародопсина I, затем в течение примерно миллисекунды превращается в метародопсин II и, наконец, гораздо медленнее (в течение нескольких секунд) расщепляется на отдельные продукты — скотопсин и полностью-транс-ретиналь.
Именно метародопсин II, называемый также активированным родопсином, вызывает электрические изменения в палочках, которые затем передают зрительный образ в центральную нервную систему в форме потенциалов действия зрительного нерва, что будет изложено далее.
в) Восстановление родопсина. Как показано на рисунке выше, первой стадией восстановления родопсина является обратное превращение полностью- транс-ретиналя в 11-цис-ретиналь. Этот процесс нуждается в метаболической энергии и катализируется ферментом ретиналь-изомеразой. Сразу после образования 11-цис-ретиналя он автоматически соединяется со скотопсином, вновь формируя родопсин, который остается стабильным, пока снова не начнется его распад при поглощении световой энергии.
г) Роль витамина А в формировании родопсина. На рисунке выше показан второй химический путь, с помощью которого полностью — транс-ретиналь может превращаться в 11-цис-ретиналь. Это происходит путем конверсии полностью-транс-ретиналя сначала в полностью-транс-ретинол — одну из форм витамина А. Затем под влиянием фермента изомеразы полностью- транс-ретинол превращается в 11-цис-ретинол. Наконец, 11-цис-ретинол конвертируется в 11-цис-ретиналь, который комбинируется со скотопсином, формируя новый родопсин.
Витамин А присутствует и в цитоплазме палочек, и в пигментном слое сетчатки. Следовательно, в норме при необходимости он всегда доступен для формирования нового ретиналя. С другой стороны, при избытке ретиналя в сетчатке он легко превращается снова в витамин А, уменьшая таким образом количество светочувствительного пигмента. Позднее мы увидим, что взаимопревращения ретиналя и витамина А особенно важны при долговременной адаптации сетчатки к различной интенсивности света.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Источник
ЗРИТЕЛЬНЫЕ ПИГМЕНТЫ
Зрительные пигменты (лат. pigmentum краска) — светочувствительные пигменты фоторецепторов сетчатки глаза. Воспринимая энергию светового импульса, Зрительные пигменты претерпевают сложный цикл фотохимических превращений, в результате которых отдельный зрительный рецептор сетчатки глаза, содержащий Зрительные пигменты (колбочка или палочка), переходит в возбужденное состояние и по зрительному нерву передает полученную информацию в ц. н. с. Являясь основной структурно-функциональной частью фоторецепторной мембраны зрительных клеток сетчатки глаза, Зрительные пигменты таким образом играют ключевую роль в механизмах зрения (см.).
Номенклатура и строение зрительных пигментов
Все изученные Зрительные пигменты позвоночных и беспозвоночных животных представляют собой комплексы водонерастворимого мембранного белка опсина и связанного с ним хромофора (ретиналя). Ретиналь, или альдегид витамина А, может существовать в двух формах — ретиналь-1 и ретиналь-2.
По природе хромофора 3. п. разделяют на два класса — родопсины (см.), содержащие ретиналь1, и порфиропсины, содержащие ретиналь2. Родопсины содержатся в сетчатой оболочке глаза всех сухопутных и морских животных, порфиропсины — в сетчатке глаз пресноводных животных. У некоторых рыб и амфибий найдены 3. п., содержащие одновременно ретиналь! и ретиналь,. Есть попытки классифицировать 3. п. на основе различий в опсинах, специфичных для палочек или колбочек сетчатки глаза. Напр., родопсин — это комплекс ретиналя1 с палочковым опсином, йодопсин — ретиналя1 с колбочковым опсином, порфиропсин — ретиналя2 с палочковым опсином, комплекс ретиналь — колбочковый опсин образует цианопсин. Однако классифицировать 3. п. на основе опсинов крайне трудно, т. к. различных опсинов, по крайней мере, пять.
Из всех известных 3. п. наиболее полно исследованы родопсины, выделенные из глаз быка, лягушки и кальмара. Их мол. вес (масса) порядка 30—40 тыс., каждая молекула содержит ок. 400 аминокислот и один хромофор. Кроме того, в состав молекулы 3. п. входит олигосахаридная цепь: 3 радикала глюкозамина, 2 маннозы, 1 галактозы. Липиды (гл. обр. фосфолипиды) образуют с молекулой 3. п. прочный комплекс. Сохраняя свои основные спектральные свойства (см. Спектральный анализ), 3. п. без липидов теряют ряд функционально важных, напр, способность к восстановлению.
Чистый ретиналь имеет желтый цвет, максимум его спектра поглощения лежит в области 370 нм. Опсин бесцветен, максимум поглощения — в ультрафиолетовой области (ок. 280 нм). Цвет молекулы родопсина красновато-розовый, максимум спектра поглощения ок. 500 нм. Причина такого сильного спектрального сдвига при образовании комплекса (с 370 до 500 нм — так наз. батохромного сдвига) не получила до сих пор однозначного объяснения.
Максимумы спектров поглощения родопсинов и порфиропсинов захватывают достаточно широкую область видимого спектра — от 433 до 562 нм у родопсинов и от 510 до 543 нм у порфиропсинов. Если же к порфиропсинам относить и 3. п. колбочек головастика лягушки, карпа и пресноводной черепахи, т. е. цианопсин с максимумом спектра поглощения при 620 нм, то эта область оказывается еще шире. Развитие методов микроспектрофотометрии позволило определить спектры поглощения многих типов одиночных фоторецепторных клеток животных и человека. По полученным данным, 3. п. сетчатки человека имеют следующие максимумы спектров поглощения: палочки 498, сине-, зелено- и красночувствительные колбочки — 440, 535 и 575 нм соответственно.
Изучение Зрительных пигментов начато нем. исследователем Мюллером (H. Muller), который в 1851 г. описал, как извлеченная из глаза лягушки розовато-пурпурная сетчатка становится на свету сначала желтоватой, а потом белесой. В 1877 г. Болль (F. Boll) также описал этот феномен, сделав вывод, что в зрительных клетках сетчатки находится какое-то красное светочувствительное вещество и что обесцвечивание этого вещества связано с механизмом зрения. Большая заслуга в изучении 3. п. принадлежит Кюне (W. Kuhne, 1877), к-рому удалось выделить 3. п. и подробно исследовать их. Он назвал извлеченный им 3. п. зрительным пурпуром, установил его белковую природу, исследовал некоторые его спектральные свойства и фотопревращения, обнаружил способность 3. п. к восстановлению в темноте. Большой вклад в изучение 3. п. внес амер. биохимик и физиолог Дж. Уолд.
Фотопревращения зрительных пигментов
При действии на 3. п. света в них происходит цикл фотохимических превращений, в основе к-рого лежит первичная фотохимическая реакция цис-транс-изомеризации ретиналя (см. Изомерия). При этом происходит нарушение связи хромофора с белком. Последовательность превращений 3. п. может быть представлена следующим образом: родопсин (хромофор находится в цис-форме) —> прелюмиродопсин —> люмиродопсин —> метародопсин I —> метародопсин II —> белок опсин —> хромофор в транс-форме. Под влиянием фермента — ретинолдегидрогеназы — последний переходит в витамин А, который поступает из наружных члеников палочек и колбочек в клетки пигментного слоя сетчатки. При затемнении глаза происходит регенерация 3. п., для осуществления к-рой необходимо наличие цис-изомера витамина А, служащего исходным продуктом для образования хромофора (альдегида витамина А). При недостатке или отсутствии в организме витамина А может нарушиться образование родопсина и развиться как следствие расстройство сумеречного зрения, так наз. куриная слепота (см. Гемералопия). В процессе фотопревращений родопсина на стадии перехода люмиродопсина в метародопсин I в рецепторной клетке возникает в ответ на яркую вспышку так наз. ранний (коротколатентный) рецепторный потенциал. Вместе с тем он не является зрительным сигналом, хотя и может служить одним из тестов для исследования механизма превращений 3. п. в фоторецепторной мембране. Функциональное значение имеет так наз. поздний рецепторный потенциал, латентный период к-рого (5—10 мсек) соизмерим со временем образования метародопсина II. Предполагают, что реакция перехода метародопси-на I в метародопсин II обеспечивает возникновение зрительного сигнала.
Поскольку на свету Зрительные пигменты непрерывно обесцвечиваются, то должны существовать механизмы их постоянного восстановления. Одни из них чрезвычайно быстрые (фоторегенерация), другие достаточно быстрые, (биохимическая регенерация, Темновая), третьи медленные (синтез 3. п. в ходе постоянного обновления фоторецепторной мембраны в зрительной клетке). Фоторегенерация имеет физиол, значение у беспозвоночных животных (напр., у головоногих моллюсков — кальмаров, осьминогов). В механизме биохим. регенерации 3. п. у позвоночных важную роль, по-видимому, играет фермент изомераза (см.), обеспечивающий изомеризацию транс-ретиналя (или транс-витамина А) снова в цис-изомерную форму. Однако окончательных доказательств существования такого фермента пока не имеется. Сама же реакция образования молекулы Зрительного пигмента при наличии в системе 11-цис-изомера ретиналя и опсина происходит легко, без затраты энергии. Обнаружена способность обесцвеченного родопсина к реакции фосфорилирования (см.); предполагается, что эта реакция является одним из звеньев механизма световой адаптации зрительной клетки.
Библиография: Аккерман Ю. Биофизика, пер. с англ., М., 1964; Вилли К. и Деть e В. Биология, пер. с англ., М., 1974, библиогр.; Конев С. В. и Волотовский И. Д. Введение в молекулярную фотобиологию, с. 61, Минск, 1971; Островский М. А. и Федорович И. Б. Фотоиндуцированные изменения фоторецепторной мембраны, в кн.: Структура и функции биол, мембран, под ред. А. С. Трошина и др., с. 224, М., 1975, библиогр.; Физиология сенсорных систем, под ред. Г. В. Гершуни, ч. 1, с. 88, Л., 1971; Biochemistry and physiology of visual pigments, ed. by H. Lan-ger, В. a. o., 1973; Handbook of sensory physiology, ed. by H. A. R. Jung a. o., v. 7, pt 1—2, B., 1972.
Источник