Синтез пуриновых нуклеотидов довольно сложен
Синтез пуриновых оснований происходит во всех клетках организма , главным образом в печени. Исключение составляют эритроциты, полиморфноядерные лейкоциты, лимфоциты.
Условно все реакции синтеза можно разделить на 4 этапа:
1. Синтез 5′-фосфорибозиламина
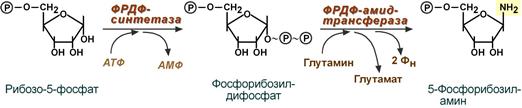
Первая реакция синтеза пуринов заключается в активации углерода в положении С1 рибозо-5-фосфата, это достигается синтезом 5-фосфорибозил-1-дифосфата (ФРДФ). Фосфорибозил-дифосфат является тем якорем, на основе которого синтезируется сложный пуриновый цикл.
Вторая реакция – это перенос NH2-группы глутамина на активированный атом С1 с образованием 5′-фосфорибозиламина . Указанная NH2-группа фосфорибозиламина уже принадлежит будущему пуриновому кольцу и ее азот будет атомом номер 9.
Реакции синтеза 5′-фосфорибозиламина
2. Синтез инозинмонофосфата
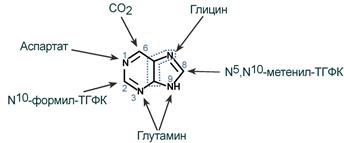
5-фосфорибозиламин вовлекается в девять реакций, и в результате образуется первый пуриновый нуклеотид – инозинмонофосфорная кислота (ИМФ). В этих реакциях источниками атомов пуринового кольца являются глицин, аспартат, еще одна молекула глутамина, углекислый газ и производные тетрагидрофолиевой кислоты (ТГФК). В целом на синтез пуринового кольца затрачивается энергия 6 молекул АТФ.
Источники атомов пуринового кольца
3. Синтез аденозинмонофосфата и гуанозинмонофосфата
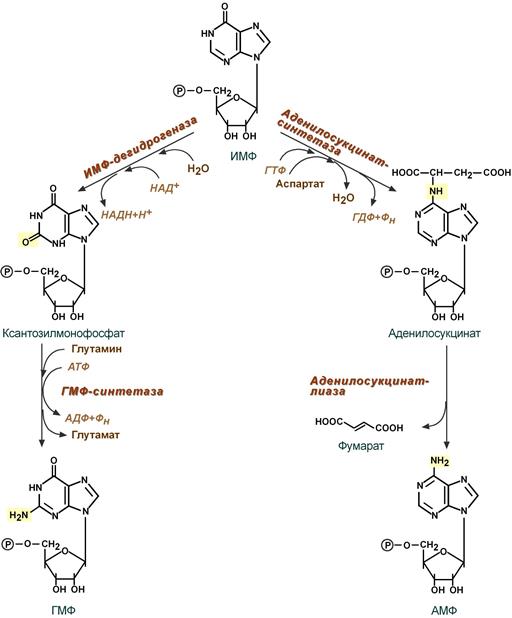
- Гуанозинмонофосфат (ГМФ) образуется в двух реакциях – сначала ИМФ окисляется ИМФ-дегидрогеназой до ксантозилмонофосфата, источником кислорода является вода, акцептором водорода – НАД. После этого работает ГМФ-синтетаза, она использует универсальный клеточный донор NH2-групп – глутамин, источником энергии для реакции служит АТФ.
- Аденозинмонофосфат (АМФ) также образуется в двух реакциях, но в качестве донора NH2-группы выступает аспарагиновая кислота. В первой, аденилосукцинат-синтетазной, реакции на присоединение аспартата используется энергия распада ГТФ, во второй реакции аденилосукцинат-лиаза производит удаление части аспарагиновой кислоты в виде фумарата.
Реакции синтеза АМФ и ГМФ
4. Образование нуклеозидтрифосфатов АТФ и ГТФ.
Синтез ГТФ осуществляется в 2 стадии посредством переноса макроэргических фосфатных групп от АТФ. Синтез АТФ происходит несколько иначе. АДФ из АМФ образуется также за счет макроэргических связей АТФ. Для синтеза же АТФ из АДФ в митохондриях есть фермент АТФ-синтаза , образующий АТФ в реакциях окислительного фосфорилирования.
Источник
Нарушения метаболизма. Биохимия специализированных тканей. (Для клин.ордов КЛД)
Нарушения пуринового обмена
1. Пуриновый обмен
Пуриновый обмен — совокупность процессов синтеза и распада пуриновых нуклеотидов. Пуриновые нуклеотиды состоят из остатка азотистого пуринового основания, углевода рибозы (дезоксирибозы), связанного бета-гликозидной связью с атомом азота пуринового основания, и одного или нескольких остатков фосфорной кислоты, присоединенных эфирной связью к атому углерода углеводного компонента.
Важнейшие азотистые основания
Мажорным пуриновым нуклеотидом является АТФ. В организме АТФ является одним из самых часто обновляемых веществ; так, у человека продолжительность жизни одной молекулы АТФ менее 1 мин. В течение суток одна молекула АТФ проходит в среднем 2000—3000 циклов ресинтеза (человеческий организм синтезирует около 40 кг АТФ в день, но содержит в каждый конкретный момент примерно 250 г), то есть запаса АТФ в организме практически не создаётся, и для нормальной жизнедеятельности необходимо постоянно синтезировать новые молекулы АТФ.
Аденозинтрифосфа́т или Аденозинтрифосфорная кислота (сокр. АТФ, англ. АТР) — нуклеозидтрифосфат, имеющий большое значение в обмене энергии и веществ в организмах. АТФ — универсальный источник энергии для всех биохимических процессов, протекающих в живых системах. Открытие вещества произошло в 1929 году группой учёных Гарвардской медицинской школы — Карлом Ломаном, Сайрусом Фиске и Йеллапрагадой Суббарао, а в 1941 году Фриц Липман показал, что АТФ является основным переносчиком энергии в клетке.
У человека и приматов мочевая кислота — конечный продукт обмена пуринов, образующийся в результате ферментативного окисления ксантина под действием ксантиноксидазы; у остальных млекопитающих мочевая кислота превращается в аллантоин. Небольшие количества мочевой кислоты содержатся в тканях (мозг, печень, кровь), а также в моче и поте млекопитающих и человека. При некоторых нарушениях обмена веществ происходит накопление мочевой кислоты и её кислых солей (уратов) в организме (камни в почках и мочевом пузыре, подагрические отложения, гиперурикемия). У птиц, ряда пресмыкающихся и большинства наземных насекомых мочевая кислота — конечный продукт не только пуринового, но и белкового обмена. Система биосинтеза мочевой кислоты (а не мочевины, как у большинства позвоночных) в качестве механизма связывания в организме более токсичного продукта азотистого обмена — аммиака — развилась у этих животных в связи с характерным для них ограниченным водным балансом (мочевая кислота выводится из организма с минимальным количеством воды или даже в твёрдом виде). Высохшие экскременты птиц (гуано) содержат до 25 % мочевой кислоты. Обнаружена она и в ряде растений.
Источник
Синтез пуриновых нуклеотидов витамин
Биосинтез пуринов и пиримидинов
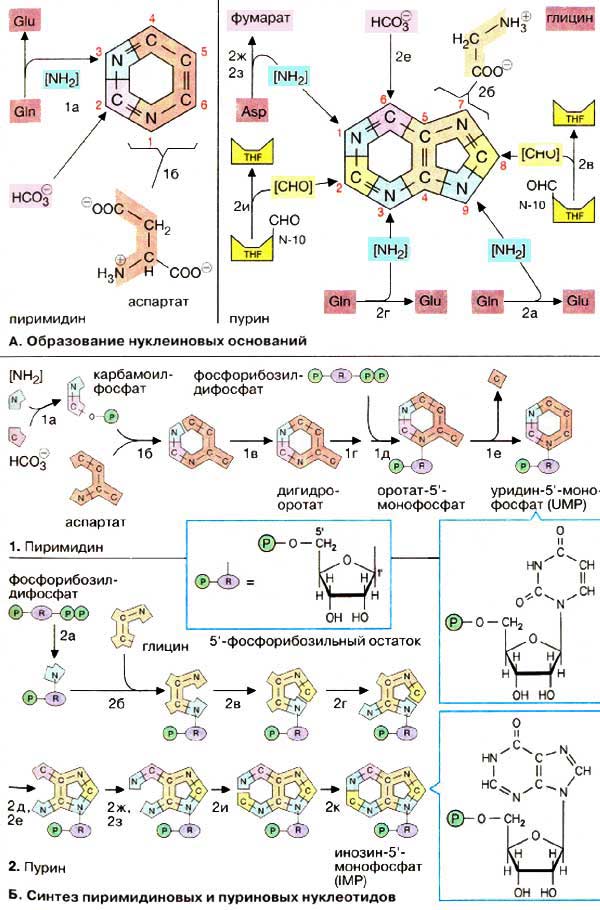
А. Образование нуклеиновых оснований
Пиримидиновое кольцо собирается из трех компонентов: атомы азота N-1 и углерода с С-4 по С-6 поставляются аспартатом . С-2 происходит из НСО 3 — , а второй атом азота (N-3) — из амидной группы глутамина.
Синтез пуринового кольца идет сложнее: единственным крупным предшественником является глицин , из которого происходят С-4 и С-5, а также N-7. Все другие атомы кольца поставляются отдельно: С-6 происходит из НСО 3 — , амидная группа глутамина дает атомы N-3 и N -9, донором аминогруппы для N-1 выступает аспартат, переход как и в цикле мочевины (см. с. 184), в фумарат. Наконец, атомы углерода С-2 и С-8 происходят из формильной группы N 10 -формилтетрагидрофолата (см. с. 110).
Б. Биосинтез пиримидиновых и пуриновых нуклеотидов
Центральными промежуточными продуктами биосинтеза предшественников нуклеиновых кислот являются мононуклеотид уридинмонофосат [УМФ (UMP)] для пиримидинового ряда и инозинмонофосфат [ИМФ (IMP), основание: гипоксантин) для пуринов. Путь синтеза различен для пиримидиновых и пуриновых оснований. В первом случае строится прежде всего пиримидиновое кольцо и затем к нуклеотиду присоединяется рибозо-5′-фосфат. Синтез пуриновых нуклеотидов, напротив, начинается с рибозо-5′-фосфата и исходя из него шаг за шагом формируется кольцо.
Непосредственными предшественниками в синтезе пиримидинового кольца являются карбамоилфосфат , который образуется из глутамина и НСО 3 — ( 1а ), и аспартат . После образования N-карбамоиласпартата ( 1б ) происходит замыкание кольца с образованием дигидрооротата ( 1в ). У млекопитающих стадии от 1а до 1в проходят в цитоплазме и катализируются одним полифункциональным ферментом. На следующей стадии ( 1г ) дигидрооротат окисляется флавинмо-нонуклеотидзависимой дегидрогеназой в оротат , который связывается с фосфорибозилдифосфатом (PRPP) с образованием нуклеотида оротидин-5′-монофосфата [ ОМФ (ОМР)], декарбоксилирование которого приводит к уридин-5′-монофосфату [ УМФ (UMP)].
Пуриновый биосинтез начинается с фосфорибозилдифосфата (названия отдельных промежуточных продуктов перечислены на с. 406). Сначала присоединяется аминогруппа, которая впоследствии в кольце становится N-9 ( 2а ). Глицин и формильная группа N 10 -формилтетрагидрофолата поставляют недостающие атомы пятичленного кольца ( 2б, 2в ). Прежде чем это кольцо замкнется ( 2е ), присоединяются атомы N-3 и N-6 шестичленного кольца ( 2г, 2д ). Затем построение кольца продолжается путем присоединения N-1 и С-2. На последней стадии шестичленное кольцо замыкается с образованием инозин-5′-монофосфата [ ИМФ (IMP)], который, однако, не накапливается, а быстро превращается в АМФ и ГМФ. Эти реакции и синтез других нуклеотидов рассмотрены на с. 192.
Механизм регуляции бактериальной аспартат-карбамоилтрансферазы с участием АТФ и ЦТФ изучен достаточно подробно (см. с. 118). В организме животных ключевым ферментом пиримидинового синтеза является не аспартат-карбамоилтрансфераза, а карбамоилфосфатсинтаза . Она активируется АТФ и фосфорибозилдифосфатом (PRPP) и тормозится УТФ. Регуляция синтеза пуринов также основана на ингибировании конечным продуктом: образование PRPP из рибозо-5′-фосфата тормозится АДФ и ГДФ. Аналогичным образом АМФ и ГМФ тормозят стадию 2а .
Источник
Синтез пуриновых нуклеотидов витамин
В 40-50-х годах XX столетия опытами с мечеными изотопами удалось выяснить происхождение атомов пуринового ядра при синтезе пуринов de novo. Было установлено, что в формировании кольца принимают участие аминокислоты Асп, Гли, Глн, СО2 и два одноуглеродных производных тетрагидрофолата: метенил-Н4-фолат и формил-Н4-фолат. Этим способом образуется основное количество пуриновых нуклеотидов, тогда как нуклеотиды, синтезирующиеся за счёт повторного использования азотистых оснований или нуклеозидов, составляют не более 10 — 20% общего фонда этих соединений.
А. Образование 5-фосфорибозил-1-дифосфата
Фосфорибозилдифосфат (ФРДФ), или фосфорибозилпирофосфат (ФРПФ) занимает центральное место в синтезе как пуриновых, так и пиримидиновых нуклеотидов (рис. 10-2).
Рис. 10-2. Образование 5-фосфорибозил-1-дифосфата.
Он образуется за счёт переноса β, y-пирофосфатного остатка АТФ на рибозо-5-фосфат в реакции, катализируемой ФРДФ-синтетазой.
Источниками рибозо-5-фосфата могут быть: пентозофосфатный путь превращения глюкозы или катаболизм нуклеозидов, в ходе которого под действием нуклеозидфосфорилазы первоначально образуется рибозо-1-фосфат, а затем с помощью, соответствующей мутазы фосфатный остаток переносится в 5-положение.
ФРДФ участвует не только в синтезе пуриновых и пиримидиновых нуклеотидов из простых предшественников (т. е. de novo), но используется на образование пуриновых нуклеотидов по «запасному» пути и в синтезе нуклеотидных коферментов.
Б. Биосинтез пуриновых нуклеотидов de novo
Сборка пуринового гетероцикла осуществляется на остатке рибозо-5-фосфата при участии различных доноров углерода и азота (рис. 10-3).
Рис. 10-3. Происхождение атомов С и N в пуриновом кольце.
Включение простых предшественников в пуриновое кольцо с образованием ИМФ
Первая специфическая реакция образования пуриновых нуклеотидов — перенос амидной группы Глн на ФРДФ с образованием 5-фосфорибозил-1-амина (рис. 10-4). Эту реакцию катализирует фермент амидофосфорибозилтрансфераза. При этом формируется β-N-гликозидная связь.
Рис. 10-4. Синтез пуриновых нуклеотидов de novo.
Затем к аминогруппе 5-фосфорибозил-1 -амина присоединяются остаток глицина, N 5 , N 10 -метенил-Н4-фолата ещё одна амидная группа глутамина, диоксид углерода, аминогруппа аспартата и формильный остаток N 10 -формил Н4-фолата.
Результатом этой десятистадийной серии реакций является образование первого пуринового нуклеотида — инозин-5′-монофосфата (ИМФ), на синтез которого затрачивается не менее шести молекул АТФ. В отличие от прокариотов, у которых каждую стадию этого процесса катализирует отдельный фермент, у эукариотов за
счёт слияния генов возникли полифункциональные ферменты, каждый из которых катализирует несколько реакций. В синтезе пуриновых нуклеотидов de novo это реакции 3, 4 и 6, 7 — 8 и 10 — 11 соответственно.
ИМФ в основном используется на синтез АМФ или ГМФ. Небольшое количество этого продукта обнаруживается также в тРНК в качестве одного из минорных нуклеотидов.
Превращение ИМФ в АМФ и ГМФ в обоих случаях включает 2 стадии и идёт с затратой энергии (рис. 10-5).
Рис. 10-5. Синтез АМФ и ГМФ из ИМФ. 1 — аденилосукцинатсинтетаза; 2 — аденилосукциназа; 3 — ИМФ-дегидрогеназа; 4 — ГМФ-синтетаза.
Аденилосукцинатсинтетаза, используя энергию ГТФ, присоединяет аспартат к ИМФ с образованием аденилосукцината, который в реакции, катализируемой аденилосукциназой, отщепляет фумарат и превращается в АМФ.
Второй пуриновый нуклеотид (ГМФ) образуется также в 2 стадии. Сначала ИМФ окисляется NAD + -зависимой ИМФ-дегидрогеназой с образованием ксантозин-5′-монофосфата (КМФ). Последующее трансамидирование гидроксильной группы при С2-пуринового кольца КМФ катализирует ГМФ-синтетаза с использованием амидной группы Глн и энергии АТФ.
При образовании пуриновых нуклеотидов ГТФ расходуется на синтез АМФ, а АТФ — на синтез ГМФ. Перекрёстное использование пуриновых нуклеозидтрифосфатов на образование конечных продуктов синтеза помогает поддерживать в клетках баланс адениловых и гуаниловых нуклеотидов.
Печень — основное место образования пуриновых нуклеотидов, откуда они могут поступать в ткани, не способные к их синтезу: эритроциты, ПЯЛ и частично мозг.
Образование нуклеозид- ди- и трифосфатов
В образовании нуклеиновых кислот, некоторых коферментов и во многих синтетических процессах нуклеотиды используются в виде ди- и трифосфатов, синтез которых катализируют ферменты класса трансфераз. АМФ и ГМФ превращаются в нуклеозиддифосфаты (НДФ) с помощью специфичных к азотистому основанию нуклеозидмонофосфаткиназ (НМФ-киназ) и АТФ. Так, аденилаткиназа катализирует реакцию:
АМФ + АТФ —> 2 АДФ,
ГМФ + АТФ —> ГДФ + АДФ.
Аденилаткиназа особенно активна в печени и мышцах, где высок уровень энергоёмких процессов. Функция этого фермента заключается в том, чтобы поддерживать в тканях равновесие фонда адениловых нуклеотидов: АМФ, АДФ и АТФ.
Взаимопревращения нуклеозиддифосфатов и нуклеозидтрифосфатов осуществляет нуклеозид- дифосфаткиназа. Этот фермент в отличие от НМФ-киназ обладает широкой субстратной специфичностью и, в частности, может катализировать реакцию:
ГДФ + АТФ —> ГТФ + АДФ.
Превращение АДФ в АТФ происходит, в основном, за счёт окислительного фосфорилирования или в реакциях субстратного фосфорилирования гликолиза или цитратного цикла.
В. ‹Запасные› пути синтеза пуриновых нуклеотидов (реутилизация азотистых оснований и нуклеозидов)
Огромные затраты энергии для синтеза пуриновых нуклеотидов de novo не способны полностью обеспечить субстратами синтез нуклеиновых кислот в период гаструляции и раннего роста ребёнка. Потребность в большом количестве нуклеотидов привела к развитию «запасных» путей синтеза этих «дорогих» молекул. Наибольшее значение в этом процессе имеют ферменты, осуществляющие превращение пуринов в мононуклеотиды с использованием ФРДФ как донора остатка фосфорибозы.
Синтез АМФ и ГМФ из аденина и гуанина
ФРДФ-зависимое фосфорибозилирование пуринов катализируют 2 фермента.
Аденинфосфорибозилтрансфераза, ответственная за образование АМФ (рис. 10-6).
Рис. 10-6. Фосфорибозилирование аденина в АМФ.
Гипоксантин-гуанинфосфорибозилтрансфераза, катализирующая образование ИМФ и ГМФ из гипоксантина и гуанина соответственно (рис. 10-7).
Рис. 10-7. Фосфорибозилирование гипоксантина и гуанина с образованием ИМФ и ГМФ.
Однако в организме при любых ситуациях этот путь синтеза пуриновых нуклеотидов, получивший название «путь спасения», имеет вспомогательное значение.
Нуклеозиды, получающиеся при катаболизме нуклеиновых кислот из нуклеотидов под действием нуклеотидаз, могут повторно фосфорилироваться, образуя нуклеозид-5′-монофосфаты за счёт переноса y-фосфатного остатка АТФ на соответствующий субстрат. У млекопитающих такой путь пополнения запасов пуриновых нуклеотидов в клетке не имеет существенного значения. Основным ферментом этой группы является аденозин- киназа, которая ускоряет реакцию:
Аденозин + АТФ —> АМФ + АДФ.
Из всех способов реутилизации пуринов наиболее активна гипоксантин-гуанинфосфорибозилтрансферазная реакция, поскольку ИМФ, образующийся в этой реакции, вовлекается в синтез АМФ и ГМФ. Использование гипоксантина и гуанина по запасному пути становится жизненно важным событием в клетках, не способных к синтезу пуриновых нуклеотидов de novo. Значение аденинфосфорибозилтрансферазы в повторном использовании аденина менее существенно. По сравнению с аденозином количество аденина в клетках мало, а первый возвращается в фонд нуклеотидов с помощью аденозинкиназы.
Г. Регуляция синтеза пуриновых нуклеотидов
Основным показателем, от которого зависит синтез пуриновых нуклеотидов, служит концентрация ФРДФ, которая, в свою очередь, зависит от скорости его синтеза, утилизации и разрушения. Количество ФРДФ определяется доступностью рибозо-5-фосфата и активностью ФРДФ синтетазы — фермента, чувствительного к концентрации фосфата и пуриновых нуклеотидов.
Внутриклеточная концентрация ФРДФ строго регулируется и обычно низкая. ФРДФ синтетаза — аллостерический фермент. Он активируется неорганическим фосфатом (Рi) и ингибируется пуриновыми нуклеозид- моно-, ди- и трифосфатами, которые по эффективности ингибирования распределяются в следующем по-
рядке: НМФ> НДФ> НТФ (рис. 10-8). ФРДФ служит не только субстратом, но и аллостерическим активатором второй реакции синтеза пуринонуклеотидов de novo, которую катализирует амидофосфорибозилтрансфераза.
Рис. 10-8. Регуляция синтеза пуриновых нуклеотидов. 1 — ФРДФ синтетаза; 2 — амидофосфорибозилтрансфераза; 3 — ИМФ дегидрогеназа; 4 — аденилосукцинатсинтетаза.
Пуриновые нуклеотиды, особенно АМФ и ГМФ по механизму отрицательной обратной связи ингибируют амидофосфорибозилтрансферазу, которая катализирует первую специфическую реакцию синтеза пуриновых нуклеотидов de novo.
Метаболическая цепь образования АМФ и ГМФ de novo регулируется также в месте её разветвления: АМФ ингибирует аденилосукцинат- синтетазу, а ГМФ — реакцию образования ксантиловой кислоты, которую катализирует ИМФ дегидрогеназа. Перекрёстная регуляция путей использования ИМФ служит для того, чтобы снизить синтез одного пуринового нуклеотида при дефиците другого.
Помимо ферментов основного пути синтеза пуриновых нуклеотидов de novo, регулируется также активность ферментов «запасных» путей: аденинфосфорибозилтрансфераза ингибируется АМФ, а гипоксантин-гуанинфосфорибозилтрансфераза — ИМФ и ГМФ.
В различных клетках организма синтезируется до 90% пуриновых и пиримидиновых нуклеотидов из простых предшественников de novo. Введённые в кровь азотистые основания и нуклеозиды, а также основания и нуклеозиды, образующиеся в результате внутриклеточного разрушения нуклеиновых кислот, в небольшом количестве могут использоваться для повторного синтеза нуклеотидов по так называемым «запасным» путям.
Источник