Синтез пуринового кольца витамин
Биосинтез пуринов и пиримидинов
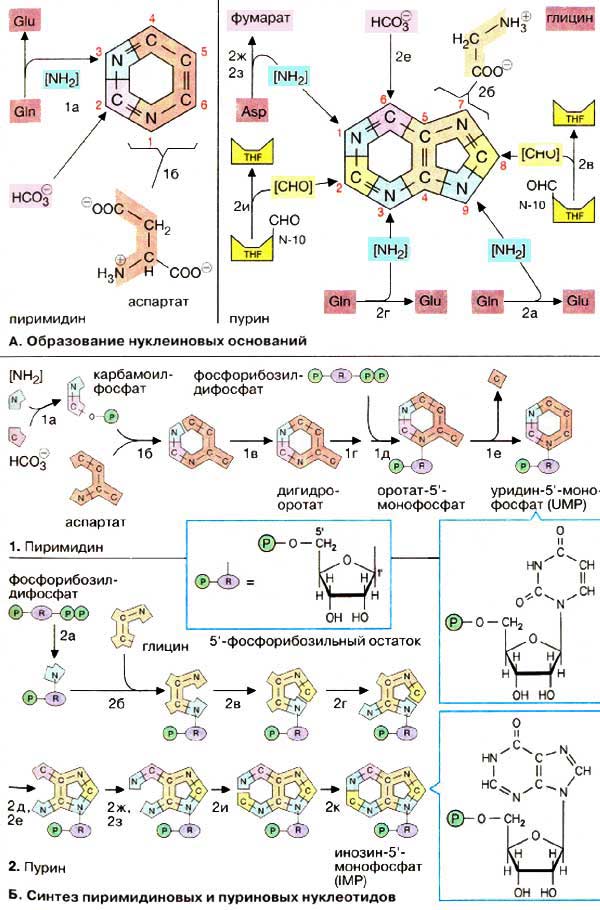
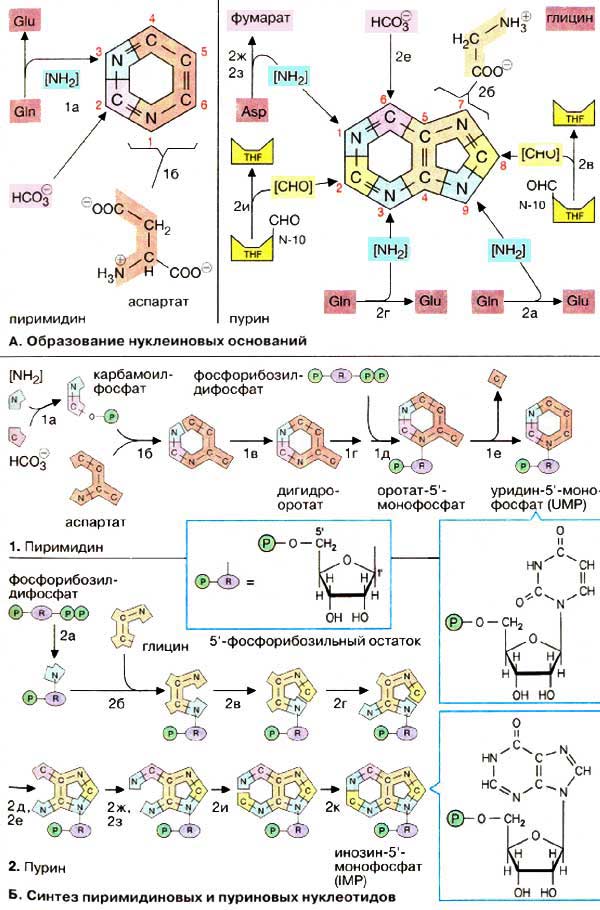
А. Образование нуклеиновых оснований
Пиримидиновое кольцо собирается из трех компонентов: атомы азота N-1 и углерода с С-4 по С-6 поставляются аспартатом . С-2 происходит из НСО 3 — , а второй атом азота (N-3) — из амидной группы глутамина.
Синтез пуринового кольца идет сложнее: единственным крупным предшественником является глицин , из которого происходят С-4 и С-5, а также N-7. Все другие атомы кольца поставляются отдельно: С-6 происходит из НСО 3 — , амидная группа глутамина дает атомы N-3 и N -9, донором аминогруппы для N-1 выступает аспартат, переход как и в цикле мочевины (см. с. 184), в фумарат. Наконец, атомы углерода С-2 и С-8 происходят из формильной группы N 10 -формилтетрагидрофолата (см. с. 110).
Б. Биосинтез пиримидиновых и пуриновых нуклеотидов
Центральными промежуточными продуктами биосинтеза предшественников нуклеиновых кислот являются мононуклеотид уридинмонофосат [УМФ (UMP)] для пиримидинового ряда и инозинмонофосфат [ИМФ (IMP), основание: гипоксантин) для пуринов. Путь синтеза различен для пиримидиновых и пуриновых оснований. В первом случае строится прежде всего пиримидиновое кольцо и затем к нуклеотиду присоединяется рибозо-5′-фосфат. Синтез пуриновых нуклеотидов, напротив, начинается с рибозо-5′-фосфата и исходя из него шаг за шагом формируется кольцо.
Непосредственными предшественниками в синтезе пиримидинового кольца являются карбамоилфосфат , который образуется из глутамина и НСО 3 — ( 1а ), и аспартат . После образования N-карбамоиласпартата ( 1б ) происходит замыкание кольца с образованием дигидрооротата ( 1в ). У млекопитающих стадии от 1а до 1в проходят в цитоплазме и катализируются одним полифункциональным ферментом. На следующей стадии ( 1г ) дигидрооротат окисляется флавинмо-нонуклеотидзависимой дегидрогеназой в оротат , который связывается с фосфорибозилдифосфатом (PRPP) с образованием нуклеотида оротидин-5′-монофосфата [ ОМФ (ОМР)], декарбоксилирование которого приводит к уридин-5′-монофосфату [ УМФ (UMP)].
Пуриновый биосинтез начинается с фосфорибозилдифосфата (названия отдельных промежуточных продуктов перечислены на с. 406). Сначала присоединяется аминогруппа, которая впоследствии в кольце становится N-9 ( 2а ). Глицин и формильная группа N 10 -формилтетрагидрофолата поставляют недостающие атомы пятичленного кольца ( 2б, 2в ). Прежде чем это кольцо замкнется ( 2е ), присоединяются атомы N-3 и N-6 шестичленного кольца ( 2г, 2д ). Затем построение кольца продолжается путем присоединения N-1 и С-2. На последней стадии шестичленное кольцо замыкается с образованием инозин-5′-монофосфата [ ИМФ (IMP)], который, однако, не накапливается, а быстро превращается в АМФ и ГМФ. Эти реакции и синтез других нуклеотидов рассмотрены на с. 192.
Механизм регуляции бактериальной аспартат-карбамоилтрансферазы с участием АТФ и ЦТФ изучен достаточно подробно (см. с. 118). В организме животных ключевым ферментом пиримидинового синтеза является не аспартат-карбамоилтрансфераза, а карбамоилфосфатсинтаза . Она активируется АТФ и фосфорибозилдифосфатом (PRPP) и тормозится УТФ. Регуляция синтеза пуринов также основана на ингибировании конечным продуктом: образование PRPP из рибозо-5′-фосфата тормозится АДФ и ГДФ. Аналогичным образом АМФ и ГМФ тормозят стадию 2а .
Источник
Нарушения метаболизма. Биохимия специализированных тканей. (Для клин.ордов КЛД)
Нарушения пуринового обмена
1. Пуриновый обмен
Пуриновый обмен — совокупность процессов синтеза и распада пуриновых нуклеотидов. Пуриновые нуклеотиды состоят из остатка азотистого пуринового основания, углевода рибозы (дезоксирибозы), связанного бета-гликозидной связью с атомом азота пуринового основания, и одного или нескольких остатков фосфорной кислоты, присоединенных эфирной связью к атому углерода углеводного компонента.
Важнейшие азотистые основания
Мажорным пуриновым нуклеотидом является АТФ. В организме АТФ является одним из самых часто обновляемых веществ; так, у человека продолжительность жизни одной молекулы АТФ менее 1 мин. В течение суток одна молекула АТФ проходит в среднем 2000—3000 циклов ресинтеза (человеческий организм синтезирует около 40 кг АТФ в день, но содержит в каждый конкретный момент примерно 250 г), то есть запаса АТФ в организме практически не создаётся, и для нормальной жизнедеятельности необходимо постоянно синтезировать новые молекулы АТФ.
Аденозинтрифосфа́т или Аденозинтрифосфорная кислота (сокр. АТФ, англ. АТР) — нуклеозидтрифосфат, имеющий большое значение в обмене энергии и веществ в организмах. АТФ — универсальный источник энергии для всех биохимических процессов, протекающих в живых системах. Открытие вещества произошло в 1929 году группой учёных Гарвардской медицинской школы — Карлом Ломаном, Сайрусом Фиске и Йеллапрагадой Суббарао, а в 1941 году Фриц Липман показал, что АТФ является основным переносчиком энергии в клетке.
У человека и приматов мочевая кислота — конечный продукт обмена пуринов, образующийся в результате ферментативного окисления ксантина под действием ксантиноксидазы; у остальных млекопитающих мочевая кислота превращается в аллантоин. Небольшие количества мочевой кислоты содержатся в тканях (мозг, печень, кровь), а также в моче и поте млекопитающих и человека. При некоторых нарушениях обмена веществ происходит накопление мочевой кислоты и её кислых солей (уратов) в организме (камни в почках и мочевом пузыре, подагрические отложения, гиперурикемия). У птиц, ряда пресмыкающихся и большинства наземных насекомых мочевая кислота — конечный продукт не только пуринового, но и белкового обмена. Система биосинтеза мочевой кислоты (а не мочевины, как у большинства позвоночных) в качестве механизма связывания в организме более токсичного продукта азотистого обмена — аммиака — развилась у этих животных в связи с характерным для них ограниченным водным балансом (мочевая кислота выводится из организма с минимальным количеством воды или даже в твёрдом виде). Высохшие экскременты птиц (гуано) содержат до 25 % мочевой кислоты. Обнаружена она и в ряде растений.
Источник
Синтез пуринового кольца витамин


Основания, содержащиеся в нуклеиновых кислотах, являются производными ароматических гетероциклических соединений пурина и пиримидина (см. с. 86). Путь биосинтеза нуклеиновых оснований довольно сложен, однако этот процесс жизненно необходим почти для всех клеток. Сборка нуклеиновых оснований представлена здесь схематически. Полная схема реакций приведена на сс. 405 и 406.
А. Образование нуклеиновых оснований
Пиримидиновое кольцо собирается из трех компонентов: атомы азота N-1 и углерода с С-4 по С-6 поставляются аспартатом. С-2 происходит из НСО 3 — , а второй атом азота (N-3) — из амидной группы глутамина.
Синтез пуринового кольца идет сложнее: единственным крупным предшественником является глицин, из которого происходят С-4 и С-5, а также N-7. Все другие атомы кольца поставляются отдельно: С-6 происходит из НСО 3 — , амидная группа глутамина дает атомы N-3 и N -9, донором аминогруппы для N-1 выступает аспартат, переход как и в цикле мочевины (см. с. 184), в фумарат. Наконец, атомы углерода С-2 и С-8 происходят из формильной группы N 10 -формилтетрагидрофолата (см. с. 110).
Центральными промежуточными продуктами биосинтеза предшественников нуклеиновых кислот являются мононуклеотид уридинмонофосат [УМФ (UMP)] для пиримидинового ряда и инозинмонофосфат [ИМФ (IMP), основание: гипоксантин) для пуринов. Путь синтеза различен для пиримидиновых и пуриновых оснований. В первом случае строится прежде всего пиримидиновое кольцо и затем к нуклеотиду присоединяется рибозо-5′-фосфат. Синтез пуриновых нуклеотидов, напротив, начинается с рибозо-5′-фосфата и исходя из него шаг за шагом формируется кольцо.
Непосредственными предшественниками в синтезе пиримидинового кольца являются карбамоилфосфат , который образуется из глутамина и НСО 3 — ( 1а ), и аспартат . После образования N-карбамоиласпартата ( 1б ) происходит замыкание кольца с образованием дигидрооротата ( 1в ). У млекопитающих стадии от 1а до 1в проходят в цитоплазме и катализируются одним полифункциональным ферментом. На следующей стадии ( 1г ) дигидрооротат окисляется флавинмо-нонуклеотидзависимой дегидрогеназой в оротат , который связывается с фосфорибозилдифосфатом (PRPP) с образованием нуклеотида оротидин-5′-монофосфата [ ОМФ (ОМР)], декарбоксилирование которого приводит к уридин-5′-монофосфату [ УМФ (UMP)].
Пуриновый биосинтез начинается с фосфорибозилдифосфата (названия отдельных промежуточных продуктов перечислены на с. 406). Сначала присоединяется аминогруппа, которая впоследствии в кольце становится N-9 ( 2а ). Глицин и формильная группа N 10 -формилтетрагидрофолата поставляют недостающие атомы пятичленного кольца ( 2б, 2в ). Прежде чем это кольцо замкнется ( 2е ), присоединяются атомы N-3 и N-6 шестичленного кольца ( 2г, 2д ). Затем построение кольца продолжается путем присоединения N-1 и С-2. На последней стадии шестичленное кольцо замыкается с образованием инозин-5′-монофосфата [ ИМФ (IMP)], который, однако, не накапливается, а быстро превращается в АМФ и ГМФ. Эти реакции и синтез других нуклеотидов рассмотрены на с. 192.
Механизм регуляции бактериальной аспартат-карбамоилтрансферазы с участием АТФ и ЦТФ изучен достаточно подробно (см. с. 118). В организме животных ключевым ферментом пиримидинового синтеза является не аспартат-карбамоилтрансфераза, а карбамоилфосфатсинтаза. Она активируется АТФ и фосфорибозилдифосфатом (PRPP) и тормозится УТФ. Регуляция синтеза пуринов также основана на ингибировании конечным продуктом: образование PRPP из рибозо-5′-фосфата тормозится АДФ и ГДФ. Аналогичным образом АМФ и ГМФ тормозят стадию 2а .
Источник
Биосинтез пуриновых нуклеотидов
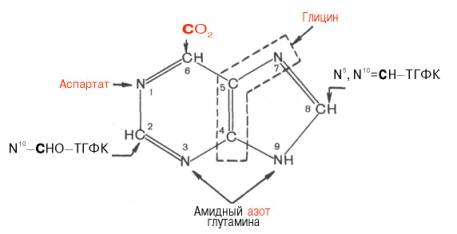
Пуриновые основания, образующиеся в процессе переваривания нуклеиновых кислот в кишечнике, в дальнейшем практически не используются, поэтому их синтез осуществляется из низкомолекулярных предшественников, продуктов обмена углеводов и белков. Впервые работами Дж. Бьюкенена, Дж. Гринберга экспериментально доказано включение ряда меченых атомов, в частности 15 N- и 14 С-глицина, 15 N-аспартата, 15 N-глутамина и др., в пуриновое кольцо мочевой кислоты. Скармливая птицам эти и другие меченые соединения, Дж. Бьюкенен анализировал места включения метки в пуриновое кольцо; полученные данные были в дальнейшем уточнены и подтверждены рядом других исследователей. Результаты этих исследований можно представить в виде схемы:
Из схемы видно, что 4-й и 5-й атомы углерода и 7-й атом азота в ядре имеют своим источником глицин. Два атома азота (N-3 и N-9) происходят из амидной группы глутамина, один атом азота (N-1) – из азота аспара-гиновой кислоты; углеродный атом (С-2) происходит из углерода N 10 -фор-мил-ТГФК, атом углерода в 8-м положении – из N 5 ,N 10 -метенил-ТГФК и, наконец, углерод С-6 имеет своим источником СО2.
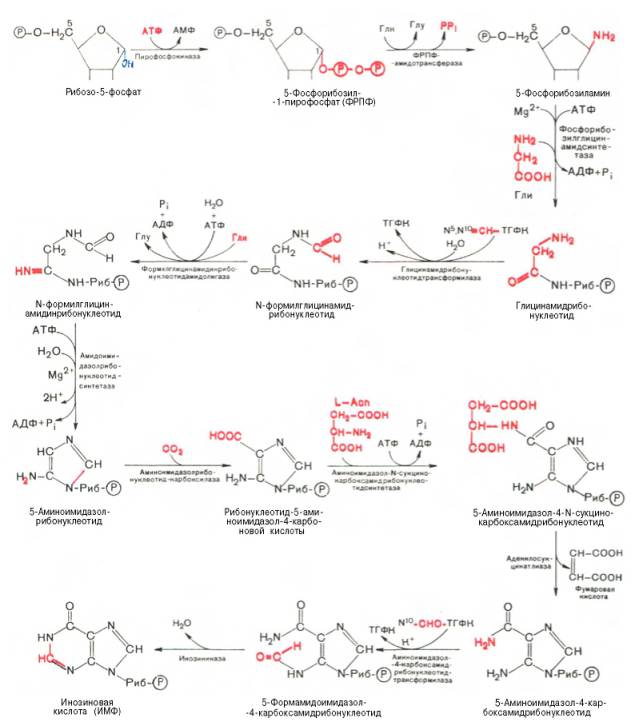
В настоящее время благодаря исследованиям Дж. Бьюкенена, Дж. Гринберга, А. Корнберга и сотр. полностью расшифрована последовательность включения перечисленных веществ в пуриновое кольцо, установлена природа всех промежуточных соединений и ферментных систем, катализирующих химические реакции синтеза. Интересным оказался факт почти полного совпадения путей синтеза пуриновых оснований в печени животных и у микроорганизмов, в частности у Е. coli и Neurospora crassa. Следует, однако, отметить, что конечным результатом синтеза оказалось не свободное пуриновое основание, а рибонуклеотид – инозиновая кислота (ИМФ), из которой далее синтезируются АМФ и ГМФ. На схеме представлена последовательность всех 11 химических реакций этого синтеза с указанием ферментных систем, коферментов, источников энергии и других известных к настоящему времени кофакторов (см. с. 472).
Как видно из приведенной схемы, синтез инозиновой кислоты начинается с D-рибозо-5-фосфата, который, как известно, является продуктом пентозофосфатного цикла и на который переносится в необычной реакции пирофосфатная группа АТФ. Образовавшийся 5-фосфорибозил-1-пирофос-фат (ФРПФ) взаимодействует с глутамином, являющимся донором NH2-группы, в результате чего образуется β-5-фосфорибозил-амин, причем в процессе реакции наряду с освобождением пирофосфата и свободной глутаминовой кислоты происходит изменение его конфигурации (из α- в β-). Таким образом, данная стадия становится ключевой реакцией в синтезе пуринов. На следующей стадии присоединяется вся молекула глицина к свободной NH2-группе β-5-фосфорибозил-амина (реакция нуждается в доставке энергии АТФ) с образованием глицинамидрибонуклеотида. Затем, на следующей стадии, цепь удлиняется за счет присоединения формильной группы из N 5 ,N 10 -метенил-ТГФК с образованием формилглицинамид-рибонуклеотида. На формильную группу последнего переносится далее амидная группа глутамина и синтезируется формилглицинамидинрибо-нуклеотид (реакция также идет с потреблением энергии АТФ). На следующей стадии замыкается пятичленное имидазольное кольцо и образуется 5-аминоимидазолрибонуклеотид, который способен акцептировать СО2 с образованием рибонуклеотида 5-аминоимидазол-4-карбоновой кислоты.
В последующем двухступенчатом процессе, в котором участвуют аспа-рагиновая кислота и АТФ, образуется 5-аминоимидазол-4-карбоксамид-рибонуклеотид и освобождается фумаровая кислота. В этих реакциях азот аспарагиновой кислоты включается в 1-е положение будущего пуринового ядра. Последний углеродный атом пиримидинового остатка кольца пурина вводится в виде формильного остатка (источник N 10 -формил-ТГФК), который присоединяется к 5-NH2-группе. После этого отщепляется молекула воды и второе кольцо замыкается. В результате образуется первый пу-риновый нуклеотид – инозиновая кислота (ИМФ), которая является предшественником пуриновых нуклеотидов в составе нуклеиновых кислот.
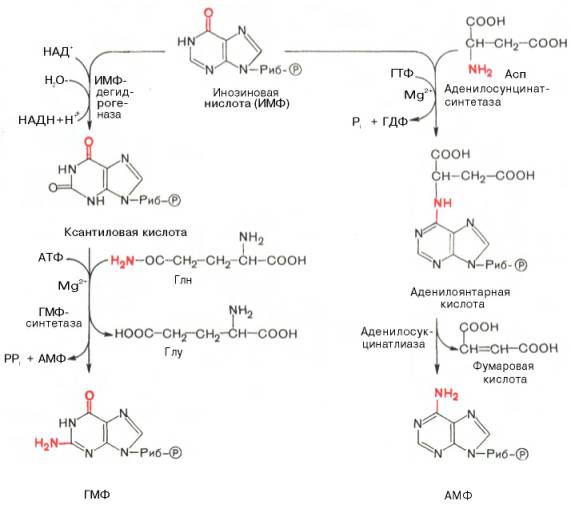
АМФ и ГМФ образуются из ИМФ, причем в синтезе обоих моно-нуклеотидов участвуют по два фермента, различных по своему механизму действия. Образование ГМФ из ИМФ катализируют ИМФ-дегидрогеназа и ГМФ-синтетаза, а образование АМФ из того же предшественника катализируется последовательным действием аденилосукцинатсинтетазы и аденилосукцинат-лиазы. Механизм двухэтапного синтеза АМФ и ГМФ можно представить в виде химических реакций.
В ферментативном синтезе АМФ из ИМФ специфическое участие принимает аспарагиновая кислота, являющаяся донором NH2-группы, и ГТФ в качестве источника энергии; промежуточным продуктом реакции является аденилоянтарная кислота. Биосинтез ГМФ, напротив, начинается с де-гидрогеназной реакции ИМФ с образованием ксантозиловой кислоты; в аминировании последней используется только амидный азот глутамина.
Превращение АМФ и ГМФ в соответствующие нуклеозидди- и нуклео-зидтрифосфаты также протекает в 2 стадии при участии специфических нуклеозидмонофосфат- и нуклеозиддифосфаткиназ :
ГМФ + АТФ ГДФ + АДФ; ГДФ + АТФ ГТФ + АДФ.
Следует указать на существование в клетках весьма тонкого механизма регуляции синтеза пуриновых нуклеотидов. Синтез их тормозится конечными продуктами по принципу обратной связи, т.е. ингибированием первой стадии переноса аминогруппы глутамина на ФРПФ. Фермент, катализирующий эту стадию, оказался аллостерическим регуляторным ферментом. Вторая особенность механизма регуляции заключается в том, что избыток ГМФ в клетках оказывает аллостерическое торможение только на свой собственный синтез, не влияя на синтез АМФ, и, наоборот, накопление АМФ подавляет свой синтез, не ингибируя синтеза ГМФ.
Источник