Роль печени в обмене витаминов
1. Как липо-, так и большинство гидровитаминов при избыточном поступлении в организм способны депонироваться в печени.
2. В гепатоцитах большая часть натуральных алиментарных компонентов активируется: а) путём фосфорилирования; например: витамин В1 – в тиаминдифосфат (ТДФ); В6 – в фосфопиридоксамин или фосфопиридоксаль (ФП); б) включаясь в нуклеотиды: витамин РР в НАД + , НАД + Ф; рибофлавин в ФМН, ФАД; пантотеновая кислота в кофермент ацилирования (НS-КоА); в) витамин Д гидроксилируясь; г) каротины под действием каротиндиоксигеназы преобразуются в витамин А; д) за счёт реакций гидрирования фолиевая кислота превращается в тетрагидрофолиевую кислоту (ТГФК); реакция восстановления используется и для реактивации витамина С.
3. В печени осуществляется синтез специфических белков, транспортирующих витамины в плазме крови к органам-мишеням. Комплекс: витамин + транспортный белок обеспечивает растворимость липовитамина в биологической жидкости; предупреждает преждевременное проявление активности витамина; затрудняет выделение его через почечный фильтр; создаёт специфическое взаимодействие с рецепторами мембран клеток-мишеней.
4. Катаболическая фаза обмена многих витаминов завершается в печени. Продукты биотрансформации липовитаминов, В12 выделяются из организма в составе жёлчи через желудочно-кишечный тракт.
Общие механизмы действия витаминов
Практически все незаменимые пищевые компоненты обладают внутриклеточной рецепцией, то есть проникают в цитозоль и органоиды, где и выполняют свои специфические функции.
1. После созревания гормоновитамины, взаимодействуя с гормончувствительными элементами (ГЧЭ) транскриптонов, растормаживают матричную активность отдельных генов, запуская транскрипцию и трансляцию.
2. В качестве простетической группы могут входить в состав различных белков, выполняющих разнообразные функции:
а) пластическую: липовитамины – облигатный компонент билипидного слоя мембран;
б) каталитическую: модифицированные В6 – коэнзим аминофераз, В1 – лиаз, В2 и В5 (РР) – дегидрогеназ;
в) специфическую – родопсин — сложный протеин, содержащий в качестве небелкового компонента витамин А, обеспечивает свето- и цветоощущения.
3. Сопряжённая система редокс-витаминов способна:
а) реагировать с радикалом, неспаренный электрон которого вступает в сопряжение с общим π-электронным облаком витамина и делокализуется, что делает образовавшийся радикал витамина стабильным, тем самым подавляется скорость СРО (витамины Е, А, С, Р) (ловушки радикалов); б) усиливать подвижность протонов. Являясь их источниками, витамины выступают восстановителями (косубстратами) в ОВР (аскорбиновая кислота – донор восстановительных эквивалентов в реакциях гидроксилирования аминокислот, в преобразовании витамина Вс в ТГФК).
Срок жизни незаменимого пищевого фактора в клетке ограничен. Инактивация натурального ингредиента начинается в органах-мишенях и часто заканчивается в печени. Продукты его деградации или он сам выделяются с мочой, потом, с выдыхаемым воздухом или через желудочно-кишечный тракт с калом.
Источник
Биохимия печени
Тема: «БИОХИМИЯ ПЕЧЕНИ»
1. Химический состав печени: содержание гликогена, липидов, белков, минеральный состав.
2. Роль печени в углеводном обмене: поддержание постоянной концентрации глюкозы, синтез и мобилизация гликогена, глюконеогенез, основные пути превращения глюкозо-6-фосфата, взаимопревращения моносахаридов.
3. Роль печени в обмене липидов: синтез высших жирных кислот, ацилглицеролов, фосфолипидов, холестерола, кетоновых тел, синтез и обмен липопротеинов, понятие о липотропном эффекте и липотропных факторах.
4. Роль печени в белковом обмене: синтез специфических белков плазмы крови, образование мочевины и мочевой кислоты, холина, креатина, взаимопревращения кетокислот и аминокислот.
5. Метаболизм алкоголя в печени, жировое перерождение печени при злоупотреблении алкоголем.
6. Обезвреживающая функция печени: стадии (фазы) обезвреживания токсических веществ в печени.
7. Обмен билирубина в печени. Изменения содержания желчных пигментов в крови, моче и кале при различных видах желтух (надпечёночной, паренхиматозной, обтурационной).
8. Химический состав желчи и её роль; факторы, способствующие образованию желчных камней.
31.1. Функции печени.
Печень является органом, занимающим уникальное место в обмене веществ. В каждой печёночной клетке содержится несколько тысяч ферментов, катализирующих реакции многочисленных метаболических путей. Поэтому печень выполняет в организме целый ряд метаболических функций. Важнейшими из них являются:
- биосинтез веществ, которые функционируют или используются в других органах. К этим веществам относятся белки плазмы крови, глюкоза, липиды, кетоновые тела и многие другие соединения;
- биосинтез конечного продукта азотистого обмена в организме — мочевины;
- участие в процессах пищеварения — синтез желчных кислот, образование и экскреция желчи;
- биотрансформация (модификация и конъюгация) эндогенных метаболитов, лекарственных препаратов и ядов;
- выделение некоторых продуктов метаболизма (желчные пигменты, избыток холестерола, продукты обезвреживания).
31.2. Роль печени в обмене углеводов.
Основная роль печени в обмене углеводов заключается в поддержании постоянного уровня глюкозы в крови. Это осуществляется путём регуляции соотношения процессов образования и утилизации глюкозы в печени.
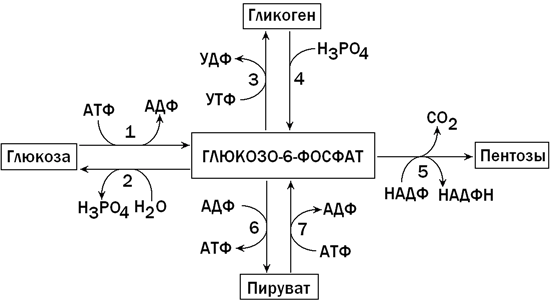
В клетках печени содержится фермент глюкокиназа, катализирующий реакцию фосфорилирования глюкозы с образованием глюкозо-6-фосфата. Глюкозо-6-фосфат является ключевым метаболитом углеводного обмена; основные пути его превращения представлены на рисунке 1.
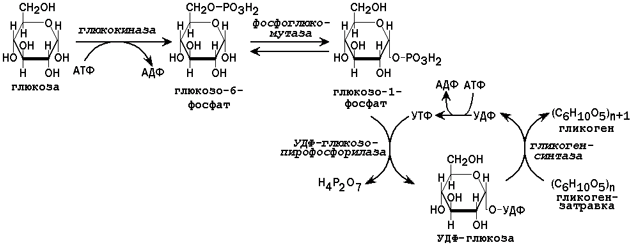
31.2.1. Пути утилизации глюкозы. После приёма пищи большое количество глюкозы поступает в печень по воротной вене. Эта глюкоза используется прежде всего для синтеза гликогена (схема реакций приводится на рисунке 2). Содержание гликогена в печени здоровых людей обычно составляет от 2 до 8% массы этого органа.
Гликолиз и пентозофосфатный путь окисления глюкозы в печени служат в первую очередь поставщиками метаболитов-предшественников для биосинтеза аминокислот, жирных кислот, глицерола и нуклеотидов. В меньшей степени окислительные пути превращения глюкозы в печени являются источниками энергии для обеспечения биосинтетических процессов.
Рисунок 1. Главные пути превращения глюкозо-6-фосфата в печени. Цифрами обозначены: 1 — фосфорилирование глюкозы; 2 — гидролиз глюкозо-6-фосфата; 3 — синтез гликогена; 4 — мобилизация гликогена; 5 — пентозофосфатный путь; 6 — гликолиз; 7 — глюконеогенез.
Рисунок 2. Схема реакций синтеза гликогена в печени.
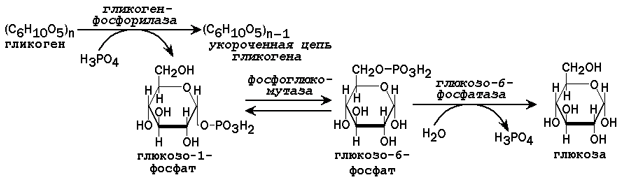
Рисунок 3. Схема реакций мобилизации гликогена в печени.
31.2.2. Пути образования глюкозы. В некоторых условиях (при голодании низкоуглеводной диете, длительной физической нагрузке) потребность организма в углеводах превышает то количество, которое всасывается из желудочно-кишечного тракта. В таком случае образование глюкозы осуществляется с помощью глюкозо-6-фосфатазы, катализирующей гидролиз глюкозо-6-фосфата в клетках печени. Непосредственным источником глюкозо-6-фосфата служит гликоген. Схема мобилизации гликогена представлена на рисунке 3.
Мобилизация гликогена обеспечивает потребности организма человека в глюкозе на протяжении первых 12 — 24 часов голодания. В более поздние сроки основным источником глюкозы становится глюконеогенез — биосинтез из неуглеводных источников.
Основными субстратами для глюконеогенеза служат лактат, глицерол и аминокислоты (за исключением лейцина). Эти соединения сначала превращаются в пируват или оксалоацетат — ключевые метаболиты глюконеогенеза.
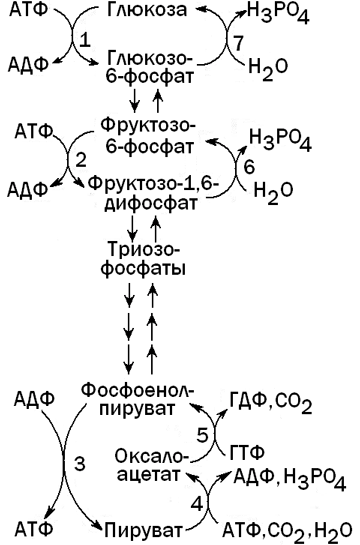
Глюконеогенез — процесс, обратный гликолизу. При этом барьеры, создаваемые необратимыми реакциями гликолиза, преодолеваются при помощи специальных ферментов, катализирующих обходные реакции (см. рисунок 4).
Из других путей обмена углеводов в печени следует отметить превращение в глюкозу других пищевых моносахаридов — фруктозы и галактозы.
Рисунок 4. Гликолиз и глюконеогенез в печени.
Ферменты, катализирующие необратимые реакции гликолиза: 1 — глюкокиназа; 2 — фосфофруктокиназа; 3 — пируваткиназа.
Ферменты, катализирующие обходные реакции глюконеогенеза: 4 -пируваткарбоксилаза; 5 — фосфоенолпируваткарбоксикиназа; 6 -фруктозо-1,6-дифосфатаза; 7 — глюкозо-6-фосфатаза.
31.3. Роль печени в обмене липидов.
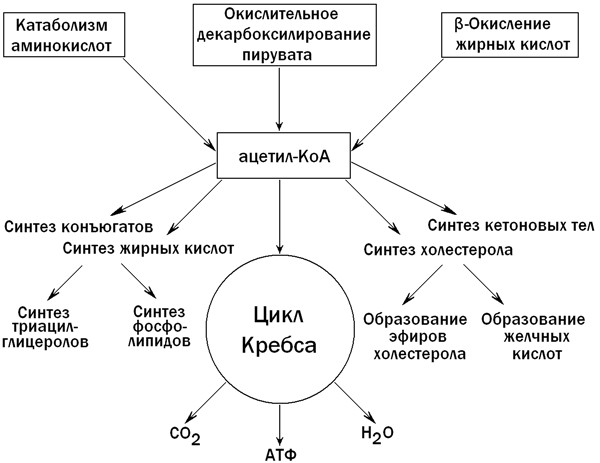
В гепатоцитах содержатся практически все ферменты, участвующие в метаболизме липидов. Поэтому паренхиматозные клетки печени в значительной степени контролируют соотношение между потреблением и синтезом липидов в организме. Катаболизм липидов в клетках печени протекает главным образом в митохондриях и лизосомах, биосинтез — в цитозоле и эндоплазматическом ретикулуме. Ключевым метаболитом липидного обмена в печени является ацетил-КоА, главные пути образования и использования которого показаны на рисунке 5.
Рисунок 5. Образование и использование ацетил-КоА в печени.
31.3.1. Метаболизм жирных кислот в печени. Пищевые жиры в виде хиломикронов поступают в печень через систему печёночной артерии. Под действием липопротеинлипазы, находящейся в эндотелии капилляров, они расщепляются до жирных кислот и глицерола. Жирные кислоты, проникающие в гепатоциты, могут подвергаться окислению, модификации (укорочению или удлинению углеродной цепи, образованию двойных связей) и использоваться для синтеза эндогенных триацилглицеролов и фосфолипидов.
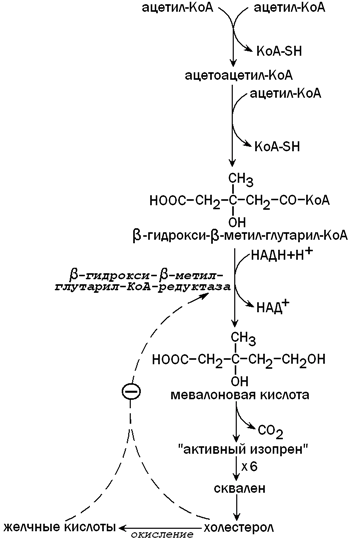
31.3.2. Синтез кетоновых тел. При β-окислении жирных кислот в митохондриях печени образуется ацетил-КоА, подвергающийся дальнейшему окислению в цикле Кребса. Если в клетках печени имеется дефицит оксалоацетата (например, при голодании, сахарном диабете), то происходит конденсация ацетильных групп с образованием кетоновых тел (ацетоацетат,β-гидроксибутират, ацетон). Эти вещества могут служить энергетическими субстратами в других тканях организма (скелетные мышцы, миокард, почки, при длительном голодании — головной мозг). Печень не утилизирует кетоновые тела. При избытке кетоновых тел в крови развивается метаболический ацидоз. Схема образования кетоновых тел — на рисунке 6.
Рисунок 6. Синтез кетоновых тел в митохондриях печени.
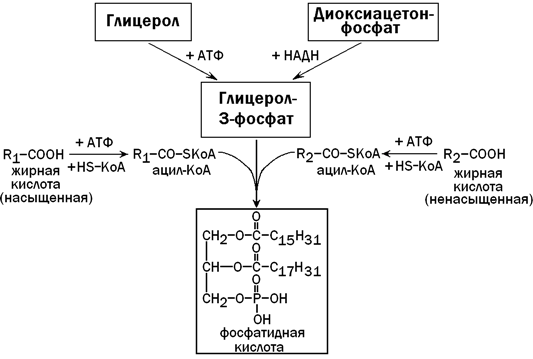
31.3.3. Образование и пути использования фосфатидной кислоты. Общим предшественником триацилглицеролов и фосфолипидов в печени является фосфатидная кислота. Она синтезируется из глицерол-3-фосфата и двух ацил-КоА — активных форм жирных кислот (рисунок 7). Глицерол-3-фосфат может образоваться либо из диоксиацетонфосфата (метаболит гликолиза), либо из свободного глицерола (продукт липолиза).
Рисунок 7. Образование фосфатидной кислоты (схема).
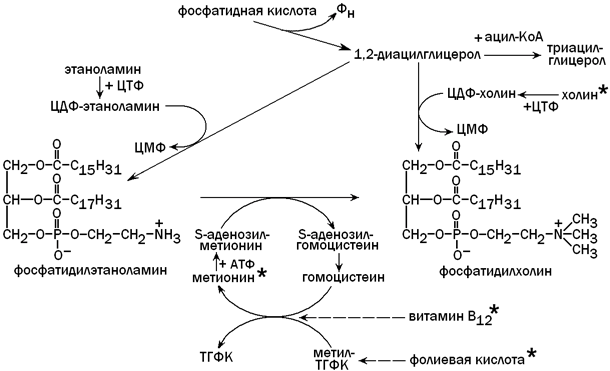
Для синтеза фосфолипидов (фосфатидилхолина) из фосфатидной кислоты необходимо поступление с пищей достаточного количества липотропных факторов (веществ, препятствующих развитию жировой дистрофии печени). К этим факторам относятся холин, метионин, витамин В 12 , фолиевая кислота и некоторые другие вещества. Фосфолипиды включаются в состав липопротеиновых комплексов и принимают участие в транспорте липидов, синтезированных в гепатоцитах, в другие ткани и органы. Недостаток липотропных факторов (при злоупотреблении жирной пищей, хроническом алкоголизме, сахарном диабете) способствует тому, что фосфатидная кислота используется для синтеза триацилглицеролов (нерастворимых в воде). Нарушение образования липопротеинов приводит к тому, что избыток ТАГ накапливается в клетках печени (жировая дистрофия) и функция этого органа нарушается. Пути использования фосфатидной кислоты в гепатоцитах и роль липотропных факторов показаны на рисунке 8.
Рисунок 8. Использование фосфатидной кислоты для синтеза триацилглицеролов и фосфолипидов. Липотропные факторы обозначены знаком * .
31.3.4. Образование холестерола. Печень является основным местом синтеза эндогенного холестерола. Это соединение необходимо для построения клеточных мембран, является предшественником желчных кислот, стероидных гормонов, витамина Д 3 . Первые две реакции синтеза холестерола напоминают синтез кетоновых тел, но протекают в цитоплазме гепатоцита. Ключевой фермент синтеза холестерола — β-гидрокси-β-метилглутарил-КоА-редуктаза (ГМГ-КоА-редуктаза)ингибируется избытком холестерола и желчными кислотами по принципу отрицательной обратной связи (рисунок 9).
Рисунок 9. Синтез холестерола в печени и его регуляция.
31.3.5. Образование липопротеинов. Липопротеины — белково-липидные комплексы, в состав которых входят фосфолипиды, триацилглицеролы, холестерол и его эфиры, а также белки (апопротеины). Липопротеины транспортируют нерастворимые в воде липиды к тканям. В гепатоцитах образуются два класса липопротеинов — липопротеины высокой плотности (ЛПВП) и липопротеины очень низкой плотности (ЛПОНП).
31.4. Роль печени в обмене белков.
Печень является органом, регулирующим поступление азотистых веществ в организм и их выведение. В периферических тканях постоянно протекают реакции биосинтеза с использованием свободных аминокислот, либо выделение их в кровь при распаде тканевых белков. Несмотря на это, уровень белков и свободных аминокислот в плазме крови остаётся постоянным. Это происходит благодаря тому, что в клетках печени имеется уникальный набор ферментов, катализирующих специфические реакции обмена белков.
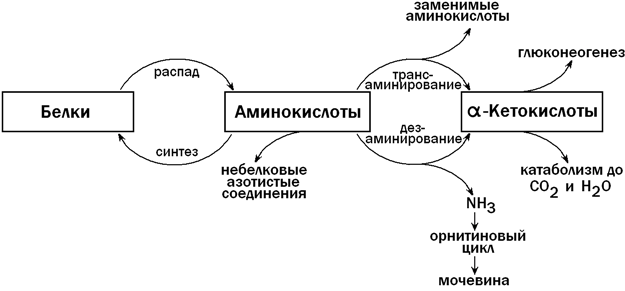
31.4.1. Пути использования аминокислот в печени. После приёма белковой пищи в клетки печени по воротной вене поступает большое количество аминокислот. Эти соединения могут претерпевать в печени ряд превращений, прежде чем поступить в общий кровоток. К этим реакциям относятся (рисунок 10):
а) использование аминокислот для синтеза белков;
б) трансаминирование — путь синтеза заменимых аминокислот; осуществляет также взаимосвязь обмена аминокислот с глюконеогенезом и общим путём катаболизма;
в) дезаминирование — образование α-кетокислот и аммиака;
г) синтез мочевины — путь обезвреживания аммиака (схему см. в разделе «Обмен белков»);
д) синтез небелковых азотсодержащих веществ (холина, креатина, никотинамида, нуклеотидов и т.д.).
Рисунок 10. Обмен аминокислот в печени (схема).
31.4.2. Биосинтез белков. В клетках печени синтезируются многие белки плазмы крови: альбумины (около 12 г в сутки), большинство α- и β-глобулинов, в том числе транспортные белки (ферритин, церулоплазмин, транскортин, ретинолсвязывающий белок и др.). Многие факторы свёртывания крови (фибриноген, протромбин, проконвертин, проакцелерин и др.) также синтезируются в печени.
31.5. Обезвреживающая функция печени.
В печени обезвреживаются неполярные соединения различного происхождения, в том числе эндогенные вещества, лекарственные препараты и яды. Процесс обезвреживания веществ включает две стадии (фазы):
1) фаза модификации — включает реакции окисления, восстановления, гидролиза; для ряда соединений необязательна;
2) фаза конъюгации — включает реакции взаимодействия веществ с глюкуроновои и серной кислотами, глицином, глутаматом, таурином и другими соединениями.
Более подробно реакции обезвреживания будут рассмотрены в разделе «Биотрансформация ксенобиотиков».
31.6. Желчеобразовательная функция печени.
Желчь — жидкий секрет желтовато-коричневого цвета, выделяемый печёночными клетками (500-700 мл в сутки). В состав желчи входят: желчные кислоты, холестерол и его эфиры, желчные пигменты, фосфолипиды, белки, минеральные вещества (Nа + , К + , Са 2+ , Сl — ) и вода.
31.6.1. Желчные кислоты. Являются продуктами метаболизма холестерола, образуются в гепатоцитах. Различают первичные (холевая, хенодезоксихолевая) и вторичные (дезоксихолевая, литохолевая) желчные кислоты. В желчи присутствуют главным образом желчные кислоты, конъюгированные с глицином или таурином (например, гликохолевая, кислота, таурохолевая кислота и т.д.).
Желчные кислоты принимают непосредственное участие в переваривании жиров в кишечнике:
- оказывают на пищевые жиры эмульгирующее действие;
- активируют панкреатическую липазу;
- способствуют всасыванию жирных кислот и жирорастворимых витаминов;
- стимулируют перистальтику кишечника.
При нарушении оттока желчи желчные кислоты проникают в кровь и мочу.
31.6.2. Холестерол. С желчью выводится из организма избыток холестерола. Холестерол и его эфиры присутствуют в желчи в виде комплексов с желчными кислотами (холеиновые комплексы). При этом отношение содержания желчных кислот к содержанию холестерола (холатный коэффициент) должно быть не ниже 15. В противном случае нерастворимый в воде холестерол выпадает в осадок и откладывается в виде камней желчного пузыря (желчно-каменная болезнь).
31.6.3. Желчные пигменты. Из пигментов в желчи преобладает конъюгированный билирубин (моно- и диглюкуронид билирубина). Он образуется в клетках печени в результате взаимодействия свободного билирубина с УДФ-глюкуроновой кислотой. При этом снижается токсичность билирубина и увеличивается его растворимость в воде; далее конъюгированный билирубин секретируется в желчь. При нарушении оттока желчи (механическая желтуха) в крови значительно увеличивается содержание прямого билирубина, в моче обнаруживается билирубин, в кале и моче снижено содержание стеркобилина. Дифференциальную диагностику желтух см. в разделе «Обмен сложных белков».
31.6.4. Ферменты. Из ферментов, обнаруженных в желчи, следует в первую очередь отметить щелочную фосфатазу. Это экскреторный фермент, синтезируемый в печени. При нарушении оттока желчи активность щелочной фосфатазы в крови возрастает.
Источник