Диагностика индивидуального здоровья
Трём уровням организации системы «Человек» соответствуют и три аспекта индивидуального здоровья — физический, психический и духовный. Теоретически возможно построение диагностической модели, основанной на характеристике всех аспектов здоровья, но это будет сложная и неудобная для практического применения модель. Очевидно, следует остановиться на одной, но основополагающей функции, с угасанием которой невозможно выполнение и других. Этой функцией является функция выживания, то есть жизнеспособность.
Выделяют три типа диагностических моделей индивидуального здоровья: нозологическая диагностика, донозологическая диагностика и диагностика здоровья по прямым показателям.
Нозологическая диагностика ставит своей задачей установление характера заболевания в соответствии с Международной классификацией болезней. Донозологическая диагностика представляет собой определение стадии адаптационного процесса на пути от здоровья к болезни [5]. На наш взгляд, данный подход далёк от истинного отражения положения индивида в системе координат «здоровье-болезнь». В самом деле, выделяемые состояния адаптационного потенциала, хотя в определенной степени и характеризуют здоровье, все же это скорее результат взаимодействия организма с окружающей средой. Можно представить себе индивида с высоким уровнем здоровья, но попавшего в экстремальную производственную либо бытовую ситуацию, приведшую к перенапряжению адаптации, несмотря на значительные резервы функций. При выходе из критической ситуации (нередко – в тот же день) функции восстанавливаются. С другой стороны, у больного, находящегося в стадии ремиссии хронического соматического заболевания (к примеру — хронической пневмонией), будет определяться стадия удовлетворительной адаптации, хотя уровень здоровья у него будет достаточно низким.
Следовательно, необходима единая шкала здоровья, на которой были бы представлены все уровни здоровья с формированием патологии при его критическом снижении.
Совершенно очевидно, что в качестве показателей, количественно характеризующих уровень индивидуального здоровья, могут использоваться только те, которые связаны с его сущностными характеристиками. К ним относятся показатели, в той или иной степени отражающие деятельность механизмов самоорганизации живой системы — адаптации, гомеостаза, реактивности и т. д. В качестве показателей уровня здоровья предпочтительнее использовать характеристики проявлений здоровья, так как они отражают результат деятельности всей сложнейшей функциональной системы Человек. Чем эффективнее выполнение биологических и социальных функций, тем уровень здоровья выше.
К настоящему времени наиболее распространены две модели диагностики уровня здоровья по прямым показателям. Первая из них — определение биологического возраста. Для его определения используются «батареи » тестов различной степени сложности, они подробно описаны в литературе [8 и др]. Вторая — оценка энергопотенциала (резервов биоэнергетики) на организменном уровне [1]. Обе они характеризуют биологическую функцию выживания – одно из основных проявлений здоровья.
Теоретические основы диагностики индивидуального здоровья по резервам биоэнергетики. В мире ничего не происходит без затрат энергии. Это касается и живой материи. Чем мощнее энергопотенциал биосистемы, тем она устойчивее. Основой энергетики человеческого организма являются анаэробные и аэробные механизмы энергобразования. Они могут быть охарактеризованы количественно по мощности, эффективности (экономичности) и ёмкости. Превосходя аэробные механизмы по мощности, анаэробные механизмы существенно уступают им по экономичности и ёмкости. Поэтому в основе предлагаемого метода оценки уровня соматического здоровья лежит информация об аэробных механизмах. Отметим, что эволюция механизмов энергообеспечения живых систем проходила именно по пути их совершенствования.
В основе энергообеспечения клетки лежит функция митохондрий. Митохондрии — блестящее изобретение природы. Увеличивая их количество, можно наращивать энергетические возможности клетки без роста её внешней поверхности. При этом каждая митохондрия обладает ещё и встроенными механизмами «контроля» и «ремонта».
Переход клеток к выработке энергии с помощью митохондрий можно сравнить с промышленной революцией. Вместо того чтобы линейно наращивать размер мануфактуры, клетки пошли на качественное изменение: они построили «завод» и поставили в него ряды специализированных «станков».
Потому, несмотря на миллиарды лет существования, прокариоты, не имеющие митохондрий, и поныне остались относительно простыми существами, а эукариоты «изобрели» новые средства передачи сигналов между клетками и шагнули в сторону многоклеточных форм жизни. Некоторые исследователи утверждают, что рост энергообеспечения клетки – не только показатель [11], но и один из стимулов эволюции живого на Земле [14].
Многочисленными исследованиями установлена взаимосвязь между мощностью аэробных механизмов энергообразования, их экономичностью и ёмкостью. Таким образом, решение проблемы сужается до оценки мощности аэробного энергообразования. Научная литература заполнена доказательствами того, что устойчивость организма к самым различным негативным воздействиям – от гипоксии и кровопотери до радиации – определяется резервами аэробной способности [7 и др.]. Именно это обстоятельство позволило нам идентифицировать этот показатель с уровнем жизнеспособности, иными словами — соматического здоровья.
Методические подходы. Проблема диагностики (измерения «количества») здоровья может быть решена путём определения мощности аэробного энергообразования — максимального потребления кислорода (МПК). Этот показатель интегрально характеризует резервы систем внешнего дыхания, кровообращения, тканевых ферментов и др. Однако особенности методики (нагрузочная проба до отказа, аппаратное обеспечение, трудоёмкость, готовность к оказанию ургентной помощи и т.п.) не позволяют рекомендовать её для широкого применения. В проведенном нами исследовании на здоровых и больных людях [1] отобраны простейшие показатели, имеющие достоверные связи с конечным результатом пробы. Сюда вошли: рост, масса тела, жизненная ёмкость лёгких, динамометрия сильнейшей кисти, частота пульса и уровень АД в покое, время восстановления частоты пульса до исходного уровня после 20 приседаний за 30 сек. На основе этих показателей сформированы индексы, они ранжированы, каждому рангу присвоено определённое количество баллов ( с учётом связи с конечным результатом), а суммой баллов определяется уровень здоровья. Выделяется 5 уровней здоровья. Система доступна для использования средним медперсоналом.
Коэфициент корреляции между суммой баллов и МПК/кг массы тела равен 0,806. Несмотря на простоту используемых показателей, они отражают две глобальные физиологические закономерности, сопровождающие рост энергопотенциала организма: экономизацию функций («двойное произведение» в покое, время восстановления ЧСС после физической нагрузки) и расширение их резерва (жизенный и силовой индексы). Кроме того, учитывается и весо-ростовой индекс.
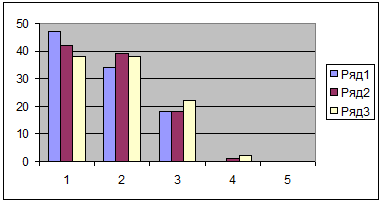
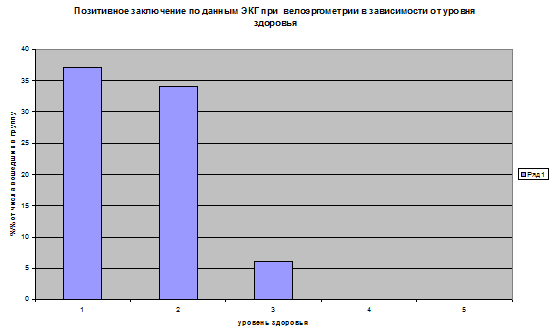
При определении информативной ценности наиболее распространенных методов количественной оценки индивидуального здоровья — Р.М.Баевского, Л.Х.Гаркави с соавт., К.Купера, И.А.Гундарова и др., Г.Л.Апанасенко [5,9,10,12,1] было установлено, что наибольшей диагностической эффективностью обладает именно этот подход [6]. В наших исследованиях показано, что снижение уровня здоровья, знаменующее собой, по сути, развитие митохондриальной недостаточности, сопровождается формированием эндогенных факторов риска и латентных форм ИБС (рис.1 и 2).
Анализ результатов популяционных исследований позволил впервые описать феномен “безопасного уровня” здоровья (IV-V уровни) и дать ему количественную характеристику [3]. В “безопасной зоне” здоровья практически не регистрируются эндогенные факторы риска, манифестированные формы хронических неинфекционных заболеваний, низок риск смерти от них. Годом позже факт прогрессивного повышения смертности при снижении максимальных аэробных возможностей ниже 10 МЕТ у мужчин и 9 МЕТ у женщин подтверждён американскими исследователями [13], однако авторы его не анализируют.
При выходе индивида из “безопасной зоны” здоровья проявляется феномен “саморазвития” патологического процесса без изменения силы действующих факторов (условий существования): вначале формируются эндогенные факторы риска, развивается патологический процесс и происходит его манифестация в виде конкретной нозологической формы. Описаны механизмы развития этого феномена [4].
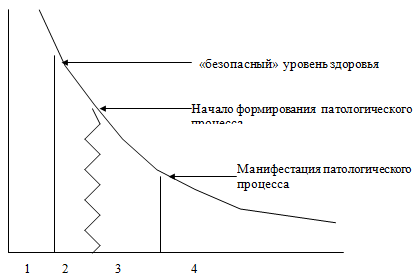
Возможность диагностики уровня здоровья позволила построить единую шкалу здоровья (рис.3). Такая шкала представляет собой систему координат; на одной оси которой – уровень здоровья, на другой – медико-социальные состояния, зависящие от этого уровня. При использовании шкалы здоровья появилась возможность диагностировать и «третье», или переходное между здоровьем и болезнью состояние. Основной признак предболезни — возможность саморазвития патологического процесса без изменения силы действующего фактора вследствие снижения резервов здоровья [4]. Границей перехода от состояния здоровья к состоянию предболезни является тот уровень здоровья, который не может компенсировать происходящие в организме под влиянием негативных факторов изменения и, вследствие этого, формируется тенденция к саморазвитию процесса. В качестве начала болезни принято считать появление признаков манифестации патологии, т.е. момент наступления снижения или утраты способности к выполнению функций. Таким образом, границы «третьего состояния» очерчены довольно четко. Что же касается возможности определить границу между предболезнью и началом неманифестированного патологического процесса, то на сегодняшний день эта проблема неразрешимая. Именно здесь могла бы сыграть ведущую роль нормология (учение о норме), однако показатели «нормы» настолько индивидуальны, что вынести суждение о «нормальности» функций у конкретного индивида невозможно. Именно поэтому в практической деятельности следует использовать категорию «третьего состояния» и только в том случае, если есть возможность подтвердить или отвергнуть наличие неманифестированного патологического процесса, можно говорить о предболезни или следующей за ней стадии развития .
Возможности практической реализации теоретических данных
Реализация изложенных теоретических данных до сего времени не используется в сфере здравоохранения, ибо это противоречит главенствующей парадигме ведомства – лечить больных. Наиболее близким к проблеме сохранения и укрепления здоровья практически здоровых индивидов является специалист по восстановительному лечению. В то же время специалисты этого профиля недостаточно подготовлены в области как диагностики здоровья, так и методов, обеспечивающих весь процесс управления здоровьем индивида. Отсюда следует необходимость расширения и реформирования образовательного стандарта в медицинских ВУЗах с целью подготовки специалистов в области здоровьесберегающих технологий.
Отметим, что доля лиц, находящихся в «безопасной» зоне здоровья в Украине составляет около 1% (трудно представить, что в России ситуация более благоприятная). Отсюда очевидно, что никакие усовершенствования лечебно-диагностического процесса не способны решить проблему снижения заболеваемости и смертности на постсоветском пространстве. Единственный путь решения проблемы – переход основной части популяции на более высокий уровень энергообеспечения функций. С этих позиций целесообразно говорить о «превентивной реабилитации» — комплексе оздоровительных мероприятий по возвращению индивида в «безопасную» зону здоровья. Это и есть наиболее обоснованный и реальный путь первичной профилактики ХНИЗ.
- Апанасенко Г.Л. Эволюция биоэнергетики и здоровье человека.- СПб., Петрополис, 1992, 137 с.
- Апанасенко Г.Л. О возможности количественной оценки уровня здоровья человека // Гигиена и санитария, 1985, № 6, с. 55-58.
- Апанасенко Г.Л., Науменко Р.Г. Соматическое здоровье и максимальная аэробная способность индивида //Теория и практика физической культуры, 1988.-№ 4, -с. 29-31.
- Апанасенко Г.Л., Попова Л.А. Медицинская валеология.- Киев, Здоровье, 1998, 248 с.
- Баевский Р.М. Прогнозирование состояний на грани нормы и патологии. — Медицина, Москва,1979, 298 с.
- Безматерных Э.Л.,Куликов В.П. .Диагностическая эффективность методов количественной оценки индивидуального здоровья\Физиология человека, 1998,-№3,- С.79-85.
- Василенко А.М. Максимальное потребление кислорода как критерий устойчивости человека к гипоксии, гипо- и гипертермии// . Космическая биология и авиакосмическая медицина.- 1980, № 6 с.3-10
- Войтенко В.П. Здоровье здоровых (введение в санологию).- Киев, Здоровья, 1991, 246 с.
- Гаркави Л.К., Квакина Е.Б. Понятие здоровья с позиции теории неспецифических реакций организма// Валеология. 1996, №2, с.15-20.
- Гундаров И.А., Полесский В.А.»Золотой запас» человека // Мед.газета. 1990, 18 апреля, с.3.
- Зотин А.И. Биоэнергетическая направленность эволюционного процесса организмов. Пущино,1981, 11 с.
- Купер К. Аэробика для хорошего самочувствия.- М,.ФиС, 1987, 192 с.
- Blaire S., Kone H., Paffenberger R. a.o. Physical fitness a. all-cause mortality \JAMA, 1989,-Vol.17,-№ 7,- Р. 2395-2401.
- Fox Ronald F. Energy and the evolution.-W.H.Freeman a.Co, N.-Y, 1992, 262 p.
Рис.1 Уровень соматического здоровья и распространённость факторов риска ИБС (гиперхолестеринемия, артериальная гипертензия, избыточная масса тела), %% от числа вошедших в группу (N=786: практически мужчины 35-59 лет)
Рис.2. Доля лиц, не достигших субмаксимального уровня нагрузки вследствие появления признаков нетолерантности на ЭКГ (1-5 — уровни здоровья) (N=786: практически мужчины 35-59 лет)
Рис.3 Состояния, определяемые уровнем здоровья. По вертикали – уровень здоровья, по горизонтали – состояния: здоровье (1), «третье состояние» (предболезнь –2 и неманифестированный патологический процесс-3), болезнь (4).
Источник
Шкала оценок функциональных состояний связанных с переходом от здоровья
ФГБВОУ ВО «Военно-медицинская академия им. С.М. Кирова», Санкт-Петербург, Россия
ФГБОУ ВО «Первый Санкт-Петербургский государственный медицинский университет им. акад. И.П. Павлова» Минздрава России, Санкт-Петербург, Россия
ГБУЗ МО «Московский областной научно-исследовательский клинический институт им. М.Ф. Владимирского», Москва, Россия
ФГБВОУ ВО «Военно-медицинская академия им. С.М. Кирова» Минобороны России, Санкт-Петербург, Россия
ФГБВОУ ВО «Военно-медицинская академия им. С.М. Кирова» Минобороны России, Санкт-Петербург, Россия
Шкалы и тесты для оценки эффективности лечебно-реабилитационных мероприятий у пациентов со спастичностью нижней конечности
Журнал: Журнал неврологии и психиатрии им. С.С. Корсакова. 2018;118(5): 120-128
Коваленко А. П., Камаева О. В., Мисиков В. К., Полещук Ю. Р., Кошкарев М. А. Шкалы и тесты для оценки эффективности лечебно-реабилитационных мероприятий у пациентов со спастичностью нижней конечности. Журнал неврологии и психиатрии им. С.С. Корсакова. 2018;118(5):120-128. https://doi.org/10.17116/jnevro201811851120
ФГБВОУ ВО «Военно-медицинская академия им. С.М. Кирова», Санкт-Петербург, Россия


Проблемно-ориентированный подход при реабилитации пациентов со спастическим парезом требует тщательного изучения ситуации в концепции Международной классификации функционирования, ограничения жизнедеятельности и здоровья, а именно — оценки нарушения структуры, функции и ограничения активности и участия с учетом средовых факторов. Применение стандартизированных инструментов при оценке мышечного тонуса позволяет получить объективные данные о состоянии мышц и выраженности двигательных нарушений. Обсуждены особенности применения модифицированных шкал Эшворта и Тардье. Важное место в оценке эффективности проведенного лечения занимают стандартизированные инструменты оценки самостоятельного перемещения пациента. Конечная цель вмешательства, включая применение ботулинотерапии в случае спастичности, заключается в поддержке повседневной деятельности пациента. В статье приведены шкалы и тесты, позволяющие оценить подвижность: индекс ходьбы Хаузера, индекс мобильности Ривермид и функциональные тесты оценки ходьбы. Представлен клинический случай лечения спастичности мышц нижней конечности абоботулотоксином А и его оценка с помощью представленных шкал.
ФГБВОУ ВО «Военно-медицинская академия им. С.М. Кирова», Санкт-Петербург, Россия
ФГБОУ ВО «Первый Санкт-Петербургский государственный медицинский университет им. акад. И.П. Павлова» Минздрава России, Санкт-Петербург, Россия
ГБУЗ МО «Московский областной научно-исследовательский клинический институт им. М.Ф. Владимирского», Москва, Россия
ФГБВОУ ВО «Военно-медицинская академия им. С.М. Кирова» Минобороны России, Санкт-Петербург, Россия
ФГБВОУ ВО «Военно-медицинская академия им. С.М. Кирова» Минобороны России, Санкт-Петербург, Россия
Правильный и обоснованный выбор методов оценки функционального состояния пациента является обязательным условием адекватной реабилитации. Особое место этот аспект занимает в российской системе реабилитации пациентов с повреждениями ЦНС, поскольку число нуждающихся в реабилитации достигает 1,5 млн, при этом методология и возможности проведения реабилитационных мероприятий отстают от потребностей.
Реабилитация — многонаправленный процесс. Осмыслить и структурировать его помогает Международная классификация функционирования, ограничения жизнедеятельности и здоровья — МКФ (International Classification of Functioning, Disability and Health — ICF) [1]. Заложенный в МКФ принцип рассмотрения любого нарушения жизнедеятельности через систематизацию имеющихся проблем по трем основным позициям (нарушение структуры, функции, активности и участия с учетом средовых факторов) позволяет охватить все аспекты деятельности конкретного пациента и, соответственно, все аспекты ограничения этой деятельности.
Ведение пациентов со спастическим парезом требует тщательного изучения состояния больного с точки зрения всех компонентов, входящих в МКФ: оценки изменений структуры тела (наличие контрактур, деформаций суставов и изменений кожи в местах сдавлений и др.), функций мышечно-связочного аппарата (растяжимость мышц, возможность активного сокращения, степень изменения мышечного тонуса, наличие клонуса, болезненности в мышцах и окружающих тканях), активности и участия (т.е. ограничение необходимых пациенту видов деятельности), а также изменений социальных ролей, присущих данному индивидууму. Для верификации каждого из этих направлений, описанных с помощью МКФ, существуют свои оценочные шкалы.
Серьезные проблемы для успешной реабилитации пациентов с повреждением первого (центрального, верхнего) мотонейрона создает повышенный тонус мышц паретичных конечностей. К настоящему времени лечение фокальной и сегментарной спастичности инъекциями ботулинического нейротоксина (БоНТ) стало неотъемлемым компонентом процессов реабилитации пациентов с синдромом первого мотонейрона различной этиологии [2, 3]. Правильная диагностика спастичности у пациента до проведения инъекции БоНТ и оценка эффективности лечения после развития действия БоНТ являются актуальными вопросами ботулинотерапии, а решение проблемы спастичности, в свою очередь, является одной из основных целей в реабилитации пациентов с повреждением головного и спинного мозга.
Основная задача реабилитации — восстановление деятельности больного (ходьба, активность в быту, сложные двигательные бытовые навыки), а не функции его мышц, как зачастую полагают. Понятия деятельности и функции движения конечности (объем активного движения в суставе) не тождественны, и восстановление функции не всегда приводит к восстановлению деятельности. Поэтому необходимо использовать шкалы, которые позволяют оценить проблемы спастичности через призму жизнедеятельности и одновременно являются основным показателем для оценки результата реабилитации в целом.
Выбрать из множества предложенных мировой практикой инструментов оценки наиболее адекватный (валидный и чувствительный) имеющейся проблеме вариант довольно сложно. Для этого необходимы: 1) стандартизированная оценка состояния мышц и их реактивности; 2) оценка двигательной активности и самообслуживания пациента.
В настоящей статье представлены оригинальный перевод и методическая разработка некоторых шкал.
Шкалы оценки состояния и функции мышц
Основными шкалами, позволяющими оценить состояние мышц, являются: шкала силы мышечного сокращения и объема произвольных движений (Medical Research Council Scale — MRСS), модифицированная шкала Эшворта (Modified Ashworth Scale — MAS) и шкала Тардье (Modified Tardieu Scale — MTS).
MRCS (табл. 1) 
MAS (табл. 2) 
MTS (табл. 3) 
Скорости выбираются согласно следующим характеристикам: как можно медленнее (V1); скорость, равная скорости опускаемой конечности, движущейся под действием силы тяжести (V2); как можно быстрее (V3) (быстрее, чем скорость естественного падения сегмента конечности под действием силы тяжести).
В последние годы наблюдается тенденция к упрощению использования и интерпретации данных MTS. В частности, считается достаточным измерить ХV1 — угол диапазона пассивного движения конечности на медленной скорости (angle arrest) и XV3 — угол остановки движения конечности на высокой скорости (angle catch), чтобы вычислить X — угол спастичности [8—10]:
Для балльной оценки степени мышечной реакции (Y) используется таблица баллов и их интерпретации (см. табл. 3).
Еще одним количественным параметром оценки является индекс Тардье (ИТ) — отношение типа мышечной реакции в баллах к величине угла сгибания/разгибания в суставе, выраженной в градусах, при котором достигается реакция:
Таким образом, если угол, на котором возникает реакция и/или балльная оценка меняются в зависимости от скорости, получаются три результата. Например:
ИТV1 характеризует повышенный мышечные тонус вне реакции на стретч-рефлекс. Результаты, полученные на скорости V2 и V3, характеризуют степень реакции мышцы на скорость растяжения сухожилия и являются разной степенью провокации стретч-рефлекса. Значительная разница между ИТV1—V3 (в 2,5 раза и более) может свидетельствовать о степени динамичности мышечно-сухожильной контрактуры или ее отсутствии, что позволяет рассчитывать на хороший результат при применении БоНТ. Незначительная разница в значениях ИТ (в 1,5—2 раза и менее) указывает на худший прогноз.
Таким образом, шкалу MTS можно использовать для регистрации следующих показателей: угла спастичности (Х, градусы), угла диапазона движения в суставе при разных скоростях (XV1, XV2, XV3, градусы), степень мышечной реакции (Y, баллы), И.Т. Относительным недостатком этой шкалы является необходимость фиксации данных, расчета и наличия гониометра.
Шкалы оценки активности и участия
Спастичность крайне негативно влияет на повседневную и профессиональную деятельность, резко ограничивает самостоятельное передвижение, самообслуживание, снижает роль больного в семье и обществе. Терапевтическое воздействие на спастичность ставит конечной целью нормализацию жизни и деятельности пациента, а при благоприятном исходе — возврат к нормальному жизненному уровню.
Для верификации нарушений в области самостоятельного передвижения и самообслуживания используются: индекс ходьбы Хаузера (Hauser Ambulation Index — HAI), индекс мобильности Ривермид (Rivermead Mobility Index — RMI) и шкала оценки равновесия и ходьбы Тинетти (TBAT). Поскольку данные шкалы недостаточно чувствительны к небольшим изменениям в подвижности, их можно сочетать с одним из количественных тестов для оценки ходьбы: на расстояние, на время и на независимость.
Понятие самообслуживание включает в себя не только перемещение, его оценка должна быть дополнена анализом степени влияния спастичности в руке на повседневную деятельность. Наиболее удобными и информативными инструментами для проведения этого анализа являются: шкала влияния спастичности руки на деятельность Лидс (Leeds arm spasticity impact scale — LASIS), шкала уровня активности руки (ArMA), индекс активности руки Френчай (Frenchay).
Тесты для оценки передвижения
HAI включает ранжирование пациентов по 10 градациям в зависимости от необходимости внешней помощи, использования приспособлений для передвижения и времени прохождения тестового расстояния (табл. 4) 
RMI (табл. 5) 
Тесты оценки ходьбы
Тест «ходьба 10 метров» оценивает возможность без помощи посторонних лиц пройти небольшое расстояние, например дойти до кухни или туалета. Пациенту предлагают пройти в удобном для него темпе заранее отмеченную дистанцию 10 м. Пациент может идти с подобранным для него дополнительным средством ходьбы, но наблюдателю не разрешается давать ему словесные инструкции при движении.
Тест «10 самостоятельных шагов» оценивает возможность сделать 10 шагов без опоры руками. Во время ходьбы допускаются словесные инструкции, но пациент не должен пользоваться дополнительными опорами.
С помощью теста 10-метровой комфортной ходьбы (КХ) оценивают скорость ходьбы. Такая ходьба, например, важна при переходе дороги при ограниченном времени на регулируемом светофором перекрестке. Пациент должен пройти расстояние 10 м босиком или в комфортной обуви, с максимальной скоростью, с/или без вспомогательных средств для ходьбы. Тест выполняется с визуальной поддержкой в условиях ходьбы без препятствий и необходимости разворота на 180°. Длительность ходьбы оценивается с помощью секундомера. Отсчет времени начинается, когда первая нога пересекает стартовую отметку, и завершается, когда эта же нога пересекает финальную отметку [15]. Ограничением применения этого теста является достижение пациентом нормальной скорости ходьбы. В таком случае более уместен будет тест на выносливость.
Тест 6-минутной ходьбы оценивает выносливость. При его применении учитывается суммарная дистанция, преодоленная за 6 мин. Дистанция ходьбы по прямой должна составлять не менее 50 м. Использование бегущей дорожки невозможно, так как пациент сам должен выбирать удобный для него темп и иметь возможность сделать остановку, если это потребуется.
Общим для этих тестов является отсутствие оценки качества ходьбы. К сожалению, качество ходьбы не может быть оценено надежно без использования лабораторных методов анализа походки. Но нужно иметь в виду, что для пациента всегда будет более важно иметь возможность дойти до необходимого ему объекта безопасно и быстро, чем дойти «красиво». Поэтому приведенные выше шкалы и тесты не теряют своей актуальности в клинической практике, несмотря на развитие инструментальных методов диагностики нарушений ходьбы.
Опыт применения шкал в клинической практике
При оценке двигательной функции в рутинной клинической практике, как правило, пользуются шкалой оценки силы MRCS. В тех случаях, когда пациенту предполагается назначить инъекцию ботулинического токсина, специалист по ботулинотерапии может также применить шкалу MAS. Иногда используются шкалы оценки самообслуживания Рэнкина или Бартел. Активное участие пациента в тестировании может быть важным мотивационным моментом, структурировать для пациента время реабилитационных мероприятий, помочь определиться с целью реабилитации. Фактически полноценная оценка и выявление в результате проблем у пациента помогают сформировать список реабилитационных целей ближайшего времени (рис. 1). 
Клиническое наблюдение
Пациент Ц., 61 год, перенес в ноябре 2016 г. острое нарушение мозгового кровообращения по геморрагическому типу в бассейне правой средней мозговой артерии с развитием левостороннего гемипареза. К моменту исследования (апрель 2017 г.) у пациента наблюдалась сформированная спастичность левых конечностей. В верхней конечности — паттерн 1-го типа по Hefter [16], в ноге — эквиварусная деформация стопы (статический паттерн) со сгибанием пальцев. Больной периодически проходил лечение в неврологических и реабилитационных стационарах. Терапию спастичности инъекциями БоНТ не получал. Рентгенологическое исследование суставов и ультразвуковое исследование мышц не выявили суставных контрактур и/или выраженного диффузного мышечного перерождения.
Пациент был протестирован с использованием шкал MAS, MTS, Бартел, Рэнкина, RMI, HAI, теста КХ и визуальной аналоговой шкалы (ВАШ) для определения степени удовлетворенности лечением.
Трудность передвижения при выходе на улицу являлась основной в списке проблем пациента, что определило лечение спастичности в нижней конечности в качестве первоочередной задачи. При мануальном тестировании было выявлено повышение тонуса mm. qastrocnemius, soleus, flexor digitorum longus. Тестирование мышц голени было проведено по следующей методике:
1. Для дифференцировки повышения тонуса m. soleus и головок m. qastrocnemius применяли тест Silfverskiold [17]. Для дифференцированного выявления спастичности в головках m. qastrocnemius тест был модифицирован и дополнен следующим приемом — супинация стопы в последней фазе движения при медленном выпрямлении конечности расценивалась как повышение тонуса медиальной головки. В качестве дополнительного тестирования при выпрямленной нижней конечности было произведено пассивное тыльное сгибание стопы с одновременной резкой ее пронацией. Визуально и пальпаторно зафиксированное сокращение медиальной головки m. qastrocnemius подтверждало повышение тонуса мышцы.
2. Повышение тонуса в m. flexor digitorum longus подтверждалось сгибанием пальцев при тыльном сгибании голеностопного сустава.
В качестве лечебного средства был применен абоботулотоксин, А (диспорт), введение которого осуществлялось с использованием ультразвуковой навигации [18]. Суммарная доза препарата на мышцы нижней конечности (620 ЕД) была распределена следующим образом: медиальная головка m. qastrocnemius — 300 ЕД, m. soleus — 200 ЕД, m. flexor digitorum longus — 120 ЕД.. Нежелательных явлений при введении препарата и в дальнейшем не наблюдалось.
Обследование и оценка результатов были проведены при 5 визитах: 1-й визит — исходный (апрель 2017 г.), обследование перед введением препарата; 2-й — через 25±3 сут после 1-й инъекционной сессии БоНТ; 3-й — через 100±10 сут после 1-й инъекционной сессии; 4-й — через 25±3 сут после 2-й инъекционной сессии БоНТ (125±3 сут от начала наблюдения); 5-й — через 100±10 сут после 2-й инъекционной сессии (200±10 сут от начала наблюдения). Подбор упражнений и обучение самостоятельным занятиям лечебной физкультурой (ЛФК) было проведено при 1-м и 3-м визитах.
Кроме того, при 1-м и 2-м визитах обследовали состояние пациента и определяли эффективность БоНТ без постановки реабилитационной цели и объяснения пациенту смысла тестирования. Это было сделано для независимости оценок действия препарата и мотивации к занятиям ЛФК. В последующем, при 3-м и 4-м визитах, пациенту и его родственникам были объяснены методология и задачи тестирования, а также принципы постановки цели, было предложено самостоятельно использовать шкалы и производные от них в качестве реабилитационных целей и оценки динамики. Например, оценка мобильности по RMI 9 баллов при 3-м визите могла предполагать в качестве ближайшей реабилитационной цели возможность пройти 10 м без использования вспомогательных средств ходьбы (10-й пункт RMI) или возможность ходить самостоятельно с дополнительной опорой за пределами квартиры по неровной поверхности (12-й пункт RMI). Поскольку цели ставятся с учетом важности нового навыка (активности) для пациента в тех условиях, в которых он живет, цель была сформулирована следующим образом: «Через месяц я буду самостоятельно гулять в сквере и сам схожу на почту». Таким образом, была выбрана цель возможности ходьбы по неровной поверхности вне дома.
При применении шкалы MTS для оценки спастичности голеностопного сустава использовали методику, изложенную M. Delgado и соавт. (рис. 2) 
Анализ динамики изменений показателей MAS и ИТ выявил прогрессивное снижение тонуса мышц на протяжении 28 нед, что отражает общую реабилитационную динамику. Введение абоботулотоксина, А (диспорт) при 1-м и 3-м визитах позволило снизить тонус на 1—2 балла по MAS и на 0,003—0,013 и 0,003—0,014 по ИТV1 и ИТV3, соответственно (табл. 6). 
Опрос при 3-м визите пациента и его родственников показал, что обучение занятиям ЛФК, проведенное при 1-м визите, не привело к практике системных регулярных занятий. При этом опрос, проведенный при 5-м визите, дал совсем иную картину. Было выяснено, что в период с 3-го по 5-й визитах пациент занимался не менее 1 ч в день 6 дней в неделю.
Показательно, что после 1-й инъекции (3-й визит) показатели ИТ и MAS имели тенденцию возвращения к прежнему уровню, а после 2-й инъекции (5-й визит) устойчиво снизились на 50—70% от исходного уровня. Разница между показателями MAS и ИТ при 3-м и 5-м визите свидетельствует о влиянии занятий ЛФК на спастичность, в том числе через уменьшение сухожильно-мышечной контрактуры, которая выросла в отсутствие занятий к 3-му визиту и стала менее выраженной к 5-му визиту. Кроме того, обращает на себя внимание уменьшение при 3-м визите разницы между показателями ИТV1 и ИТV3 при одновременном обоюдном увеличении угла разгибания в суставе, что можно расценить как нарастание степени сухожильно-мышечной контрактуры при относительном снижении мышечного тонуса.
При дифференцированном тестировании m. qastrocnemius и m. soleus клонусы были получены только в m. soleus, при том что снижение тонуса в этой мышце в ответ на введение БоНТ было более выраженным и устойчивым (+1, 0, 1 балл для m. soleus и 3, 2, 3 балла для m. qastrocnemius по MAS при 1, 2 и 3-м визитах соответственно).
В процессе использования шкал были выявлены следующие недостатки: так в шкале MAS не предусмотрена возможность четкой остановки под определенным углом (catch) и не оговаривается возможность возникновения клонусов. Анализ оценки активности и участия по шкалам показал, что значения шкал Бартел и Рэнкина в процессе лечения пациента изменяются в малой степени и не отражают существующую прогрессивную динамику (табл. 7). 
Динамика изменении показателей RMI, HAI и КХ была сходна с динамикой данных по MAS и ИТ — эти шкалы достаточно чутко отреагировали на уменьшение спастичности и последующие изменения жизнедеятельности (рис. 3). 
Разъяснения, данные при 3-м и 4-м визитах пациенту и его родственникам по методологии тестов RMI, HAI, КХ, позволили им осознать стоящие перед ними цели и использовать тестирование самостоятельно для получения данных о динамике состояния больного, что, в свою очередь, явилось важным мотивирующим фактором. В результате занятия ЛФК стали более систематическими и целенаправленными. Описания интерпретации баллов по шкалам Бартел и Рэнкин не удалось сформулировать в качестве реабилитационных задач. Было признано, что шкалы недостаточно чутко оценивают изменение движения, сопряженное со снижением спастичности и мало пригодны для мотивации пациента.
Особого внимания заслуживает оценка динамики показателей ВАШ, которые при 4-м и 5-м визитах заметно отличались (6 и 8 баллов) от показателей при 2-м и 3-м визитах (5 и 4 балла) и отражали изменение отношения пациента к лечению в положительную сторону. Следует отметить, что к 3-му визиту здесь также наблюдалась отрицательная динамика, которая была обусловлена отсутствием понимания пациентом сути процесса лечения и реабилитации, низким уровнем вовлеченности в него, отсутствием критериев и инструментов для понимания динамики своего состояния. Эта ситуация изменилась после активного вовлечения пациента в реабилитационный процесс, произошедшее после 3-го визита.
Заключение
Таким образом, при анализе полученных результатов можно сделать следующие выводы:
1. Использование препарата диспорт для лечения спастичности мышц нижних конечностей у больных с последствиями церебрального инсульта является целесообразным, эффективным и безопасным, улучшает качество жизни и расширяет возможности реабилитации пациентов. Применение абоботулотоксина, А (диспорт) в суммарной дозе 620 Ед эффективно для лечения варианта спастичности в голени со сгибанием пальцев стопы. Последовательность проведения инъекционных сессий БоНТ 1 раз в 12—14 нед (на фоне занятий ЛФК) устойчиво улучшает показатели самостоятельного передвижения и активности.
2. Шкалы MAS и MTS информативны для оценки спастичности. Шкала MTS позволяет выявить нюансы спастичности и признаки нарастания сухожильно-мышечной контрактуры.
3. Шкалы Бартел и Рэнкина фиксируют состояние, не предлагая пациенту понятных для него ориентиров динамики реабилитационного процесса, не позволяют доступно сформулировать реабилитационные цели и мотивировать пациента. Таким образом, эти шкалы целесообразно использовать для скрининговой оценки общего процесса реабилитации.
4. RMI, HAI и тест КХ признаны информативными методиками, чутко реагирующими на изменения состояния пациента как в отношении функции мышц, так и жизнедеятельности. Четкость задач и градация оценки позволяют формулировать реабилитационные цели в доступном для пациента формате, что повышает его мотивацию и удовлетворенность лечением.
5. Снижение скорости ходьбы к 3-му визиту говорит о необходимости активного участия пациента в реабилитационных мероприятиях, в частности занятиях ЛФК. Разъяснение пациенту сути применение специализированных методик оценки ходьбы на фоне введения абоботулотоксина, А (диспорт) привело к пониманию этапов и ориентированности занятий ЛФК, дало возможность пациенту и его родственникам самостоятельно ставить конкретные задачи и определять этапы их достижения. Результатом стали систематические занятия, которые привели к регрессу сухожильно-мышечной контрактуры, улучшению динамики ходьбы и пластичности шага, более спокойному и уверенному передвижению, что позволило проходить большее расстояние и улучшило качество жизни пациента. Таким образом, шкалы и тесты в реабилитации могут являться не только способом оценки, но инструментом реабилитации.
Авторы заявляют об отсутствии конфликта интересов.
Источник