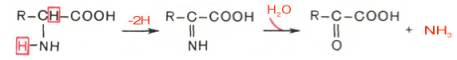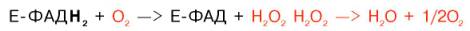Дезаминирование аминокислот
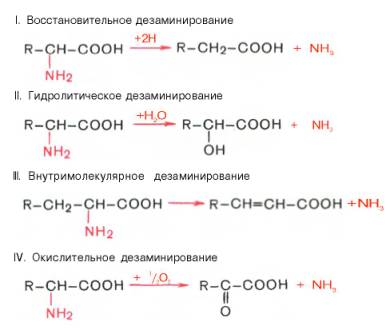
Доказано существование 4 типов дезаминирования аминокислот (отщепление аминогруппы). Выделены соответствующие ферментные системы, катализирующие эти реакции, и идентифицированы продукты реакции. Во всех случаях NH2-группа аминокислоты освобождается в виде аммиака.
Помимо аммиака, продуктами дезаминирования являются жирные кислоты, оксикислоты и кетокислоты. Для животных тканей, растений и большинства аэробных микроорганизмов преобладающим типом реакций является окислительное дезаминирование аминокислот, за исключением гис-тидина, подвергающегося внутримолекулярному дезаминированию.
Рассмотрим более подробно механизм окислительного дезаминирования аминокислот, протекающего в две стадии.
Первая стадия является ферментативной и завершается образованием неустойчивого промежуточного продукта (иминокислота), который на второй стадии спонтанно без участия фермента, но в присутствии воды распадается на аммиак и α-кетокислоту.
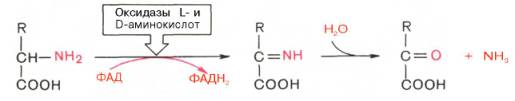
Следует указать, что оксидазы аминокислот (L- и D-изомеров) являются сложными флавопротеинами, содержащими в качестве кофермента ФМН или ФАД, которые выполняют в этой реакции роль акцепторов двух электронов и протонов, отщепляющихся от аминокислоты. Оксидазы L-аминокислот могут содержать как ФМН, так и ФАД, а оксидазы D-аминокислот – только ФАД в качестве простетической группы. Схематически реакции окислительного дезаминирования аминокислот с участием коферментов могут быть представлены в следующем виде:
Восстановленные флавиннуклеотиды оксидаз L- и D-аминокислот могут непосредственно окисляться молекулярным кислородом. При этом образуется перекись водорода, которая подвергается расщеплению под действием каталазы на воду и кислород.
Впервые в лаборатории Д. Грина из ткани печени и почек крыс была выделена оксидаза, катализирующая дезаминирование 12 природных (L-изомеров) аминокислот. Оказалось, однако, что этот фермент имеет оптимум действия в щелочной среде (рН 10,0) и при физиологических значениях рН его активность на порядок ниже, чем при рН 10,0. В тканях животных и человека отсутствует подобная среда, поэтому оксидазе L-ами-нокислот принадлежит, вероятнее всего, ограниченная роль в процессе окислительного дезаминирования природных аминокислот. В животных тканях оксидазным путем со значительно большей скоростью дезами-нируются D-изомеры аминокислот. Эти данные подтвердились после того, как из животных тканей был выделен специфический фермент оксидаза D-аминокислот, который в отличие от оксидазы L-аминокислот оказался высокоактивным при физиологических значениях рН среды. Не до конца ясным остается вопрос о том, каково значение столь активной оксидазы D-аминокислот в тканях, если поступающие с пищей белки и белки тела животных и человека состоят исключительно из природных (L-изомеров) аминокислот.
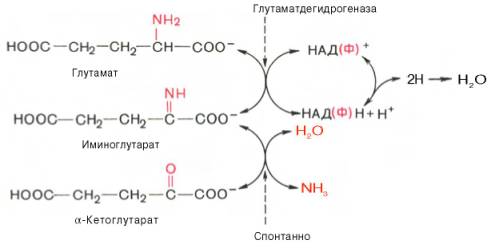
В животных тканях Г. Эйлером открыт высокоактивный при физиологических значениях рН специфический фермент (глутаматдегидрогеназа), катализирующий окислительное дезаминирование L-глутаминовой кислоты. Он является анаэробным ферментом и чрезвычайно широко распространен во всех живых объектах. В качестве кофермента глутаматдегидрогеназа содержит НАД (или НАДФ). Реакция включает анаэробную фазу дегидрирования глутаминовой кислоты с образованием промежуточного продукта – иминоглутаровой кислоты и спонтанный гидролиз последней на аммиак и α-кетоглутаровую кислоту в соответствии со следующей схемой:
Первая стадия окисления глутаминовой кислоты аналогична реакции окислительного дезаминирования. Восстановленный НАДН далее окисляется при участии флавиновых ферментов и цитохромной системы (см. главу 9) с образованием конечного продукта воды. Образовавшийся аммиак благодаря обратимости ферментативной реакции, но обязательно в присутствии восстановленного НАДФН может участвовать в синтезе глу-тамата из α-кетоглутаровой кислоты. Различают три разных типа глутаматдегидрогеназ: один из них использует в качестве кофермента как НАД, так и НАДФ (клетки животных); два других используют или НАД, или НАДФ (микроорганизмы, клетки растений и грибов), соответственно катализируя дезаминирование или биосинтез глутамата.
Глутаматдегидрогеназа животных тканей является одним из наиболее изученных ферментов азотистого обмена. Это олигомерный фермент (мол. масса 312000), состоящий из 6 субъединиц (мол. масса каждой около 52000) и проявляющий свою основную активность только в мультимерной форме. При диссоциации этой молекулы на субъединицы, наступающей легко в присутствии НАДН, ГТФ и некоторых стероидных гормонов, фермент теряет свою главную глутаматдегидрогеназную функцию, но приобретает способность дезаминировать ряд других аминокислот. Это свидетельствует об аллостерической природе глутаматдегидрогеназы, действующей как регуляторный фермент в аминокислотном обмене.
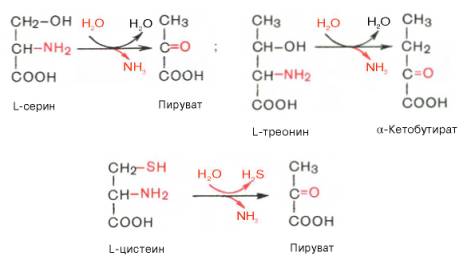
Помимо перечисленных 4 типов дезаминирования аминокислот и ферментов, катализирующих эти превращения, в животных тканях и печени человека открыты также три специфических фермента (серин- и треонин-дегидратазы и цистатионин-γ-лиаза), катализирующих неокислительное дезаминирование соответственно серина, треонина и цистеина.
Конечными продуктами реакции являются пируват и α-кетобутират, аммиак и сероводород. Поскольку указанные ферменты требуют присутствия пиридоксальфосфата в качестве кофермента, реакция неокислительного дезаминирования, вероятнее всего, протекает с образованием шиффовых оснований как промежуточных метаболитов.
Наиболее изучен фермент треониндегидратаза, которая оказалась не только аллостерическим ферментом, но наряду с триптофан-2,3-диокси-геназой и тирозинаминотрансферазой индуцибельным ферментом в животных тканях (индукция синтеза ферментов de novo является общим свойством микроорганизмов). Так, при скармливании крысам гидролизата казеина активность треониндегидратазы печени повышается почти в 300 раз. Этот синтез тормозится ингибитором белкового синтеза пуромицином. Поскольку индукция почти полностью тормозится также глюкозой пищи, треонингидратаза, по-видимому, является ответственной за глюконеогенез, так как α-кетобутират легко превращается в пируват и соответственно в глюкозу.
Источник
ДЕЗАМИНИРОВАНИЕ
ДЕЗАМИНИРОВАНИЕ — один из основных этапов обмена азотистых соединений; представляет собой процесс отщепления аминогруппы (NH2-группы) от органических соединений — аминокислот, аминов, аминопуринов, аминопиримидинов, их нуклеозидов и нуклеотидов и т. д., сопровождающийся замещением NH2-группы какой-либо другой. В обмене веществ человека и животных Д. играет большую роль. В животных и растительных организмах и у микроорганизмов Д. происходит в результате действия специфических ферментов. Аммиак, образующийся при Д., далее превращается в конечные продукты азотистого обмена (мочевину, мочевую к-ту и др.) или используется для синтеза новых аминокислот и других азотистых соединений, необходимых для жизнедеятельности организма (см. Азотистый обмен). Часть аммиака используется для нейтрализации образующихся в организме к-т и выводится с мочой в виде солей аммония (см. Кислотно-щелочное равновесие).
В небиол. системах Д. осуществляется действием хим. агентов, таких, как, напр., азотистая к-та или другие нитрозильные соединения. Д. аминокислот путем их окисления с образованием CO2 и соответствующих альдегидов происходит под действием O2 или H2O2 в присутствии солей тяжелых металлов, играющих роль катализаторов. Аналогичные продукты образуются в результате Д. аминокислот при их взаимодействии с хинонами, аллоксаном, изатином, нингидрином (см.). При взаимодействии азотистой к-ты с NH2-группой аминокислот и первичных (алифатических) аминов освобождается молекулярной азот:
Эта реакция положена в основу метода определения NH2-групп аминокислот и аминов по Ван-Слайку (см. Ван-Слайка методы). Ароматические амины реагируют с HNO2, образуя диазосоединения (см.).
Существует несколько типов биохим. процессов Д.
Содержание
Окислительное дезаминирование аминокислот
Одним из главных видов Д. у человека, млекопитающих и других классов животных является окислительное Д.:
Окислительное Д. может осуществляться двумя путями: прямым и непрямым (трансдезаминирование). В организме теплокровных животных прямое окислительное Д. аминокислот впервые было обнаружено и изучено Нейбауэром (О. Neubauer) и Ф. Кноопом в 1909—1911 гг. Позднее оно было воспроизведено в опытах с изолированными органами, тканевыми срезами и бесклеточными препаратами. В установлении окислительного пути Д. в тканях животных большую роль сыграли исследования Г. Кребса. Он показал наличие в печени и почках ферментной системы, катализирующей Д. аминокислот. Действие этой системы проявлялось в аэробных условиях с потреблением кислорода и образованием аммиака и кетокислот по суммарному уравнению 1. Д. природных (L-) и неприродных (D-) аминокислот протекало с различной скоростью и под действием разных ферментов, которые были названы L- и D-дезаминазами (оксидазами). Для ферментов окислительного Д. аминокислот Международной комиссией по ферментам были предложены следующие названия: оксидаза L-амино-кислот (КФ 1.4.3.2) и оксидаза D-аминокислот (КФ 1.4.3.3). Оксидаза D-аминокислот обнаружена в почках и печени животных, а также у бактерий и плесеней. Впервые фермент был выделен из почек свиньи; позднее получены его кристаллические препараты из разных источников. Эти ферменты, как правило, содержат в качестве кофермента ФАД (см. Флавопротеиды). Физиол, роль оксидазы D-аминокислот до конца не выяснена; считают, что она заключается в Д. D-аминокислот, образующихся в кишечнике из L-амино-кислот белков пищи под влиянием бактериальных ферментов—рацемаз.
В 1944 г. Грин (D. Green) и сотр. обнаружили в печени ряда животных фермент глициноксидазу, избирательно катализирующую Д. глицина (см.) с образованием глиоксиловой кислоты (см.) и аммиака. Эта оксидаза представляет собой флавопротеид, содержащий рибофлавин-фосфат (ФМН). В том же году Грин и сотр. выделили из почек крысы оксидазу L-аминокислот. В отличие от оксидазы D-аминокислот, она оказалась в физиол, условиях малоактивной и менее распространенной в природе. Оксидаза L-аминокислот (почечная) окисляла обычные монокарбоновые L-альфа-аминокислоты (кроме глицина, треонина и серина) и более активно — соответствующие L-альфа-оксикислоты; диамино- и дикарбоновые аминокислоты не дезаминировались этим ферментом. Коферментом оксидазы L-аминокислот, выделенной из почек, является ФМН. Активные оксидазы L-аминокислот получены в очищенном и кристаллическом виде из ядов и тканей змей и из микроорганизмов. Оксидаза L-аминокислот из яда змей содержит в качестве кофермента две молекулы ФАД на одну молекулу фермента. В опытах с очищенными препаратами оксидаз D- и L-аминокислот реакция протекает по уравнению:
Как in vivo, так и в опытах с неочищенными препаратами оксидаз L-и D-аминокислот, содержащих обычно в качестве примеси фермент каталазу (КФ 1.11.1.6), расщепляющую перекись водорода, процесс окислительного Д. аминокислот протекает по суммарному уравнению 1. Механизм процесса схематически может быть представлен следующими реакциями:
В первой, ферментативной, фазе реакции аминокислота отдает два водородных атома акцептору (ФАД или ФМН) и превращается в альфа-иминокислоту. Водород далее передается через систему дыхательных ферментов (см.) к конечному акцептору — кислороду, образуя H2O (см. Окисление биологическое). Во второй, самопроизвольной, фазе реакции нестойкая иминокислота гидролизуется с образованием кетокислоты и аммиака. Особые специфические флавинсодержащие оксидазы, активно дезаминирующие ароматические L-ами-нокислоты, L-диаминокислоты и глицин, обнаружены в тканях печени и почек птиц. В 1937 г. X. Эйлер-Хелыгин и сотр. впервые выделили фермент глутаматдегидрогеназу, специфически дезаминирующую L-глутаминовую к-ту до альфа-кетоглутаровой к-ты и аммиака. Этот фермент найден у человека, животных, растений и микроорганизмов. Он обнаружен почти во всех тканях млекопитающих, наиболее активен в тканях печени, почек и сердца. Его действие обратимо: в организме при физиол, условиях в присутствии альфа-кетоглутаровой к-ты и аммиака реакция направлена преимущественно в сторону синтеза глутаминовой кислоты (см.). Фермент получен из разных источников в кристаллическом виде. В его действии принимает участие НАД или НАДФ (см. Коферменты).
Окислительным путем дезаминируются также амины (см.), образующиеся в организме при декарбоксилировании (см.) аминокислот. Многие амины токсичны, поэтому их Д. имеет большое физиол, значение для организма. Д. аминов протекает при участии соответствующих аминоксидаз по уравнению:
Образующиеся в этой реакции альдегиды превращаются при участии окислительных ферментов в соответствующие к-ты. Известны два основных типа аминоксидаз: моноаминоксидазы (МАО; КФ 1.4.3.4), действующие на первичные, вторичные и третичные амины (напр., изоамиламин, тирамин, адреналин, 5-окситриптамин и др.) и диаминоксидазы (КФ 1.4.3.6), действующие на гистамин, путресцин, кадаверин и др. Эти ферменты найдены в печени, почках, слизистой оболочке кишечника, плазме крови и других тканях животных и человека, а также у растений и у многих бактерий (см. Аминоксидазы, Диаминоксидаза, Моноаминоксидазы). Некоторые аминоксидазы получены в очищенном виде; одни из них относятся к флавопротеидам, а другие (гистаминаза, сперминоксидаза из плазмы крови) — к медьсодержащим протеидам, в каталитическом действии которых, вероятно, участвует пиридоксальфосфат или сходный с ним кофактор.
Непрямое окислительное Д. (транс-дезаминирование) и синтез аминокислот были впервые теоретически предсказаны советским биохимиком
А. Е. Браунштейном в 1937—1939 гг.; впоследствии эти представления были подтверждены экспериментально А. Е. Браунштейном и его сотр., а затем и исследованиями других авторов. Механизм транс дезаминирования состоит из двух последовательных ферментативных реакций. В первой происходит переаминирование (см.) аминокислоты с альфа-кетоглутаровой к-той под действием ферментов аминотрансфераз, или трансаминаз (см. Аминотрансферазы), с образованием L-глутаминовой к-ты и a-кетоаналога исходной аминокислоты. При переаминировании NH2-группа переносится от аминокислоты на альфа-кетоглутаровую к-ту без промежуточного освобождения аммиака. Коферментом трансаминаз является производное витамина B6—пиридоксальфосфат (см. Коферменты). Последний выполняет роль переносчика NH2-группы и атома водорода. Во второй реакции транс-дезаминирования L-глутаминовая к-та дезаминируется в альфа-кетоглутаровую с помощью глутаматдегидрогеназы. Наибольшая активность глутаматдегидрогеназы, важнейшего фермента аминокислотного обмена, у человека сосредоточена в печени. Трансаминазы присутствуют во всех живых клетках человека, животных, растений, микроорганизмов.
Для доказательства процесса транс-дезаминирования, протекающего в тканях животных, были проведены исследования на модельных ферментных системах, включающих очищенные препараты трансаминаз и глутаматдегидрогеназы и необходимые кофакторы. Большое значение имели также исследования, проведенные с B6-авитаминозными животными, и опыты с использованием ингибиторов реакций переаминирования и образования кетоглутаровой к-ты в клетках. Эти исследования подтвердили, что трансдезаминирование играет преимущественную роль в окислительном распаде аминокислот у млекопитающих.
Гидролитическое дезаминирование
Этот вид Д. аминокислот приводит к образованию альфа-оксикислот по суммарному уравнению 4:
Гидролитическое Д. обнаружено у плесневых грибов и некоторых бактерий. Образование оксикислот у животных наблюдали при массивных нагрузках аминокислотами. Ферменты, катализирующие этот процесс, не известны. Большинство авторов считает, что альфа-оксикислоты представляют собой продукты вторичного ферментативного восстановления кетокислот или гидратации ненасыщенных к-т. образующихся из аминокислот в результате их окислительного или внутримолекулярного Д. Путем прямого ферментативного гидролиза происходит Д. пуриновых и пиримидиновых оснований (см. Пиримидиновые основания, Пуриновые основания), нуклеозидов и нуклеотидов при участии гидролитических ферментов пурин- и пиримидиндезаминаз. Последние относительно специфичны и неравномерно распространены в природе. Некоторые из них получены в очищенном и кристаллическом виде и хорошо изучены. Д. аденина (см. Пуриновый обмен) протекает с образованием гипоксантина (см.) при участии адениндезаминазы (КФ 3.5.4.2). Этот фермент не обнаружен у высших животных и человека; он найден у насекомых, ракообразных, у растений и бактерий. Д. гуанина в ксантин (см.) происходит при действии гуаниндезаминазы (КФ 3. 5.4.3). Высокая активность этого фермента обнаружена в мозге и в эритроцитах крыс. Аналогичным путем протекает Д. нуклеозидов аденина и гуанина при участии аденозиндезаминазы (КФ 3.5.4.4.), широко распространенного в природе фермента, и гуаназиндезаминазы, фермента, найденного у микроорганизмов (псевдомонад), но не обнаруженного у животных. Д. адениловой к-ты (см. Аденозинфосфорные кислоты) наиболее хорошо изучено; фермент АМФ-дезаминаза (КФ 3.5.4.6) присутствует в больших количествах в скелетных мышцах человека и животных и практически отсутствует в гладких мышцах; найден у растений и бактерий. Фермент получен в кристаллическом виде, содержит SH-группы и ионы Zn 2+ . Необратимая реакция Д. адениловой к-ты протекает с образованием инозиновой кислоты (см. Инозиновые кислоты). В тканях животных, у дрожжей и бактерий обнаружен фермент цитозиндезаминаза (КФ 3.5.4.1), превращающий цитозин (см. Пиримидиновые основания) в уридин (см.). Описано Д. цитидина и цитидиловой к-ты, а также дезоксицитидиловой к-ты соответствующими дезаминазами.
Восстановительное дезаминирование
Этот вид Д. распространен у некоторых спороносных анаэробных бактерий из семейства Clostridium и известен под названием «реакции Стикленда». Процесс протекает по суммарному уравнению 5:
Механизм восстановительного Д. заключается в сопряженной анаэробной окислительно-восстановительной реакции между двумя аминокислотами, из которых одна выступает как донор водорода, а другая — как его акцептор. В результате обе аминокислоты дезаминируются. Напр., реакция между аланином (донор) и глицином (акцептор) складывается схематически из следующих превращений:
Аналогичные реакции наблюдали между другими парами аминокислот. В качестве продуктов реакции из пролина образуется дельта-аминовалериановая к-та, из изолейцина, лейцина, валина — альфа-метилмасляная, изовалериановая и изомасляная соответственно. Ферменты, участвующие в этом виде Д., мало изучены; механизм этого процесса нуждается в уточнении.
Внутримолекулярное дезаминирование
Процесс протекает с образованием ненасыщенной к-ты по суммарному уравнению 6:
У растений и некоторых бактерий таким путем происходит Д. L-аспарагиновой к-ты с помощью широко распространенной аспартат-аммиаклиазы (КФ 4.3.1.1; прежнее название «аспартаза»); в результате из L-аспарагиновой к-ты образуются фумаровая к-та и аммиак. Реакция обратима. Фермент был очищен и изучен; он содержит ионы Mg 2+ и SH-группы. В печени человека и животных аналогичным путем происходит Д. L-гистидина ферментом гистидин-аммиак-лиазой (КФ 4.3.1.3). Гистидин (см.) необратимо дезаминируется в бета-имидазолилакриловую (уроканиновую) к-ту. У некоторых бактерий происходит подобное Д. других аминокислот (напр., ароматических).
Некоторые бета- и гамма-оксиаминокислоты (серин, треонин) и меркаптоаминокислоты (цистеин, метионин) дезаминируются особыми путями при участии специфических ферментов.
Определение активности ферментов, катализирующих различные виды дезаминирования
Определение активности ферментов, катализирующих различные виды дезаминирования, является дополнительным диагностическим тестом при ряде заболеваний. Нарушение процессов Д. в печени и других органах и тканях человека и животных связано с изменением активности ферментов, катализирующих процессы Д. и переаминирования. При заболеваниях, связанных с белковой недостаточностью, наблюдается уменьшение активности ферментов, катализирующих окислительное Д. и переаминирование. Наиболее популярным и широко применимым методом энзимодиагностики в лабораториях и клиниках является определение активности аспартат-(КФ 2.6.1.1) и аланин- (КФ 2.6.1.2) аминотрансфераз (АсАТ и АлАТ) соответственно. Наибольшее содержание АсАТ обнаружено в сердечной мышце, затем (в убывающем порядке) в печени, скелетной мускулатуре, головном мозге, почках, семенниках. Наибольшая активность АлАТ выявлена в печени, поджелудочной железе, сердце и скелетной мускулатуре.
Активность обоих ферментов в сыворотке крови увеличивается при заболеваниях, протекающих с некрозом и повреждением тканей, гл. обр. сердечной мышцы и печени. Активность АсАТ наиболее резко возрастает при инфаркте миокарда, обычно пропорционально величине участка некроза.
При заболеваниях печени в первую очередь и значительно увеличивается активность АлАТ. Особенно резко увеличивается она при вирусном гепатите (максимум на 6—11-й день заболевания), причем активность АлАТ повышается уже в инкубационном периоде, что имеет большое диагностическое значение. Увеличивается активность АсАТ и АлАТ и при метастазах рака в печени; при механических желтухах увеличения активности аминотрансфераз в сыворотке крови не отмечали. В лабораторной диагностике используют величину отношения активности АсАТ к АлАТ. У здоровых людей величина этого коэффициента равна 1,33±0,42; у больных острым вирусным гепатитом — 0,65, при инфаркте миокарда величина коэффициента резко превышает нормальную. Гипераминотрансфераземии отмечаются также при гемолитических анемиях, панкреатитах, отравлениях и пр.
В норме активность АсАТ и АлАТ колеблется от 0,005 до 0,0182 и от 0,0028 до 0,0186 мкмолей субстрата, расщепленного 1 мл сыворотки крови в 1 мин.
Библиография: Березов Т. Т. Обмен аминокислот нормальных тканей и злокачественных опухолей, М., 1969, библиогр.; Браунштейн А. Е. Биохимия аминокислотного обмена, М., 1949, библиогр.; он же, Главные пути ассимиляции и диссимиляции азота у животных, М., 1957, библиогр.; M e i s t e г A. Biochemistry of the amino acids, v. 1—2, N. Y.—L., 1965, bibliogr.; Sallach H. J. a. F a-hien L. A. Nitrogen metabolism of amino acids, в кн.: Metabolic pathways, ed. by D. М» Greenberg, v. 3, p. 1, N. Y.—L., 1969, bibliogr.; Tabor C. W. a. T a b о г H. 1,4-diaminobutane (putrescine), spermidine, and spermine, Ann. Rev. Biochem., v. 45, p. 285, 1976, bibliogr.
Источник