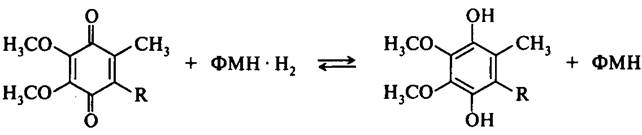Биохимические механизмы аэробного биологического окисления
Транспорт высокоэнергетических электронов и протонов от окисляемого субстрата на кислород осуществляет система, состоящая из окислительно-восстановительных ферментов, локализованная на внутренней мембране митохондрий. В состав этой системы входят:
— пиридиновые дегидрогеназы, у которых в качестве коферментов выступают НАД (никотинамидадениндинуклеотид) или НАДФ (никотинамидадениндинуклеотидфосфат);
— флавиновые дегидрогеназы (флавиновые ферменты), роль небелковой части у которых выполняют ФАД (флавинадениндинуклеотид) или ФМН (флавинмононуклеотид);
— убихинон (кофермент Q);
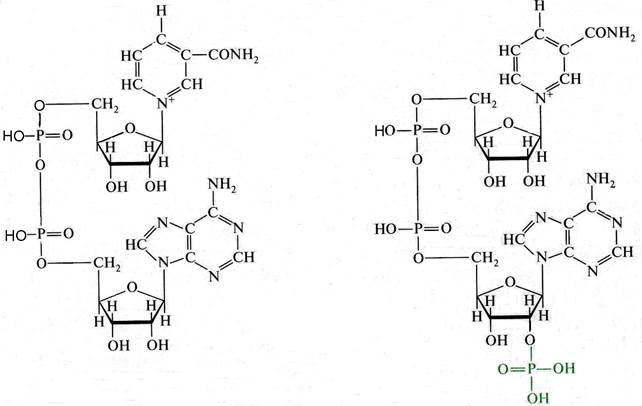
Пиридиновые дегидрогеназы. Строение НАД и НАДФ представлено на рис. 4.
динуклеотид (НАД) нуклеотидфосфат (НАДФ)
Рис. 4. Строение НАД и НАДФ
НАД и НАДФ являются динуклеотидами, нуклеотиды которых связаны пирофосфатной связью (через два соединенных между собой остатка фосфорной кислоты). В состав одного нуклеотида входит амид никотиновой кислоты (витамин РР), другой нуклеотид представлен адениловой кислотой. В молекуле НАДФ имеется дополнительный остаток фосфорной кислоты, присоединенный ко второму углеродному атому рибозы, связанной с адениловой кислотой.
НАД и НАДФ являются коферментами большого числа специфических для разных субстратов окисления дегидрогеназ. Связь между ними и белковой частью непрочная, они объединяются только непосредственно в момент реакции.
Некоторые пиридиновые дегидрогеназы локализованы в матриксе митохондрий. НАД-зависимые дегидрогеназы передают электроны и протоны в дыхательную цепь, НАДФ-зависимые дегидрогеназы служат источником восстановительных эквивалентов для реакций биосинтеза
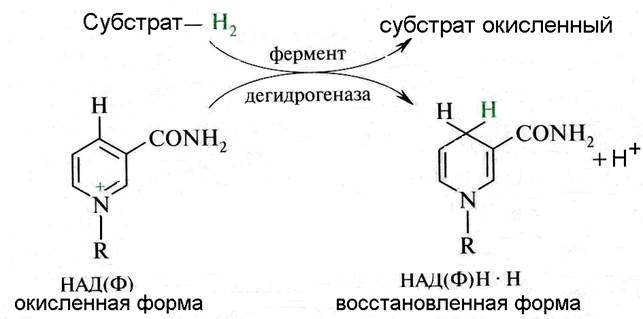
Активной частью НАД и НАДФ является витамин РР. При взаимодействии с восстановленным субстратом пиридиновое кольцо витамина РР связывает два электрона и протон, второй протон остается в среде ( рис. 5).
Рис. 5. Окисление субстрата пиридиновыми дегидрогеназами
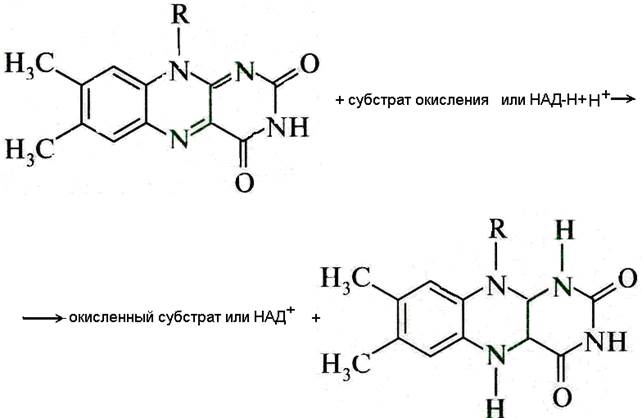
Флавиновые ферменты.В отличие от НАД и НАДФ, простетические группы флавиновых ферментов (ФАД и ФМН) прочно связаны с белковой частью. Обе простетические группы содержат метаболически активную форму рибофлавина (витамина В2), к которой в процессе их восстановления присоединяются атомы водорода (рис.6).
Рис. 6. Окисление субстратов активной частью (витамин В2) простетической группы флавиновых ферментов
ФАД — содержащие флавиновые ферменты выполняют функцию, аналогичную пиридиновым ферментам – являются первичными акцепторами электронов и протонов. Они непосредственно окисляют некоторые субстраты, например сукцинат (янтарную кислоту) или ацил-КоА (активную форму любой жирной кислоты).
ФМН-зависимая дегидрогеназа выполняет роль промежуточного переносчика электронов и протонов между НАД и убихиноном, т.е. является непосредственным участником дыхательной цепи.
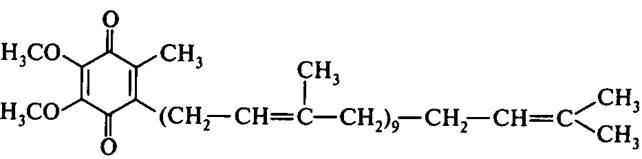
Убихинон (кофермент Q). Убихинон является производным бензохинона с длинной боковой цепью. Его строение представлено на рис.7.
Рис. 7. Строение кофермента Q (убихинона)
Кофермент Q играет роль промежуточного переносчика электронов и протонов в дыхательной цепи, непосредственно окисляя флавиновые ферменты. Место присоединения протонов и электронов – атомы кислорода в кольце бензохинона (рис. 8):
Рис. 8. Механизм переноса протонов молекулой кофермента Q (убихина)
Цитохромы.Цитохромы относятся к классу хромопротеинов. В их состав входит железосодержащий гем, по своему строению аналогичный гему гемоглобина. Различные цитохромы отличаются строением боковых цепей в структуре гема, структурой белковых компонентов, способом соединения гема с белковым компонентом. Функция цитохромов связана с переносом электронов от убихинона к кислороду. Они локализованы в дыхательной цепи в определенной последовательности:
Цитохромы b, с1 и с выполняют функцию промежуточных переносчиков электронов, а комплекс цитохромов а и а3, называемый цитохромоксидазой, является терминальным дыхательным ферментом, непосредственно взаимодействующим с кислородом. Этот комплекс состоит из шести субъединиц, каждая из которых содержит геминовую группу и атом меди. Две субъединицы из шести составляют цитохром а, а остальные четыре образуют цитохром а3.
Перенос цитохромами электронов непосредственно связан с присутствием в их составе ионов железа. Окисленная форма цитохромов содержит Fе 3+ . Принимая электроны от убихинона или другого цитохрома, Fe 3+ переходит в восстановленное состояние (Fе 2+ ), а передавая электроны другому цитохрому или кислороду, Fe 2+ вновь переходит в окисленное состояние (F 3+ ).
Кислород, принимая электроны от цитохромоксидазы, переходит в активное (ионизированное) состояние, затем принимает два протона из окружающей среды. В результате образуется молекула воды.
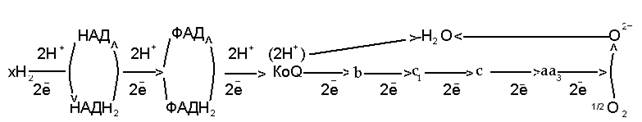
Схематично систему переноса электронов и протонов по дыхательной цепи можно представить следующим образом (рис. 9):
Рис. 9. Последовательность расположения переносчиков электронов и протонов в дыхательной цепи
Источник
Тесты «Ферменты»
1. Ферменты являются:
В) активаторами субстратов;
Г) переносчиками веществ через мембрану;
Д) медиаторами нервного импульса.
2. Ферменты могут состоять только из:
Б) белка и небелковой части;
Г) низкомолекулярных азотсодержащих органических веществ;
Д) липидов и углеводов.
3. Тест. Кофактор – это:
А) активная часть простого фермента;
Б) показатель активности фермента;
В) показатель стабильности фермента;
Г) белковая часть сложного фермента;
Д) небелковая часть сложного фермента.
4. Кофермент – это:
А) легкоотделяющаяся белковая часть сложного фермента;
Б) неотделяющаяся небелковая часть сложного фермента;
В) белковая часть сложного фермента;
Г) небелковая часть простого фермента;
Д) непрочносвязанная небелковая часть сложного фермента.
5. Простетическая группа – это:
А) белковая часть сложного фермента;
Б) стабилизатор структуры фермента;
В) активатор сложного фермента;
Г) прочносвязанная с ферментом небелковая часть;
Д) часть фермента, образующая каталитический центр.
6. По типу реакций ферменты подразделяются на:
А) оксидазы, трансферазы, гидролазы, каталазы, изомеразы, эстеразы;
Б) оксидоредуктазы, изомеразы, гидролазы, эстеразы, пероксидазы, лиазы;
В) оксидазы, оксидоредуктазы, каталазы, гидролазы, эстеразы, лиазы;
Г) оксидоредуктазы, гидролазы, лиазы, карбоксилазы, изомеразы, лигазы;
Д) оксидоредуктазы, гидролазы, трансферазы, изомеразы, лиазы, лигазы.
7. К оксидоредуктазам относятся:
8. К оксидазам относятся:
Тест 9. В состав пиридинзависимых дегидрогеназ входят:
Г) пантотеновая кислота и цитохромы;
Д) пангамовая кислота и АТФ.
10. В состав флавинзависимых дегидрогеназ входят:
Д) кофермент А (КоА).
А) катализируют гидролиз субстратов;
Б) ускоряют окислительно-восстановительные реакции с участием кислорода;
В) ускоряют окислительно-восстановительные реакции в анаэробной среде;
Г) ускоряют реакции переноса только электронов;
Д) ускоряют реакции отщепления водорода и электронов от субстрата на промежуточный окислитель.
А) ускоряют реакции гидрирования субстратов;
Б) катализируют превращения альдегидов в спирты;
В) ускоряют реакции переноса гидроксо-групп внутри молекулы субстрата;
Г) катализируют гидролитическое расщепление субстратов;
Д) ускоряют реакции отщепления воды от субстрата.
13. К гидролазам относятся:
А) протеазы, липазы;
Б) декарбоксилазы, карбоксилазы;
Д) цитохромы, убихинон.
14. К протеазам относятся:
Д) пепсин, трипсин.
15. Протеазы катализируют расщепление:
А) сложноэфирных связей;
Б) углерод-углеродных связей (С-С);
В) пептидных связей;
Г) гликозидных связей;
Д) углерод-водородных связей (С-Н).
16. Трансферазы катализируют и могут содержать:
А) перенос групп внутри молекулы субстрата; витамин В2;
Б) перенос групп от одной молекулы к другой; витамин В6;
В) перенос остатков фосфорной кислоты от АТФ на глюкозу;
Г) отщепление от субстрата низкомолекулярных соединений; витамин В1;
Д) присоединение к субстрату низкомолекулярных соединений; витамин Н.
17. К трансферазам относится:
18. Лиазы катализируют:
А) реакции соединения молекул;
Б) реакции изомеризации;
В) расщепление связей в субстрате с помощью воды;
Г) расщепление связей в субстрате без участия воды;
Д) перенос электронов от одного субстрата к другому.
19. К лиазам относятся:
А) катализируют расщепление связей в субстрате с помощью воды;
Б) катализируют отщепление от субстрата углекислого газа, воды или аммиака;
В) для выполнения своих биохимических функций используют энергию АТФ;
Г) катализируют реакции синтеза;
Д) катализируют реакции переноса групп атомов в молекуле субстрата.
21. К лигазам относятся:
22. Абсолютную специфичность к субстрату проявляет фермент:
23. Пантотеновая кислота является составной частью:
А) липоевой кислоты;
Г) тетрагидрофолиевой кислоты;
24. Реакции превращения аминокислот связаны с участием:
25. Тиаминпирофосфат, липоевая кислота и коэнзим А одновременно входят в качестве кофакторов в состав:
А) синтетазы высших жирных кислот;
Г) пируватдегидрогеназы декарбоксилирующей;
26. Реакции переноса одноуглеродных групп (например, формильной) протекают при участии:
Г) тетрагидрофолиевой кислоты;
Д) флавинадениндинуклеотида (ФАД).
А) способствует усвоению витамина А;
Б) содержит в составе витамин А;
В) катализирует перенос углеводных остатков (арабинозы);
Г) катализирует перенос остатков жирных кислот;
Д) катализирует отщепление ацильных остатков от субстратов.
28. В состав родопсина – рецепторного белка сетчатки глаза входит:
29. Реакция, протекающая по уравнению
R1–O–R2 + H3PO4 R1OPO3H2 + R2–OH является реакцией:
30. Превращение 2H2O2 → 2H2O + O2 происходит при участии:
31. Оксидаза (А); дегидрогеназа (Б); каталаза (В); пероксидаза (Г); гидратаза (Д) ускоряют реакции:
Источник
Lechebnoe_delo
10. В СОСТАВ НАД + ВХОДИТ:
1. амид никотиновой кислоты
11. РАЗОБЩАЮЩИМ ДЕЙСТВИЕМ НА ПРОЦЕССЫ ОКИСЛИТЕЛЬНОГО ФОСФОРИЛИРОВАНИЯ ОБЛАДАЮТ:
1. ингибиторы цитохромоксидазы
3. гидрофобные кислоты
12. В СОСТАВ ПРОСТЕТИЧЕСКИХ ГРУПП ФЛАВИНОВЫХ ДЕГИДРОГЕНАЗ ВХОДИТ ВИТАМИН:
13. СВОБОДНЫЕ РАДИКАЛЫ МОГУТ ОБРАЗОВАТЬСЯ:
1. в процессе тканевого дыхания
2. при работе моно- и диаминооксидаз
3. в микросомальном окислении
4. под действием ионизирующей радиации
14. ГИПОЭНЕРГЕТИЧЕСКОЕ СОСТОЯНИЕ, ВОЗНИКАЮЩЕЕ ПРИ ДЕФИЦИТЕ ВИТАМИНА В 1 , ХАРАКТЕРИЗУЕТСЯ НАРУШЕНИЕМ РЕАКЦИИ:
1. образования ацетил КоА из пирувата
2. образования цитрата
3. окисления сукцината
4. окисления альфа-кетоглутарата
15. АНТИОКСИДАНТНЫМИ ФЕРМЕНТАМИ ЯВЛЯЮТСЯ:
1. глутатионпероксидаза селенсодержащая
2. глутатион s- трансфераза
16. СПЕЦИФИЧЕСКИЕ ПУТИ МЕТАБОЛИЗМА
3. бета – окисление
17. ОБЩИЕ ПУТИ КАТАБОЛИЗМА
3. окислительное декарбоксилирование пирувата
18 ПОСТУПИВШИЙ В КЛЕТКИ КИСЛОРОД МОЖЕТ БЫТЬ ИСПОЛЬЗОВАН
1. в тканевом дыхании
2. в реакциях дегидрирования
3. в реакциях переаминирования
4. в реакциях коньюгации
5. в реакциях декарбоксилирования
19. СУБСТРАТОМ, ДЕГИДРИРОВАНИЕ КОТОРОГО ОБЕСПЕЧИВАЕТ РАБОТУ ДЫХАТЕЛЬНОЙ ЦЕПИ I ТИПА, ЯВЛЯЕТСЯ
20. ПРИ ПРЕВРАЩЕНИИ АЦЕТИЛ-КОА В ЦТК ДО СО 2 И Н 2 О С УЧЕТОМ ЦТЭ ОБРАЗУЮТСЯ
21. В ЦИТРАТНОМ ЦИКЛЕ ОБРАЗУЕТСЯ МОЛЕКУЛ СО 2
22. ФЕРМЕНТ, КАТАЛИЗИРУЮЩИЙ РЕАКЦИЮ СУБСТРАТНОГО ФОСФОРИЛИРОВАНИЯ
23. ОКСАЛОАЦЕТАТ ИСПОЛЬЗУЕТСЯ ДЛЯ БИОСИНТЕЗА
1. жирных кислот
3. кетоновых тел
24. РЕАКЦИЮ ФОСФОРИЛИРОВАНИЯ АДФ В МИТОХОНДРИЯХ КАТАЛИЗИРУЕТ ФЕРМЕНТ
3. QН 2 -дегидрогеназа
5. Nа + /К + -АТФ-аза
25. РАСПОЛОЖЕНИЕ ФЕРМЕНТОВ В ДЫХАТЕЛЬНОЙ ЦЕПИ ЗАВИСИТ
1. молекулярной массы
2. степени гидрофобности
4. металла, входящего в состав гема
5. окислительно-восстановительного (Redox) потенциала
26. БЕЛОК-ПРОТОНОФОР БУРОЙ ЖИРОВОЙ ТКАНИ
3. транслоказа адениловых нуклеотидов
5. анионтранспортный белок
27. ПЕРОКСИД ВОДОРОДА – СУБСТРАТ ДЛЯ
28. ВОССТАНОВЛЕНИЕ ПЕРОКСИДА ВОДОРОДА В ПРИСУТСТВИИ ГЛУТАТИОНА КАТАЛИЗИРУЕТ ФЕРМЕНТ
29. КИСЛОТА – АНТИОКСИДАНТ
30. АНТИОКСИДАНТ БИОЛОГИЧЕСКИХ МЕМБРАН
31. СУММАРНЫЙ ЭНЕРГЕТИЧЕСКИЙ ЭФФЕКТ ЦИКЛА КРЕБСА:
32. К МАКРОЭРГИЧЕСКИМ СОЕДИНЕНИЯМ ОТНОСЯТСЯ ВСЕ, КРОМЕ:
5. фосфоенолпировиноградной кислоты.
33. ФЕРМЕНТ, УЧАСТВУЮЩИЙ В НЕЙТРАЛИЗАЦИИ СУПЕРОКСИДАНИОН-РАДИКАЛА
ОБМЕН И ФУНКЦИИ УГЛЕВОДОВ
1. ПОД ПРОЦЕССОМ ПЕРЕВАРИВАНИЯ УГЛЕВОДОВ ПОНИМАЮТ:
1. расщепление до СО 2 Н 2 О
2. расщепление до лактата
3. гидролитическое расщепление до моносахаров
4. расщепление до ацетил СоА
5. расщепление до пирувата
2. СУТОЧНАЯ ПОТРЕБНОСТЬ В УГЛЕВОДАХ ДЛЯ ВЗРОСЛОГО ЧЕЛОВЕКА СОСТАВЛЯЕТ:
3. ДЕПОНИРОВАНИЯ ГЛИКОГЕНА В ПЕЧЕНИ УСИЛИВАЕТСЯ ПОД ДЕЙСТВИЕМ СЛЕДУЮЩЕГО ГОРМОНА:
4. АЭРОБНОЕ ОКИСЛЕНИЕ ГЛЮКОЗЫ:
1. окисление глюкозы до лактата
2. глюкозы до СО 2 и Н 2 О
3. окисление в бескислородной среде
4. окисление в присутствии О 2
5. ФЕРМЕНТАМИ ГЛИКОЛИЗА ЯВЛЯЮТСЯ:
6. РЕГУЛЯТОРНЫМИ ФЕРМЕНТАМИ ГЛИКОЛИЗА ЯВЛЯЮТСЯ:
2. глюкозо-6- фосфатизомераза
7. МЕТАБОЛИТЫ ПЕНТОЗОФОСФАТНОГО ПУТИ МОГУТ ВКЛЮЧАТЬСЯ
1. синтеза липидов
2. синтеза макроэргов
3. общего пути катаболизма
4. тканевого дыхания
8. ГОРМОНЫ, ПОВЫШАЮЩИЕ УРОВЕНЬ ГЛЮКОЗЫ В КРОВИ:
9. В ГЛИКОЛИЗЕ И ГЛЮКОНЕОГЕНЕЗЕ УЧАСТВУЕТ:
10. ЭНЕРГЕТИЧЕСКИЙ ЭФФЕКТ АНАЭРОБНОГО ГЛИКОГЕНОЛИЗА СОСТАВЛЯЕТ:
1. построен из остатков фруктозы
2. содержит мономеры, связанные α -1,3-гликозидной связью
3. имеет линейное расположение мономеров
4. поступает в организм в составе растительной пищи
5. является формой депонирования глюкозы в клетках животных
12. ГАЛАКТОЗА ОБРАЗУЕТСЯ ПРИ ПЕРЕВАРИВАНИИ
13. ОСНОВНОЙ УГЛЕВОД ПИЩИ ВЗРОСЛОГО ЧЕЛОВЕКА
14. ФЕРМЕНТ СЕКРЕТА ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ
15. ПРИ ПЕРЕВАРИВАНИИ УГЛЕВОДОВ ПРОИСХОДИТ
1. расщепление дисахаридов до моносахаридов
2. расщепление полисахаридов до моносахаридов
3. образование продуктов, которые могут всасываться клетками слизистой кишечника
16. ПЕРЕВАРИВАНИЕ УГЛЕВОДОВ В РОТОВОЙ ПОЛОСТИ ПРОИСХОДИТ ПОД ДЕЙСТВИЕМ ФЕРМЕНТОВ
Источник