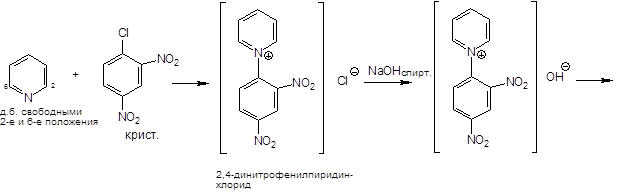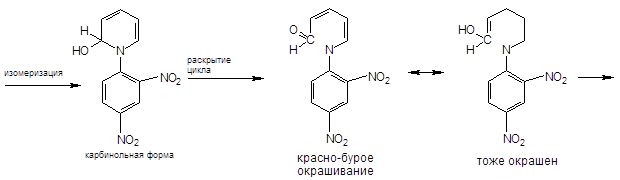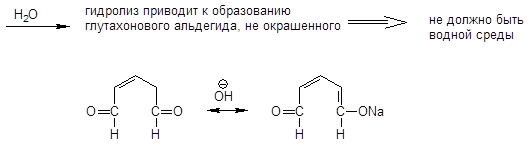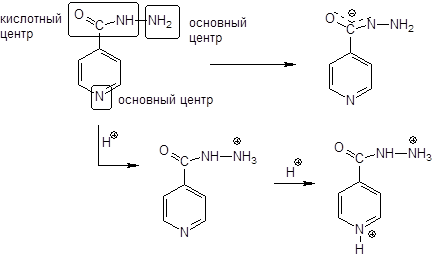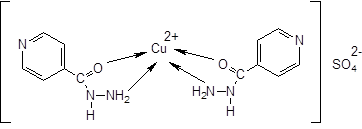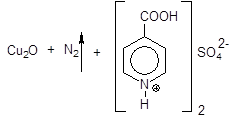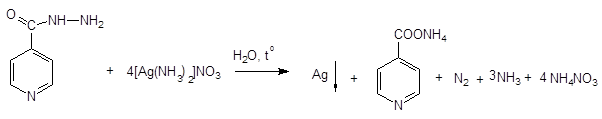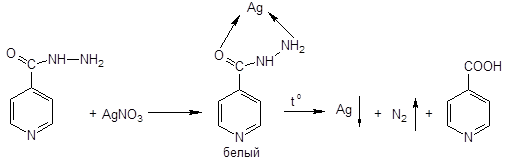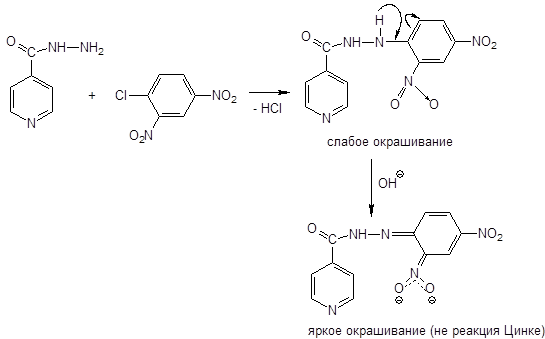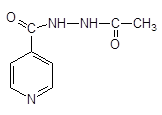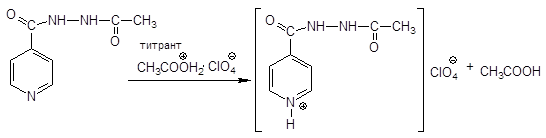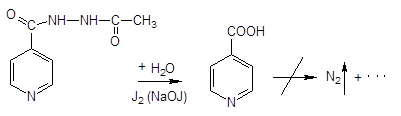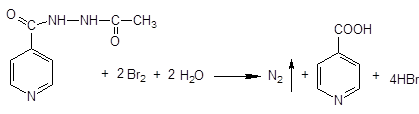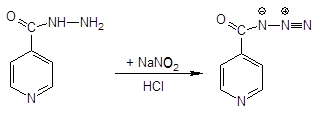Лекарственные вещества, производные пиридина — лекция
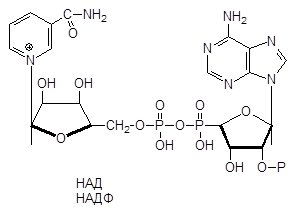 |
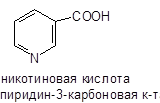 |
 |
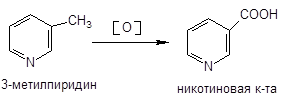 |
Пиколины (природные соединения) – это метилпиридины
1. Производные пиридин-4-карбоновой (изоникотиновой) кислоты — синтетические вещества
 |
Изониазид, Метазид, Фтивазид, Солюзид растворимый — противотуберкулезное действие.
Производные тиоаминоизоникотиновой кислоты: Этионамид, Протионамид.
2. Производные пиридин-3-карбоновой (никотиновой) кислоты:
Кислота никотиновая, никотинамид — витамины РР
Никодин — желчегонное и бактерицидное
Пикомилон — ноотропное действие
Ницеритрол, Никоклонад — антигиперлейкемические
Кислота нифлуновая, Никобоксил — противовоспалительные
3. Производные пиридинметанола
Пиридоксин г/х, Пиридоксаль фосфат — витамины группы В6.
Отдаленно относится Эмоксипин — антиоксидант, ангиопротектор, антикоагулянт
4. Производные 1,4-дигидропиридина
Нифедипин, Амлодипин, Риодимин — антагонисты Са 2+ , гипотензивные и антиангинальные.
1. Производные изоникотиновой кислоты — противотуберкулезные ЛС
изониазид — Isoniazidum 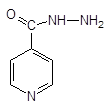 гидразид изоникотиновой кислоты гидразид изоникотиновой кислоты | МЕТАЗИД — Methazidum 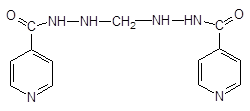 2,2-метилен-бис-гидразид изоникотиновой кислоты — Продукт конденсации изониазида и формальдегида 2,2-метилен-бис-гидразид изоникотиновой кислоты — Продукт конденсации изониазида и формальдегида |
фТИВАЗИД — Phthivazidum 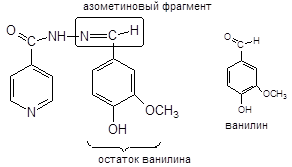 3-метокси-4-оксибензилиден-гидразид кислоты изоникотиновой (это основание Шиффа) 3-метокси-4-оксибензилиден-гидразид кислоты изоникотиновой (это основание Шиффа) | СОЛЮЗИД РАСТВОРИМЫЙ — Soluzidum solubile 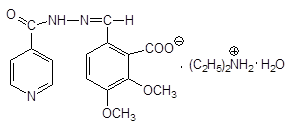 диэтиаммониевая соль 2-карбокси-3,4-диметоксибензилиденгидразида кислоты изоникотиновой, гидрат диэтиаммониевая соль 2-карбокси-3,4-диметоксибензилиденгидразида кислоты изоникотиновой, гидрат |
Общегрупповые реакции на пиридиновый фрагмент
¾ нагревание сухого препарата группы пиридина вместе с сухим гидрокарбонатом натрия в тигле ведет к образованию пиридина (появляется характерный запах)
¾ взаимодействие кристаллических веществ группы пиридина с кристаллической лимонной кислотой и кристаллическим уксусным ангидридом, при нагревании образуется красное окрашивание
2. Реакция Цинке.
Пиридин — рКа = 5,35 (средней силы).
Электронная плотность распределена неравномерно:
Реакции электрофильного замещения идут трудно (нитрование).
Изониазид — является амфолитом, т.к. основный центр — атом азота с не поделенной парой электронов в цикле и аминогруппа.
Это белый кристаллический порошок, растворимый в воде.
Как основание — вступает в осадительные реакции с общеалкалоидными реактивами.
Соли тяжелых металлов — осадители.
Изониазид + сульфат меди ® осадок синего цвета и синий раствор над ним:
После дальнейшего нагревания раствор приобретает зеленую окраску, выделяется газ:
Данная реакция включена во временную фармакопейную статью.
Реакция Цинке — красно-бурое окрашивание (химизм см. выше).
+ реакция взаимодействия с 2,4-динитрохлорбензолом без нагревания.
Не в условиях фармакопейной статьи:
В ФС: реакция с нитратом серебра, ИК-спектроскопия, реакция Цинке.
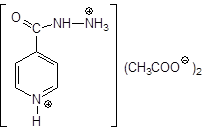 |
К.О. — титрование в среде ледяной уксусной кислоты с добавлением достаточного количества уксусного ангидрида.
Если просто с уксусной кислотой и ангидридом как примесью.
Образуется диацетат по двум основным центрам:
Часть гидразида уксусной кислоты ацетилируется, следовательно, с препаратом взаимодействует только 1 моль хлорной кислоты. В результате титрования образуется:
Если есть уксусный ангидрид, то титруется только гетероатом:
Йодометрия: (обратное титрование)
в среде гидрокарбоната натрия йод диспропорционирует до йодид-иона (гипойодида):
 |
 |
При количественном определении препарата добавляется соляная кислота, оставляют в темном месте.
1. Гидролиз и воздействие йода:
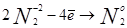 |
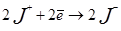 |
Фактор эквивалентности = 4. Выделившийся йод оттитровывают тиосульфатом.
1-ый титрант — бромат калия, 2-ой титрант — тиосульфат натрия.
KBrO3 + 5KBr + 6HCl ® 3Br2 + 3H2O + 6KCl
Изониазид — таблетки, растворы для инъекций. К.О. в ЛФ — УФ-спектрофотометрия.
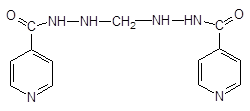 метазид метазид |
Метазид: отличается по свойствам — не растворим в воде, т.к. это продукт конденсации с альдегидом.
1. УФ-спектры, ИК-спектры
2. Реакция Цинке (как на изониазид) — красно-бурый продукт
3. Гидролиз — образование формальдегида и изониазида
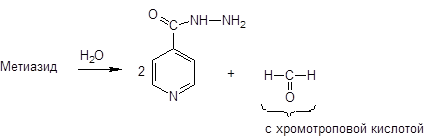 |
Чистота: Изониазид — примесь свободного гидразина (ТСХ) — примесь допустимая.
 1 — изониазид 2 — гидразина сульфат (свидетель) (NH3-NH3)SO4 Интенсивность окрашивания после опрыскивания пДБА не должна превышать свидетель — гидразина сульфат 1 — изониазид 2 — гидразина сульфат (свидетель) (NH3-NH3)SO4 Интенсивность окрашивания после опрыскивания пДБА не должна превышать свидетель — гидразина сульфат | После опрыскивания образуется оранжевое основание Шиффа: 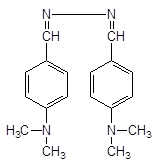 |
В Метазиде: примесь гидразида — встряхивают ледяную воду, фильтруют. К фильтрату добавляют 1 каплю соляной кислоты и 1 каплю нитрата натрия -на йодкрахмальную бумагу — синее окрашивание если нет изониазида.
NaNO2 + 2KJ + 4HCl ® J2 + 2NO + 2KCl + 2NaCl + 2H2O
Если есть изониазид — йодкрахмальная бумага не окрашивается, т.к. образуется азид гидразида изоникотиновой кислоты:
К. О. определение — окислительно-восстановительное титрование — Йодометрия.
| | | следующая лекция ==> | |
| Производные 4-аминохинолина | | | Производные пиримидин-4,6-диона |
Дата добавления: 2016-11-28 ; просмотров: 9441 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Источник
Витамин PP — никотиновая кислота
Исторические сведения
История противопеллагрического витамина, пожалуй, одна из самых увлекательных и сложных. Еще в 1867 г. Huber получил впервые никотиновую кислоту путем окисления никотина хромовой кислотой, но только в 1937 г. было доказано, что она является витамином PP. В 1873 г. Weidel. получил никотиновую кислоту путем окисления никотина азотной кислотой, а в 1879 г.— путем окисления бета-пиколина. Он же предложил ее название. Одновременно с ним в 1879 г. русский химик-органик А. Н. Вышнеградский синтезировал никотиновую кислоту из 3-этилпиридина. В 1877г. Laiblin получил никотиновую кислоту окислением никотина перманганатом. В 1912г. Suzuki, Shimamura и Odake выделили никотиновую кислоту из рисовых отрубей, а в 1913 г., независимо от них, Funk выделил ее из рисовых отрубей и дрожжей. Однако выделенное кристаллическое вещество не предохраняло и не излечивало бери-бери.
В 1926 г. Vickery вновь выделил никотиновую кислоту из дрожжей. Но никто из перечисленных исследователей не подозревал, что это вещество является истинным противопеллагрическим фактором. Это еще более удивительно потому, что примерно в это же время американский врач Goldberger установил в качестве основной причины пеллагры недостаточность в питании человека нового, до сих пор неизвестного фактора РР (pellagra preventing). Он пытался вызвать у крыс недостаточность этого вещества. Однако причиной полученных им в эксперименте нарушений впоследствии оказалась недостаточность витамина В6.
В 1935 г. В. В. Ефремов показал, что витамин B6 не излечивает экспериментальную пеллагру у собак.
В 1936 г. Koehn и Elvehjem установили, что печеночный экстракт не предупреждал и не излечивал собачьей пеллагры, а также пеллагру у человека.
В 1936 г. ими была получена из печеночного экстракта активная фракция, 64 мг которой излечивали собачью пеллагру. Из этой фракции в 1937 г. Strong и Woolley получили кристаллическое вещество, которое оказалось никотиновой кислотой.
В 1937 г. Elvehjem и соавторы установили в опытах на собаках, у которых была воспроизведена экспериментальная пеллагра, что никотиновая кислота излечивает это заболевание. В 1937 г. никотиновая кислота была с успехом применена при пеллагре человека.
В 1938 г. В. В. Ефремов впервые в СССР излечил тяжелую пеллагру с психозом никотиновой кислотой.
В процессе своих поисков по раскрытию этиологии пеллагры Goldberger и Tanner в 1922 г. высказали гипотезу, что причиной этого заболевания может быть недостаток некоторых аминокислот, а именно триптофана, что впоследствии подтвердилось.
Warburg и Christian в 1934 г. впервые показали значение никотиновой кислоты в биохимических реакциях. Они выделили амид никотиновой кислоты из кодегидразы II (НАДФ) и установили его функцию как составной части кофермента, переносящего водород. Почти одновременно с ним в 1935 г. Euler и соавторы выделили из кодегидразы I (НАД) вещество, которое также было индентифицировано с амидом никотиновой кислоты. Большое биологическое значение никотиновой кислоты было затем установлено рядом исследований, показавших, что это вещество является важным фактором для некоторых микроорганизмов.
Химические и физические свойства витамина РР
Никотиновая кислота довольно легко выделяется из большинства природных продуктов. Она представляет собой белое игольчатое, кристаллическое вещество без запаха, кисловатого вкуса с точкой плавления 234—237°. Молекулярный вес ее 123,11. Один грамм никотиновой кислоты растворим в 60 мл воды и 80 мл этилового спирта при 25°. Она нерастворима в эфире, но растворима в водных растворах гидроксидов и карбонатов щелочей. Никотиновая кислота не гигроскопична, очень стойкая в сухом виде. Растворы ее могут переносить автоклавирование при 120° в течение 20 минут без разрушения. Она хорошо переносит кипячение в 1 н. и 2 н. растворах минеральных кислот и щелочей. Никотиновая кислота имеет спектр поглощения в ультрафиолетовых лучах с максимумом при 260—260,5 нм. Наблюдается прямолинейная зависимость между коэффициентами поглощения никотиновой кислоты и ее концентрацией.
По химическому строению никотиновая кислота является бета-пиридинкарбоновой или пиридин-3-карбоксиловой кислотой. Никотинамид представляет собой белый кристаллический порошок без запаха, горько-соленого вкуса. Он плавится при 129—131°, имеет молекулярный вес 122,12. Один грамм растворяется в 1 мл воды и в 1,5 мл 95% этилового спирта. Он растворим в ацетоне, амиловом спирте, этиленгликоле, хлороформе, бутаноле, немного растворим в эфире и бензине. Никотинамид резко повышает растворимость рибофлавина. В сухом виде при температуре ниже 50° очень стоек. В водном растворе может быть автоклавирован при 120° в течение 20 минут без видимой потери активности. Под влиянием кислот и щелочей он превращается в никотиновую кислоту.
Никотинамид имеет абсорбционный максимум при 260—261,5 нм. По химическому строению он является амидом бета-пиридинкарбоновой или пиридин-3-карбоксиловой кислоты.
Никотиновая кислота может быть получена из никотина, из бета-пиколина, хинолина, пиридина и др. Никотинамид может быть получен из никотиновой кислоты, ее эфиров и из 3-циано-пиридина. Одним из важнейших аналогов никотиновой кислоты является 3-ацетилпиридин, который в опытах на животных используется для воспроизведения недостаточности никотиновой кислоты, как и другой аналог — 6-аминоникотинамид. 3-Ацетилпиридин почти не оказывает действия на здоровых собак, так как только малая часть его превращается в организме в никотиновую кислоту, а большая часть выделяется с мочой в виде никотината и других соединений. При применении его в опытах на мышах в дозе 3 мг в день через 3—4 дня появлялись симптомы недостаточности никотиновой кислоты.
Токсичность 3-ацетилпиридина LD50 для мышей составляет 300— 350 мг/кг, а для крыс — 80 мг/кг. Токсичность 6-аминоникотинамида (LD50 для мышей 35 мг/кг) значительно выше, чем у 3-ацетилпиридина. При дозе 2 мг/кг 50% животных погибали через 11 дней.
Гидразид изоникотиновой кислоты (изоникотинилгидразид, изониазид) угнетает рост микобактерий туберкулеза, которые теряют около 50% НАД при концентрации изониазида в среде 0,1 мкг/мл. Исходя из этого его с успехом применяют в качестве лечебного средства при туберкулезе.
Распространение витамина РР в природе
Никотиновая кислота довольно широко распространена в растительных и особенно в животных продуктах, которые значительно богаче никотиновой кислотой. Из растительных продуктов богаче всего сухие пивные дрожжи (40 мг%) и пекарские прессовые дрожжи (28 мг%). Значительное количество никотиновой кислоты находится в зерновых продуктах. Например, в пшенице содержится свыше 5 мг%.
Распространение никотиновой кислоты в пшеничном зерне примерно такое же, как и тиамина. Она содержится преимущественно во внешнем слое эндосперма, зародыше и отрубях с той разницей, что в отрубях больше никотиновой кислоты и меньше тиамина, чем в зародыше- В обойной муке находится вся никотиновая кислота, а в хлебе из нее — 3,5 мг%, в муке 1-го сорта – 1 мг%, а в хлебе из нее – 0,7 мг%. Рожь значительно беднее пшеницы в отношении витамина РР — 1,1 мг%. В ржаной муке содержится 1 мг%, а в ржаном хлебе — 0,45 мг% никотиновой кислоты. Кукуруза содержит около 2 мг%.
Из круп наиболее богата никотиновой кислотой гречневая (свыше 4 мг%), затем пшено (свыше 2 мг%), ячневая (2 мг%), овсяная (1,6 мг%), перловая (1,5 мг%), рис шлифованный (1,6 мг%), манная крупа — 0,9 мг%.
В кукурузе, как и в большинстве других зерновых культур, никотиновая кислота находится на 95 -98% в связанной, не усвояемой организмом форме- эфире сложного строения (ниацитин). Она освобождается полностью только после щелочного гидролиза. Освобожденная щелочным гидролизом никотиновая кислота уже легко усваивается организмом животных и человека. Наряду с этим такая зерновая культура, как кукуруза, очень бедна триптофаном. Это должно учитываться при оценке содержания никотиновой кислоты в пищевых рационах.
Из других растительных продуктов хорошими источниками являются бобовые, в которых никотиновая кислота находится в усвояемом виде: зеленый горошек, чечевица, фасоль, соя (2 — 2,5 мг%). Хороший источник никотиновой кислоты — кофейные бобы, содержащие в зависимости от сорта и обжарки от 2 до 10 мг%. Очень богаты никотиновой кислотой земляной орех — арахис (10 — 16 мг%), затем шпинат, томаты, капуста, брюква, баклажаны (0,5 — 0,7 мг%). В картофеле содержится 0,9 мг% (в вареном 0,5 мг%), в моркови — 1 мг%, сладком перце — 0,9 мг°/0, репе — 0,8 мг%, красной свекле — 1,6 мг%, в свежих грибах — 6 мг%, в сушеных — до 60 мг%.
Очень богаты никотиновой кислотой животные продукты, за исключением яиц (0,2 мг%) и молока (около 0,1 мг%). Так мясо домашней птицы содержит 6- 8 мг%, баранина -5,8 мг%, говядина -4 мг%, телятина -свыше 6 мг%, свинина-около 3 мг%, печень- 15- 16 мг%, почки -12 -15 мг%, сердце -6 — 8 мг%. Рыба беднее никотиновой кислотой, чем мясо скота. Свежая рыба содержит в среднем около 3 мг% никотиновой кислоты, мороженая треска — около 2 мг%, щука — 3,5 мг%, судак- 1,8 мг%.
В животных тканях почти вся никотиновая кислота находится в виде амида, связанного с нуклеотидами,— НАД и НАДФ. В продуктах растительного происхождения содержание никотинамида колеблется от 7% (желтая кукуруза) до 70% (картофель) по отношению ко всей никотиновой кислоте. В большинстве продуктов растительного происхождения никотиновая кислота распределена главным образом в наружных оболочках. Например, пшеничные отруби содержат 330 мкг в 1 г, пшеничная мука высшего сорта — 12 мкг, цельная пшеница — 70 мкг, шлифованный рис — 0,9 мкг, нешлифованный — 6,9 мкг, рисовые отруби — 96,6 мкг и т. д.
Никотиновая кислота — один из наиболее стойких витаминов в отношении хранения и кулинарной обработки. Она также очень стойкая при процессах консервирования. В консервах, хранившихся 2 года, потери ее не превышают 15%. Практически отсутствуют потери при замораживании или сушке. Обычные методы приготовления пищи приводят к потерям от 15 до 20% активности. При некоторых методах кулинарной обработки потери доходят до 50% . Состав почвы может влиять на содержание никотиновой кислоты в растениях. Снижение содержания основных ионов в питательных растворах уменьшало содержание никотиновой кислоты в овсе. Удобрение почвы известью или внесение в нее нитратов повышало содержание никотиновой кислоты в пшенице.
Методы определения витамина РР
Химический метод определения основан на использовании реакции с цианистым бромом, а затем с ароматическим амином. Возникающее окрашенное соединение измеряется фотометрически. Реакция протекает в два этапа: получение пиридинового производного путем реакции никотиновой кислоты с цианистым бромом и получение окрашенного диальдегидного соединения путем реакции с ароматическим амином.
Никотиновая кислота определяется также микробиологическими методами, чаще всего с использованием культуры Lactobacillus arabinosus и последующим турбидиметрическим определением, а также с простейшим— Tetrahymena pyroformis. Ни ниацин, ни никотинамид сами по себе не флюоресцируют, но их можно превратить во флуоресцирующие соединения. Такие методы широко применяются для определения коферментных форм никотинамида- НАД и НАДФ. Основной продукт обмена никотиновой кислоты Nl-метилникотинамид также определяется флуориметрическим методом. В различных реакциях обмена, связанных с переносом водорода, пиридиннуклеотиды, являясь коферментами специфических дегидрогеназ, действует как в окисленной, так и в восстановленной форме.
В восстановленной форме максимум спектра поглощения находится в ультрафиолетовой области при 340 нм. Восстановленные пиридиннуклеотиды при облучении ультрафиолетовыми лучами флуоресцируют. Так НАДФ-Н имеет два максимума спектра поглощения при 260 и 340 нм и один максимум спектра флуоресценции при 457 нм. Отмечен параллелизм между наличием флуоресценции и биологической активностью восстановленного кофермента.
Наиболее распространенным, быстрым, чувствительным и простым методом определения метаболитов никотиновой кислоты является определение Nl-метилникотинамида в моче . В основе этого метода лежит реакция конденсации Nl-метилникотинамида с ацетоном в присутствии щелочи с переходом в флуоресцирующий дериват. Этим путем можно определить 0,3 мкг в 1 мл разведенной мочи. Другой выделяемый с мочой метаболит — 6-пиридон Nl-метилникотинамид — определяется также флуориметрическим путем.
Содержание НАД и НАДФ в эритроцитах определяется также флуориметрическим путем, основанным на методе , предложенном для их определения в моче. Для этой цели предварительно белки крови осаждают трихлоруксусной кислотой. Затем происходит конденсация с ацетоном в присутствии щелочи, дающая флуоресцирующее соединение, которое определяется количественно. Так же определяется содержание НАД и НАДФ в тканях.
Обмен витамина РР в организме
Судьба никотиновой кислоты, поступающей в организм, зависит от вида питания и содержащихся в нем продуктов. Как уже упоминалось выше, никотиновая кислота, находящаяся в ряде зерновых продуктов в форме сложного эфира — ниацитина, на 95—96% не усваивается организмом человека, собаки и крысы, тогда как ниацин, находящийся в животных и бобовых продуктах, усваивается ими целиком.
Организм человека, собаки и свиньи не в состоянии синтезировать никотиновую кислоту в количествах, необходимых для покрытия потребности в ней организма, и поэтому постоянно нуждается в получении ее с пищей. Некоторые млекопитающие, например крыса, лошадь, корова и овца, могут синтезировать никотиновую кислоту.
Источником никотиновой кислоты является триптофан. Начиная с 1945 г. в ряде работ описаны отдельные этапы синтеза никотиновой кислоты из триптофана у млекопитающих.Существуют два пути эндогенного синтеза ниацина в организме животных: микробный синтез в кишечнике и биосинтез в тканях. Основное превращение L-триптофана идет по пути расщепления триптофан-пирролазой его пиррольного кольца с образованием формил-кинуренина, из которого образуются кинуренин и 3-оксикинуренин, являющиеся одними из главных продуктов диссимиляции триптофана в организме. 3-оксикинуренин далее превращается в 3-оксиантраниловую кислоту. После включения двух атомов кислорода образуются 2-акролеил-З-аминофумаровая кислота и хинолиновая кислота, являющаяся предшественником никотиновой кислоты. В результате ряда промежуточных реакций у всеядных животных и человека образуются никотиновая кислота и Nl-метилникотинамид.
При сбалансированном питании лишь незначительная часть триптофана выделяется из организма животных и человека с мочой в виде специфических продуктов его распада. При нагрузках триптофаном с мочой выделяются в значительных количествах такие продукты его обмена, как кинуренин, 3-оксикинуренин, кинуреновая и ксантуреновая кислоты. Участие витамина B6 в обмене триптофана у млекопитающих предполагалось в связи с обнаружением в моче при недостаточности витамина B6 ксантуреновой кислоты — одного из продуктов обмена триптофана. Кроме того, ряд авторов наблюдали при недостаточности витамина B6 у животных снижение концентрации НАД и НАДФ в эритроцитах крови и снижение выделения Nl-метилникотинамида с мочой.
Оказалось, что производное витамина В6 — пиридоксальфосфат является ко-ферментом кинурениназы, участвующим в гидролитическом расщеплении кинуренина и 3-оксикинуренина. Нарушение кинурениназной реакции при недостаточности витамина В6 приводит к нарушению синтеза 3-оксиантраниловой кислоты и снижению образования никотиновой кислоты.
Никотиновая кислота, поступающая в организм человека и всеядных и плотоядных животных, переходит в никотинамид и затем метилируется в Nl-метилникотинамид, который частично окисляется в Nl-метил-2-пиридон-5-карбоксамид. От 40 до 50% принятой никотиновой кислоты выделяется в этой форме. У травоядных животных никотиновая кислота не переходит в амид и выделяется с мочой в свободном или связанном виде, а находящийся в пище этих животных никотинамид выделяется в виде никотиновой или никотинуровой кислот. Метилирование никотинамида происходит путем присоединения метильной группы к азоту пиридинового кольца. Nl-метилникотинамид имеет адсорбционный максимум в ультрафиолетовых лучах 264,5 нм. Nl-метилникотинамид 6-пиридон — 260 и 290 нм.
Подсчет выделения с мочой метаболитов никотиновой кислоты у людей, получавших различные количества витамина РР и триптофана, показал, что в среднем от 55 до 60 мг триптофана, содержащегося в пище, эквивалентны 1 мг никотиновой кислоты.
Horwitt предложил называть 1 мг никотиновой кислоты, или 60 мг трип-тофана «ниациновым эквивалентом». Таким образом, в никотиновую кислоту превращается от 1,9 до 5% (в среднем 3,3%) триптофана.
Участие витамина РР в обмене веществ
Никотиновая кислота и никотинамид являются веществами, необходимыми для жизнедеятельности всех животных и растительных клеток. Они входят в состав коферментов НАД и НАДФ и вместе с апоферментами катализируют окислительно-восстановительные реакции клеточного обмена. Эта роль никотиновой кислоты установлена еще до того, как было открыто ее значение в качестве витамина PP. НАД был обнаружен еще в 1905 г., в 1933 г. было установлено его адениннуклеотидное строение, а в 1936 г. НАД в чистом виде был выделен из пивных дрожжей. Он представляет собой белый аморфный порошок, слабо растворимый в феноле и метаноле с соляной кислотой. В ультрафиолетовых лучах он имеет абсорбционный спектр 260 и 340 нм.
НАД представляет собой динуклеотид, состоящий из никотинамида, двух молекул рибозы, двух молекул фосфорной кислоты и аденина. НАДФ имеет сходное с НАД свойство взаимодействовать с водородом и тот же абсорбционный спектр. Он содержит одну молекулу никотинамида, две молекулы рибозы, одну молекулу аденина и три молекулы фосфорной кислоты, отличаясь от НАД наличием одного остатка фосфорной кислоты во втором положении аденозина.
НАД и НАДФ находятся во всех клетках организма животных и растений. Для примера представлена таблица их содержания в тканях крыс.
| НАД+ | НАДФ+ | |||
| над-н2 | НАДФ-Н2 | |||
| Ткани | в ммолях на | НАД-Н в % | в ммолях | НАДФ-Н2 в % |
| 1 кг сырого веса | на 1 кг сырого веса | |||
| Печень | 0,86 | 36 | 0,28 | 97 |
| Сердце | 0,72 | 38 | 0,049 | 95 |
| Почки | 0,66 | 48 | 0,077 | 95 |
| Диафрагма | 0,65 | 32 | 0,018 | 100 |
| Эритроциты | 0,14 | 40 | 0,011 | 40 |
Потребность человека и животных в витамине РР
Мы видим, что НАД находится в тканях в гораздо больших количествах, чем НАДФ. По их содержанию в тканях можно судить об интенсивности участия этих коферментов в обмене веществ. В клетках отношение НАД/НАД-Н2 выше отношения НАДФ/НАДФ-Н2. НАД и НАДФ в клетках, если исходить из расчета ферментативной активности всего гомогената, содержатся в большем количестве в ядре, где происходит их синтез, и в меньшем количестве — в митохондриях и микросомах Фермент НАД-пирофосфорилаза входит в состав ферментов клеточного ядра, НАД-Н-цитохром С-редуктаза и НАДФ-Н-цитохром С-редуктаза — в состав ферментов собственно ядерной оболочки, НАД-Н-дегидрогеназа, НАД-Н-цитохром С-редуктаза, НАД-Н-цитохром В5-редуктаза, НАД-Н-оксидаза и НАД- и НАДФ-изоцитратдегидрогеназа — в состав ферментов митохондрий, НАД-Н-цитохром С-редуктаза, НАД-Н2-оксидаза, НАДФ-Н2-цитохром С-редуктаза — в состав ферментов зндоплазматического ретикулума. Таким образом, НАД и НАДФ участвуют в качестве коферментов в ряде весьма важных ферментных систем обмена веществ в организме человека и животных. Однако благодаря структурным особенностям белковых компонентов дегидрогеназ связь коферментов НАД и НАДФ с этими ферментами менее прочная, чем других содержащих витамины ферментов. Вследствие этого НАД и НАДФ могут принять участие во многих реакциях окисления и восстановления, мигрируя от одного апофермента к другому.
Нуклеотиды НАД и НАДФ, содержащие в качестве каталитически активной группировки амид никотиновой кислоты, относятся к наиболее универсальным по распространению и биологической роли коферментам.
Одним из наиболее характерных физических свойств никотинамидных коферментов является наличие у восстановленных форм (НАД-Н2 и НАДФ-Н2) полосы поглощения в ультрафиолетовом свете с максимумом при 340 нм. Возбуждение НАДФ-Н2 излучением с этой длиной волны приводит к появлению флуоресценции с максимумом при 480 нм.
Спектрофотометрические и спектрофлуориметрические методы, основанные на этих свойствах, применяются для аналитического определения никотинамидных коферментов, а также для измерения активности связанных с ними дегидрогеназ.
При участии никотинамидных коферментов специфические дегидрогеназы катализируют обратимые реакции дегидрирования спиртов, оксикислот и некоторых аминокислот в соответствующие альдегиды, кетоны и кетокислоты. В настоящее время выделены и изучены свойства большого количества ферментов, содержащих в качестве кофермента никотинамид.
Важнейшие из этих ферментов следующие:
1. Алкогольдегидрогеназы (КФ 1.1.1 —2).
R-CH2—ОН+НАД (или НАДФ) — R-СНО + НАД-Н (или НАДФ-Н) + Н+
2. Альдегиддегидрогеназы (КФ 1.2.1.3—5)
R-CHO+Н2О+НАД (или НАДФ)—-R-COOH+НАД-Н (или НАДФ-Н) + Н+
3. Глюкозо-дегидрогеназа (КФ 1.1.1.47).
D-глюкоза + НАД(или НАДФ) —дельта-лактон-D-глюконовой кислоты + НАД-Н (или НАДФ-Н) + Н+
4. Дегидрогеназа D-глюкозо-б-фосфата (КФ 1.1.1.49)
D-глюкозо-б-фосфат+НАДФ——дельта-лактон-6-фосфат D-глюконовой кислоты + НАДФ-Н + Н+
5. Дегидрогеназа L-глютаминовой кислоты (КФ 1.4.1.2—4)
L-глютаминовая кислота + НАД (или НАДФ) + Н2О—— альфа-кетоглютаровая кислота + NH+ + НАД-Н (или НАДФ-Н)
6. Дегидрогеназа L-глицеро-З-фосфата (КФ 1.1.1.8)
L-глицеро-З-фосфат + НАД — диоксиацетонфосфат + НАД-Н + Н+
7. Дегидрогеназа молочной и яблочной кислот (КФ 1.1.1.27—28; 1.1.1.37—40)
R-CHOH—СООН + НАДФ—— R—СО—СООН + НАДФ-Н + Н+
Наиболее важная биологическая функция никотинамидных коферментов состоит в их участии в переносе электронов и водорода от окисляющихся субстратов к кислороду в процессе клеточного дыхания. Молекулы НАД и НАДФ в окисленной форме обладают выраженными свойствами акцепторов независимо от того, получены ли они путем биосинтеза или химическим путем. Можно сделать вывод, что в основе механизма химического действия этих коферментов лежит высокое сродство никотинамида к электрону. На основе квантовой механики это определяется его низшей свободной молекулярной орбитой. В окисленных формах НАД и НАДФ являются сильными акцепторами электронов. Так как их высшая заполненная орбита расположена низко, они являются слабыми донаторами электронов. Для восстановленных форм НАД и НАДФ энергии орбит имеют обратное соотношение, поэтому коферменты в окисленной форме проявляют тенденцию к захвату электронов, а в восстановленной форме — к их отдаче. Это мы видим на примере целого ряда соединений, в образовании которых участвует НАД.
Таким образом, коферментные функции НАД и НАДФ проявляются главным образом в окислительно-восстановительных реакциях, в обратимом присоединении атома водорода. Главная функция коферментов выражается в обратимом превращении пиридинового кольца в 1,4-дигидропиридиновое.
При гидрировании пиридинового кольца меняется его световое поглощение. Дигидропиридиновая система обладает абсорбционным максимумом при 340 нм, а пиридиновая почти не имеет абсорбции в этой области. В процессах дегидрирования, которые катализируются никотинамидными коферментами, субстрат отдает два атома водорода (2Н или 2Н+ + 2е), но присоединяется к молекуле кофермента лишь один атом Н (в четвертом положении пиридинового цикла), а второй атом Н отдает коферменту электрон и превращается в Н+ (протон). Установлено, что передача атома Н от субстрата к НАДФ происходит непосредственно и стереоспецифично для данного фермента, всегда в одну сторону плоскости пиридинового ядра НАДФ. В зависимости от направления присоединения атома водорода все дегидрогеназы, содержащие НАД, разделяются на два типа — А и В.
К типу А относятся дегидрогеназы спиртов, L-лактата, L-малата, D-глицерата, ацетальдегида и др., тогда как к типу В — дегидрогеназы L-глутамата, D-глюкозы, D-глицеро-З-фосфата, D-глицеральдегид-З-фосфата, бета-оксистероидов и др. Примером поэтапного включения в ход ферментативных реакций НАД, НАД-Н2, НАДФ и НАДФ-Н2 является цикл лимонной кислоты Кребса. Этот цикл служит центром скрещивания всех важных метаболических реакций, в которых принимают участие никотинамидадениндинуклеотиды.
В некоторых ферментативных реакциях, например в реакции анаэробного распада глюкозы, имеются 2 фермента — лактат-дегидрогеназа .и фос-фоглицеринальдегид-дегидрогеназа, которые соединяются системой НАД-НАД-Н2. Реакция эта обратима и ее направление определяется коэффициентом НАД/НАД -Н2 и концентрацией веществ в реакции.
Особой группой ферментов являются трансгидрогеназы, катализирующие реакции между НАД и НАДФ-Н2 в направлении дигидрирования НАДФ-Н2 за счет НАД.
С помощью специфической дегидрогеназы, коферментом которой служит НАДФ, осуществляется превращение фолиевой кислоты в тетрагидрофолиевую кислоту (см. раздел «Фолиевая кислота»).
Особым вопросом является структура молекулы НАД-Н, которая представляет собой дигидропиридин, имеющий два основных типа, содержащих алкильную группу в положении 1: 1-алкил-1,2-дигидропиридины и 1-алкил-1,4-дигидропиридины.
Наибольшее биологическое значение имеют дигидропиридины, содержащие в 3-м положении карбамидную группу. Эти соединения имеют три изомера: 1,2, 1,4 и 1,6.
Проявление недостаточности ВИТАМИНА РР
Минимальное суточное содержание никотиновой кислоты в пищевых рационах, включающих кукурузу, должно быть около 7,5 мг. Наряду с этим имеет значение то, что кукуруза большую часть никотиновой кислоты содержит в неусвояемом виде и бедна триптофаном, являющимся предшественником никотиновой кислоты (см. выше). Со времени этого открытия в изучение обмена и потребности в никотиновой кислоте должно быть также включено и потребление триптофана как потенциального ее источника.
Во многих странах заболеваемость пеллагрой связана с преимущественным питанием кукурузой. Однако питание, в котором преобладают другие злаки, бедные никотиновой кислотой и триптофаном, так же приводит к явлениям недостаточности никотиновой кислоты. Связанная форма никотиновой кислоты содержится в злаках, но не обнаружена в бобовых продуктах и в продуктах животного происхождения. Она должна быть принята во внимание при оценке пищевых рационов в отношении никотиновой кислоты и составлении норм суточной потребности в никотиновой кислоте.
В Мексике и Центральной Америке из кукурузы готовят лепешки «тортилла». При их приготовлении кукурузу обрабатывают известью, что освобождает связанную форму никотиновой кислоты и делает ее усвояемой организмом. Варка кукурузы не освобождает связанной формы никотиновой кислоты. Очевидно, этим объясняется низкая заболеваемость пеллагрой населения указанных районов. Имеются и другие продукты, содержащие усвояемую никотиновую кислоту и обладающие противопеллагрической активностью, например стручковые овощи, некоторые напитки и среди них прежде всего кофе. Как уже указывалось, из триптофана в организме образуется никотиновая кислота, причем триптофан обладает не только профилактическим, но и лечебным действием при пеллагре .
Для более точного учета противопеллагрической активности триптофана он был .назван ниациновым эквивалентом. Таким образом, ниациновый эквивалент представляет собой 1 мг никотиновой кислоты или 60 мг триптофана. Содержание ниациновых эквивалентов в некоторых пищевых продуктах представлено в таблице.
| Продукты | Ниацин 1 в мг на 1000 ккал | Триптофан в мг на 1000 ккал | Ниациновые эквиваленты на 1000 ккал | Ниациновые эквиваленты, исправленные для связанного ниацина на 1000 ккал |
| Коровье молоко | 1,2 | 673 | 12,4 | 12,4 |
| Женское молоко | 2,5 | 443 | 9,8 | 9,8 |
| Говядина | 24,7 | 1280 | 46,0 | 46,0 |
| Яйца цельные | 0,6 | 1150 | 19,8 | 19,8 |
| Соленая свинина | 1,2 | 61 | 2,2 | 2,2 |
| Пшеничная мука | 2,5 | 297 | 7,4 | 5,0 |
| Кукурузная крупа | 1,8 | 70 | 3,0 | 1,2 |
| Кукуруза | 5,0 | 106 | 6,7 | 1,7 |
1 Величины для пшеничной муки, кукурузной крупы и кукурузы представляют собой количества связанного ниацина, который, как было показано, не усваивается. Поэтому ниациновые эквиваленты, исправленные в отношении содержания связанного ниацина, значительно снижены (графа 4).
В таблице показано содержание ниацина, триптофана, ниациновых эквивалентов и ниациновых эквивалентов, исправленных для связанной формы ниацина (ниацитина), из расчета на 1000 ккал в наиболее распространенных пищевых продуктах (молоко, мясо, яйца, пшеница и кукуруза). Такие продукты, как пшеничная мука, кукурузная мука, рисовые и ячменные отруби, имеют довольно высокое содержание ниацина, однако почти весь он находится в связанной, неусвояемой форме. Поэтому количества ниациновых эквивалентов, уточненных в отношении связанного ниацина для этих продуктов, естественно снижаются.
Большинство пищевых рационов в США содержит от 500 до 1000 мг или больше триптофана в день и от 8 до 17 мг преформированного ниацина с общим количеством ниациновых эквивалентов от 16 до 38 мг. Группой экспертов ФАО/ВОЗ в Риме в 1965 г. было принято, что 5,5 мг ниациновых эквивалентов на 1000 ккал представляют собой соотношение, на основании которого может быть рекомендовано суточное потребление никотиновой кислоты. При этом соотношении ни у одного из наблюдаемых лиц не обнаружено клинических явлений пеллагры, а у некоторых даже отмечалось повышение выделения с мочой метаболитов никотиновой кислоты. Добавление к этому соотношению 20%, обеспечивающих индивидуальные вариации, дает рекомендуемое потребление никотиновой кислоты 6,6 мг на 1000 ккал в сутки.
При беременности выделение Nl-метилникотинамида с мочой повышается приблизительно на 40% с III до VI—IX месяца беременности и возвращается к норме через 2 месяца после родов, поэтому национальный исследовательский совет США рекомендует повышение ниациновых эквивалентов на 3 мг в день в течение 3—6 и 6—9 месяцев беременности в соответствии с повышением потребления калорий. Для периода кормления рекомендуется дополнительно 7 мг ниациновых эквивалентов. Женское молоко содержит в среднем 0,17 мг ниацина и 22 мг триптофана в 100 мл — примерно 0,5 мг ниациновых эквивалентов. В отношении питания детей, у которых 15% калорийности обеспечивалось казеином молока, общее содержание никотиновой кислоты в рационе составляло 6 мг, а при питании, в котором 10% калорийности было за счет казеина,— 4 мг.
Грудному ребенку весом 6 кг, получающему с материнским молоком 2 г белка на 1 кг веса, такое вскармливание обеспечивает 200 мг триптофана. Получаемое ребенком молоко содержит 3,3 мг никотиновой кислоты и 1,7 мг — за счет триптофана (всего 5 мг никотиновой кислоты). Для детей с момента рождения до 6 месяцев кормление грудью хорошо питающейся матери достаточно для удовлетворения потребности в ниациновых эквивалентах.
Вскармливаемый грудью ребенок, получающий 850 мл молока калорийностью 600 калорий, потребляет примерно 4,5 мг ниациновых эквивалентов в день. Все это указывает, что рекомендуемое потребление 6,6 мг ниациновых эквивалентов на 1000 ккал может быть принято для детей в возрасте от 6 месяцев и старше.
Установлена необходимость никотиновой кислоты не только для профилактики пеллагры, но и для регулирующего воздействия на высшую нервную деятельность. Головной мозг содержит наибольшее количество НАД, что говорит о важной роли коферментных соединений никотиновой кислоты для обеспечения нормальной деятельности центральной нервной системы. Правильное соотношение процессов возбуждения и торможения в коре больших полушарий и, особенно, прочность процесса внутреннего торможения, в значительной степени определяющего поведение человека, очень важны при адаптации организма человека к различным стрессовым ситуациям. Достаточно высокое содержание ниациновых эквивалентов должно быть обеспечено в питании лиц, работающих в условиях повышенного нервно-психического напряжения (члены летных экипажей, телефонистки, работники на пультах дистанционных управлений и т. д.).
Степень физической нагрузки также, по-видимому, может влиять на потребность в никотиновой кислоте. Например, одной из причин развития пеллагры в период Великой Отечественной войны при прочих условиях считали сильное переутомление. Обмен ряда витаминов, в том числе никотиновой кислоты, претерпевает значительные изменения в процессе старения организма. У старых животных, а также у людей пожилого и особенно старческого возраста наблюдается снижение обеспеченности организма никотиновой кислотой с уменьшением выделения Nl-метилникотинамида с мочой. Это связывают с развитием эндогенного полигиповитаминоза, одной из важных причин которого является возрастное понижение активности ферментных систем организма. Среди эндогенных факторов потребность в ниациновых эквивалентах значительно повышают заболевания желудочно-кишечного тракта, в особенности с поносами, различные инфекции, главным образом дизентерия и инфекционный гепатит, тифы, нервные и психические заболевания, особенно шизофрения, а также различные интоксикации.
Потребность в ниациновых эквивалентах увеличивается при приеме различных медикаментов, таких, как сульфаниламидные препараты, антибиотики, препараты изоникотиновой кислоты (фтивазид, тубазид), представляющие собой антагонисты никотиновой кислоты. Об этом следует помнить при построении пищевых рационов в соответствующих лечебных и профилактических учреждениях.
Как известно, никотиновая кислота наиболее устойчива из всех витаминов. Она весьма стойка при хранении и обычных методах консервирования. Потери ее при кулинарной обработке не превышают 15— 20%. Триптофан также очень стоек в отношении обычных методов тепловой обработки, применяемой в питании.
Для установления обеспеченности человека никотиновой кислотой или ниацинового статуса необходим выбор соответствующих показателей. К числу наиболее специфических показателей относится определение выделения ее метаболита — метилированного амида никотиновой кислоты с суточной мочой. Оно составляет от 7 до 12 мг. Наблюдения показали известный параллелизм экскреции с мочой Nl-метилникотинамида и содержания никотиновой кислоты в крови.
К специфическим методам относится также определение никотиновой кислоты в цельной крови (в среднем 0,4 мг%), а также определение коферментных форм никотиновой кислоты (НАД и НАДФ) в эритроцитах (в среднем от 60 до 80 мкг в 1 мл). Однако определение коферментных форм выявляет сравнительно поздние стадии недостаточности никотиновой кислоты в организме. Объективной реакцией для распознавания недостаточности никотиновой кислоты являются также определение содержания свободного триптофана в плазме крови. Содержание в плазме триптофана натощак колеблется у здоровых от 0,65 до 0,88 мг в 100 мл, а у больных пеллагрой — от 0,10 до 0,30 мг в 100 мл .
Автор статьи: доцент кафедры биохимии МБФ РГМУ, к.м.н. Адрианов Николай Владимирович.
Специально для ООО «Электронная Медицина».
Источник