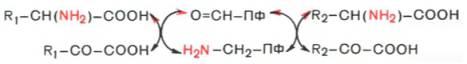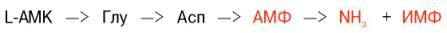Кофакторы ферментов: ионы металлов и коферменты. Коферментные функции витаминов, (на примере трансаминаз и дегидрогеназ, витаминов В6 , РР, В2)
Кофакторы ферментов: ионы металлов и коферменты.
Активность ряда ферментов (простые белки) в норме зависит только от их структуры, тогда как для других, названных холоферментами (сложные белки), требуются кофакторы — вещества небелковой природы, в роли которых могут быть сложные органические соединения (коферменты) и ионы металлов.
Кофактор может образовывать с апоферментом прочные ковалентные связи. В этом случае кофермент называют простетической группой фермента. Примерами могут служить ФАД, ФМН, биотин, ковалентно связанный с остатком лизина в активном центре, Zn 2+ , который содержится в активном центре карбоксипептидазы. В том случае, если кофермент связывается с апоферментом нековалентными связями только на время химической реакции (НАД + и НАДФ + ), он может рассматриваться в качестве второго субстрата данного фермента Один и тот же кофермент может участвовать в разных биохимических реакциях, комплементарно связываясь с разными апоферментами. Собственной каталитической активностью коферменты не обладают.
Апофермент формирует активный центр, отвечает за специфичность действия фермента, фиксирует и ориентирует субстрат в активном центре и создает условия для преобразования субстрата в продукты реакции. Ионы металла выполняют две главные функции.
I). Стабилизируют нативную конформацию фермента, структуру его активного центра и субстрата. 2). Участвуют в ферментативном катализе.
1). Металлоферменты, лишенные ионов металла, либо сохраняют способность к химическому катализу, утрачивая стабильность, либо полностью теряют активность. Например, щелочная фосфатаза — металлофермент, в активном центре которого находится Zn 2+ , лишенная ионов цинка щелочная фосфатаза, теряет ферментативную активность, но восстанавливает ее после добавления металла. В некоторых металлоферментах ион металла (Mg 2+ , Mn 2+ , Zn 2+ , Co 2+ , Мо 2+ ) участвует в образовании связи между молекулой субстрата и активным центром кофермента. в отсутствие иона эти ферменты не обладают активностью. Ряд ферментов в качестве субстрата используют комплекс превращаемого вещества с ионом. Для большинства киназ одним из субстратов служит не молекула АТФ, а комплекс Mg 2+ -ATФ.
2). Ферментативный электрофильный катализ. Ионы металла непосредственно участвуют в катализе и локализованы в активном центре фермента.В активном центре ферментов могут содержатся Zn 2+ , Mn 2+ , Fe 2+ , Си 2+ . Пример элек-трофильного катализа — действие карбоангидразы, содержащей ион цинка в активном центре.
B6 Коферментные функции выполняют два фосфорилированных производных пиридоксина: пиридоксальфосфат и пиридоксаминофосфат. Распад коферментов идет путем дефосфорилирования и окисления с образованием 4-пиридоксиловой кислоты. которая выводится из организма.
Коферментные формы витамина В6 включены в реакции, катализируемые почти всеми классами ферментов. Наиболее значительная группа пиридоксалевых ферментов — аминотрансферазы. Пиридоксальзависимые (пиридоксалевые ферменты) ферменты катализируют взаимопревращения и распад аминокислот (регулируют аминокислотный состав крови при разном аминокислотном составе пиши), участвуют в специфических реакциях метаболизма отдельных аминокислот (серина, треонина, триптофана). Участвуют в обмене липидов, синтезе сфинголипидов. В качестве кофактора ферментов участвуют в начальных стадиях синтеза гема. Влияют на обмен жирных кислот.
PP — предшественник коферментов -никотинамидадениндинуклеотида (НАД + ) и никотинамидадениндинуклеотид-фосфата (НАДФ ), входящих в состав дегидрогеназ и редуктаз.
НАД + и НАДФ + приобретают коферментные функции после присоединения к никотинамиду радикала, включающего остаток рибозы, пирофосфат и нуклеотид — аденин. Витамин РР такими функциями не обладает.
1. НАД + — кофермент дегидрогеназ, участвующих в реакциях окисления глюкозы, жирных кислот, глицерола, аминокислот после их дезаминирования; является коферментом дегидрогеназ цикла Кребса (кроме сукцинатдегидрогеназы). В этих реакциях кофермент выполняет функцию промежуточного акцептора электронов и протонов.
2. НАДН и НАДФН — коферменты реакций (НАДН-оксидазной и НАДФН-оксидазной), способствующих возникновению активных форм кислорода в фагоцитах.
B2 Кофермент ФМН и ФАД
1. ФМН и ФАД — коферменты оксидаз, переносящих электроны с окисляемого субстрата на кислород. Это ферменты распада аминокислот (оксидазы D- и L-аминокислот), нуклеотидов (ксантиноксидаза), биогенных аминов (моно- и диа-минооксидазы).
2. ФАД — кофермент пируват- и альфа-кетоглутаратдегидрогеназных комплексов. Совместно с тиаминпирофосфатом и другими коферментами катализируют окислительное декарбоксилирование кетокислот.
Источник
78. Трансаминирование: аминотрансферазы; коферментная функция витамина в6. Специфичность аминотрансфераз.
Из реакции переноса NH2 наиболее важны реакции трансаминирования . Они катализируются трансаминазами и участвуют в катаболических и анаболических процессах с участием аминокислот. При трансаминировании аминогруппа аминокислоты(аминокислота 1) переносится на 2-кетокислоту (кетокислота 2). Из аминокислоты при этом образуется 2-кетокислота (а), а из первоначальной кетокислоты — аминокислота (b). Переносимая NH2-группа временно присоединяется к связанному с ферментомпиридоксальфосфату , который вследствие этого переходит в пиридоксаминофосфат.
Механизм трансаминирования. В отсутствие субстратов альдегидная группа пиридоксальфосфата ковалентно связана с остатком лизина трансаминазы (1). Этот тип соединения, найденный также в родопсинах (см. с. 346), относится к альдиминам или шиффовым основаниям, во время реакции аминокислота 1 вытесняет остаток лизина и образуется новый альдимин (2). Затем за счет изомеризации происходит перемещение двойной связи. Полученный кетимин (3) гидролизуется до 2-кетокислоты и пиридоксаминфосфата (4). На второй частиреакции те же стадии протекают в противоположном направлении: пиридоксаминфосфат и вторая 2-кетокислота образуют кетимин, который иэомеризуется в альдимин. Наконец, отщепляется вторая аминокислота и регенерируется кофермент.
Аминотрансфера́зы (трансаминазы) — ферменты из группы трансфераз, переносящие аминогруппы без образования свободного аммиака. Аминотрансферазы также называют трансаминазами, а реакцию — трансаминированием.Для аминотрансфераз донором аминогрупп являются аминокислоты, а акцептором — кетокислоты:
AK1 + KK2 ↔ KK1 + AK2
В составе простетической группы аминотрансферазы содержат производные витамина B6. Во время переноса аминогруппы простетическая группа переходит из пиридоксаль-5-фосфатной формы в пиридосамино-5-фосфатную форму. Механизм реакции трансаминирования открыт в 1937 году советскими учеными А.Е. Браунштейном и М.Г.Крицман. Процесс протекает в две стадии. Альдегидная группа пиридоксальфостфата (-СНО) взаимодействует с аминогруппой аминокислоты с образованием иминной связи в основании Шиффа: сначала α-аминогруппа аминокислоты-донора замещает ε-аминогруппуапофермента, а затем происходит перегруппировка через кетимин и в результате гидролиза образуется пиридосамино-5-фосфат и α-кетокислота. Реакции повторяются в обратном порядке
Аминотрансферазы являются каталитически совершенными ферментами. Аминотрансферазы содержаться практически во всех органах, но наиболее активно реакции трансаминирования идут в печени. К этой группе ферментов относятся такие важные для клинической лабораторной диагностики ферменты, как АСТ и АЛТ.
Пиридоксальфосфат является простетической группой аминотранс-фераз, катализирующих обратимый перенос аминогруппы (NH2-группы) от аминокислот на α-кетокислоту, и декарбоксилаз аминокислот, осуществляющих необратимое отщепление СО2 от карбоксильной группы аминокислот с образованием биогенных аминов. Установлена кофер-ментная роль пиридоксальфосфата в ферментативных реакцияхнеокислительного дезаминирования серина и треонина, окисления триптофана, кинуренина, превращения серосодержащих аминокислот, взаимопревращения серина и глицина, а также в синтезе δ-аминолевулиновой кислоты, являющейсяпредшественником молекулы гема гемоглобина. В последние годы число вновь открытых пиридокса-левых ферментов быстро увеличивалось. Так, для действия гликогенфос-форилазы существенной оказалась фосфорильная, а не альдегидная группа пиридоксальфосфата. Вследствие широкого участия пиридоксальфосфата в процессах обмена при недостаточности витамина В6 отмечаются разнообразные нарушения метаболизма аминокислот.
79. Аминокислоты, участвующие в трансаминировании; особая роль глутаминовой кислоты. Биологическое значение реакций трансаминирования. Определение трансаминаз в сыворотке крови при инфаркте миокарда и болезнях печени.
Чрезвычайно широкое распространение трансаминаз в животных тканях, у микроорганизмов и растений, их высокая резистентность к физическим, химическим и биологическим воздействиям, абсолютная стереохимическая специфичность по отношению к L-аминокислотам, а также высокая каталитическая активность в процессах трансаминирования послужили предметом детального исследования роли этих ферментов в обмене аминокислот. Ранее было указано, что при физиологических значениях рН средыактивность оксидазы L-аминокислот резко снижена. Учитывая это обстоятельство, а также высокую скорость протекания реакциитрансами-нирования, А.Е. Браунштейн выдвинул гипотезу о возможности существования в животных тканях непрямого путидезаминирования аминокислот через реакции трансаминирования, названного им трансдезаминированием. Основой для выдвижения этой гипотезы послужили также данные Г. Эйлера о том, что в животных тканях из всех природных аминокислот с высокой скоростью дезаминируется только L-глутаминовая кислота в реакции, катализируемой высокоактивной и специфической глутамат-дегидрогеназой.
Согласно гипотезе, получившей экспериментальное подтверждение, все или почти все природные аминокислоты (исключение составляет метионин) сначала реагируют с α-кетоглутаровой кислотой в реакции трансами-нирования с образованием глутаминовой кислоты и соответствующей кетокислоты. Образовавшаяся глутаминовая кислота затем подвергается непосредственному окислительному дезаминированию под действием глу-таматдегидрогеназы. Суммарная реакция при этом следующая:
Поскольку обе реакции (трансаминирование и дезаминирование глу-таминовой кислоты) являются обратимыми, создаются условия для синтеза по существу любой аминокислоты, если в организме имеются соответствующие α-кетокислоты. Известно, что организмживотных и человека не наделен способностью синтеза углеродных скелетов (α-кетокислот), так называемых незаменимыхаминокислот; этой способностью обладают только растения и многие микроорганизмы. Механизм, при помощи которого в живых организмах осуществляется синтез природных аминокислот из α-кетокислот и аммиака, был назван А.Е. Браунштейном трансреаминированием. Сущность его сводится к восстановительному аминированию α-кетоглутаровойкислоты с образованием глутаминовой кислоты (реакцию катализирует НАДФ-зависимая глута-матдегидрогеназа, работающая в режиме синтеза) и к последующему трансаминированию глутамата с любой α-кетокислотой. В результате образуется L-аминокислота, соответствующая исходной кетокислоте, и вновь освобождается α-кетоглутаровая кислота, которая может акцептировать новуюмолекулу аммиака. Таким образом, трансаминазы катализируют опосредованное через глутаматдегидрогеназу дезаминирование природных аминокислот и биосинтез аминокислот .
Получены доказательства существования в организме теплокровных животных еще одного механизма непрямого (опосредованного) дезаминирования L-аминокислот, при котором Глу, Асп и АМФ выполняют роль системы переноса NН2-группы; гидролитическоедезаминирование АМФ приводит к образованию инозинмонофосфата (ИМФ) и аммиака:
Возможно, что в аналогичной системе в качестве промежуточного переносчика NH2-группы вместо АМФ участвует НАД.
Клиническое значение определения активности трансаминаз. Широкое распространение и высокая активность трансаминаз в органах и тканях человека, а также сравнительно низкие величины активности этих ферментов в крови послужили основанием для определения уровня ряда трансаминаз в сыворотке крови человека при органических и функциональных поражениях разных органов. Для клинических целей наибольшее значение имеют две трансаминазы – аспартат-аминотрансфераза (AcAT) и аланин-аминотрансфераза (АлАТ), катализирующие соответственно следующие обратимые реакции:
В сыворотке крови здоровых людей активность этих трансаминаз в тысячи раз ниже, чем в паренхиматозных органах. Поэтому органические поражения при острых и хронических заболеваниях, сопровождающиеся деструкцией клеток, приводят к выходу трансаминаз из очага поражения в кровь. Так, уже через 3–5 ч после развития инфаркта миокарда уровень АсАТ в сыворотке кровирезко повышается (в 20–30 раз). Максимум активности обеих трансаминаз крови приходится на конец первых суток, а уже через 2–3 дня при благоприятном исходе болезни уровень сывороточных трансаминаз возвращается к норме. Напротив, при затяжном процессе или наступлении повторного инфаркта миокарда наблюдается новый пик повышения активности этих ферментов в крови. Этим объясняется тот факт, что в клинике трансаминазный тест используется не только для постановки диагноза, но и для прогноза и проверки эффективности лечения . При поражениях клеток печени, например при гепатитах, также наблюдается гипертрансаминаземия (за счет преимущественного повышения уровня АлАТ), но она имеет более умеренный и затяжной характер, а повышение активноститрансаминазы в сыворотке крови происходит медленно. При различного рода коронарной недостаточности (стенокардия, пороки сердца и др., кроме инфаркта миокарда) гипертрансаминаземия или не наблюдается, или незначительна. Определение активноститрансаминаз в сыворотке крови при заболеваниях сердца следует отнести к дифференциально-диагностическим лабораторным тестам. Повышение уровня трансаминаз в сыворотке крови отмечено, кроме того, при некоторых заболеваниях мышц, в частности при обширных травмах, гангрене конечностей и прогрессивной мышечной дистрофии.
Источник
АМИНОТРАНСФЕРАЗЫ
АМИНОТРАНСФЕРАЗЫ (синоним трансаминазы; устаревшее название аминоферазы) — ферменты из класса трансфераз, катализирующие реакцию трансаминирования, то есть перенос аминогруппы (—NH2) и атома водорода от одной молекулы субстрата к другой; играют важную роль в азотистом обмене. Общая схема реакции:
Реакция протекает без промежуточного образования аммиака. Ферментативное трансаминирование было открыто в 1937 году А. Е. Браунштейном и М. Г. Крицман, которые показали, что препараты из грудной мышцы голубя катализируют обратимую реакцию образования глутаминовой кислоты (см.) и α-кетокислоты (см. Кетокислоты) из α-кетоглутарата и различных аминокислот.
Аминотрансферазы обнаружены во всех исследованных тканях растений и животных и в клетках микроорганизмов. Известно около 50 аминотрансферазы, которые действуют избирательно на природные α-аминокислоты и многие β-, γ- и δ-аминокислоты. Наиболее активные и самые распространенные аминотрансферазы используют глутаминовую и α-кетоглутаровую кислоты в качестве одной из донорно-акцепторных пар; остальные аминокислоты трансаминируются менее активными аминотрансферазами, обычно проявляющими групповую специфичность (см. Ферменты) к нескольким субстратам сходного строения, например к аминокислотам с разветвленной цепью или ароматическим аминокислотам. В органах высших животных (мышцы, сердце, печень) наиболее активны аспартат-кетоглутарат-аминотрапсферазы и аланин-кетоглутаратамино-трансферазы.
Все очищенные аминотрансферазы, выделенные из тканей животных, высших растений и многих микроорганизмов, стерео-специфичны. Они катализируют, как правило, трансаминирование аминокислот (см.) только L-ряда. Однако известны аминотрансферазы некоторых бактерий, которые действуют только на D-аминокислоты и не действуют на их L-изомеры.
Донорами аминогрупп служат не только α-аминокислоты. Так, в тканях животных и у микроорганизмов обнаружены аминотрансферазы, осуществляющие трансаминирование β-аланина, γ-аминомасляной и некоторых других аминокислот с α-кетоглутаровой (реже с пировиноградной) кислотой. Одним из основных путей метаболизма γ-аминомасляной кислоты в мозге является ее трансаминирование с α-кетоглутаратом, в результате чего образуется глутамат и янтарный полуальдегид (аналогичная реакция имеет место у бактерий). δ-Аминогруппа орнитина и аминолевулиновой кислоты также может переноситься аминотрасферазы на кетокислоты. Глутамин и аспарагин реагируют (при участии аминотрасферазы) с различными кетокислотами с образованием соответствующих аминокислот и амидов (см.) кетоглутаровой и щавелево-уксусной кислот.
За немногими исключениями аминотрасферазы имеют широкий рН-оптимум с максимумом в области 8—9. Коферментами аминотрасферазы являются производные витамина В6 — пиридоксальфосфат и пиридоксаминфосфат. Согласно теории А. Е. Браунштейна и М. М. Шемякина, аминокислоты реагируют с пиридоксальфосфатом (соединенным с белковой частью молекулы А.) с образованием промежуточных альдиминов пиридоксальфосфата (оснований Шиффа) и таутомерных им кетпмпнов пиридоксаминфосфата:
Образовавшийся таким образом кетимин затем гидролизуется с освобождением кетокислоты. соответствующей исходной аминокислоте, и пиридоксаминфосфата:
Далее пиридоксаминфосфат взаимодействует с другой кетокислотой, и все стадии реакции повторяются, протекая в обратном направлении. В результате образуется исходная форма протеида пиридоксальфосфата и новая аминокислота. Суммируя, получаем: фермент-пиридоксальфосфат + аминокислота1ферментпиридоксаминфосфат + кетокислота1 фермент-пиридоксаминфосфат + кетокислота2 фермент-пиридоксальфосфат + аминокислота2.
Спектральные исследования аминотрасферазы показали, что пиридоксальфосфат, связанный с белком,существует не в виде свободного альдегида, а в виде основания Шиффа (см. Шиффа основание).
Образование основания Шиффа между пиридоксальфосфатом и апоферментом объясняет тот факт, что пиридоксальфосфат труднее диссоциирует от аминотрасферазы, чем пиридоксаминфосфат.
Аминотрасферазы участвуют в следующих превращениях: образование аминокислот из кетокислот и обратное превращение (окислительный распад аминокислот); биосинтез γ-аминомасляной кислоты, мочевины, пуриновых и пиримидиновых оснований, порфиринов, флавинов, птеридинов, кобаламина.
Обратимое образование аланина, аспартата и глутамата из соответствующих кетокислот является важным звеном, непосредственно связывающим обмен углеводов с обменом аминокислот.
Аминотрасферазы играют основную роль в азотистом обмене (см.). Окислительное дезаминирование аминокислот (за исключением глутамата) в животном организме осуществляется через реакции трансаминирования с учетом ос-кетоглутаровой кислоты в качестве переносчика аминогрупп. Сначала аминокислоты трансаминируются с кетоглутаровой кислотой. Образующаяся при этом глутаминовая кислота дезаминируется под действием глутаматдегидрогеназы с образованием свободного аммиака и освобождением кетоглутаровой кислоты. Обратимость описанных реакций обеспечивает возможность синтеза аминокислот из аммиака и кетокислот путем непрямого аминирования последних. После перехода азота глутаминовой кислоты в аспарагиновую кислоту под действием аминотрасферазы азот аспартата используется в различных процессах биосинтеза, диссимилируется в других ферментативных превращениях до конечных азотистых продуктов (аммиак, мочевина, мочевая кислота). Определение активности аминотрасферазы в крови и других биологических жидкостях имеет определенное диагностическое значение. Так, содержание аминотрасферазы в плазме крови больных резко возрастает при некоторых патологических состояниях, в частности сопровождающихся деструктивными процессами в паренхиматозных органах. Так, например, содержание аминотрасферазы (и в первую очередь аспарат-кетоглутарат-аминотрансферазы) в плазме крови больного увеличивается многократно при инфаркте миокарда, достигая максимума на вторые и третьи сутки. Это позволяет проводить дифференциальный диагноз (в частности, от приступа стенокардии, при котором активность аминотрасферазы в плазме не повышается). Аналогичным образом при вирусном гепатите из пораженных клеток печени в плазму крови поступает большое количество аминотрасферазы, в особенности аланин-кетоглутарат-аминотрансферазы, чего не наблюдается при иных формах желтухи (например, обструкционной). При вирусном гепатите и других поражениях паренхимы печени определение аминотрасферазы в плазме крови имеет не только диагностическое, но и прогностическое значение.
Библиография: Молекулярные основы действия и торможения ферментов, Труды 5-го Международного биохим. конгресса, Симпозиум 4, М., 1962; Guirard В. М. а. Snell Е. Е. Vitamin B6 function in trans-amination and decarboxylation reactions, Cpmprehens. Biochem., v. 15, p. 138, 1964, bibliogr.
Источник