Витамин С (аскорбиновая кислота, антицинготный)
Источники
Свежие овощи и фрукты (по убыванию количества): шиповник, смородина, клюква, брусника, перец сладкий, укроп, капуста, земляника, клубника, апельсины, лимоны, малина.
Суточная потребность
- младенцы – 30-35 мг,
- дети от 1 до 10 лет – 35-50 мг
- подростки и взрослые – 50-100 мг.
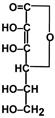
Строение
Витамин является производным глюкозы. Его синтез осуществляют все организмы, кроме приматов и морских свинок.
Строение
аскорбиновой кислоты
Биохимические функции
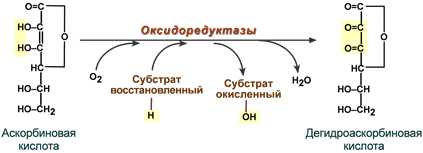
Витамин С не является коферментом в привычном понимании. Он используется как донор электронов, например, для восстановления ионов металлов (железо, медь), входящих в состав активного центра оксидоредуктаз, после осуществления ферментом своей реакции.
Окисление аскорбиновой кислоты в биохимической реакции
1. Реакции гидроксилирования :
Пример реакции с участием аскорбиновой кислоты
- при синтезе биогенного амина нейромедиатора серотонина,
- при синтезе карнитина (витаминоподобное вещество Вт), необходимого для окисления жирных кислот.
2. Восстановление неорганического иона железа Fe 3+ в ион Fe 2+ в кишечнике для улучшения всасывания и в крови (высвобождение из связи с трансферрином).
3. Участие в иммунных реакциях :
- повышает продукцию защитных белков нейтрофилов,
- высокие дозы витамина стимулируют бактерицидную активность и миграцию нейтрофилов.
4. Антиоксидантная роль сводится к:
- восстановлению окисленного витамина Е,
- лимитирование свободнорадикальных реакций благодаря взаимодействию с супероксид-анион-радикалом, гидроксил-радикалом, синглетным кислородом,
- снижает окисление липопротеинов в плазме крови и, таким образом, оказывает антиатерогенный эффект.
Гиповитаминоз С
Причина
Пищевая недостаточность, тепловая обработка пищи (потери от 50 до 80%), длительное хранение продуктов (каждые 2-3 месяца количество витамина сокращается наполовину).
В весенне-зимний период дефицит витамина захватывает, в зависимости от региона, 25-75% населения России.
Клиническая картина
Так как особенно интенсивно аскорбиновая кислота накапливается в надпочечниках и тимусе, то ряд симптомов связана со сниженной функцией этих органов. Отмечается нарушение иммунитета , особенно легочного, развивается общая слабость, быстрая утомляемость, похудание, одышка, боли в сердце, отек нижних конечностей. У мужчин происходит слипание сперматозоидов и возникает бесплодие .
Снижается всасываемость железа в кишечнике, что вызывает снижение синтеза гема и гемоглобина и железодефицитную анемию . Уменьшается активность фолиевой кислоты – это приводит к мегалобластической анемии .
У детей дефицит аскорбиновой кислоты приводит к болезни Меллера-Барлоу , проявляющуюся в поражении костей: разрастание и минерализация хряща, торможение рассасывания хряща, корытовидное западение грудины, искривление длинных трубчатых костей ног, выступающие четкообразные концы ребер. Цинготные четки, в отличие от рахитических, болезненны.
Полное отсутствие витамина приводит к цинге – самому известному проявлению недостаточности аскорбиновой кислоты. При этом наблюдается нарушение синтеза коллагена, гиалуроновой кислоты и хондроитинсульфата, что приводит к поражению соединительной ткани, ломкости и проницаемости капилляров и к ухудшению заживления ран. Сопровождается дегенерацией одонтобластов и остеобластов, ухудшается состояние зубов.
Все животные способны синтезировать витамин С самостоятельно, только приматы и морские свинки утратили эту способность и должны получать аскорбиновую кислоту с пищей.
Лекарственные формы
Аскорбиновая кислота чистая или с глюкозой. Аскорутин (в комплексе с биофлавоноидом рутином).
Источник
Пример химической реакции с участием кофермента витамин с
Большинство ферментов для проявления ферментативной активности нуждается в низкомолекулярных органических соединениях небелковой природы (коферментах) и/или в ионах металлов (кофакторах).
Термин «кофермент» был введён в начале XX века и обозначал часть некоторых ферментов, которая легко отделялась от белковой молекулы фермента и удалялась через полупроницаемую мембрану при диализе. Несколько позже было выяснено, что большинство ферментов состоит из термолабильной белковой части и термостабильного небелкового фактора — кофермента. Белковая часть получила название «апофермент», который в отсутствие кофермента не обладает каталитической активностью. Кофермент с белковой молекулой (апоферментом) формируют молекулу холофермента, обладающую каталитической активностью.
Более 25% всех ферментов для проявления полной каталитической активности нуждается в ионах металлов. Рассмотрим роль кофакторов в ферментативном катализе.
1. Роль металлов в присоединении субстрата в активном центре фермента
Ионы металла выполняют функцию стабилизаторов молекулы субстрата, активного центра фермента и конформации белковой молекулы фермента, а именно третичной и четвертичной структур.
Ионы металлов — стабилизаторы молекулы субстрата
Для некоторых ферментов субстратом служит комплекс превращаемого вещества с ионом металла. Например, для большинства киназ в качестве одного из субстратов выступает не молекула АТФ, а комплекс Mg 2+ -АТФ. В этом случае ион Мg 2+ не взаимодействует непосредственно с ферментом, а участвует в стабилизации молекулы АТФ и нейтрализации отрицательного заряда субстрата, что облегчает его присоединение к активному центру фермента (см. схему).
Схематично роль кофактора при взаимодействии фермента и субстрата можно представить, как комплекс Е-S-Ме, где Е — фермент, S — субстрат, Ме — ион металла.
В качестве примера можно привести расположение субстратов в активном центре гексокиназы (рис. 2-3).
Гексокиназа катализирует перенос концевого, y-фосфатного остатка молекулы АТФ на глюкозу с образованием глюкозо-6-фосфата:
Рис. 2-3. Участие ионов магния в присоединении субстрата в активном центре гексокиназы. В активном центре гексокиназы есть участки связывания для молекулы глюкозы и комплекса Мg 2+ -АТФ. В результате ферментативной реакции происходит перенос концевого, y-фосфатного остатка молекулы АТФ на глюкозу с образованием глюкозо-6-фосфата.
Ион Мg 2+ участвует в присоединении и «правильной» ориентации молекулы АТФ в активном центре фермента, ослабляя фосфоэфирную связь и облегчая перенос фосфата на глюкозу.
Ионы металла — стабилизаторы активного центра фермента
В некоторых случаях ионы металла служат «мостиком» между ферментом и субстратом. Они выполняют функцию стабилизаторов активного центра, облегчая присоединение к нему субстрата и протекание химической реакции. В ряде случаев ион металла может способствовать присоединению кофермента. Перечисленные выше функции выполняют такие металлы, как Мg 2+ , Мn 2+ , Zn 2+ , Со 2+ , Мо 2+ . В отсутствие металла эти ферменты активностью не обладают. Такие ферменты получили название «металлоэнзимы». Схематично данный процесс взаимодействия фермента, субстрата и металла можно представить следующим образом:
К металлоэнзимам относят, например, фермент пируват киназу (рис. 2-4), катализирующий реакцию:
Рис. 2-4. Участие ионов магния в присоединении субстрата в активном центре пируваткиназы. Активный центр пируваткиназы имеет участки связывания для фосфоеноппирувата и АДФ. Мg 2+ участвует в стабилизации активного центра, что облегчает присоединение фосфоеноппирувата. В ходе ферментативной реакции образуется пируват и АТФ.
2. Роль металлов в стабилизации третичной и четвертичной структуры фермента
Ионы металлов обеспечивают сохранение вторичной, третичной, четвертичной структуры молекулы фермента. Такие ферменты в отсутствие ионов металлов способны к химическому катализу, однако они нестабильны. Их активность снижается и даже полностью исчезает при небольших изменениях pH, температуры и других незначительных изменениях внешнего окружения. Таким образом, ионы металлов выполняют функцию стабилизаторов оптимальной конформации белковой молекулы.
Иногда в стабилизации вторичной и третичной структуры принимают участие ионы щёлочноземельных металлов. Так, для поддержания третичной конформации пируваткиназы необходимы ионы К + .
Для стабилизации четвертичной структуры алкогольдегидрогеназы, катализирующей реакцию окисления этанола, необходимы ионы цинка. Алкогольдегидрогеназа состоит из 4 субъединиц с молекулярной массой 151 кД. В состав фермента входят 4 атома Zn 2+ . Удаление Zn 2+ приводит к потере активности фермента за счёт диссоциации на 4 неактивные субъединицы с молекулярной массой 36 кД (рис. 2-5).
Рис. 2-5. Роль ионов цинка в стабилизации четвертичной структуры алкогольдегидрогеназы.
3. Роль металлов в ферментативном катализе
Не менее важную роль отводят ионам металлов в осуществлении ферментативного катализа.
Участие в электрофильном катализе
Наиболее часто эту функцию выполняют ионы металлов с переменной валентностью, имеющие свободную d-орбиталь и выступающие в качестве электрофилов. Это, в первую очередь, такие металлы, как Zn 2+ , Fе 2+ , Мn 2+ , Сu 2+ . Ионы щелочноземельных металлов, такие как Na + и К + , не обладают этим свойством. В качестве примера можно рассмотреть функционирование фермента карбоангидразы. Карбоангидраза — цинксодержащий фермент, катализирующий реакцию образования угольной кислоты:
Ион Zn 2+ в результате электрофильной атаки участвует в образовании Н + и ОН — ионов из молекулы воды:
Протон и гидроксильная группа последовательно присоединяются к диоксиду углерода с образованием угольной кислоты (см. схему А).
В ходе электрофильного катализа ионы металлов часто участвуют в стабилизации промежуточных соединений.
Участие в окислительно-восстановительных реакциях
Ионы металлов с переменной валентностью могут также участвовать в переносе электронов. Например, в цитохромах (гемсодержащих белках) ион железа способен присоединять и отдавать один электрон:
Благодаря этому свойству цитохромы участвуют в окислительно-восстановительных реакциях.
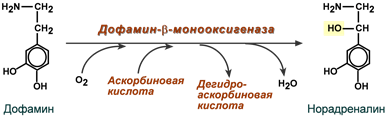
Другой пример участия ионов металлов в окислительно-восстановительных реакциях — работа фермента дофамингидроксилазы, катализирующего реакцию образования норадреналина при участии витамина С (см. схему Б).
За окислительно-восстановительные свойства у дофамингидроксилазы отвечает ион меди (рис. 2-6).
Рис. 2-6. Участие иона меди в активации молекулы кислорода при функционировании дофамингидроксилазы. 1 — восстановление Сu 2+ , входящего в состав активного центра дофамингидроксилазы, до Сu + с помощью аскорбиновой кислоты; 2 — взаимодействие Сu + с кислородом с образованием перекисного соединения; 3 — перенос гидроксильной группы на молекулу дофамина с образованием норадреналина.
Фермент, содержащий ион Сu 2+ , не вступает в реакцию с молекулой кислорода. При восстановлении Сu 2+ до Сu + с помощью аскорбиновой кислоты образуется ион меди, способный взаимодействовать с кислородом с образованием перекисного соединения. Далее гидроксильная группа переносится на молекулу дофамина с образованием норадреналина.
4. Роль металлов в регуляции активности ферментов
Иногда ионы металлов выступают в роли регуляторных молекул. Например, ионы Са 2+ служат активаторами фермента протеинкиназы С, катализирующего реакции фосфорилирования белков (см. раздел 5). Ионы Са 2+ также изменяют активность ряда кальций-кальмодулинзависимых ферментов (см. подраздел V).
Как уже было сказано, для проявления каталитической активности большинству ферментов необходимо наличие кофермента. Исключение составляют гидролитические ферменты (например, протеазы, липазы, рибонуклеаза), выполняющие свою функцию в отсутствие кофермента.
Кофермент, локализуясь в каталитическом участке активного центра, принимает непосредственное участие в химической реакции, выступая в качестве акцептора и донора химических группировок, атомов, электронов. Кофермент может быть связан с белковой частью молекулы ковалентными и нековалентными связями. В первом случае он называется простетической группой (например, FAD, FMN, биотин, липоевая кислота). Вместе с тем известны примеры, когда кофермент присоединяется к ферменту нековалентными связями настолько прочно, что не диссоциирует от белковой молекулы, например, тиаминдифосфат.
Во втором случае кофермент взаимодействует с ферментом только на время химической реакции и может рассматриваться в качестве второго субстрата. Примеры — NАD + , NАDР + .
Апофермент обеспечивает специфичность действия и отвечает за выбор типа химического превращения субстрата. Один и тот же кофермент, взаимодействуя с различными апоферментами, может участвовать в разных химических превращениях субстрата. Например, пиридоксальфосфат в зависимости от того, с каким апоферментом взаимодействует, участвует в реакциях трансаминирования или декарбоксилирования аминокислот.
Химическая природа коферментов, их функции в ферментативных реакциях чрезвычайно разнообразны. Традиционно к коферментам относят производные витаминов, хотя помимо них есть значительный класс небелковых соединений, принимающих участие в проявлении каталитической функции ферментов.
К коферментам относят следующие соединения:
• гемы, входящие в состав цитохромов, каталазы, пероксидазы, гуанилатциклазы, NO- синтазы и являющиеся простетической группой ферментов;
• нуклеотиды — доноры и акцепторы остатка фосфорной кислоты;
• убихинон, или кофермент Q, участвующий в переносе электронов и протонов в ЦПЭ;
• фосфоаденозилфосфосульфат, участвующий в переносе сульфата;
• S-аденозилметионин (SAM) — донор метальной группы;
• глутатион, участвующий в окислительновосстановительных реакциях.
Строение и функции этих коферментов подробно рассмотрены в соответствующих разделах учебника.
В. Мультисубстратные реакции
Большинство ферментов катализирует реакции, в которых участвует более чем один субстрат. В случае если кофермент не является простетической группой, его также можно рассматривать как ещё один субстрат. Следовательно, участников ферментативной реакции может быть несколько: непосредственно фермент, несколько субстратов и кофермент.
В этих случаях механизм ферментативной реакции, как правило, может идти по одному из двух путей: по механизму «пинг-понг» (механизму двойного замещения) или последовательному. Рассмотрим оба механизма.
1. Механизм «пинг-понг»
Схематично механизм «пинг-понг» может быть представлен следующим образом:
Субстрат А, взаимодействуя с ферментом (Е), превращается в продукт (Р1). Фермент остаётся в результате этого преобразования не в нативной форме, а в изменённой (Е’) в результате модификации кофермента. Далее к активному центру Е’ присоединяется субстрат В, подвергающийся преобразованию в продукт (Р2) с высвобождением нативной формы фермента (Е).
Хороший пример механизма «пинг-понг» — реакции трансаминирования с участием ферментов аминотрансфераз (кофермент пиридоксальфосфат). Аминотрансферазы, открытые отечественным учёным А. Е. Браунштейном, катализируют обратимые реакции переноса аминогруппы с аминокислоты на кетокислоту. Механизм «пинг-понг» данной реакции схематично представлен на рис. 2-7.
Рис. 2-7. События в активном центре аминотрансферазы как пример механизма «пинг-понг». Кофермент пиридоксальфосфат (ПФ), связанный с ферментом, принимает α-аминогруппу от первой аминокислоты (АК1) которая при этом превращается в α-кетокислоту 1 (КК1) и высвобождается из активного центра фермента. Далее в активный центр фермента присоединяется α-кетокислота 2 (КК2), которая забирает аминогруппу от кофермента и превращается в α-аминокислоту (АК2).
Другой пример механизма «пинг-понг» — реакции дегидрирования с участием кофермента FAD (флавинадениндинуклеотид) или FMN (флавинмононуклеотид), которые прочно связаны с ферментом и, следовательно, не могут рассматриваться в качестве второго субстрата.
Схематично структура этих коферментов и соответствующие им химические формулы представлены на рис. 2-8.
Рис. 2-8. Структура (А) и химическое строение (Б) коферментов FMN и FAD.
FMN и FAD участвуют в окислительно-восстановительных реакциях, акцептируя 2 е — и 2 Н+ в изоаллаксазиновом кольце (см. схему ниже).
Схему реакции дегидрирования (как пример механизма «пинг-понг» с участием коферментов FMN и FAD) можно представить в следующем виде:
где АН2 — донор водорода, окисляемый субстрат 1; А — окисленная форма субстрата 1; В — акцептор водорода — субстрат 2; ВН2 — восстановленная форма субстрата 2; Е (FAD), Е (FADH2) — окисленная и восстановленная формы кофермента FAD, входящего в состав фермента Е.
В качестве примера FAD-зависимой реакции можно привести сукцинатдегидрогеназную реакцию. В этой реакции в качестве второго субстрата участвует убихинон — один из посредников ЦПЭ (см. схему).
2. Последовательный механизм
В случае последовательного механизма для протекания ферментной реакции требуется одновременно взаимодействие двух субстратов. В этом случае возможно присоединение субстратов двумя различными путями:
Механизм упорядоченного взаимодействия субстрата с активным центром фермента:
Первым в активный центр фермента присоединяется субстрат А, облегчая присоединение субстрата В. После химической модификации также наблюдают определённый порядок высвобождения продуктов реакции.
Механизм случайного взаимодействия субстрата с активным центром фермента:
Приоритетности за взаимодействие субстратов А и В в активном центре фермента нет (каждый субстрат имеет свой центр связывания в активном центре). Также нет строгой закономерности высвобождения продуктов реакции.
Примером последовательного упорядоченного механизма может быть реакция дегидрирования с участием коферментов NАD + , NАDР + .
Схематично структура и химические формулы этих коферментов представлены на рис. 2-9.
Рис. 2-9. Структура (А) и химическое строение (Б) коферментов NAD + и NАDР + .
Оба кофермента функционируют как посредники переноса двух электронов и одного протона от донора к акцептору, другого протона — в среду (см. схему А).
Донор и акцептор не обязательно участвуют в одном метаболическом пути. Другими словами, восстановленная форма этих нуклеотидов действует как общий пул электронов, образованный в результате окислительных реакций, и может быть использована в различных восстановительных реакциях. Такие реакции называют сопряжёнными (см. схему Б).
где АН2 — донор водорода, восстановленная форма субстрата 1; А — окисленная форма субстрата 1; В — акцептор водорода — второй субстрат; ВН2 — восстановленная форма субстрата 2; NAD + , NADH — окисленная и восстановленная формы кофермента; Е1 и Е2 — ферменты.
Две ферментативные реакции, катализируемые ферментами Е1 и Е2, сопряжены друг с другом посредством кофермента NAD + , служащего в каждом из этих случаев субстратом. Для первого фермента субстратом служит окисленная форма NAD, в качестве второго субстрата выступает донор водорода — пример последовательных реакций, продуктом — восстановленная форма NAD, для фермента Е2 — наоборот.
В качестве примера можно рассмотреть следующие сопряжённые реакции (см. схему), где Е1 — глицеральдегидфосфат дегидрогеназа; Е2 — лактатдегцдрогеназа.
Источник