Витамины – как предшественники коферментов.
Биохимическая роль кофермента в катализе
Перенос протона и элетрона
Перенос Н+, входит в состав дыхат. фермента
Окисление декарбоксилирование кетокислот
Обмен веществ, активация витамина С, перенос CO2 декарбоксилирование
переносчик ацильных групп(CH3CO) кислотных остатков.
Перенос аминогрупп. Ок-ие аминокислот: отщепление аминогрупп и карбоксо-групп.
Вс (фолиевая к-та)
Перенос одноуглеродных групп, синтез пуриновых оснований
Витамины — (от лат. vita — жизнь), низкомолекулярные органические соединения различной химической природы, необходимые в незначительных количествах для нормального обмена веществ и жизнедеятельности живых организмов. Многие витамины — предшественники коферментов, в составе которых участвуют в различных ферментативных реакциях. Человек и животные не синтезируют витамины или синтезируют их в недостаточном количестве и поэтому должны получать витамины с пищей. Первоисточником витаминов обычно служат растения. Некоторые витамины образуются микрофлорой кишечника. Длительное употребление пищи, лишенной витаминов, вызывает заболевания (гипо- и авитаминозы). Многие витамины, используемые как лекарственные препараты, получают химическим или микробиологическим синтезом. Основные витамины: А1(ретинол), В1(тиамин), В2(рибофлавин), В3(пантотеновая кислота), В6(пиридоксин), В12(цианкобаламин), Вс(фолиевая кислота), С (аскорбиновая кислота), D (кальциферолы), Е (токоферолы), Н (биотин), РР (никотиновая кислота), К1(филлохинон).
По химическому строению и физико-химическим свойствам (в частности, по растворимости) витамины делят на 2 группы.
Жирорастворимые витамины: А, Д, Е, К, провитамин А (каротиноиды).
Водорастворимые витамины: В1, В2, В5, В6, В9, В12, С, Н, РР.
По физиологическому действию на человеческий организм классификация витаминов выглядит следующим образом:
антиоксиданты (витамины А, С, Е, каротиноиды);
прогормоны (витамин А и Д);
коферменты (витамины В6, В1, В2, РР, В5, В9, В12, витамин К, витамин Н).
Водорастворимые витамины при их избыточном поступлении в организм, будучи хорошо растворимыми в воде, быстро выводятся из организма.
Жирорастворимые витамины хорошо растворимы в жирах и легко накапливаются в организме при их избыточном поступлении с пищей. Их накопление в организме может вызвать расстройство обиена веществ, называемое гипервитаминозом, и даже гибель организма.
Номенклатура витаминов базируется на трех принципах :
1)По буквам латинского алфавита – А , B, C, D
2)По особенностям химического строения – тиамин, рибофлавин и др.
3)По болезни, развивающейся при отсутсвии данного витамина, с приставкой «анти» — антиневритный, антирахитный, антицинготный и др.
Источник
СУКЦИНАТДЕГИДРОГЕНАЗА
СУКЦИНАТДЕГИДРОГЕНАЗА [КФ 1. 3. 99. 1; сукцинат: (акцептор) оксидоредуктаза; син.: сукциндегидрогеназа (устар.) фумаратредуктаза] — фермент класса оксидоредуктаз и группы оксидоредуктаз, действующих на CH-CH-группу доноров; катализирует реакцию образования двойной связи в молекуле субстрата за счет прямого дегидрирования по простой углерод — углеродной связи. Биол. роль С. чрезвычайно велика, т. к. этот фермент катализирует одну из главных реакций цикла трикарбоновых к-т (см. Трикарбоновых кислот цикл), причем непосредственным акцептором электронов от восстановленной С. служит Ко Q10 (убихинон-10). Советским биохимикохм А. Д. Виноградовым было установлено, что компонентом митохондриальной мембраны, ответственным за реакцию С. с убихиноном, является особый полипептид с мол. весом (массой) ок. 13000. А. Г. Гинецинский и Ю. В. Наточин показали, что С. является одной из составных частей системы, обеспечивающей в аэробных условиях трансмембранный перенос ионов Na+ в почках и других осморегулирующих органах. Измерение активности С. в лимфоцитах пытаются использовать для оценки состояния трансплантационного иммунитета.
Биол. окисление янтарной к-ты (сукцината) было открыто в 1909 г. Тунбергом (Т. Thunberg). Фермент, катализирующий это окисление, сукцинатдегидрогеназа — широко распространен в животном и растительном мире. У человека и высших позвоночных животных С. наиболее богаты почки, печень и сердце. Установлено, что в клетках С. содержится лишь в митохондриях и локализована в их внутренней мембране. С. представляет собой белок с мол. весом ок. 70 000, его молекула содержит ковалентно связанный ФАД и два (Fe2S2)-центра. Этот белок тесно связан с другим белком (мол. вес ок. 27 000), имеющим (Fe4S4)-центр, но не содержащим флавина. Связь ФАД с белком в молекуле С. осуществляется за счет имидазольной группы остатка гистидина и 7-CH3-группы рибофлавина.
С. обладает практически абсолютной специфичностью, катализируя окисление сукцината в фумарат (анион фумаровой к-ты) в соответствии с уравнением:
В очень незначительной степени под действием С. окисляются монохлор- и монометилсукцинат. С. имеет четко выраженный оптимум действия между pH 7,0 и 8,0. Среди ингибиторов С. прежде всего следует упомянуть соединения, специфически связывающие SH-группы,— n-хлор-меркурибензоат, о-йодозобензоат, йодацетамид, малеиновую к-ту, ионы тяжелых металлов и др. Это свидетельствует о существенной роли SH-rpynn в обеспечении каталитической активности фермента. Одним из наиболее сильных ингибиторов С. является малонат, к-рый является классическим примером структурного аналога субстрата ферментативной реакции, выступающего как конкурентный ингибитор фермента. Анионы других двухосновных к-т (оксалоацетат, оксалат, глутарат) также подавляют активность С.
Из методов определения активности С. наиболее распространены фотометрические (см. Фотометрия), в к-рых в качестве акцептора водорода используют вещества, бесцветные в окисленной форме (напр., производные тетразолия) и дающие окрашенные продукты при восстановлении (формазаны). Эта реакция лежит и в основе гистохимического выявления С. Общеупотребителен метод, основанный на восстановлении 2,6-дихлорфенолиндофенола в присутствии феназинметасульфата с последующей фотометрией при 600 нм.
Библиография: Гавриков В. Г., Гаврикова Э. В. и Виноградов А.Д. Реконструкция сукцинат-убихинон-редук-тазного участка дыхательной цепи митохондрий, Биохимия, т. 45, в. 4, с. 747, 1980; Зеленцова О. А., Жаркова Т. Г. иВерболович В. П. Дегидрогеназы цитратного цикла лимфоцитов как показатель активности трансплантационного иммунитета, в кн.: Биохимия и патохимия обмена веществ, под ред. П. А. Верболовича, с. 157, Алма-Ата, 1975; Наточин Ю. В. Ионорегулирующая функция почки, Л., 1976; В e i-n ert Н. Iron-sulfur centres of the mitochondrial electron transfer system, в кн.: The iron-sulfur proteins, ed. by W. Loven-berg, v. 3, p. 61, N. Y., 1977; H a t e f i Y. a. S t i g a 1 1 D. L. Metall-containing fla-voprotein dehydrogenases, в кн.: The enzymes, ed. by P. Boyer, v. 13, p. 222, N. Y., 1976; King Т. E. Preparation of succinate dehydrogenase and reconstitution of succinate oxidase, в кн.: Methods in enzymol., ed. by S. P. Colowick a. N. O. Kaplan, v. 10, p. 322, N. Y., 1967.
Источник
СУКЦИНАТДЕГИДРОГЕНАЗА
[сукцинат: (акцептор)-оксидоредуктаза, сукцинат -убихинон редуктаза], фермент класса оксидоредуктаз, катализирующий окисление дианиона янтарной к-ты (сукцината) до дианиона фума-ровой к-ты (фумарата) в трикарбоновых кислот цикле; прир. акцепторы электронов в этой р-ции-убихиноны, нафтохиноны, неприродные-гексацианоферрат и нек-рые др.
С. высших организмов катализирует и обратную р-цию (фумаратредуктазную)-восстановление фумарата до сукцината; доноры электронов -убихинолы, флавинмононуклео-тид (см. Рибофлавин) и др. У ряда микроорганизмов фумаратредуктазная р-ция катализируется спец. ферментом (фумаратредуктазой), очень близким по структуре к С. У нек-рых организмов в клетках одновременно присутствуют С. и фумаратредуктаза. С. высших организмов кроме сукцината способна катализировать окисление (со значительно меньшими скоростями) его галогензамещенных и дианиона яблочной к-ты.
Фермент состоит из 4 субъединиц с мол. массами ок. 70, 30, 14 и 12 тыс. и содержит в качестве окислит.-восстановит. групп флавинадениндинуклеотид (ковалентно связанный с самой тяжелой субъединицей) и 3 Fe-S-кластера (ассоциированных с субъединицей с мол. м. 30 тыс.). Одна из малых субъединиц С. высших организмов и фумаратредук-тазы микроорганизмов содержит гем. Активный центр, связывающий сукцинат, локализован на самой тяжелой субъединице, а центр, связывающий убихинон,-в субъединице с мол. м. 12 тыс. В специфич. связывании сукцината участвуют остатки аргинина, гистидина и цистеина. С. проявляет оптим. каталитич. активность при рН 7,5-8. Установлены первичные структуры субъединиц с мол. м. 70 и 30 тыс.
Специфич. ингибиторы С.-ртутьорг. соед., N-алкилами-ды малеиновой к-ты, фенилглиоксаль, 2,3-бутандион, нек-рые эфиры карбоновых к-т и др.
Обратимые конкурентные (по отношению к сукцина-ту) ингибиторы-дианионы малоновой и щавелевоуксус-ной к-т.
С. всех изученных организмов прочно связаны с внутр. мембраной митохондрий (высшие животные, дрожжи) или плазматич. мембраной (бактерии и синезеленые водоросли), являясь компонентами электронотранспортной дыхат. цепи (см. Дыхание, Окислительное фосфорилиро-вание).
Активность С. часто используют для идентификации внутр. мембран митохондрий при фракционировании клеток и клеточных органелл.
Лит.: Виноградов А. Д., «Биохимия», 1986, т. 51, в. 12, с. 1944-73.
Химическая энциклопедия. — М.: Советская энциклопедия . Под ред. И. Л. Кнунянца . 1988 .
Смотреть что такое «СУКЦИНАТДЕГИДРОГЕНАЗА» в других словарях:
сукцинатдегидрогеназа — сукцинатдегидрогеназа … Орфографический словарь-справочник
сукцинатдегидрогеназа — сущ., кол во синонимов: 1 • фермент (253) Словарь синонимов ASIS. В.Н. Тришин. 2013 … Словарь синонимов
сукцинатдегидрогеназа — succinate dehydrogenase сукцинатдегидрогеназа [КФ 1.3.99.1]. Высокоспецифичный фермент класса оксидоредуктаз, катализирующий реакцию образования двойной связи между атомами углерода в простой алифатической цепи донора: OOC CH2 CH2 COO + акцептор… … Молекулярная биология и генетика. Толковый словарь.
сукцинатдегидрогеназа — фермент класса оксидоредуктаз (КФ 1.3.99.1), катализирующий обратимую реакцию окисления янтарной кислоты в фумаровую; участвует в цикле трикарбоновых кислот … Большой медицинский словарь
Сукцинатдегидрогеназа — фермент класса оксидоредуктаз (См. Оксидоредуктазы). С. широко распространена в растительных и животных клетках, где локализована во внутренней мембране митохондрий. С. один из важных ферментов энергетического обмена: в Трикарбоновых… … Большая советская энциклопедия
Сукцинатдегидрогеназа — – фермент, участвующий в цикле Кребса, катализирует обратимую реакцию окисления янтарной в фумаровую кислоту … Словарь терминов по физиологии сельскохозяйственных животных
Цикл трикарбоновых кислот — Цик … Википедия
Кребса цикл — Цикл трикарбоновых кислот (цикл Кребса, цитратный цикл) центральная часть общего пути катаболизма, циклический биохимический аэробный процесс, в ходе которого происходит превращение двух и трёхуглеродных соединений, образующихся как промежуточные … Википедия
Лимоннокислый цикл — Цикл трикарбоновых кислот (цикл Кребса, цитратный цикл) центральная часть общего пути катаболизма, циклический биохимический аэробный процесс, в ходе которого происходит превращение двух и трёхуглеродных соединений, образующихся как промежуточные … Википедия
ЦТК — Цикл трикарбоновых кислот (цикл Кребса, цитратный цикл) центральная часть общего пути катаболизма, циклический биохимический аэробный процесс, в ходе которого происходит превращение двух и трёхуглеродных соединений, образующихся как промежуточные … Википедия
Источник
Предшественником кофермента сукцинатдегидрогеназы является витамин
Сукцинатдегидрогеназа (СДГ и КФ 1.3.5.1) представляет собой гетеротетрамерный ферментативный комплекс, который одновременно участвует в цикле Кребса и дыхательной цепи переноса электронов. Фермент играет центральную роль в клеточном метаболизме и преобразовании энергии. На шестой стадии цикла Кребса сукцинатдегидрогеназа катализирует реакцию окисления сукцината до фумарата с восстанавлением убихинона до убихинола. СДГ содержит ковалентно связанный кофактор ФАД. Активность фермента выявлена практически во всех исследованных организмах. Даже некоторые анаэробные прокариоты содержат множественные гены, кодирующие II комплекс дыхательной цепи. Впервые очищенный препарат растворимой СДГ из животных тканей был получен Сингером в 1954 г. [1].
В исследовании сукцинатдегидрогеназы важную роль играет выяснение механизмов регуляции активности СДГ не только на уровне белковой молекулы (воздействие на скорость ее функционирования различных метаболитов), но и регуляция фермента путем действия на генетический аппарат. Известно, что комплекс СДГ связан с внутренней мембраной митохондрий, имеет сложную структуру и состоит из 4 субъединиц, включая 2 гидрофильные субъединицы – СДГ-А и СДГ-Б, которые вместе образуют каталитический центр энзима, и 2 гидрофобные субъединицы – СДГ-С и СДГ-Д [2].
СДГ — это мультисубъединичный фермент, для правильной сборки которого требуется ряд белков в несколько этапов. Этот фермент имеет медицинское значение, так как существует широкий спектр заболеваний человека от рака до нейродегенерации, связанной с неисправностью СДГ. Некоторые из этих нарушений недавно были связаны с дефектными факторами сборки, что стимулирует дальнейшие исследования в этой области. Кроме того, этот фермент имеет сельскохозяйственное значение, так как было разработано множество фунгицидов, предназначенных специально для этого фермента в растительных грибковых патогенах.
Субъединицы СДГ кодируются четырьмя генами — СДГА, СДГБ, СДГС, СДГД. СДГ является единственным комплексом окислительного фосфорилирования, в котором отсутствуют субъединицы, кодируемые митохондриальным геномом. Исследование субъединичного строения фермента, физико-химических свойств, кинетики катализируемой реакции невозможно без получения ферментных препаратов, характеризующихся гомогенностью [3].
2.Сукцинатдегидрогеназа: структура, механизм катализа, регуляция активности
СДГ состоит из четырёх субъединиц, кодируемых ядерным геномом. Молекулярная масса составляет от 125кД до 140 кД. СДГ-С и СДГ-Д содержат гидрофобные компоненты, которые закрепляют комплекс на внутренней мембране митохондрий. Гидрофобные субъединицы С и Д — трансмембранные белки. Вместе они образуют цитохром b560, в шести трансмембранных α-спиралях которого расположен гем b и сайт связывания убихинона. Две молекулы фосфолипидов, один кардиолипин и один фосфатидилэтаноламин, которые заполняют гидрофобное пространство между субъединицами С и Д ниже гема b [2]. В сторону матрикса обращены субъединицы СДГ-А и СДГ-Б. Субъединица СДГ-А содержит ковалентно связанный ФАД и сайт для связыввания сукцината, а субъединица СДГ-Б содержит 3 железо-серных кластера: [2Fe-2S], [4Fe-4S] и [3Fe-4S], которые обеспечивают перенос электрона от сукцината к убихинону. В комплексе СДГ есть два убихинон-связывающих сайта. Сайт с высоким сродством образован субъединицами СДГ-Б, СДГ-С и СДГ-Д, расположенными вблизи со стороны матрицы внутренней митохондриальной мембраны. Сайт с низким сродством образован субъединицами СДГ-С и СДГ-Д, расположенными ближе к межмембранному пространству внутренней митохондриальной мембраны. Наконец, гем B, который расположен между СДГ-С и СДГ-Д, предположительно поглощает свободные электроны, чтобы предотвратить образование активных форм кислорода [4].
На субъединице A расположен сайт связывания и окисления сукцината. Сайт связывания сукцината и сайт связывания убихинона соединены цепочкой из редокс-центров, состоящей из ФАД и трёх железосерных кла-стеров. Эта цепочка простирается на 40 Å через всё тело фермента. Прибли-зительная дистанция между кофакторами не превышает физиологический предел для переноса электронов в 14 Å [2].
Установлено, что присутствие в структуре комплекса II всех субъединиц является необходимым требованием для обеспечения его стабильности. Исследования на дрожжах показали, что отсутствие одной из гидрофобных субъединиц СДГ приводит к значительному снижению обеих гидрофильных субъединиц, следовательно, каталитический центр, не может существовать как свободная димерная структура, без мембранного домена [5].
Все больше свидетельств указывает на то, что дыхательный комплекс II является источником и модулятором активных форм кислорода (АФК). Как потеря функций II комплекса, так и его фармакологическое ингибирование могут приводить к образованию активных форм кислорода в клетках, что оказывает существенное влияние на развитие патофизиологических состояний, то есть рака и нейродегенеративных заболеваний. Несмотря на то, что участие II комплекса в производстве АФК была определена, тонкие детали все еще ожидают прояснения. Важно разрешить эти аспекты, чтобы полностью понять роль II комплекса в патологии и изучить его терапевтический потенциал при раке и других заболеваниях [6].
2.2. Механизм катализа сукцинатдегидрогеназы
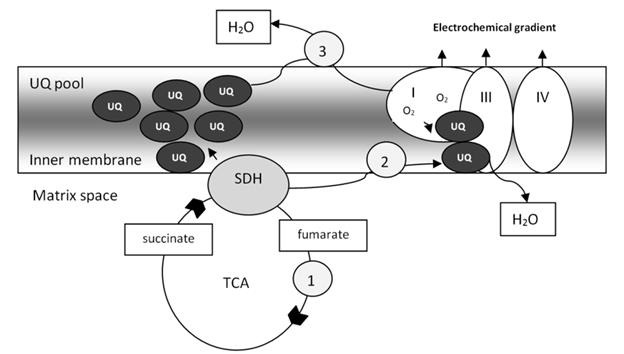
Сукцинатдегидрогеназа является ключевым ферментом в промежуточном метаболизме и преобразовании энергии в живых клетках. Митохондриальный комплекс СДГ катализирует окисление сукцината до фумарата в цикле Кребса и подает электроны в пул убихинона (UQ) дыхательной цепи (рис.1.). Этот фермент катализирует окисление сукцината до фумарата в цикле Кребса (1), а полученные электроны поступают в дыхательный комплекс III для восстановления кислорода и образования воды (2). Это создает электрохимический градиент через внутреннюю мембрану митохондрий, что позволяет синтезировать АТФ. Альтернативно, электроны могут быть направлены для уменьшения пула убихинона (пула UQ) и обеспечения восстанавливающих эквивалентов, необходимых для уменьшения супероксидных анионов, происходящих либо из экзогенного источника, либо из самой дыхательной цепи (3) [7].
Рисунок 1. Подача электронов в пул убихинона дыхательной цепи. [7].
В реакции окисления сукцината до фумарата два атома водорода удаляются из субстрата с помощью ФАД, протезной группы, которая тесно связана с сукцинатдегидрогеназой.
Два электрона из восстановленного комплекса СДГ-ФАДН2 переносятся на убихинон (Q). Затем убихинон восстанавливается до убихинола (QH2). Восстановленный убихинол окисляется комплексом III, а затем электроны переносятся через цитохром c в комплекс IV, где молеку-лярный кислород восстанавливается до воды. Протонная накачка комплекса-ми I, III и IV генерирует электрохимический градиент, который затем ис-пользуется для синтеза АТФ комплексом V (АТФ-синтаза).
Биохимические исследования выявили, что в СДГ митохондрий эука-риот имеется два сайта связывания убихинона [8]. Первый сайт – проксимальный (Qp) располагается на стороне матрицы митохондрий, обладает высоким сродством к убихинону и образован фрагментами СДГБ, СДГС и СДГД, а второй – дистальный (Qd) близок к межмембранному пространству, имеет слабое сродство к убихинону [2,9]. Восстановление убихинона протекает в два этапа: на первом происходит неполное восстановление семихинона (в качестве стабилизатора выступает проксимальный сайт) который восстанавливается до убихинола [2]. В реакции окисления сукцината до фумарата два атома водорода удаляются из субстрата флавинадениндинуклеотидом, протеиновой группой, прикрепленной к сукцинатдегидрогеназе. Два электрона из восстановленного комплекса СДГ ФАДH2 затем переносятся на убихинон растворимой части фермента электронно-транспортной системы. Происходит восстановление убихинона до убихинола. ФАД является неотъемлемым кофактором сукцинатдегидрогеназы. АТФ в митохондриях связывается с окисленным НАДН и ФАДH2 и восстановленным кислородом в воде дыхательной цепи митохондрий [10].
Важным аспектом окисления сукцината комплексом II является требо-вание ковалентно связать ФАД с атомом N-гистидинового остатка через 8α-N (3) –гистидила, что увеличивает потенциал восстановления кофактора примерно на 150 мВ (от -199 мВ до -55 мВ в E.coli). Данная связь наблюдается только у сложных членов семейства II, а не в гомологиях растворимых флавопротеином. Механизм ковалентного сближения и прикрепления ФАД к белку не был очерчен, но введение ФАД может облегчаться сложным комплексом II сборным фактором, обозначенным СДГ5 у дрожжей [7] и СДГE у бактерий [11].
Транспортирование электронов от центра связывания сукцината с пер-вым или проксимальным хинонсвязывающим сайтом осуществляется вдоль цепи окислительно-восстановительных групп, которые включают ковалентно присоединенные ФАД и три кластера железо-серы [12].
В комплексе II расположены два различных активных центра и коор-динированный катализ на этих участках связывает два ключевых биологических пути, то есть окисление сукцината в цикле трикарбоновых кислот и восстановление хинона в цепи переноса электронов. Субъединица СДГА содержит ковалентно присоединенный ФАД-редокс-фрагмент и сайт связывания дикарбоксилата, где сукцинат окисляется до фумарата. Протоны этого окисления переносятся на растворитель, а фумарат действует как следующий субстрат в цикле Кребса. Электроны продукта катализа переносятся на 40 Å через три кластера железо-серы в белке СДГБ. Эти электроны действуют как сосубстраты на втором активном центре, расположенном на границе интегральных мембранных субъединиц. На этом хинон-восстанавливающем сайте, 2Н + и 2е- уменьшают убихинон до убихинола. Полученный пул хинола поддерживает синтез АТФ [13].
Два электрона, абстрагированные от дегидрирования сукцината, последовательно направляются в цепь переноса электронов от флавин-адениндинуклеотида до захваченного мембраной убихинона через кофакторы [2Fe-2S], [4Fe-4S], [3Fe-4S] и, возможно, гем b. Этот дальний, линейно-линейный электронный канал простирается более чем на 40 Å от растворимого каталитического домена СДГ до мембранно-закрепляющего домена фермента [2]. Участие гема b как части цепи переноса электронов не было четко установлено, поэтому функциональная значимость гема неясна [14].
2.3.Регуляция активности фермента сукцинатдегидрогеназы
Активность СДГ можно модулировать с помощью конкурентов сукцината, ингибиторов убихинона или посттрансляционных модификаций. Конкурентными ингибиторами сукцината являются малонат, малат и оксалоацетат. По структуре эти соединения похожи на сукцинат, что объясняет их способность конкурировать за связывание с активным центром СДГ. Примечательно, что как малат, так и оксалоацетат являются метаболитами цикла трикарбоновых кислот. Карбоксин и теноилтрифторацетон являются синтетическими ингибиторами убихинона, которые блокируют перенос электрона от комплекса СДГ к убихинону [4].
Что касается посттрансляционных модификаций, было показано, что фосфорилирование и ацетилирование остатков лизина субъединицы СДГA модулируют активность СДГ [15,16]. Например, снижение SIRT3, обладающий деацетилазной активностью, приводил к накоплению ацетилированного лизина СДГА. Это снизило активность комплекса СДГ. После повторной экспрессии SIRT3 ацетилирование лизина СДГA было удалено, а активность СДГ восстановлена [16]. Точно так же фосфорилирование остатков лизина СДГА оказывает аналогичное влияние на активность СДГ [15]. Недавно сообщалось о сукцинилировании остатков лизина СДГА в клетках, обработанным ингибитором СДГ или при снижение активности сукцинил-КоА-синтетазы. Модификация сукцинил-лизина может модулировать активность СДГ. [17,18]
Установлено, что в условиях in vitro ингибирующим эффектом на сук-цинатдегидрогеназную активность митохондрий обладают все исследован-ные производные 1,3,4-тиадиазинов. Максимальное ингибирующее влияние показано для L-9 и L-10 1,3,4-тиадиазиновых соединений, под воздействием которых активность СДГ снизилась в 6 раз по сравнению с нативными митохондриями. Высказано предположение о том, что сходный ингибирующий эффект на активность СДГ обусловлен наличием 1,3,4-тиадиазиновых колец и колец морфолина, тогда как разная степень ингибирующей активности СДГ, вероятно, связана с различием заместителей в пятом положении 1,3,4-тиадиазинового кольца [19].
За последние несколько лет комплекс СДГ стал предметом нового интереса. Это было обусловлено, прежде всего, открытием его роли в различных заболеваниях, а также открытием новых факторов сборки. Как и большинство важных открытий, эти новые открытия дают больше вопросов, чем ответов. Предстоящие годы, вероятно, станут свидетелями нового понимания сборки СДГ, включая новые факторы и большую ясность в отношении механизмов [20].
Таким образом, изучая заболевания человека, связанных с СДГ, позволяет предположить, что фермент играет не только центральную роль в цикле Кребса и дыхательной цепи, но также отличается от других митохондриальных дегидрогеназ благодаря своим уникальным окислительно-восстановительным свойствам. В партнерстве с убихиноном СДГ будет представлять собой важный антиоксидантный фермент в митохондриях [7].
Источник