ТРИПТОФАН
Триптофан — β-(3-индолил)-α-аминопропионовая кислота, индолаланин; в организме человека и животных не синтезируется, относится к незаменимым аминокислотам. Триптофан входит в состав молекул белков (см.), в т. ч. ферментов (см.), а также является биосинтетическим предшественником алкалоидов (см.), никотиновой кислоты (см.), серотонина (см.) и других биологически активных веществ. Недостаток Триптофана в рационе является причиной нарушения синтеза белков, снижения содержания серотонина в мозге и других тканях, он может привести также к развитию пеллагры (см.). При дефиците пиридоксина (см.) нарушается обмен Триптофана: с мочой выделяется резко увеличенное против нормы количество метаболитов Триптофана кинуренина и ксантуреновой к-ты. Нарушение обмена Триптофана у человека может быть первичным, генетически обусловленным, и вторичным — при заболевании печени и почек, при шизофрении (см.), маниакально-депрессивном психозе (см.), эпилепсии (см.), семейной атаксии Фридрейха (см. Атаксия), болезни Иценко—Кушинга (см. Иценко—Кушинга болезнь), коллагенозах (см. Коллагеновые болезни), туберкулезе (см.), заболеваниях жел.-киш. тракта, анемиях (см.), нек-рых злокачественных опухолях (см.). К наследственным дефектам обмена Т. относятся болезнь Хартнупа (см. Хартнупа болезнь) — нарушение всасывания Т. в кишечнике и реабсорбции Т. в почках; так наз. синдром «голубых пеленок» — нарушение всасывания Т. в кишечнике, при этом из двух молекул индола (см.) образуется синее индиго, выделяющееся с мочой; синдром Тады — триптофанурия в сочетании с карликовостью (см.); синдром Прайса — кинуренинурия, склеродермия (см.); наследственная ксантуренинацидурия, при к-рой снижена активность кинурениназы (КФ 3.7.1.3), пиридоксальфосфатзависимого фермента, участвующего в обмене Т. Нарушение обмена Т. установлено также при аллергических дерматозах (см.). У растений Т. является биосинтетическим предшественником алкалоидов и других соединений: гармина, псилоцибина, индолил-3-ацетата (ауксина), лизергиновой кислоты (см.), резерпина (см.).
История открытия Т. является интересным эпизодом в изучении и идентификации аминокислот (см.). Уже задолго до его открытия в 1901 г. было известно, что при триптическом переваривании белков (см. Трипсин) можно наблюдать цветную реакцию с бромной водой, к-рая не появляется ни с нативными белками, ни с продуктами кислотного гидролиза белка. Эта реакция была названа «триптофане вой», что означает «реакция, извещающая о расщеплении». Позже было установлено, что реакция с бромной водой происходит только в присутствии свободного Т., но не при кислотном гидролизе, т. к., в кислой среде Т. разрушается.
Содержание Т. в гемоглобине (см.) и миоглобине (см.) человека составляет 1,9 и 3,6% соответственно, в цитохроме с лошади (см. Цитохромы) — 1,5%, в инсулине и рибонуклеазе Т. отсутствует.
Суточная потребность Триптофана для детей (в зависимости от возраста) составляет в среднем от 15 до 30 мг/кг, а для взрослых — 7 мг/кг. Принятые с пищей 60 мг Т. эквивалентны 1 мг никотиновой к-ты (ниацина).
Мол. вес (масса) Т. составляет 204,22. В основе структуры Т. лежит гетероциклическая индольная система, представляющая собой как бы конденсированные бензольные и пиррольные кольца.
Водородный атом у азота пиррольного кольца обладает свойством образовывать связи с плоскими молекулами, а также с группами, локализованными внутри глобулы белков. Изоэлектрическая точка (см.) Т. находится при pH 5,89. По сравнению с фенилаланином (см.) и тирозином (см.) Т. обладает более сильным поглощением в УФ-части спектра (максимум поглощения находится при длине волны 279 нм). В составе живых организмов встречается только L-триптофан (см. Изомерия). В очищенном виде он представляет собой бесцветные гексагональные листочки. Уд. вращение плоскости поляризации света (а)20 = —33,7; t°пл 293° (с разложением). Растворимость (в г/100 мл) в воде при 25° равна 1,14, а при 75° — 2,79; Т. мало растворим в этаноле, нерастворим в эфире. D-триптофан представляет собой бесцветные кристаллы, (а)90 — = 4-32,9; t°пл 282°. Рацемическая смесь (см. Рацемические соединения) изомеров Т. имеет вид бесцветных гексагональных пластинок, t°пл 283°, растворима в горячей воде, мало растворима в холодной воде и этаноле.
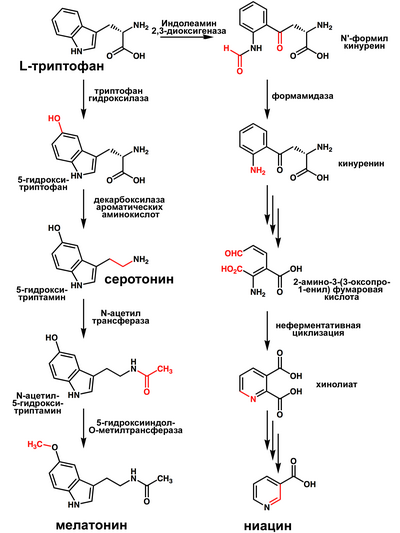
В организм человека и животных Триптофан поступает в составе белков пищи. После всасывания из кишечника в кровь большая часть Т. используется для биосинтеза белков. Т. кодируется триплетом УГГ — урацил, гуанин, гуанин (см. Генетический код), причем триптофан способствует образованию альфа-спирали белка, т. е. формированию его вторичной структуры. Метаболизм Т. осуществляется по серотониновому, индольному и кинурениновому путям. Гидроксилирование Т. ведет к образованию 5-гидрокситриптофана с его последующим декарбоксилированием (см.) до 5-гидрокситриптамина. Продукты превращения последнего 5-(гидр)оксииндолилуксусная (ОИУК) и 5-метоксииндолилуксусная к-ты экскретируются с мочой, по этому пути метаболизируется 3% поступившего с пищей Т. В норме с мочой человека выводится ок. 5 мг ОИУК в сутки. У больных со злокачественным карциноидом (см.) экскреция ОИУК достигает 400 мг в сутки. В печени и кишечнике Т. превращается в триптамин, из к-рого образуются индолилуксусная и индолилпировиноградная к-ты (см. Активаторы роста). Под действием бактериальной флоры толстой кишки Т. подвергается дезаминированию (см.) и последующему распаду боковых цепей с образованием скатола (см.), скатоксила, индола, индоксила. В кишечнике индол может образовываться непосредственно из Т. Концентрация индоксилсульфата в моче является показателем активности бактериальной флоры кишечника. И, наконец, Т. окисляется до кинуренина, к-рый превращается в антраниловую, кинуреновую, ксантуреновую, хинолиновую, пиколиновую к-ты и другие продукты, выделяемые с мочой, причем их суммарное количество соответствует количеству метаболизируемого Т. Из хинолиновой к-ты в организме человека и животных образуются никотинамидные коферменты (см. Никотинамидадениндинуклеотид).
Получают Т. из триптических гидролизатов белков, а также путем хим. синтеза.
Для качественного и количественного определения Т. в биол. материале используют различные методы хроматографии (см.), а для количественного определения используют метод Гопкинса (см. Гопкинса методы), или реакцию с ароматическими альдегидами (n-диметиламинобензальдегид, растворенный в концентрированной серной кислоте, при взаимодействии с Т. дает красно-фиолетовое окрашивание, интенсивность к-рого пропорциональна содержанию Т.), а также спектрофотометрические (см. Спектрофотометрия) и электрофоретические (см. Электрофорез) методы.
При определении обеспеченности организма витамином B6 используют пробу с нагрузкой Триптофаном: в моче исследуемого определяют содержание ксантуреновой к-ты после приема 10 г Т. Однако повышенное выведение ксантуреновой к-ты с мочой не всегда бывает проявлением гиповитаминоза B6 (см. Витаминная недостаточность), а может зависеть от повышения активности триптофанпирролазы (триптофан-2,3-диоксигеназы; КФ 1.13.11.11), катализирующей окисление Триптофана с образованием L-формилкинуренина.
Библиогр.: Березов Т. Т. и Коровкин Б. Ф. Биологическая химия, М., 1982; Рапопорт С. М. Медицинская биохимия, пер. с нем., с. 54 и др., М., 1966; Рудзит В. К. Триптофан (в норме и патологии), Л., 1973, библиогр.; Уайт А. и др. Основы биохимии, пер. с англ., т. 1—3, М., 1981; Tadа К. а. о. Vitamin B6 dependent xanthurenic aciduria, Tohoku J. exp. Med., v. 93, p. 115, 1967.
Источник
Триптофан
| Триптофан | |
 | |
 | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | 2-амино-3-(1H-индол-3-ил)пропановая кислота |
| Сокращения | Три, Trp, W UGG |
| Хим. формула | ? |
| Рац. формула | C11H12N2O2 |
| Физические свойства | |
| Молярная масса | 204,23 г/моль |
| Химические свойства | |
| pKa | 9,39 [1] |
| Классификация | |
| Рег. номер CAS | 73-22-3 |
| PubChem | 6305 |
| Рег. номер EINECS | 200-795-6 |
| SMILES | |
| ChEBI | 16828 , 57912 и 21407 |
| ChemSpider | 6066 |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Триптофа́н (β-(β-индолил)-α-аминопропионовая кислота, сокр.: Три, Трп, Trp, W) — ароматическая альфа-аминокислота. Существует в двух оптически изомерных формах, L и D, и в виде рацемата (DL).
L-триптофан является протеиногенной аминокислотой и входит в состав белков всех известных живых организмов. Относится к ряду гидрофобных аминокислот, поскольку содержит ароматическое ядро индола. Участвует в гидрофобных и стэкинг-взаимодействиях.
Содержание
Биосинтез
Триптофан в природе синтезируется через антранилат. В процессе биосинтеза антранилата промежуточными соединениями являются шикимат, хоризмат. Биосинтез антранилата рассмотрен в статье шикиматный путь. Четыре обратимые реакции составляют кратчайший путь преобразования антранилата в триптофан. Гены, ответственные за эти реакции, а также за необратимую реакцию образования антранилата из хоризмата, имеют название trp-гены и у бактерий объединены в триптофановый оперон.
Стадии биосинтетического процесса хоризмат →→ триптофан:
- Из хоризмата синтезируется антранилат. Донором аминогруппы выступает амидный азот глутамина либо аммоний. В результате реакции образуется также пируват. У Escherichia coli реакцию осуществляет компонент I антранилат-синтазы, продукт гена trpE.
- Антранилат фосфорибозилируется фосфорибозилпирофосфатом с образованием фосфорибозилантранилата. В реакции высвобождается неорганический пирофосфат (в присутствии пирофосфатазы реакция протекает практически необратимо). У Escherichia coli реакцию осуществляет компонент II антранилат-синтазы, продукт гена trpD.
- Фосфорибозилантранилат, претерпевая перегруппировку Амадори, изомеризуется в фосфорибулозилантранилат. У Escherichia coli реакция определяется фосфорибозилантранилат-изомеразной активностью индол-глицерол-фосфат-синтазы, являющейся продуктом гена trpC.
- Циклизация фосфорибулозилантранилата, сопровождаемая декарбоксилированием-дегидратацией приводит к индол-глицерол-фосфату. У Escherichia coli реакция определяется индол-глицерол-фосфат-синтазной активностью индол-глицерол-фосфат-синтазы, являющейся продуктом гена trpC.
- Заместитель отщепляется в виде глицеральдегид-3-фосфата, происходит замена этого заместителя на другой трёхуглеродный заместитель, происходящий из молекулы L-серина. Реакция протекает через промежуточное образование незамещённого индола. Реакция пиридоксаль-зависима. У Escherichia coli реакцию осуществляет триптофан-синтаза субъединичного состава α2β2 (субъединица α — продукт гена trpA, субъединица β — продукт гена trpB) [2] .
В природе триптофан синтезируют микроорганизмы, растения и грибы. Многоклеточные животные не способны синтезировать триптофан de novo. Для человека, как и для всех Metazoa, триптофан является незаменимой аминокислотой и должен поступать в организм в достаточном количестве с белками пищи.
Катаболизм
Катаболические превращения L-триптофана в организме человека:
Метаболиты
Триптофан является биологическим прекурсором серотонина [3] (из которого затем может синтезироваться мелатонин) и ниацина (см. рисунок).
Часто гиповитаминоз по витамину B3 сопряжён с недостатком триптофана.
Также триптофан является биохимическим предшественником индольных алкалоидов. Например, триптофан→триптамин→N,N-диметилтриптамин→псилоцин→псилоцибин
Метаболит триптофана — 5-гидрокситриптофан (5-HTP) был предложен в качестве средства для лечения эпилепсии [4] и депрессии, но клинические испытания не дали окончательных результатов [5] . 5-HTP легко проникает через гематоэнцефалический барьер и, кроме того, быстро декарбоксилируется в серотонин (5-гидрокситриптамин, или 5-HT) [6] .
В связи с преобразованием 5-HTP в серотонин в печени есть значительный риск появления пороков сердца из-за влияния серотонина на сердце [7] [8] .
Способы получения и производство триптофана
Химический синтез
Индол аминометилируют формальдегидом и диметиламином по методу Манниха. Полученный 3-диметиламинометилиндол конденсируют с метиловым эфиром нитроуксусной кислоты, что приводит к метилату 3-индолилнитропропионовой кислоты. Затем восстанавливают нитрогруппу до аминогруппы. После щелочного гидролиза эфира получают D,L-триптофан обычно в форме натриевой соли. [9] В триптофане, полученном химическим синтезом, обнаруживаются примеси токсичных соединений. Синтетический триптофан добавляют в комбикорма для животных.
Химико-ферментативный синтез
У микроорганизмов, в том числе и у Escherichia coli, известен пиридоксальзависимый фермент триптофан-индол-лиаза (триптофаназа КФ 4.1.99.1, продукт гена tnaA). Функция этого фермента заключается в поддержании равновесия:
триптофан + вода ⇋ индол + пируват + аммоний.
Благодаря этому триптофан может быть получен ферментативной конденсацией индола, пировиноградной кислоты и аммиака.
Микробиологический синтез
В промышленном производстве L-триптофана обычно используются штаммы дрожжей Candida utilis, дефектные по aro-генам и, как следствие, ауксотрофные по фенилаланину и тирозину. Исходным сырьём обычно служит относительно дешёвая синтетическая антраниловая кислота, что является целесообразным по нескольким причинам. Во-первых, это упрощает и удешевляет процесс, а во-вторых, позволяет обойти механизмы регуляторного контроля (целевой продукт триптофан оказывает ингибирующее действие на антранилатсинтазу). В присутствии минимальных, не вызывающих регуляторных эффектов, количеств фенилаланина и тирозина мутанты Candida utilis переводит вводимую в культуральную среду антраниловую кислоту в L-триптофан.
Исходным сырьём в микробиологическом производстве триптофана может служить также синтетический индол. Процесс зависит от активности триптофан-синтазы и доступности серина.
Пищевые источники триптофана
Триптофан является компонентом пищевых белков. Наиболее богаты триптофаном такие продукты, как сыр, рыба, мясо, бобовые, творог, грибы [ источник не указан 1481 день ] , овёс, сушёные финики [ источник не указан 1481 день ] , арахис, кунжут, кедровый орех, молоко, йогурт.
Триптофан присутствует в большинстве растительных белков, особенно им богаты соевые бобы. Очень малое количество триптофана содержится в кукурузе, поэтому питание только кукурузой приводит к нехватке этой аминокислоты и, как следствие, к пеллагре. Арахис является отличным источником триптофана, однако в арахисе его меньше чем в продуктах животного происхождения.
Мясо и рыба содержат триптофан неравномерно: белки соединительной ткани (коллаген, эластин, желатин) не содержат триптофан [10] .
Таблица содержания триптофана в продуктах
| № п/п | продукт | в мг на 100 г |
|---|---|---|
| 1 | красная икра | 960 |
| 2 | чёрная икра | 910 |
| 3 | сыр голландский | 780 |
| 4 | арахис | 285 [12] |
| 5 | миндаль | 630 |
| 6 | кешью | 600 |
| 7 | соевые бобы | 600 |
| 8 | сыр плавленый | 500 |
| 9 | кедровые орехи | 420 |
| 10 | халва | 360 |
| 11 | мясо кролика, индейки | 330 |
| 12 | кальмары | 320 |
| 13 | ставрида | 300 |
| 14 | семечки подсолнуха | 300 |
| 15 | фисташки | 300 |
| 16 | курица | 290 |
| 17 | горох, фасоль | 260 |
| 18 | сельдь | 250 |
| 19 | телятина | 250 |
| 20 | говядина | 133 |
| 21 | лосось | 220 |
| 22 | треска | 210 |
| 23 | баранина | 210 |
| 24 | творог жирный | 210 |
| 25 | яйца куриные | 200 |
| 26 | минтай | 200 |
| 27 | шоколад | 200 |
| 28 | свинина | 190 |
| 29 | творог нежирный | 180 |
| 30 | карп | 180 |
| 31 | палтус, судак | 180 |
| 32 | крупа гречневая | 180 |
| 33 | пшено | 180 |
| 34 | окунь морской | 170 |
| 35 | скумбрия | 160 |
| 36 | крупа овсяная | 160 |
| 37 | курага | 150 |
| 38 | грибы | 130 |
| 39 | крупа ячневая | 120 |
| 40 | крупа перловая | 100 |
| 41 | хлеб пшеничный | 100 |
| 42 | картофель жаренный | 84 |
| 43 | финики | 75 |
| 44 | рис отварной | 72 |
| 45 | картофель отварной | 72 |
| 46 | хлеб ржаной | 70 |
| 47 | чернослив | 69 |
| 48 | зелень (укроп, петрушка) | 60 |
| 49 | свекла | 54 |
| 50 | изюм | 54 |
| 51 | капуста | 54 |
| 52 | бананы | 45 |
| 53 | морковь | 42 |
| 54 | лук | 42 |
| 55 | молоко, кефир | 40 |
| 56 | помидоры | 33 |
| 57 | абрикосы | 27 |
| 58 | апельсины | 27 |
| 59 | гранат | 27 |
| 60 | грейпфрут | 27 |
| 61 | лимон | 27 |
| 62 | персики | 27 |
| 63 | вишня | 24 |
| 64 | клубника | 24 |
| 65 | малина | 24 |
| 66 | мандарины | 24 |
| 67 | мёд | 24 |
| 68 | сливы | 24 |
| 69 | огурцы | 21 |
| 70 | кабачки | 21 |
| 71 | арбуз | 21 |
| 72 | виноград | 18 |
| 73 | дыня | 18 |
| 74 | хурма | 15 |
| 75 | клюква | 15 |
| 76 | яблоки | 12 |
| 77 | груши | 12 |
| 78 | ананасы | 12 |
Нарушения обмена
Семейная гипертриптофанемия
Семейная гипертриптофанемия — редкое аутосомно-рецессивное наследственное заболевание, нарушение обмена веществ, которое приводит к накоплению триптофана в крови и выведению его с мочой (триптофанурия).
Болезнь Хартнапа
Причиной заболевания является нарушение активного транспорта триптофана через кишечную стенку, вследствие чего усиливаются процессы его бактериального разложения и образования индольных продуктов, таких как индол, скатол.
Синдром Тада
Наследственное заболевание, связанное с нарушением превращения триптофана в кинуренин. При заболевании наблюдается повреждение ЦНС и нанизм. Заболевание впервые описано К. Тада в 1963 году.
Синдром Прайса
Генетическое заболевание, причиной которого является нарушение превращения кинуренина в 3-гидрокси-L-кинуренин (за реакцию ответственна NADP-зависимая L-кинуренин-3-гидроксилаза КФ 1.14.13.9). Заболевание проявляется повышенной экскрецией кинуренина с мочой, а также склеродермией.
Индиканурия
Индиканурия — повышенное содержание в моче индикана. Причиной может являться непроходимость кишечника, из-за чего в нём начинают усиленно протекать гнилостные процессы.
Триптофан и синдром эозинофилии-миалгии
В конце 1980-х в США и некоторых других странах отмечалась очень большое число случаев синдрома эозинофилии-миалгии (Eosinophilia–myalgia syndrome). Огласке эта проблема подверглась в 1989, после того как личные врачи трёх американок, обсудив между собой ситуацию, подняли тревогу. Впоследствии масштаб той вспышки оценили как приблизительно равный 60 000 случаев, из которых около 1500 случаев привели к инвалидизации и не менее 27 закончились смертельным исходом.
Было установлено, что практически все заболевшие принимали L-триптофан японского производителя Showa Denko. Этот триптофан производился при помощи нового специально разработанного штамма генетически изменённых микроорганизмов. При расследовании были взяты образцы препарата из нескольких партий триптофана. В этих образцах выявили более 60 различных примесей. Эти примеси, среди которых особенно подозрительными оказались EBT (1,1′-ethylidene-bis-L-tryptophan) и MTCA (1-methyl-1,2,3,4-tetrahydro-beta-carboline-3-carboxylic acid), тщательно исследовались, но ни у одной из них не выявили способность вызывать такие серьёзные нарушения здоровья, как синдром эозинофилии-миалгии.
Рассматривалась также возможность того, что синдром эозинофилии-миалгии может вызываться самим L-триптофаном при его избыточном поступлении в организм. Эксперты пытались оценить вероятность того, что метаболиты триптофана могут тормозить деградацию гистамина, а избыточный гистамин может способствовать воспалительным процессам и развитию синдрома эозинофилии-миалгии. Несмотря на все предпринятые усилия, так и не удалось достоверно установить, что именно вызывало эозинофилию-миалгию у людей, принимавших триптофан.
Усиление контроля оборота триптофана, в том числе запрет на ввоз импортного триптофана, привело к резкому снижению случаев синдрома эозинофилии-миалгии. В 1991 году в США большая часть триптофана была не пущена в продажу, другие страны также последовали этому примеру. В феврале 2001 FDA ослабил ограничения, но все же выразил беспокойство:
«Based on the scientific evidence that is available at the present time, we cannot determine with certainty that the occurrence of EMS in susceptible persons consuming L-tryptophan supplements derives from the content of L-tryptophan, an impurity contained in the L-tryptophan, or a combination of the two in association with other, as yet unknown, external factors.» [13]
«Опираясь на научные данные, которыми мы в настоящее время располагаем, мы не можем с уверенностью ответить на вопрос, что вызывает эозинофилию-миалгию у восприимчивых людей, употребляющих L-триптофан. Мы не можем сказать, способен ли вызвать эозинофилию-миалгию сам L-триптофан, или же примесь, содержавшаяся в L-триптофане, или комбинации L-триптофана, примесей с другими, пока ещё неизвестными факторами».
Триптофан и иммунная система
Индоламин-2,3-диоксигеназа (изозим триптофан-2,3-диоксигеназы) активируется во время иммунной реакции, чтобы ограничить доступность триптофана для клеток, инфицированных вирусом, или раковых клеток.
Триптофан и продолжительность жизни
Опыты на крысах показали, что диета с пониженным содержанием триптофана увеличивает максимальную продолжительность жизни, но также увеличивает смертность в молодом возрасте [14] .
Триптофан и сонливость
Сонливость, которая наблюдается после употребления мяса индейки (актуально в США, где индейку традиционно употребляют на День благодарения и Рождество), связывают с действием мелатонина, образующегося из триптофана. Существует заблуждение, что индейка содержит очень большое количество триптофана. Индюшатина действительно содержит много триптофана, но его содержание приблизительно такое же, как и во многих других мясных продуктах. Хотя механизмы возникновения сонливости действительно связаны с обменом триптофана, её причиной является общая высокая калорийность и высокое содержание углеводов в пище, которая вызывает сонливость, а не повышенное содержание в ней триптофана.
Флуоресценция
Триптофан обладает наиболее сильной флуоресценцией среди всех 20 протеиногенных аминокислот. Триптофан поглощает электромагнитное излучение с длиной волны 280 нм (максимум) и сольватохромно излучает в диапазоне 300—350 нм. Молекулярное окружение триптофана оказывает влияние на его флуоресценцию. Этот эффект имеет значение для изучения белков. Взаимодействие индольного ядра с азотистыми основаниями нуклеиновых кислот приводит к уменьшению интенсивности флуоресценции, что позволяет установить роль этой аминокислоты в протеин-нуклеиновых взаимодействиях.
Аналоги триптофана
Синтетический 7-азатриптофан из-за структурного сходства с триптофаном может быть ошибочно использован белоксинтезирующей системой вместо триптофана.
Применение
Гипотеза о том, что при депрессивных расстройствах уменьшается содержание в мозге серотонина, привела к терапевтическому использованию L-триптофана при депрессии [3] . Он применяется как в качестве монотерапии, так и в сочетании с традиционными антидепрессантами [3] .
Имеются данные контролируемых испытаний, согласно которым добавление L-триптофана может усиливать терапевтический эффект антидепрессантов группы ИМАО. Назначение L-триптофана рекомендуется для дополнительного потенцирования серотонинергических эффектов комбинаций «литий + ИМАО» и «литий + кломипрамин»(«серотониновый коктейль») [15] .
Также L-триптофан используется при обсессивно-компульсивном расстройстве. Дополнительное введение L-триптофана в дозе 6—8 г в сутки особенно оправданно при снижении синтеза или истощении запасов серотонина, например вследствие длительного применения серотонинергических антидепрессантов. При этом у части больных терапевтический эффект L-триптофана при длительном лечении склонен истощаться [16] .
Кроме того, препараты L-триптофана назначаются при расстройствах сна [17] , чувстве страха и напряжения, дисфории, предменструальном синдроме [ источник не указан 1182 дня ] . Показаниями к применению также являются комплексная терапия больных с алкогольной, опиатной и барбитуратной зависимостью с целью нивелирования проявлений абстинентного синдрома, лечение острой интоксикации этанолом, лечение биполярного аффективного расстройства и депрессии, связанной с менопаузой [ источник не указан 1182 дня ] . Применение при беременности и в период лактации (грудного вскармливания) не рекомендуется. Биодоступность при пероральном приёме составляет более 90%.
Побочными действиями L-триптофана являются гипотензия, тошнота, поносы и рвота [17] , анорексия. Кроме того, он вызывает сонливость днём, а если принимать его вечером — может улучшать ночной сон [3] . Сочетанное применение серотонинергических антидепрессантов и L-триптофана может вызывать серотониновый синдром [16] .
Триптофан также применяется для сбалансирования кормов для животных.
Источник