Пируватдегидрогеназный комплекс фермент кофермент витамин реакция
еУМЙ РТПГЕУУ ЛБФБВПМЙЪНБ ТБУУНБФТЙЧБФШ У ПВЭЕК ФПЮЛЙ ЪТЕОЙС, ФП НПЦОП ЧЩДЕМЙФШ ФТЙ ПУОПЧОЩЕ ЕЗП ЮБУФЙ:
лБФБВПМЙЪН ПУОПЧОЩИ РЙЭЕЧЩИ ЧЕЭЕУФЧ
- тБУЭЕРМЕОЙЕ Ч РЙЭЕЧБТЙФЕМШОПН ФТБЛФЕ . ьФП ЗЙДТПМЙФЙЮЕУЛЙЕ ТЕБЛГЙЙ, РТЕЧТБЭБАЭЙЕ УМПЦОЩЕ РЙЭЕЧЩЕ ЧЕЭЕУФЧБ Ч ПФОПУЙФЕМШОП ОЕВПМШЫПЕ ЮЙУМП РТПУФЩИ НЕФБВПМЙФПЧ: ЗМАЛПЪБ, БНЙОПЛЙУМПФЩ, ЗМЙГЕТЙО, ЦЙТОЩЕ ЛЙУМПФЩ.
- уРЕГЙЖЙЮЕУЛЙЕ РХФЙ ЛБФБВПМЙЪНБ . рТПУФЩЕ НЕФБВПМЙФЩ РПДЧЕТЗБАФУС УРЕГЙЖЙЮЕУЛЙН ТЕБЛГЙСН ТБУЭЕРМЕОЙС, Ч ТЕЪХМШФБФЕ ЛПФПТЩИ ПВТБЪХЕФУС МЙВП РЙТПЧЙОПЗТБДОБС ЛЙУМПФБ, МЙВП БГЕФЙМ — уПб. рТЙЮЕН БГЕФЙМ — уПб НПЦЕФ ПВТБЪПЧБФШУС ЙЪ РЙТХЧБФБ Ч ТЕЪХМШФБФЕ ПЛЙУМЙФЕМШОПЗП ДЕЛБТВПЛУЙМЙТПЧБОЙС. нПЗХФ ФБЛЦЕ ПВТБЪПЧБФШУС ДТХЗЙЕ УПЕДЙОЕОЙС, ОЕРПУТЕДУФЧЕООП ЧЛМАЮБАЭЙЕУС Ч ГЙФТБФОЩК ГЙЛМ.
- гЙФТБФОЩК ГЙЛМ Й ДЩИБФЕМШОБС ГЕРШ ЪБЧЕТЫБАФ ТБУЭЕРМЕОЙЕ РЙЭЕЧЩИ ЧЕЭЕУФЧ ДП ЛПОЕЮОЩИ РТПДХЛФПЧ — уп 2 Й о 2 п.
уМЕДПЧБФЕМШОП, ОБЮЙОБС УП УФБДЙЙ ПВТБЪПЧБОЙС РЙТХЧБФБ РТПЙУИПДЙФ ХОЙЖЙЛБГЙС РХФЕК ЛБФБВПМЙЪНБ. йЪ ВПМШЫПЗП ЮЙУМБ ЙУИПДОЩИ УПЕДЙОЕОЙК ПВТБЪХЕФУС ЧУЕЗП ДЧБ — РЙТХЧБФ Й БГЕФЙМ — уПб. рТПГЕУУ, ОБЮЙОБАЭЙКУС ПФ РЙТХЧБФБ, ОБЪЩЧБЕФУС ПВЭЙН РХФЕН ЛБФБВПМЙЪНБ Й Ч УЧПА ПЮЕТЕДШ ЧЛМАЮБЕФ:
- ПЛЙУМЙФЕМШОПЕ ДЕЛБТВПЛУЙМЙТПЧБОЙЕ РЙТХЧБФБ
- ГЙФТБФОЩК ГЙЛМ.
йНЕООП Ч ПВЭЕН РХФЙ ЛБФБВПМЙЪНБ ПВТБЪХЕФУС ПУОПЧОБС НБУУБ УХВУФТБФПЧ ДМС ТЕБЛГЙК ДЕЗЙДТЙТПЧБОЙС. уПЧНЕУФОП У ДЩИБФЕМШОПК ГЕРША Й ПЛЙУМЙФЕМШОЩН ЖПУЖПТЙМЙТПЧБОЙЕН ПВЭЙК РХФШ ЛБФБВПМЙЪНБ СЧМСЕФУС ПУОПЧОЩН ЙУФПЮОЙЛПН ЬОЕТЗЙЙ Ч ЖПТНЕ бфт.
пЛЙУМЙФЕМШОПЕ ДЕЛБТВПЛУЙМЙТПЧБОЙЕ РЙТПЧЙОПЗТБДОПК ЛЙУМПФЩ
уХННБТОЩК ТЕЪХМШФБФ НОПЗПУФБДЙКОПК ТЕБЛГЙЙ ЧЩЗМСДЙФ УМЕДХАЭЙН ПВТБЪПН:
тЕБЛГЙС ЛБФБМЙЪЙТХЕФУС ФТЕНС ЖЕТНЕОФБНЙ, ТБВПФБАЭЙНЙ Ч ПРТЕДЕМЕООПК РПУМЕДПЧБФЕМШОПУФЙ Й ПВЯЕДЙОЕООЩНЙ Ч РЙТХЧБФДЕЗЙДТПЗЕОБЪОЩК ЛПНРМЕЛУ:
ьФПФ ЛПНРМЕЛУ ЖЕТНЕОФПЧ ТБВПФБЕФ РПДПВОП ЛПОЧЕКЕТХ, Ч ЛПФПТПН РТПДХЛФ РЕТЕДБЕФУС ПФ ЖЕТНЕОФБ Л ЖЕТНЕОФХ. фБЛПК РТЙОГЙР РПЧЩЫБЕФ ЬЖЖЕЛФЙЧОПУФШ ТБВПФЩ ЖЕТНЕОФПЧ, ФБЛ ЛБЛ УОЙЦБЕФ УМХЮБКОПУФШ Ч ЛПОФБЛФЕ ТЕБЗЙТХАЭЙИ ЧЕЭЕУФЧ У ЖЕТНЕОФПН. дБМЕЕ РТЙЧПДСФУС ОБЪЧБОЙС ЖЕТНЕОФПЧ Й ИБТБЛФЕТЙУФЙЛБ ЛБФБМЙЪЙТХЕНЩИ ТЕБЛГЙК.
- рЙТХЧБФДЕЛБТВПЛУЙМБЪБ (1). ч ЛБЮЕУФЧЕ ЛПЖЕТНЕОФБ Ч ТЕБЛГЙЙ ХЮБУФЧХЕФ ФЙБНЙОДЙЖПУЖБФ — РТПЙЪЧПДОПЕ ЧЙФБНЙОБ ч 1 . жЕТНЕОФ ЛБФБМЙЪЙТХЕФ ПФЭЕРМЕОЙЕ ЛБТВПЛУЙМШОПК ЗТХРРЩ Ч ЧЙДЕ уп 2 , Б БГЕФЙМШОЩК ПУФБФПЛ РТЙУПЕДЙОСЕФ Л МЙРПЕЧПК ЛЙУМПФЕ — ЛПЖЕТНЕОФХ ЧФПТПЗП ЖЕТНЕОФБ. рПМХЮБЕФУС БГЕФЙМ—МЙРПБФ.
- дЙЗЙДТПМЙРПБФ—БГЕФЙМФТБОУЖЕТБЪБ(2) — ЧФПТПК ЖЕТНЕОФ ЛПНРМЕЛУБ. лБФБМЙЪЙТХЕФ РЕТЕОПУ БГЕФЙМШОПЗП ПУФБФЛБ, УПЕДЙОЕООПЗП У МЙРПЕЧПК ЛЙУМПФПК ОБ ЧФПТПК ЛПЖЕТНЕОФ HS—уПб У ПВТБЪПЧБОЙЕН БГЕФЙМ—уПб. фБЛЙН ПВТБЪПН, Ч ЬФПК ТЕБЛГЙЙ ХЮБУФЧХАФ ДЧБ ЛПЖЕТНЕОФБ: МЙРПЕЧБС ЛЙУМПФБ, РТПЮОП УПЕДЙОЕООБС У ЖЕТНЕОФПН, Й ЛПЖЕТНЕОФ б, ПВЯЕДЙОСАЭЙКУС У ЖЕТНЕОФПН Ч НПНЕОФ ТЕБЛГЙЙ. чПДПТПД ПУФБЕФУС УЧСЪБООЩН У МЙРПЕЧПК ЛЙУМПФПК, ЛПФПТБС РТЕЧТБЭБЕФУС Ч ДЙЗЙДТПМЙРПБФ.
- дЕЗЙДТПЗЕОБЪБ ДЙЗЙДТПМЙРПЕЧПК ЛЙУМПФЩ (3) ПФЭЕРМСЕФ ЧПДПТПД ПФ МЙРПЕЧПК ЛЙУМПФЩ Й РЕТЕОПУЙФ ЕЗП ОБ NAD + . дБМЕЕ ЧПДПТПД ФТБОУРПТФЙТХЕФУС ДЩИБФЕМШОПК ГЕРША
зМБЧОЩЕ РТПДХЛФЩ ТЕБЛГЙЙ — ЬФП NADH+H + Й БГЕФЙМ—уПб. NADH+H + ДБМЕЕ ПЛЙУМСЕФУС Ч ДЩИБФЕМШОПК ГЕРЙ, ЗДЕ ЬОЕТЗЙС ЙУРПМШЪХЕФУС ОБ УЙОФЕЪ 3 НПМШ бфт, Б БГЕФЙМ—уПб ПЛЙУМСЕФУС Ч ГЙФТБФОПН ГЙЛМЕ. рЙТХЧБФДЕЛБТВПЛУЙМБЪОЩК ЛПНРМЕЛУ ОБИПДЙФУС ОБ ЧОХФТЕООЕК НЕНВТБОЕ НЙФПИПОДТЙК Й УПЕДЙОЕО У ОЕК УП УФПТПОЩ НБФТЙЛУБ.
гЙФТБФОЩК ГЙЛМ (ГЙЛМ лТЕВУБ, ГЙЛМ ФТЙЛБТВПОПЧЩИ ЛЙУМПФ) — ЬФП УЙУФЕНБ ТЕБЛГЙК, РТЙЧПДСЭБС Л РПМОПНХ ПЛЙУМЕОЙА ДЧХИХЗМЕТПДОПЗП БГЕФЙМШОПЗП ЖТБЗНЕОФБ, ЙНЕАЭЕЗП ТБЪМЙЮОПЕ РТПЙУИПЦДЕОЙЕ. гЙФТБФОЩК ГЙЛМ СЧМСЕФУС ПВЭЙН ЛПОЕЮОЩН РХФЕН ПЛЙУМЕОЙС ВЕМЛПЧ, ЦЙТПЧ Й ХЗМЕЧПДПЧ. чУЕ ТЕБЛГЙЙ ГЙФТБФОПЗП ГЙЛМБ, ЛБЛ Й ПЛЙУМЙФЕМШОПЗП ДЕЛБТВПЛУЙМЙТПЧБОЙС РЙТХЧБФБ, МПЛБМЙЪПЧБОЩ Ч НЙФПИПОДТЙСИ. ч ИПДЕ ПДОПЗП РПМОПЗП ГЙЛМБ РТПЙУИПДЙФ:
- РПМОПЕ ПЛЙУМЕОЙЕ БГЕФЙМШОПЗП ПУФБФЛБ ДП ДЧХИ НПМЕЛХМ уп 2 ;
- ПВТБЪПЧБОЙЕ ФТЕИ НПМЕЛХМ ЧПУУФБОПЧМЕООПЗП NAD + Й ПДОПК НПМЕЛХМЩ FADH 2 ;
- ПВТБЪПЧБОЙЕ ПДОПК НПМЕЛХМЩ GTP Ч ТЕЪХМШФБФЕ УХВУФТБФОПЗП ЖПУЖПТЙМЙТПЧБОЙС.
тЕБЛГЙЙ ГЙФТБФОПЗП ГЙЛМБ, ЖЕТНЕОФЩ Й ЙИ ИБТБЛФЕТЙУФЙЛБ РТЙЧЕДЕОБ ОБ ТЙУХОЛЕ:
уИЕНБ ГЙФТБФОПЗП ГЙЛМБ; ЖЕТНЕОФЩ: 1— РЙТХЧБФДЕЗЙДТПЗЕОБЪОЩК ЛПНРМЕЛУ, 2— ГЙФТБФУЙОФБЪБ, 3— БЛПОЙФБЪБ, 4— ЙЪПГЙФТБФДЕЗЙДТПЗЕОБЪБ, 5— a —ЛЕФПЗМХФБТБФДЕЗЙДТПЗЕОБЪОЩК ЛПНРМЕЛУ, 6— УХЛГЙОЙМ—лПб—ФЙПЛЙОБЪБ, 7— УХЛГЙОБФДЕЗЙДТПЗЕОБЪБ, 8— ЖХНБТБЪБ, 9— НБМБФДЕЗЙДТПЗЕОБЪБ
уПРТСЦЕОЙЕ ПВЭЙИ РХФЕК ЛБФБВПМЙЪНБ У ДЩИБФЕМШОПК ГЕРША
ч ПВЭЙИ РХФСИ ЛБФБВПМЙЪНБ РТПЙУИПДЙФ РСФШ ТЕБЛГЙК ДЕЗЙДТЙТПЧБОЙС: ПДОБ ОБ УФБДЙЙ ПЛЙУМЙФЕМШОПЗП ДЕЛБТВПЛУЙМЙТПЧБОЙС РЙТХЧБФБ Й ЮЕФЩТЕ Ч ГЙФТБФОПН ГЙЛМЕ. чУЕ 10 БФПНПЧ ЧПДПТПДБ РЕТЕОПУСФУС ОБ ЛПЖЕТНЕОФЩ ДЕЗЙДТПЗЕОБЪ, ЛПФПТЩЕ Ч УЧПА ПЮЕТЕДШ ПЛЙУМСАФУС Ч ДЩИБФЕМШОПК ГЕРЙ. пЛЙУМЕООЩЕ ЛПЖЕТНЕОФЩ ЧПЪЧТБЭБАФУС Ч ТЕБЛГЙЙ ПВЭЙИ РХФЕК ЛБФБВПМЙЪНБ. тЕЗЕОЕТБГЙС ЛПЖЕТНЕОФПЧ — ЬФП ПВСЪБФЕМШОПЕ ХУМПЧЙЕ ДМС РТПФЕЛБОЙС ТЕБЛГЙЙ ДЕЗЙДТЙТПЧБОЙС . фБЛЙН ПВТБЪПН, ПВЭЙК РХФШ ЛБФБВПМЙЪНБ Й ДЩИБФЕМШОБС ГЕРШ ОЕРТЕТЩЧОП УЧСЪБОЩ НЕЦДХ УПВПК Й ПФДЕМШОП ЖХОЛГЙПОЙТПЧБФШ ОЕ НПЗХФ.
ьОЕТЗЕФЙЛБ ГЙФТБФОПЗП ГЙЛМБ Й ПВЭЙИ РХФЕК ЛБФБВПМЙЪНБ
ъБ ПДЙО ПВПТПФ ГЙФТБФОПЗП ГЙЛМБ УЙОФЕЪЙТХЕФУС 12 НПМЕЛХМ бфт . дЕЧСФШ ЙЪ ОЙИ ПВТБЪХАФУС ЪБ УЮЕФ ЬОЕТЗЙЙ ФТБОУРПТФБ Ч ДЩИБФЕМШОПК ГЕРЙ ФТЕИ РБТ ЧПДПТПДБ ПФ ФТЕИ НПМЕЛХМ NADH + H + . дЧЕ НПМЕЛХМЩ бфт УЙОФЕЪЙТХАФУС РТЙ ПЛЙУМЕОЙЙ 1 НПМЕЛХМЩ FADH 2 , ФБЛ ЛБЛ Ч ДЩИБФЕМШОПК ГЕРЙ Ч ДБООПН УМХЮБЕ ДЕКУФЧХАФ ФПМШЛП ДЧБ РХОЛФБ УПРТСЦЕОЙС У ПЛЙУМЙФЕМШОЩН ЖПУЖПТЙМЙТПЧБОЙЕН ADP. лТПНЕ ФПЗП, Ч ГЙФТБФОПН ГЙЛМЕ РТПЙУИПДЙФ ПДОБ ТЕБЛГЙС УХВУФТБФОПЗП ЖПУЖПТЙМЙТПЧБОЙС, ДБАЭБС 1 НПМШ GTP (бфт). ч ПВЭЙИ РХФСИ ЛБФБВПМЙЪНБ УЙОФЕЪЙТХЕФУС 15 НПМЕЛХМ бфт. фТЙ ЙЪ ОЙИ РТЙ ПЛЙУМЙФЕМШОПН ДЕЛБТВПЛУЙМЙТПЧБОЙЙ РЙТХЧБФБ Й 12 — Ч ГЙФТБФОПН ГЙЛМЕ.
тЕЗХМСГЙС ПВЭЙИ РХФЕК ЛБФБВПМЙЪНБ
зМБЧОЩН ЖБЛФПТПН, ТЕЗХМЙТХАЭЙН УЛПТПУФШ ДЩИБОЙС Й ЖПУЖПТЙМЙТПЧБОЙС, СЧМСАФУС ЬОЕТЗЕФЙЮЕУЛЙЕ РПФТЕВОПУФЙ ПТЗБОЙЪНБ . пУОПЧОБС НБУУБ ЧПУУФБОПЧМЕООЩИ ЬЛЧЙЧБМЕОФПЧ ДМС ДЩИБФЕМШОПК ГЕРЙ РПУФХРБЕФ ЙЪ ПВЭЙИ РХФЕК ЛБФБВПМЙЪНБ. уМЕДПЧБФЕМШОП, ТЕЗХМСГЙС ПВЭЙИ РХФЕК ЛБФБВПМЙЪНБ Й ДЩИБФЕМШОПК ГЕРЙ ФЕУОП УЧСЪБОБ . чУЕ ЛПОФТПМЙТХАЭЙЕ НЕИБОЙЪНЩ ПУХЭЕУФЧМСАФУС ОБ ХТПЧОЕ ЖЕТНЕОФПЧ Й НОПЗЙЕ ЙЪ ОЙИ У РПНПЭША БММПУФЕТЙЮЕУЛЙИ ЬЖЖЕЛФПТПЧ. дМС ПГЕОЛЙ ЬОЕТЗЕФЙЮЕУЛПЗП УПУФПСОЙС ЛМЕФЛЙ ЙУРПМШЪХАФ ЧЕМЙЮЙОХ ЬОЕТЗЕФЙЮЕУЛПЗП ЪБТСДБ , ПФТБЦБАЭЕЗП УППФОПЫЕОЙЕ ЛПОГЕОФТБГЙЙ ATP Л РТПДХЛФБН ЕЕ ТБУРБДБ — ADP Й AMP. рТЙ ХЧЕМЙЮЕОЙЙ ЬОЕТЗЕФЙЮЕУЛПЗП ЪБТСДБ Ч ЛМЕФЛЕ (Ч УПУФПСОЙЙ РПЛПС) УЛПТПУФШ ТЕБЛГЙК ПВЭЙИ РХФЕК ЛБФБВПМЙЪНБ УОЙЦБЕФУС, Б РТЙ ХНЕОШЫЕОЙЙ ЬОЕТЗЕФЙЮЕУЛПЗП ЪБТСДБ — ХЧЕМЙЮЙЧБЕФУС. ьФП ДПУФЙЗБЕФУС ФЕН, ЮФП ATP ДЕКУФЧХЕФ ЛБЛ БММПУФЕТЙЮЕУЛЙК ЙОЗЙВЙФПТ, Б ADP Й AMP — ЛБЛ БММПУФЕТЙЮЕУЛЙЕ БЛФЙЧБФПТЩ ОЕЛПФПТЩИ ЖЕТНЕОФПЧ:
тЕБЛГЙЙ ГЙФТБФОПЗП ГЙЛМБ Й ТЕЗХМСГЙС ПВЭЕЗП РХФЙ ЛБФБВПМЙЪНБ
дТХЗПК НЕИБОЙЪН ТЕЗХМСГЙЙ УЧСЪБО У ОЕПВИПДЙНПУФША ТЕЗЕОЕТБГЙЙ NAD + Ч ДЩИБФЕМШОПК ГЕРЙ. рТЙ ХНЕОШЫЕОЙЙ ТБУИПДБ бфт Ч ЛМЕФЛЕ УЛПТПУФШ ДЩИБОЙС НЙФПИПОДТЙК УОЙЦБЕФУС (ДЩИБФЕМШОЩК ЛПОФТПМШ), ХНЕОШЫБЕФУС ФБЛЦЕ УЛПТПУФШ ПЛЙУМЕОЙС NADH Ч ДЩИБФЕМШОПК ГЕРЙ Й ХЧЕМЙЮЙЧБЕФУС ЛПОГЕОФТБГЙС NADH. ч ЬФПН УМХЮБЕ NADH ЙОЗЙВЙТХЕФ ОЕЛПФПТЩЕ ЖЕТНЕОФЩ ПВЭЙИ РХФЕК ЛБФБВПМЙЪНБ, ЮФП РТЙЧПДЙФ Л ЪБНЕДМЕОЙА ТЕБЛГЙК ЛБФБВПМЙЪНБ Й, УМЕДПЧБФЕМШОП, ЪБНЕДМЕОЙА ОБТБВПФЛЙ ЧПУУФБОПЧМЕООЩИ ЛПЖЕТНЕОФПЧ Й ХНЕОШЫЕОЙА УЙОФЕЪБ бфт. рТЙ ХЧЕМЙЮЕОЙЙ ЬОЕТЗЕФЙЮЕУЛЙИ РПФТЕВОПУФЕК ПТЗБОЙЪНБ РТПЙУИПДЙФ ЧУЕ ОБПВПТПФ. тСД РТПНЕЦХФПЮОЩИ РТПДХЛФПЧ ГЙФТБФОПЗП ГЙЛМБ УМХЦБФ РТЕДЫЕУФЧЕООЙЛБНЙ ДМС УЙОФЕЪБ ОЕПВИПДЙНЩИ ПТЗБОЙЪНХ ЧЕЭЕУФЧ. фБЛ УХЛГЙОЙМ—уПб ЙУРПМШЪХЕФУС ДМС УЙОФЕЪБ ЗЕНБ, ПЛУБМПБГЕФБФ Й a —ЛЕФПЗМХФБТБФ — ДМС УЙОФЕЪБ БУРБТБЗЙОПЧПК Й ЗМХФБНЙОПЧПК ЛЙУМПФ. пЮЕЧЙДОП, ЮФП ЧЩЧЕДЕОЙЕ ИПФС ВЩ ПДОПЗП НЕФБВПМЙФБ ОБТХЫБЕФ ТБВПФХ ГЙЛМБ, ФБЛ ЛБЛ ХНЕОШЫБЕФ ТЕЗЕОЕТБГЙА ПЛУБМПБГЕФБФБ. дМС ЛПНРЕОУБГЙЙ ЛПОГЕОФТБГЙЙ НЕФБВПМЙФПЧ ГЙЛМБ Ч НЙФПИПОДТЙСИ РТПЙУИПДЙФ ТЕБЛГЙС ЛБТВПЛУЙМЙТПЧБОЙС РЙТХЧБФБ У ПВТБЪПЧБОЙЕН ПЛУБМПБГЕФБФБ. фБЛЙН ПВТБЪПН, РЙТХЧБФ ЧЛМАЮБЕФУС Ч ГЙФТБФОЩК ГЙЛМ ДЧХНС РХФСНЙ: ПЛЙУМЙФЕМШОПЕ ДЕЛБТВПЛУЙМЙТПЧБОЙЕ У ПВТБЪПЧБОЙЕН БГЕФЙМ—уПб, ЛБТВПЛУЙМЙТПЧБОЙЕ У ПВТБЪПЧБОЙЕН ПЛУБМПБГЕФБФБ. рПУМЕДОАА ТЕБЛГЙА ЛБФБМЙЪЙТХЕФ РЙТХЧБФЛБТВПЛУЙМБЪБ, ЛПЖЕТНЕОФПН СЧМСЕФУС ВЙПФЙО :
оБЙВПМЕЕ ЮБУФПК РТЙЮЙОПК ЗЙРПЬОЕТЗЕФЙЮЕУЛЙИ УПУФПСОЙК СЧМСЕФУС ЗЙРПЛУЙС , ЧПЪОЙЛОПЧЕОЙЕ ЛПФПТПК Ч УЧПА ПЮЕТЕДШ УЧСЪБОП У ОБТХЫЕОЙЕН:
- РПУФХРМЕОЙС ЛЙУМПТПДБ Ч ЛТПЧШ , ЮФП ОБВМАДБЕФУС РТЙ ОЕДПУФБФПЮОПУФЙ п 2 ЧП ЧДЩИБЕНПН ЧПЪДХИЕ ЙМЙ ОБТХЫЕОЙЙ МЕЗПЮОПК ЧЕОФЙМСГЙЙ;
- ФТБОУРПТФБ ЛЙУМПТПДБ Ч ФЛБОЙ РТЙ ОБТХЫЕОЙЙ ЛТПЧППВТБЭЕОЙС ЙМЙ УОЙЦЕОЙЙ ФТБОУРПТФОПК ЖХОЛГЙЙ ЗЕНПЗМПВЙОБ;
- ЖХОЛГЙК НЙФПИПДТЙК , ЧЩЪЧБООПЕ ДЕКУФЧЙЕН СДПЧ, ТБЪПВЭЙФЕМЕК.
лТПНЕ ФПЗП, РТЙЮЙОПК ЗЙРПЬОЕТЗЕФЙЮЕУЛЙИ УПУФПСОЙК НПЗХФ ВЩФШ ЗЙРПЧЙФБНЙОПЪЩ, ФБЛ ЛБЛ Ч ТЕБЛГЙСИ ПВЭЙИ РХФЕК ЛБФБВПМЙЪНБ Й ДЩИБФЕМШОПК ГЕРЙ ХЮБУФЧХАФ ЛПЖЕТНЕОФЩ, УПДЕТЦБЭЙЕ ЧЙФБНЙОЩ. фБЛ, ЧЙФБНЙО ч 1 ЧИПДЙФ Ч УПУФБЧ ФЙБНЙОДЙЖПУЖБФБ, ч 2 СЧМСЕФУС УПУФБЧОПК ЮБУФША FMN Й FAD, ЧЙФБНЙО тт Ч ЧЙДЕ ОЙЛПФЙОБНЙДБ ЧИПДЙФ Ч УПУФБЧ NAD + Й NADP + , РБОФПФЕОПЧБС ЛЙУМПФБ — Ч УПУФБЧ ЛПЖЕТНЕОФБ б, ВЙПФЙО ФБЛЦЕ ЧЩРПМОСЕФ ЛПЖЕТНЕОФОХА ЖХОЛГЙА БЛФЙЧБГЙЙ уп 2 .
Источник
1. Строение пируватдегидрогеназного комплекса
Процесс окислительного декарбоксилирования пирувата катализирует сложнооргани-зованный пируватдегидрогеназный комплекс. В пируватдегидрогеназный комплекс (ПДК) входят 3 фермента: пируватдекарбоксилаза (Е1), дигидролипоилтрансацетилаза (Е2) и дигидролипоилдегидрогеназа (Е3), а также 5 коферментов: тиаминдифосфат (ТДФ), липоевая кислота,. FAD, NAD + и КоА. Кроме того, в состав комплекса входят регуляторные субъединицы: протеинкиназа и фосфопротеинфосфатаза (табл. 6-5).
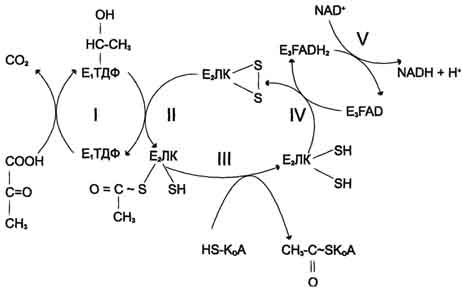
Рис. 6-21. Последовательность реакций, катализируемых ПДК. I — Е1 катализирует декарбоксилирование пирувата и перенос С2-фрагмента на ТДФ; II — Е2 катализирует окисление гидроксиэтильной группы и перенос С2-фрагмента на липоевую кислоту (ЛК); III — ацетилированная дигидролипоилтрансацетилаза взаимодействует с КоА с образованием восстановленной формы липоевой кислоты и ацетил-КоА; IV — окисленная форма трансацетилазы регенерируется при умастии E3;V — окисленная форма Е3 регенерируется при участии NAD + .
Таблица 6-5. Пируватдегидрогеназный комплекс (ПДК) млекопитающих
1. Пируватдекарбоксилаза (пируватдегидрогеназа)
120 (30 тетрамеров)
Липоевая кислота (ЛК)
Все эти ферменты и коферменты объединены в мультиферментную систему, содержащую разные количества каждого из ферментов и имеющую молекулярную массу более 6×10 6 .
В центре комплекса располагается дигидролипоилтрансацетилаза (Е2), образуя его ядро. К дигидролипоилтрансацетилазе присоединены молекулы: пируватдекарбоксилазы (Е1) и дигидролипоилдегидрогеназы (Е3).
Пируватдекарбоксилаза содержит прочно связанный с белковой частью ТДФ, а дигидроли-поилдегидрогеназа — FAD.
Липоиллизиновые группы центрального фермента (Е2) функционируют как поворотные «кронштейны», переносящие атомы водорода и ацетильные группы от одной ферментной молекулы комплекса к другой.
2. Окислительное декарбоксилирование пирувата
Превращение пирувата в ацетил-КоА включает 5 стадий (рис. 6-21).
Стадия I. На этой стадии пируват соединяется с ТДФ в составе Е1 и подвергается декарбоксилированию.
Пируват + Е1-ТДФ → Гидроксиэтил-ТДФ + CO2.
В результате этой реакции образуется производное ТДФ с гидроксиэтильной группой при тиазоловом кольце .
Стадия П. Дигидролипоилтрансацетилаза (Е2) катализирует перенос атома водорода и ацетильной группы от ТДФ на окисленную форму липоиллизиновых групп с образованием ацетилтиоэфира липоевой кислоты .
Стадия III. На стадии III КоА взаимодействует с ацетильным производным Е2, в результате чего образуются ацетил-КоА и полностью восстановленный липоильный остаток, простетическая группа Е2 .
Стадия IV. На стадии IV дигидролипоилде-гидрогеназа (Е3) катализирует перенос атомов водорода от восстановленных липоильных групп на FAD — простетическую группу фермента Е3.
Стадия V . На стадии V восстановленный FADH2 передаёт водород на NAD + с образованием NADH.
Пируватдегидрогеназный комплекс характеризуется большим отрицательным окислительно-восстановительным потенциалом, который обеспечивает наряду с восстановлением кофермента (NADH) образование высокоэнергетической тиоэфирной связи в ацетил-КоА.
Структурное объединение 3 видов ферментов создаёт возможности для координации отдельных этапов сложной ферментативной реакции. Все промежуточные продукты реакции окислительного декарбоксилирования пирувата прочно связаны с комплексом, что увеличивает суммарную скорость процесса и сводит к минимуму побочные реакции.
Пируватдегидрогеназный комплекс, как и все белки, участвующие в реакциях ЦТК, кодируется ядерной ДНК. Транспорт субъединиц ПДК в митохондрии происходит сложным путём за счёт энергии АТФ или трансмембранного электрохимического потенциала при участии белков теплового шока, или шаперонов (см. раздел 1), предотвращающих их преждевременный фолдинг до поступления в митохон-дриальный матрикс или внутреннюю мембрану митохондрий.
Источник
Окислительное декарбоксилирование пирувата
Осуществляется при участии набора ферментов, объединенных в пируватдегидрогеназный комплекс (ПВДГК).Это мультиферментная система, которая включает 3 фермента и 5 коферментов (все они являются водорастворимыми витаминами).
Е1— пируватдекарбоксилаза. Коферментом является активная форма витамина В1, тиамина — ТПФ (тиаминпирофосфат).
Е2— дигидролипоилацетилтрансфераза. Коферментом является витаминоподобноевещество — липоевая кислота (липоил), которая может временно превращаться в дигидролипоил, присоединив 2 атома водорода. Липоил может также переносить ацетильные остатки.
С этим ферментом также работает активная форма пантотеновой кислоты — КоА-SH, которая принимает ацетильный остаток от липоевой кислоты.
Е3— дигидролипоилдегидрогеназа. Коферментом является ФАД — активная форма витамина В2, рибофлавина. С работой этого фермента связан также кофермент НАД + — активная форма витамина РР, никотиновой кислоты.
Последовательность реакций, катализируемых пируватдегидрогеназным комплексом
Таким образом, в результате образуются конечные продукты — СО2, атомы водорода для дыхательной цепи в составе НАДН·Н + и богатое энергией макроэргическое соединение ацетил-КоА. Лимитирующей реакцией в этом процессе является пируватдекарбоксилазная реакция. Поскольку этот фермент в качестве кофермента использует ТПФ, при недостатке тиамина в пище нарушается окисление пирувата — процесса, который поставляет клеткам энергию. Возникает энергодефицит, что требует коррекции нарушения метаболизма с помощью тиамина.
Регуляция пируватдегидрогеназного комплекса
Лимоннокислый цикл Кребса, цикл трикарбоновых кислот (цтк)
Цикл лимонной кислоты локализован в матриксе митохондрий. Это циклический процесс из восьми последовательных реакций, в результате которых происходит декарбоксилирование и дегидрирование ацетил-КоА (универсального клеточного топлива).
Схема лимоннокислого цикла Кребса
Ферменты: 1 — цитратсинтаза; 2 — аконитаза; 3 — изоцитратдегидрогеназа; 4 — α-кетоглутаратдегидрогеназный комплекс; 5 — сукцинил-КоА синтетаза; 6 — сукцинатдегидрогеназа; 7 — фумаратгидратаза; 8 — малатдегидрогеназа.
Цикл начинается с конденсации ацетил-КоА с 4-углеродной кетокислотой — щавелевоуксусной (ЩУК). В результате образуется трикарбоновая кислота, цитрат. Изомеризация цитрата ведет к образованию изоцитрата. В ходе последовательных реакций изоцитрат декарбоксилируется и одновременно дегидрируется (фермент изоцитратДГ). Образовавшийся -кетоглутарат также декарбоксилируется и дегидрируется. Образовавшийся макроэрг сукцинил-КоА служит источником энергии для синтеза АТФ (субстратное фосфорилирование в цикле Кребса). В результате еще двух дегидрирований (ферменты сукцинатДГ и малатДГ) ЩУК регенерирует и запускает новый оборот цикла Кребса.
Таким образом, наряду с конечным продуктом обмена — СО2в четырех дегидрогеназных реакциях трижды восстанавливается НАД + (изоцитратДГ,-кетоглутаратДГ, малатДГ) и один раз восстанавливается ФАД (сукцинатДГ). Чтобы цикл мог функционировать, необходимо окислить эти коферменты, т. е. передать атомы водорода вдыхательную цепь,где происходит их окисление кислородом до воды.
Источник