МЕТАБОЛИТЫ
МЕТАБОЛИТЫ (греч, metabole перемена, превращение) — вещества, подвергающиеся хим. превращениям в организме в процессе промежуточного обмена веществ (метаболизма) .
За счет действия разного рода регуляторных механизмов динамические концентрации М. в здоровом организме поддерживаются на постоянном уровне, характерном для каждого М. Средние величины этих концентраций (с указанием пределов колебаний) служат одной из характеристик нормы. При патол, состояниях концентрации М. изменяются, причем эти изменения часто бывают специфичными для той или иной болезни. На этом основаны многие биохим, методы лаб. диагностики болезней.
Многие М. поступают в организм извне в составе пищи и являются предшественниками других М., образующихся в организме. Вещества в живой клетке последовательно превращаются сначала в один М., из к-рого образуется другой, и т. д. Такие последовательности превращений называют метаболическими путями. Напр., метаболический путь распада глюкозы до молочной кислоты включает такую последовательность М.: глюкоза —> глюкозо-6-фосфат —> фруктозо-6-фосфат —> фруктозо-1,6-дифосфат —> фосфоглицериновый альдегид 1,3-дифосфоглицериновая к-та —> фосфоенолпировиноградная к-та —> Пировиноградная к-та —> молочная к-та. Каждый метаболит образуется из своего предшественника в результате действия специфического фермента и, в свою очередь, служит субстратом для другого фермента (см. Ферменты). На этом основано избирательное прерывание метаболических цепей с помощью антиметаболитов (см.) — структурных аналогов метаболитов, к-рые используются в качестве лекарственных средств, а также в экспериментальных исследованиях.
В процессе метаболизма образуются М., являющиеся структурно-функциональными компонентами клетки, напр, такие, как коферменты, гормоны и другие регуляторные вещества, белки, нуклеиновые к-ты, структурные полисахариды и т. д. Следует, однако, отметить, что термин «метаболиты» к высокомолекулярным веществам применяют редко. М. могут превращаться в конечные продукты обмена веществ (конечные М.), выводимые из организма. Основными конечными М. для многих животных и человека являются углекислота (CO2), вода, мочевина (у рептилий и птиц вместо мочевины образуется мочевая к-та). Ряд конечных М., в т. ч. М. чужеродных соединений, выводится в форме глюкуронидов, сульфатов, продуктов микросомного окисления.
Клетки разных видов животных имеют как сходство, так и различия по составу М. Напр., аминокислоты, нуклеотиды, многие коферменты и др. являются универсальными для всех форм жизни. Напротив, М., являющиеся предшественниками незаменимых пищевых факторов человека — витаминов, незаменимых аминокислот, незаменимых жирных к-т и т. п., отсутствуют в организме человека, но имеются у многих микроорганизмов, растений и нек-рых животных, способных синтезировать эти вещества,
Источник
Первичные метаболиты это витамины
Диауксия — появление одной или нескольких переходных (т. е. временных) фаз роста в культуре. Это происходит, когда бактерии находятся в среде, содержащей два или более альтернативных источника питания. Часто бактерии используют один источник, предпочитая его другому, пока этот первый не истощится. Тогда бактерии переключаются на другой источник питания. Однако рост заметно замедляется еще до того, как произошла смена источника питания. Примером является Е. coli — бактерия, обычно обитающая в кишечнике. В качестве источника энергии и углерода она может использовать глюкозу или лактозу. Если присутствуют оба углевода, то вначале используется глюкоза, а затем рост замедляется до тех пор, пока не образуются ферменты, сбраживающие лактозу.
Образование первичных и вторичных метаболитов
Первичные метаболиты — это продукты метаболизма, необходимые для роста и выживания.
Вторичные метаболиты — продукты метаболизма, которые не требуются для роста и не существенны для выживания. Тем не менее они выполняют полезные функции и часто защищают от действия других конкурирующих микроорганизмов либо подавляют их рост. Некоторые из них токсичны для животных, поэтому они могут использоваться в качестве химического оружия. В наиболее активные периоды роста чаще всего они не образуются, но начинают производиться при замедлении роста, когда становятся доступными резервные материалы. Вторичными метаболитами являются некоторые важные антибиотики.
Измерение роста бактерий и грибов в культуре
В предыдущем разделе мы проанализировали типичную кривую роста бактерий. Можно ожидать, что такая же кривая характеризует рост дрожжей (одноклеточных грибов) или рост любой культуры микроорганизмов.
При анализе роста бактерий или дрожжей мы можем либо непосредственно подсчитывать число клеток, либо измерять некоторые параметры, зависимые от числа клеток, например мутность раствора или выделение газа. Обычно небольшое количество микроорганизмов засевают в стерильную питательную среду и выращивают культуру в инкубаторе при оптимальной температуре роста. Остальные условия должны быть как можно более близкими к оптимальным (разд. 12.1). Рост следует измерять от момента инокуляции.
Обычно в научных исследованиях придерживаются хорошего правила — проводить эксперимент в нескольких повторах и ставить контрольные пробы, где это можно и нужно. Некоторые методики измерения роста требуют определенного навыка и даже в руках специалистов они не очень точны. Поэтому имеет смысл ставить, если возможно, две пробы (один повтор) в каждом эксперименте. Контрольная проба, в которой к питательной среде не добавляли микроорганизмы, покажет, действительно ли вы работаете стерильно. Имея достаточный опыт, можно в совершенстве овладеть всеми описанными методами, поэтому мы советуем сначала попрактиковаться в них, прежде чем они будут использованы в работе над проектом. Определить число клеток можно двумя способами, а именно, подсчитывая либо число жизнеспособных клеток, либо общее число клеток. Число жизнеспособных клеток — это число только живых клеток. Общее число клеток — это суммарное число как живых, так и мертвых клеток; обычно этот показатель определить легче.
Источник
Первичные метаболиты
Ряд метаболитов клетки представляют интерес как целевые продукты ферментации. Их разделяют на первичные и вторичные.
Первичные метаболиты– это низкомолекулярные соединения (молекулярная масса менее 1500 дальтон), необходимые для роста микроорганизмов. Одни из них являются строительными блоками макромолекул, другие участвуют в синтезе коферментов. Среди наиболее важных для промышленности метаболитов можно выделить аминокислоты, органические кислоты, нуклеотиды, витамины и др.
Биосинтез первичных метаболитов осуществляют различные биологические агенты – микроорганизмы, растительные и животные клетки. При этом используются не только природные организмы, но и специально полученные мутанты. Чтобы обеспечить высокие концентрации продукта на стадии ферментации, необходимо создавать продуценты, противостоящие генетически свойственным их природному виду механизмам регуляции. Например, необходимо устранить накопление конечного продукта, репрессирующего или ингибирующего важный фермент для получения целевого вещества.
Производство аминокислот.
В процессе ферментаций, осуществляемых ауксотрофами (микроорганизмы, нуждающиеся для воспроизведения в факторах роста), производят многие аминокислоты и нуклеотиды. Распространенными объектами селекции продуцентов аминокислот являются микроорганизмы, относящиеся к родам Brevibacterium, Corynebacterium, Micrococcus, Arthrobacter.
Из 20 аминокислот, составляющих белки, восемь не могут синтезироваться в организме человека (незаменимые). Эти аминокислоты должны поступать в организм человека с пищей. Среди них особенное значение имеют метионин и лизин. Метионин производится химическим синтезом, а более 80% лизина – биосинтезом. Перспективным является микробиологический синтез аминокислот, так как в результате этого процесса получаются биологически активные изомеры (L-аминокислоты), а при химическом синтезе оба изомера получаются в равных количествах. Поскольку их трудно разделить, половина продукции оказывается биологически бесполезной.
Аминокислоты используют в качестве пищевых добавок, приправ, усилителей вкуса, а также как сырье в химической, парфюмерной и фармацевтической промышленности.
Разработка технологической схемы получения отдельной аминокислоты базируется на знании путей и механизмов регуляции биосинтеза конкретной аминокислоты. Необходимого дисбаланса метаболизма, обеспечивающего сверхсинтез целевого продукта, добиваются путем строго контролируемых изменений состава и условий среды. Для культивирования штаммов микроорганизмов при производстве аминокислот как источники углерода наиболее доступны углеводы – глюкоза, сахароза, фруктоза, мальтоза. Для снижения стоимости питательной среды используют вторичное сырье: свекловичную мелассу, молочную сыворотку, гидролизаты крахмала. Технология этого процесса совершенствуется в направлении разработки дешевых синтетических питательных сред на основе уксусной кислоты, метанола, этанола, н-парафинов.
Производство органических кислот.
В настоящее время биотехнологическими способами в промышленных масштабах синтезируют ряд органических кислот. Из них лимонную, глюконовую, кетоглюконовую и итаконовую кислоты получают лишь микробиологическим способом; молочную, салициловую и уксусную – как химическим, так и микробиологическим способами; яблочную – химическим и энзиматическим путем.
Уксусная кислота имеет наиболее важное значение среди всех органических кислот. Ее используют при выработке многих химических веществ, включая каучук, пластмассы, волокна, инсектициды, фармацевтические препараты. Микробиологический способ получения уксусной кислоты состоит в окислении этанола в уксусную кислоту при участии бактерий штаммов GluconobacterиAcetobacter:
Лимонную кислоту широко используют в пищевой, фармацевтической и косметической промышленности, применяют для очистки металлов. Самый крупный производитель лимонной кислоты – США. Производство лимонной кислоты является старейшим промышленным микробиологическим процессом (1893 г.). Для ее производства используют культуру гриба Aspergillus niger, A. wentii. Питательные среды для культивирования продуцентов лимонной кислоты в качестве источника углерода содержат дешевое углеводное сырье: мелассу, крахмал, глюкозный сироп.
Молочная кислота – первая из органических кислот, которую начали производить путем брожения. Ее используют в качестве окислителя в пищевой промышленности, как протраву в текстильной промышленности, а также при производстве пластмасс. Микробиологическим путем молочную кислоту получают при сбраживании глюкозы Lactobacillus delbrueckii.
Источник
Основные функции продуктов метаболизма в организме человека
Роль метаболитов для организма человека
Метаболизм или обмен веществ – это один из важнейших процессов, протекающих в организме живых существ. Его нарушение может привести к ряду проблем, таких как ожирение. Кроме того, неправильный обмен веществ нередко приводит к проявлению аллергических реакций, может стать причиной атопического дерматита у детей и так далее.
Важную роль в описанном процессе играют метаболиты. Собственно, именно благодаря этим веществам обмен веществ и становится возможным. Они бывают:
Метаболиты последней категории в дальнейшем уже не участвуют ни в каких процессах и выводятся из организма вместе с продуктами жизнедеятельности, а именно с мочой, калом, потом и так далее.
Первичные метаболиты
Вещества именно этой группы имеют наибольшее значение, поскольку встречаются во всех без исключения клетках организма и необходимы для нормальной жизнедеятельности. Выделяют четыре категории первичных метаболитов:
- углеводы;
- белки;
- липиды или жиры;
- нуклеиновые кислоты.
Вещества первой категории встречаются в природе чаще любых других биологических молекул. Среди наиболее важных их функций можно выделить транспортировку и хранение необходимой организму энергии. Великолепно справляются с данной задачей гликоген и крахмал. Кроме того, некоторые углеводы, в частности хитин у животных или целлюлоза у растений, выполняют еще и структурную функцию.
Огромное значение для метаболизма имеют белки. Набор задач, которые они выполняют, крайне широк. Одни из них являются катализаторами, то есть ускоряют химические реакции, протекающие в организме. Другие выполняют механическую функцию, кажем, формируя цитоскилет. Плюс к этому, белки отвечают за регуляцию клеточного цикла, иммунных реакций, а также за передачу сигналов через мембраны. Именно поэтому так важно употреблять в пищу достаточное количество белковой пищи, главным образом, мяса. Это поможет вам, кроме всего прочего, бороться с рядом заболеваний, к примеру, вызванных бактерией proteus.
Липиды являются наиболее эффективными источниками энергии в организме. Это объясняется тем, что в них содержится большое количество остатков жирных кислот, которые, в свою очередь, характеризуются крайне низким уровнем окисления. Также липиды выполняют функцию теплоизоляции. Именно поэтому у большинства теплокровных животных основное количество жировой ткани сосредоточено непосредственно под кожными покровами. Фосфолипиды, такие как, холестерин, воск и прочие выполняют структурную функцию, принимая непосредственное участие в построении клеточных мембран и некоторых наружных органов растений.
Из нуклеотидов состоят такие полимерные молекулы, как ДНК и РНК. Основная их функция – это хранение и последующая реализация генетической информации. Нарушения в этих молекулах может привести к очень серьезным заболеваниям и даже мутациям организма. Некоторые вирусы, например, ВИЧ, имеют в своем строении РНК-содержащий геном и благодаря этому могут создавать собственную матрицу ДНК.
В завершение можно сделать, что метаболиты выполняют ряд важнейших функций в жизнедеятельности любого живого организма, в том числе и человека.
Источник
Метаболическое действие микробиоты и метабиотики
*Импакт фактор за 2018 г. по данным РИНЦ
Читайте в новом номере
Микробиота кишечника выполняет важные функции, одна из которых – метаболическая. Микробиота активно участвует практически во всех видах обмена веществ, переваривая различные пищевые ингредиенты: белки, жиры и углеводы, синтезируя витамины. Важнейшими продуктами бактериального расщепления углеводов являются короткоцепочечные жирные кислоты (КЦЖК): уксусная, пропионовая и масляная. Положительные эффекты КЦЖК состоят в стимуляции роста бифидобактерий, подавлении патогенов, снижении уровня токсических метаболитов и канцерогенов, улучшении всасывания Na+, K+, Ca++, Mg++, Zn++; нормализации моторики ЖКТ, энергообеспечении организма, усилении гликогенеза в печени, уменьшении образования кетонов и противовоспалительном действии. Изменение спектра микробных метаболитов является одной из причин развития многих заболеваний кишечника, в т. ч. рака толстой кишки. Поскольку конечные продукты микробного метаболизма зависят как от характера питания, так и от состава микробиоты, прием готовых микробных метаболитов – метабиотиков обладает более предсказуемым эффектом. Они, в частности Хилак форте, эффективны в лечении ряда заболеваний кишечника.
Ключевые слова: метабиотики, микробиота кишечника, короткоцепочечные жирные кислоты, Хилак форте.
Для цитирования: Корниенко Е.А. Метаболическое действие микробиоты и метабиотики // РМЖ. 2016. № 18. С. 1196–1201.
Для цитирования: Корниенко Е.А. Метаболическое действие микробиоты и метабиотики. РМЖ. 2016;18:1196-1201.
Metabolic activities of microbiota and metabiotics
Kornienko E.A.
Saint Petersburg State Pediatric Medical University
Intestinal microbiota has important functions, including a metabolic one. Microbiota is actively involved in almost all types of metabolism, digesting various
food ingredients: proteins, fats and carbohydrates, synthesizing vitamins. Important products of bacterial digestion of carbohydrates are short chain fatty
acids (SCFA): acetic, propionic and butyric. Positive effects of SCFA include promotion of bifidobacteria growth, pathogens inhibition, reduction of the level of toxic and carcinogenic metabolites improvement of Na + , K + , Ca ++ , Mg ++ , Zn ++ absorption; normalization of GIT motility, body energy supply, enhancement
of liver glycogenesis, reduction of ketone formation and anti-inflammatory action.
Changes in the spectrum of microbial metabolites is one of the causes of intestinal diseases, including colon cancer. Since the end products of microbial metabolism depend both on food character and microbiota composition, intake of ready microbial metabolites—metabiotics—has a more predictable effect.
These drugs, in particular, Hylak forte, are effective in the treatment of a variety of intestinal diseases.
Key words: metabiotics, intestinal microbiota, short chain fatty acids, Hylak forte
For citation: Kornienko E.A. Metabolic activities of microbiota and metabiotics // RMJ. 2016. № 18. P. 1196–1201.
В статье рассмотрено метаболическое действие микробиоты и метабиотики
Кишечную микробиоту называют «забытым органом», поскольку только в последние годы стало очевидно, что она не уступает по функциональной значимости другим органам человека. Одна из главных функций микробиоты – метаболическая. В соответствии с концепцией академика А.М. Уголева, существуют два пищевых потока, поступающих из кишечника в другие органы и ткани: первый – результат всасывания продуктов ферментативного гидролиза пищи, а второй – продуктов бактериального гидролиза, который не менее значим. Часть микробных метаболитов утилизируется в кишечнике, другая, довольно значительная часть, поступает через портальную вену в печень, а оттуда немного из них – с общим кровотоком в различные органы и ткани.
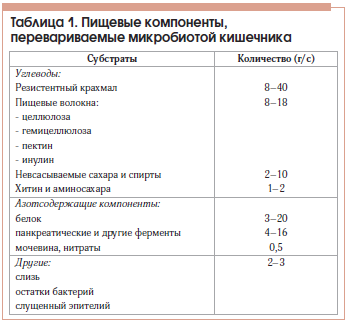
Кишечная микробиота при общей массе кишечных бактерий около 2–4 кг переваривает примерно 50 кг пищевых веществ за год. В таблице 1 представлено примерное количество перевариваемых микробиотой кишечника пищевых компонентов за сутки.
Микробиота кишечника активно участвует практически во всех видах обмена веществ, она может переваривать различные пищевые ингредиенты: белки, жиры и углеводы, а также синтезировать витамины: В1, В2, В3, В5, В6, В12, фолиевую кислоту, К. У животных-гнотобионтов всегда есть признаки гиповитаминоза, особенно витаминов В12 и К, что проявляется снижением уровня протромбина, повышением содержания гомоцистеина в крови. Интересно, что, несмотря на недостаток поступления витамина В12, у вегетарианцев обычно не бывает В12-дефицитной анемии, поскольку этот витамин в достаточном количестве синтезируется микробиотой кишечника. У детей раннего возраста доминируют бактериальные гены, которые способны синтезировать фолаты de novo, а у взрослых – извлекать фолаты из пищи [1].
Метаболические взаимоотношения внутри микробного сообщества кишечника сложны и многоступенчаты: вещества, расщепленные одними бактериями, могут стать пищей для других. Эти пищевые связи становятся основой формирования биоценозов. Оказалось, что любого человека, независимо от половой и расовой принадлежности, можно отнести к одному из 3-х основных микробиологических энтеротипов, и эта принадлежность объясняется приверженностью хозяина определенной пище. Так, для вегетарианцев характерен Prevotella-доминирующий энтеротип, для предпочитающих мясную пищу – Bacteroidetes-доминирующий, для питающихся разнообразной пищей – Ruminococci-доминирующий [2]. Изменение характера питания довольно быстро приводит к определенным изменениям микробного содружества. Исследования метагенома кишечной микробиоты показали значительные его индивидуальные отличия, но при всем разнообразии микробиоты ее метаболом (совокупность продуктов микробного метаболизма) не столь многообразен. Изучение спектра кишечных метаболитов взрослых и детей показало, что у детей доминируют продукты метаболизма углеводов и витамины, а у взрослых относительно выше доля продуктов гидролиза белка [1]. Это можно объяснить как особенностями питания, так и характером микробиоты (доминированием бифидобактерий у детей и строгих анаэробов у взрослых).
Базовые ферментативные реакции в кишечнике человека сходны с таковыми у травоядных: гидролиз полисахаридов, олигосахаридов и дисахаридов до простых сахаров, которые затем ферментируются, сопровождаясь увеличением биомассы бактерий. Гидролиз осуществляется бактериальными гидролазами, которых нет среди ферментов, секретируемых пищеварительными железами человека. В процессе ферментации образуется также энергия, которая может использоваться для роста бактерий. Азот для синтеза белка, необходимого бактериям, может поступать из мочевины. Она расщепляется уреазопродуцентами до аммиака и углекислого газа. Бактерии могут расщеплять белок: в толстую кишку (ТСК) взрослого человека поступает примерно 20 г нерасщепленного белка в сутки, а экскретируется с калом лишь 1 г, что свидетельствует о переваривании и потреблении его микробиотой. Микробы-протеолитики присутствуют в кишечнике здорового человека в незначительном количестве, составляя не более 1% биоценоза, но при заболеваниях кишечника их доля может увеличиваться. В результате воздействия их глюкуронидаз происходит гидролиз глюкуронидов, и связанные токсические вещества вновь высвобождаются. Протеолитики образуют изоформы КЦЖК (изокислоты), их доля увеличивается при патологии кишечника [3]. Избыток белка в рационе и активность протеолитической микробиоты способствуют синтезу потенциальных канцерогенов, таких как фенилнафтиламины и нитрозамины. Активность бактериальных протеаз зависит от возраста и характера питания. Так, жители США имеют значительно больший уровень уреазной активности по сравнению с аборигенами тихоокеанских островов, преимущественно питающимися углеводами и пищевыми волокнами (ПВ). Спектр бактериальных ферментов американцев более напоминает таковой у хищников, а у жителей островов сходен с таковым у травоядных животных [4].
Кишечные микробы способны переваривать и жиры – гидролиз как средне-, так и длинноцепочечных триглицеридов осуществляют не менее 7 бактериальных ферментов: ацетил-коэнзимА-синтетаза, ацетил-коэнзимА-дегидрогеназа, 3-кетоацил-коэнзимА-тиолаза, изомераза, эпимераза и др. [5]. В результате образуются жирные кислоты, кетокислоты, глицерин, углекислый газ. Полиненасыщенные жирные кислоты могут трансформироваться в насыщенные: трансвециновую и стеариновую.
Микробиота может расщеплять и эндогенные, и экзогенные гликопротеины. Некоторые микроорганизмы метаболизируют промежуточные продукты деградации: водород, лактат, сукцинат, формат, этанол до конечных продуктов [6]. Другие потребляют водород и СО2, продуцируя метан, или конвертируют СО2 в ацетат. Метан отражает активность метаногенов в кишечнике, он чаще образуется у людей, употребляющих много ПВ [7].
Важное патогенетическое значение имеет микробный метаболизм желчных кислот (ЖЧК). Под влиянием бактериальной 7-α-дегидроксилазы хенодеоксихолевая кислота деконъюгируется и образует деоксихолевую кислоту, которая, в отличие от предшественницы, не всасывается и может способствовать пролиферации эпителия ТСК, т. е. обладает канцерогенным действием. Именно этот механизм канцерогенеза доказан в эксперименте на животных и частично объясняет тот факт, что в регионах, где традиционно употребляют много жирной пищи, высока частота рака ТСК [4].
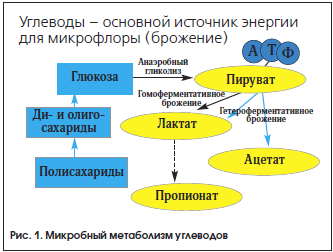
Основными источниками питания и энергии для микробиоты кишечника являются неперевариваемые углеводы (НУ): ПВ, резистентный крахмал, полисахариды, олигосахариды (рис. 1). Раньше считалось, что ПВ выполняют балластную и адсорбтивную функции, но оказалось, что большинство из них способно полностью или частично перевариваться микробиотой кишечника. Среди представителей кишечной микробиоты бактероиды имеют самый мощный набор полисахаридаз и, вследствие этого, лучшие возможности для переваривания НУ.
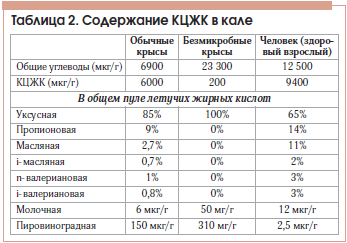
Важнейшими продуктами бактериального расщепления углеводов являются КЦЖК, прежде всего уксусная (С2), пропионовая (С3) и масляная (С4). Их концентрация в ТСК взрослого человека составляет 70–140 ммоль/л в ее проксимальных отделах и 20–70 ммоль/л – в дистальных. Безмикробные животные даже на диете, обогащенной ПВ, не дают прирост КЦЖК, что подтверждает микробное происхождение этих метаболитов (табл. 2).
КЦЖК – важнейшие анионы в полости кишки, они обеспечивают легкое закисление, что способствуют лучшему всасыванию электролитов, а также оказывают подавляющее действие на рост патогенов. В слепой кишке рН ниже, чем в дистальных отделах: в эксперименте было показано, что когда крысы вдоволь питались зернами, рН в проксимальных и дистальных участках соответственно составил 6,14 и 6,87, если поступление ПВ было ограничено – 7,4 и 7,11 [8]. Неферментируемые микробами углеводы не снижают рН, а ферментируемые снижают, особенно в слепой кишке. Но есть компоненты, которые нейтрализуют это влияние, – например, кальций.
Ацетат является основным метаболитом гетероферментативного брожения, свойственного бифидобактериям, и обнаруживается в стуле здоровых детей с первых дней жизни, в возрасте 1 мес. его уровень составляет примерно 70–80 ммоль/л [9]. Он выполняет важные энергетические задачи, всасываясь в кровь и попадая в клетки различных органов и тканей, обеспечивая от 5 до 15% общего калоража. Бутират продуцируется строгими анаэробами, которые появляются в кишечнике ребенка позднее, поэтому в первые месяцы жизни его концентрация в кале незначительна. Однако в дальнейшем его уровень нарастает, составляя у взрослых до 1/3 всех КЦЖК кала [10]. Бутират оказывает прямое воздействие на процессы регенерации кишечного эпителия, укрепляя его барьерные функции. Бутират быстро метаболизируется колоноцитами и является главным источником энергии для них, окисление КЦЖК покрывает 60–70% энергопотребности колоноцитов. Бутират обладает противовоспалительным действием, ингибируя нуклеарный фактор воспаления NFκB и препятствуя деацетилированию гистонов. При язвенном колите установлено снижение КЦЖК и, в частности, бутирата в кале. Внутрикишечное введение КЦЖК больным язвенным колитом снижает степень воспаления [11]. По данным измерения уровня ядерного клеточного антигена пролиферации (PCNA), в 40% клеток в верхушках крипт ТСК при язвенном колите усилена пролиферация, что указывает на предрасположенность к раку, эти изменения редуцируются введением КЦЖК [12].
Переваривание углеводов зависит от индустриального процессинга, способа приготовления пищи, ферментов ЖКТ, скорости кишечного транзита и микробиоты. Потребление НУ у европейцев в среднем составляет 28 г/д, но для поддержания достаточной биомассы бактерий и достаточной продукции КЦЖК необходимо гораздо большее количество НУ – 80 г/д. Это было рассчитано по концентрации КЦЖК в воротной вене. Из 1 г ферментируемых бактериями углеводов образуется примерно 0,6 г КЦЖК [13]. Чтобы получилось необходимое количество КЦЖК, бактериям нужно 32–42 г ферментируемых углеводов. Перевариваемые углеводы дают мало КЦЖК, например, из белого хлеба только 2,8% углеводов достигает подвздошной кишки, в то время как из бобовых – 13,8%. Содержание НУ в пище очень важно, но важны и другие составляющие: пережевывание, скорость кишечного транзита. Но чем больше крахмала съедено, тем больше в итоге достигнет ТСК. Поэтому, к примеру, хотя так называемая итальянская диета содержит мало резистентного крахмала (8,5 г/д), при употреблении большого количества макарон в итоге больше углеводов достигает ТСК и метаболизируется микробиотой.
Уровень КЦЖК в целом и бутирата в частности снижается при замедлении транзита: например, при употреблении зернового хлеба время транзита составило 39 ч, концентрация КЦЖК и бутирата – соответственно 113 и 79 ммоль/г, назначение лоперамида удлиняет время транзита до 74 ч, уровень КЦЖК и бутирата при этом снижается до 82 и 6,0 ммоль/г соответственно [14].
Снижение рН, обусловленное КЦЖК, препятствует росту патогенных бактерий. Например, пропионат и формиат убивают E. coli и Salmonella при рН=5. Чем выше продукция КЦЖК, тем меньше число патогенов. КЦЖК могут помогать в лечении инфекционной и антибиотико-ассоциированной диареи. Включение в питание больных с холерой резистентного крахмала на фоне регидратации уменьшает потерю жидкости и ускоряет выздоровление на 50% [15]. Образование КЦЖК и их абсорбция уменьшают потерю жидкости. Благодаря захвату колоноцитами менее 5% образовавшихся в кишечнике КЦЖК определяется в кале [16]. Захват КЦЖК ассоциирован с транспортом воды. КЦЖК стимулируют кишечное всасывание электролитов (Na + , K + ) и воды [16], а также всасывание Са ++ и Mg ++ , препятствуя тем самым остеопении. В эксперименте было показано, что КЦЖК, введенные в прямую кишку, стимулируют всасывание Са ++ [17].
Назначение КЦЖК влияет на микробную экологию кишки. В экспериментах на животных и наблюдениях за людьми было показано, что при их приеме увеличивается количество лакто- и бифидобактерий. Поскольку бифидобактерии доминируют у младенцев на грудном вскармливании, среди КЦЖК абсолютно доминирует ацетат, но у детей на искусственном вскармливании несколько выше содержание пропионата и бутирата.
КЦЖК улучшают кровоснабжение кишки: ацетат и пропионат в виде ректальных инфузий в 1,5–5 раз усиливают кровоток в органах брюшной полости [18]. Предполагается, что это воздействие реализуется через энтеральную нервную систему и хеморецепторы, а также прямо через гладкую мускулатуру кишки.
Образующиеся в кишечнике КЦЖК поступают через портальный кровоток в печень и могут влиять на моторику верхних отделов ЖКТ. Очевидно, КЦЖК активируют «илеоцекальный тормоз» прямо и дозозависимо. Это было показано по изменению внутрижелудочного давления и увеличению объема желудка. КЦЖК стимулируют рецепторы L-клеток, которые вырабатывают PYY (пептид, замедляющий моторику) в илеоцекальной области. Подобное замедление пассажа пищи приводит к ее лучшему перевариванию. При этом расширение сосудов и улучшение кровоснабжения способствуют увеличению секреции ферментов и всасыванию.
КЦЖК обладают трофическим эффектом на слизистую оболочку кишечника, при полном парентеральном питании введение КЦЖК препятствует развитию атрофии. Диета, богатая ферментируемыми ПВ, усиливает восстановление поврежденных клеток и илеальный рост за счет увеличения содержания глюкагон-подобного пептида-1 [4]. Однако деоксихолевая кислота имеет противоположное действие, усиливая пролиферацию, этот эффект не устраняется бутиратом. Но КЦЖК могут нейтрализовать воздействие ЖЧК за счет снижения рН: при рН≤6 ЖЧК протонируются и становятся нерастворимыми, поэтому не могут захватываться колоноцитами и оказывать повреждающее действие, при низких значениях рН не происходит бактериальной конверсии первичных желчных кислот во вторичные, что снижает их канцерогенный потенциал.
Канцерогенез в ТСК – многоступенчатый процесс, прогрессирующий от гиперпролиферации эпителия, формирования аберрантных крипт, дисплазии и затем только преинвазивной и метастатической карциномы. Каждый из этих этапов сопровождается генетическими нарушениями.
Наблюдение за жителями Африки показало, что потребление грубо обработанного зерна защищает от развития колоректального рака. Trock et al. [19] проанализировали результаты 39 эпидемиологических исследований связи диет и колоректального рака и установили, что употребление клетчатки имело протективный эффект только в 50% из них. Относительный риск аденокарциномы ТСК не отличался существенно при употреблении от 9,8 до 24,9 г/д клетчатки, что было показано на большой когорте (88 000) лиц женского пола в США в течение 16 лет [20]. Интервенционные исследования также не смогли продемонстрировать значимого эффекта. В австралийском исследовании по профилактике рецидивов полипов ТСК пациенты одной группы придерживались строгой диеты с высоким содержанием ПВ и низким содержанием жира, но не достигли какого-либо уменьшения рецидивов полипов в сравнении с теми, кто продолжал находиться на «западной» диете [21]. Не обнаружено и различий в уровне PCNA в ТСК. Однако обнаружена обратная зависимость между потреблением крахмала (150 г/д у урбанизированных жителей и 350 г/д у сельских) и развитием аденокарциномы ТСК [22]. Метаанализ исследований, проведенных в 12 странах мира, не нашел различий между потреблением НУ и развитием рака ТСК (r=-0,23) [22], но обнаружил сильную обратную корреляцию между общим употреблением крахмала и неоплазиями ТСК (r=-0,70). Это соответствует результатам популяционных исследований в странах с низкой частотой рака ТСК, где едят относительно мало клетчатки, но много крахмала (Япония, ЮАР), и тех, где едят мало крахмала, но много неперевариваемых ПВ (например, Австралия) [23].
Наиболее убедительные данные положительной корреляции в развитии рака ТСК подтверждены в отношении ЖЧК, особенно деоксихолевой кислоты. Резистентный крахмал увеличивает уровень экскреции бутирата и снижает экскрецию ЖЧК до 42% [24]. Показан положительный эффект олигофруктозы, но лишь в отношении проксимальных, но не дистальных опухолей [4].
Таким образом, положительные эффекты КЦЖК состоят в:
– стимуляции роста бифидобактерий;
– подавлении патогенов;
– снижении уровня токсических метаболитов и канцерогенов;
– соединении, как у анионов, с Na+, K+, их всасывании вместе с водой;
– снижении рН и усилении всасывания Ca++, Mg++,Zn++;
– нормализации моторики ЖКТ;
– энергообеспечении (до 20% энергообмена);
– усилении гликогенеза в печени, уменьшении образования кетонов.
Каковы способы повышения уровня КЦЖК? Прежде всего питание должно быть рациональным. Применительно к старшим детям и взрослым – это питание продуктами, богатыми резистентным крахмалом и ферментируемыми ПВ. Применительно к детям грудного возраста – это грудное молоко, которое содержит галактоолигосахариды, обладающие пребиотическим действием и селективно стимулирующие рост бифидобактерий. В результате переваривания этих олигосахаридов образуются КЦЖК, преимущественно ацетат. Появление в последние годы новых смесей, содержащих пробиотики и (или) пребиотики, открывает новые горизонты, поскольку они могут оказывать влияние на процесс становления кишечной микробиоты у ребенка.
Однако диета имеет скорее профилактическую направленность и рассчитана на долгосрочный эффект, она не может полностью решить проблемы терапии многих заболеваний, ассоциированных с нарушением функционального состояния кишечной микробиоты:
– функциональных расстройств ЖКТ (синдрома раздраженного кишечника, функциональной диспепсии, функциональных запоров);
– инфекционной и антибиотико-ассоциированной диареи;
– хронических заболеваний кишечника.
В последние годы появился термин «метабиотики», который относится к препаратам, содержащим активные метаболиты кишечных бактерий. Примером такого препарата является Хилак форте, который содержит продукты жизнедеятельности кишечных бактерий: E. coli, Str. faecalis, L. acidophilus, L. helveticus – это преимущественно КЦЖК. В исследованиях была показана клиническая эффективность препарата Хилак форте у детей с заболеваниями кишечника и аллергией, результат не ограничивался повышением уровня КЦЖК, но и проявлялся иммуномодулирующим действием: повышением содержания Th1, уровня SIgA, синтезом TGF-β и снижением содержания IgE. Препарат имеет удобную для дозирования форму в каплях, разрешен в любом возрасте. Детям до 3-х лет Хилак форте назначают по 15–30 капель, старше 3-х лет – по 20–40 капель 3 р./сут. В этом году Хилак форте выпустил новинку – саше с индивидуальной дозой для детей (1,1 мл) и для взрослых (2,2 мл). Теперь препарат можно не дозировать: для однократного применения необходимо добавить содержимое саше в небольшое количество воды, сока или компота. Препарат практически не имеет побочных эффектов и может быть использован как для монотерапии, так и в комплексном лечении заболеваний, требующих коррекции метаболома.
Метаболики способны не просто корректировать состояние кишечной микробиоты, но и позитивно менять ее функциональное состояние, обусловленное спектром микробных метаболитов.
Источник