Нарушение обмена витамина в12
Описание наследственных нарушений каждого этапа метаболизма витамина В12 (кобаламина) в новом свете представило патогенез дефицита кобаламина и фолата (Hall, 1990). Клинические проявления приблизительно одинаковы при всех врожденных нарушениях метаболизма кобаламина, за исключением изолированного дефицита аденозилкобаламина, проявления которого идентичны симптомам метилмалоновой ацидурии (Rosenblatt и Whitehead, 1999; Surtees, 2001; Whitehead, 2006).
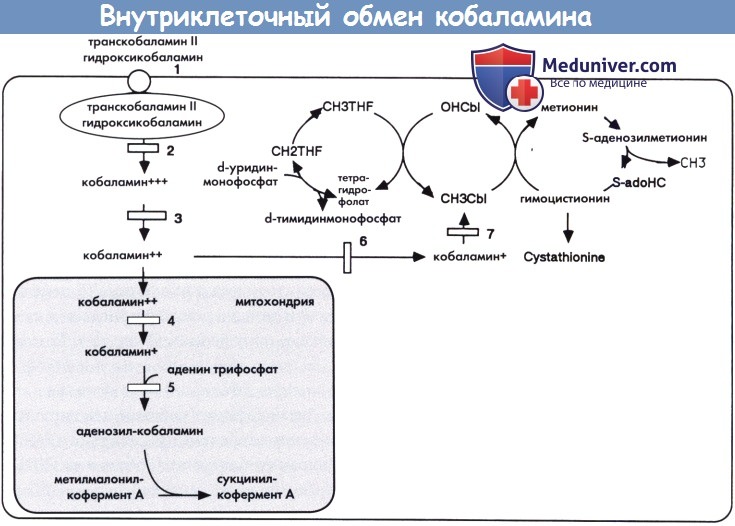
а) Биохимические изменения. Понятие «кобаламин» объединяет группу веществ, выполняющих функцию коферментов в двух клеточных реакциях человека: образовании метионина из гомоцистеина с метилкобаламином в качестве кофермента и превращении метилмалонил-кофермента А в сукцинил-кофермент А с аденозилкобаламином в качестве кофермента. Кобаламин, поступающий с пищей, преимущественно с животными белками, абсорбируется с помощью фактора Касла, затем поступает в кровоток в комплексе с транскобаламином-II после захвата клетками с помощью специфического поверхностного рецептора.
Внутри клетки кобаламин подвергается серии модификаций в результате которых образуется метилкобаламин и аденозилкобаламин. Дефицит кобаламина может быть классифицирован на четыре группы: дети, рожденные матерями с дефицитом кобаламина, дефицит системы абсорбции кобаламина, дефект транспорта витамина и нарушения внутриклеточной утилизации. Четвертая группа соответствует ряду дополнительных групп, обозначаемых от CblA до CblH, каждая из которых связана с специфическим ферментным блоком внутриклеточного метаболизма. В зависимости от участка ферментного дефекта, у пациентов отмечается метилмалоновая ацидурия или гомоцистинурия или их сочетание.
Уровень кобаламина в плазме остается нормальным при всех, за исключением одного (CblF), внутриклеточных дефектах метаболизма кобаламина, а также при дефекте транскобаламина II. С другой стороны, при врожденном гиповитаминозе и дефектах абсорбции отмечается низкий уровень кобаламина в плазме.
Дефицит транскобаламина II (1), кобаламина F (2) и кобаламина С или кобаламина D (3) приводят к нарушению синтеза кофакторов аденозил- и метил-кобаламина, в результате чего возникает комбинированная метилмалоновая ацидурия и гомоцистинурия в сочетании с гипометионинемией. Дефицит кобаламина А (4) и кобаламина В (5) приводят к нарушению синтеза только аденозил-кобаламина, в результате чего возникает изолированная метилмалоновая ацидурия. Дефицит кобаламина Е (6) и кобаламина G (7) приводит к нарушению синтеза только метил-кобаламина, в результате чего возникает гомоцистинурия и гипометионинемия (дефицит кобаламина А, В, С, D, Е, F и G является различными дополнительными группами метилмалоновой ацидурии: см. текст).
б) Генетические изменения. Все нарушения внутриклеточного метаболизма кобаламина наследуются аутосомно- рецессивным путем. Пренатальная диагностика может проводиться путем исследования амниотической жидкости и органических кислот. Дальнейшее подтверждение диагноза проводится на основании измерения количества определенных ферментов в культуре хорионических ворсин или с помощью молекулярного анализа, когда известно о наличии у пациента обеих мутаций (Morel et al., 2005).
в) Патофизиология. Многие неврологические, гематологические и биохимические проявления типичны для приобретенного дефицита кобаламина и фолата, врожденных дефектов абсорбции или транспорта кобаламина и фолата и внутриклеточных нарушений метаболизма кобаламина и фолата. Все виды нарушений приводят к дефициту метионинсинтетазы, играющей ключевую роль в патогенезе нарушений метаболизма кобаламина и фолата (Hall, 1990; Weir и Scott, 1995). Дефицит метионинсинтетазы обладает несколькими предположительными вторичными эффектами, включающими накопление метилтетрагидрофолата (СН3ТГФ) (теория фолатной ловушки), что препятствует ее участию в синтезе кофермента фолата, который необходим для синтеза ДНК и гемопоэза.
Дефицит метионинсинтетазы также приводит к нарушению синтеза метионина и аденозилметионина, который является основным донором метиловых остатков для метилирования многих субстратов, таких как нейротрансмиттеры, основный белок миелина и фосфолипиды плазматических мембран. Считается, что данное нарушение метилирования является причиной подострой сочетанной дегенерации спинного мозга, описанного как при приобретенном, так и врожденном дефекте. Другие факторы могут нарушать структуру и функцию центральной нервной системы при приобретенном и врожденном нарушении метаболизма кобаламина, например, токсическое действие накопленного гомоцистеина может стать причиной сосудистых повреждений и тромбоэмболии, и накопления метилмалонил-кофермента А и пропионил-кофермента А в связи с нарушением активности мутазы.
г) Клинические проявления:
1. Врожденный дефицит витамина В12. Дефицит кобаламина у детей на грудном вскармливании у матерей с субклинической пернициозной анемией или находящихся на строгой вегетарианской диете без достаточного поступления витамина В12 может привести к неврологическому регрессу, аномальным движениям и коме в сочетании с мегалобластной анемией. Введение витамина В12 приводит к быстрому улучшению неврологического статуса, но сохраняется задержка дальнейшего развития (Gutierrez-Aguilar et al., 2005).
2. Дефицит абсорбции и транспорта кобаламина. Нарушения абсорбции и транспорта кобаламина являются причиной синдрома дефицита кобаламина, характеризующегося прогрессирующим течением с началом в возрасте от 1 месяца до нескольких лет. Обычно первые симптомы связаны с желудочно-кишечным трактом, а также включают плохую прибавку в весе, мышечную слабость, вялость и мегалобластную анемию. Несколько месяцев спустя развиваются периферическая нейропатия, миелопатия и энцефалопатия с заметной отсрочкой развития. Нарушения абсорбции связаны с дефицитом фактора Касла или дефектом кубилинамниотического комплекса, который действует в качестве рецептора комплекса IF-кубилин (синдром Имеслунда-Гресбека) (Fyfe et al., 2004).
Дефект транспорта связан с дефицитом транскобаламина II, дефицит которого даже при лечении, может привести к тяжелым неврологическим нарушениям (Monagle и Tauro, 1995).
3. Нарушение внутриклеточного метаболизма. Внутриклеточный дефицит кобаламина, нарушающий синтез только метилкобаламина (кобаламин E/G/F) или метил- и аденозилкобаламина (кобаламин С/D) отмечается при трех основных типах заболевания. Чаще всего встречается тяжелая форма заболевания с началом в раннем возрасте, описанная у новорожденных и младенцев в возрасте до 3-х месяцев. Симптомы включают прогрессирующую сонливость, гипотонию, аномальные движения и/или припадки в сочетании с панцитопенией и мегалобластной анемией. У некоторых пациентов также отмечается полиорганная недостаточность, включающая почечную недостаточность с гемолитическим уремическим синдромом, кардиомиопатию и интерстициальную пневмонию. Поражение сетчатки с гранулярной депигментацией макулы и дальнейшим периферическим пигментным ретинитом часто является ранним признаком дефицита кобаламина С. Сообщающаяся гидроцефалия может быть дальнейшим осложнением.
У небольшого количества пациентов заболевание проявляется в детском возрасте в виде прогрессирующей неврологической деградации, микроцефалии, эпизодических припадков и мегалобластной анемии, которая обычно является основанием для постановки диагноза. При отсутствии лечения острая неврологическая деградация может сочетаться с признаками и симптомами, напоминающими подострую дегенерацию спинного мозга. В редких случаях развития заболевания у подростков и взрослых, отмечалась сходная подострая дегенерация спинного мозга, которой предшествовала острая деградация интеллектуальных функций и иногда поведенческие нарушения. Среди пациентов старшего возраста мегалобластная анемия может быть едва заметной, а пограничный макроцитоз следует рассматривать особенно тщательно (Ogier de Baulny et al., 1998; Roze et al., 2003). Fla KT и MPT выявляется атрофия мозга и/или демиелинизация (Rossi et al., 2001).
д) Лечение нарушения обмена витамина В12. Следует систематически исследовать чувствительность к поддерживающей терапии витамином В12. В зависимости от имеющегося дефекта выбирается использование парентерального или перорального пути введения, фармакологических или минимальных доз и гидроксикобаламина или естественных субстратов кобаламина (метил-, аденозилкобаламина). При нарушении транспорта и внутриклеточных дефектах может потребоваться пополнение запасов метионина путем перорального введения бетаина или дополнительного применения метионина. На основании метаболического пути бетаина предполагается, что дополнительное применение фолиевой кислоты может быть полезным при длительном лечении бетаином. В связи с тем, что эндогенный синтез карнитина зависит от метионина, при состояниях, сопровождающихся нарушением синтеза метионина, может быть эффективно поддерживающее применение карнитина. Логично соблюдение диеты с нормальным содержанием белка и отказ от повышенного потребления белка (Ogier de Baulny et al., 1998).
Редактор: Искандер Милевски. Дата публикации: 14.12.2018
Источник
Метаболизм витамина В12
Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
Витамин В12 (кобаламин) — входит в состав продуктов только животного происхождения: мясо, печень, молоко, яйца, сыр и другие (витамин в тканях животных является производным бактерий). Под влиянием кулинарной обработки и протеолитических ферментов желудка он высвобождается и быстро связывается с «R-binders» (транс-кобаламины I и III) — белками с быстрой (rapid) электро-форетической подвижностью, по сравнению с внутренним фактором; в меньшей степени витамин В12 соединяется с внутренним фактором (ВФ, фактор Касла) — гликопротеином, вырабатываемым париетальными клетками фундальной части и тела желудка. Под влиянием протеаз панкреатического сока комплекс R-витамин В,2 разрушается и высвобождается витамин В12, который соединяется с внутренним фактором, образуя комплекс витамин В12-ВФ. Последний днмеризуется и в подвздошной кишке связывается со специфическими рецепторами. В присутствии ионов кальция и при рН 7,0 этот комплекс расщепляется и витамин В12 проникает в митохондрии клеток слизистой оболочки кишки. Отсюда витамин В12 проникает в кровь, где соединяется с транспортным белком транскобаламином II (ТК II), который доставляет витамин к тканям-мишеням — гепатоцитам, гемопоэтическим клеткам и другим.
Высвобождение витамина В12 из комплекса ТКП-В12 в клетке происходит в 3 этапа:
- связывание комплекса с рецепторами клетки;
- его эндоцитоз;
- лизосомальный гидролиз с высвобождением витамина.
Часть витамина В12 в сыворотке крови связывается с кобалофилинами («R-binders») — транскобаламинами I и III. Эти В12-связывающие гликопротеины высвобождают его только в печени. При наличии большого количества витамина В12 около 1 % его может проникать в кровь путем пассивной диффузии.
Основным депо витамина В12 является печень, в 1 г которой содержится 1 мкг витамина В12. У здоровых доношенных детей резервы витамина В12 в печени составляют 20-25 мкг, депо резко истощается к году. Суточная потребность в витамине В12 у ребенка грудного возраста составляет 0,1 мкг, а у взрослого — 5-7 мкг. В 100 мл женского молока содержится 0,11 мкг витамина В12.
Витамин В12 в основном выделяется с желчью, его потеря происходит также с калом; в сутки теряется 0,1 % от всего депонированного витамина. Доказано существование кишечно-печеночного кругооборота витамина В12— около 3/4 выделенного с желчью витамина вновь реабсорбируется. Этим объясняется развитие мегалобластной анемии через 1-3 года после полного прекращения поступления витамина В12 в организм. Физиологические потери витамина с мочой крайне незначительны.
Источник
Нарушение обмена витамина в12
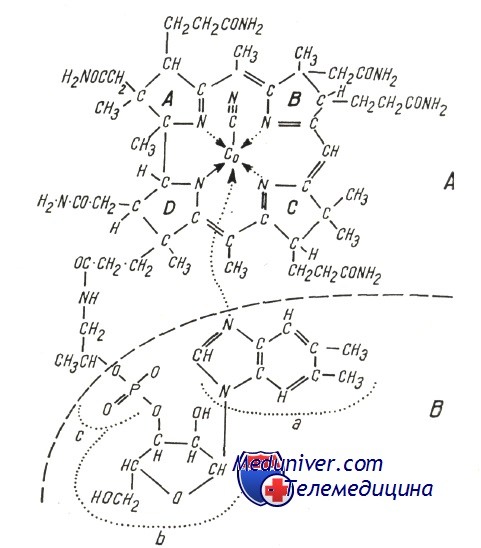
Молекула витамина В12 (цианкобаламин) состоит из двух частей:
а) хориновой — порфирин, в котором 4 восстановленных пирола связаны тремя мостиками метена и одной прямой связью, при этом к внешним позициям прикреплены радикалы, такие как аминоэтанол, аминопропанол и метил, в то время как в центре расположен атом кобальта, с которым связана группировка циан (свреху) и нуклеотидная часть (под хориновым планом);
б) нуклеотидной, в состав которой входят 5,6-диметилбензимидазол (а), рибоз (b) и фосфат (с) (которая осуществляет связь с пропионовым радикалом пирола D). Заменой связанных с кобальтом радикалов образуются различные производные (естественные и синтетические); при этом коферментной активностью обладают лишь высокозаменяемые произволные, в которых группа —С—N заменяется радикалом 5′-дезоксиаденозил или метил.
В качестве кофермента 5′-дезоксиадеознилкобаламин является межмолекулярным (реакция восстановления) или внутримолекулярным (реакция изомеризации) переносчиком водорода. Был обнаружен целый ряд реакций подобного типа, однако из них, у млекопитающих и человека, доказано наличие лишь реакции изомеризации метил-малонил-СоА в сукцинил-СоА в процессе метаболизма пропионовой кислоты (Silber и Moldow).
Реакцию восстановления рибонуклеотидов в дезоксирибонкулеотиды, обнаруженную в отдельных микроорганизмах, посредством которой можно было бы объяснить мегалобластоз за счет дефицита BJ2 независимым от метаболизма фолатов путем, еще не удалось доказать у человека (тем не менее добавление тимидина может преобразовать мегалобласты в нормобласты только при недостатке фолиевой кислоты; исключаются случаи дефицита витамина В12).
В бактериях метилкобаламин участвует в различных реакциях синтезирования, выполняя роль переносчика радикала метил. У человека доказано наличие лишь реакции метилирования гомоцистеина (в одном из путей синтезирования метионина). Поскольку источником группы метил является метилтетрагидрофолат, эта реакция составляет одновременно путь к «регенерации» тетрагидрофолиевой кислоты (FH4) из метил-тетрагидрофолиевой кислоты, что служит признанным в настоящее время объяснением мегалобластоза за счет дефицита витамина В12.
При этом теория «капкан метилфолата» (Nixon и Bertino) составляет другое последствие дефицита витамина В12, заключающееся в недостаточной задержке клетками метилтетрагидрофолиевой кислоты (Тисман и Герберт).
Дозировка витамина В12 осуществляется бактериологическими методами, при этом применяется либо фотометрическое измерение роста численного показателя отдельных микроорганизмов, находящихся в зависимости от этого витамина (Lactobacillus leishmanii, Euglena gracilis и пр.), когда вступают в контакт с материалом реакции, либо метод радиоактивных изотопов.
Кругооборот витамина В12 в организме человека
Витамин В12 синтезируется отдельными микроорганизмами, находящимися в почве, воде, на кормовых растениях или в пищеварительном тракте животных, далее витамин поступает в ткани (в частности в железы, печень, мышцы, также, яйца, в меньшей мере в молоко), которые составляют основной источник для человека.
Из 5—30 мкг среднесуточного подвоза с пищей поглощаются лишь 1—5 мкг, остальное количество выделяется с испражнениями. За сутки теряются примерно 2,5 мкг витамина В12 (Hellmuth), составляющие, следовательно, суточную потребность. Его передача плоду, в период беременности, различные гиперметаболические состояния, в период роста и пр. увеличивают потребность.
Поглощение витамина В12 обусловлено наличием внутреннего фактора (ВФ), который связывает находящийся в пищевых продуктах витамин В12 и затем переносит его к кишечным рецепторам.
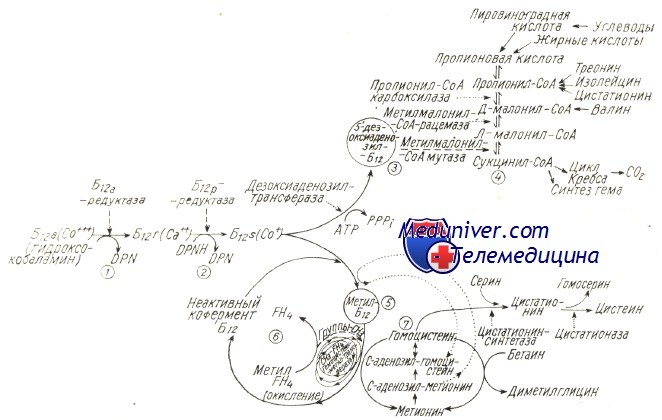
Приводятся два последовательных восстановительных процесса гидроксокобаламина (1), (2), образование 5′-дезоксиаденозил-В12 (3) и его участие в метаболизме пропионовой кислоты (4); образование метип-В12 (5), его «каталитическая» функция в переносе группы — СН3 от метил-FH4 к гомоцистеину (пусковая роль s-аденозилметионина в реакции и «регенерации’» кофермента), также взаимосвязь с метаболизмом фолатов (6) и серных аминокислот (7).
Внутренний фактор это, по существу, гликопротеид, который, у человека, выделяется пристеночными клетками слизистой оболочки дна желудка. Этот фактор отличается свойством осуществлять специфическую связь (при кислом рН) того небольшого количества В12, которое выделяется в результате пептического пищеварения.
Далее, при нейтральном рН и наличии Са2+ комплекс ВФ-В12 закрепляется на специальных рецепторах слизистой оболочки подвздошной кишки, где витамин диссоциируется а затем, с помощью еще не выведенного механизма, переходит в воротновенную кровь (Састле).
При введении большого количества витамина В12 его поглощение осуществляется путем пассивной диффузии (с быстрым поступлением в кровь) в размере примерно 1% назначенной дозы (Hellmuth).
Перенос с плазмой витамина В12 осуществляется посредством транскобаламина (прежде называемого транскобаламин II), связывающего поглощаемый из кишечника и частично эндогенный витамин В12, равно как кобалофилина (современное название «белков вида Р », включающих транскобаламин I и III), переносящего наибольшую часть эндогенного витамина В12. При хронической гранулоцитной лейкемии, а иногда и гепатомах показатель кобалофилина значительно растет. Недавно был выявлен внутриклеточный белок, связывающий кобаламин (Stenman).
Нормальная концентрация витамина В12 в плазме колеблется от 200 до 900 пг/мл.
Запасы витамина В12 в организме взрослого человека составляют примерно 2000—5000 мкг, причем в основном он сохраняется в печени (примерно 1000 мкг) и в меньшей мере в почках; мышцы содержат примерно 3000 мкг этого витамина.
Витамин В12 выделяется с мочой в незначительном количестве (примерно (0,25 мкг/сутки). Видимо его выделение через кишечник составляет основную причину потерь (доказано наличие кишечно-печеночного кругооборота с повторным поглощением примерно 3/4 выделяемого с желчью витамина В12), к этому следует добавить выпадение клеток желудочно-кишечного эпителия, выделения пищеварительной системы и пр.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Источник