Витамин N (липоевая кислота) – «универсальный антиоксидант»
В официальный список включено 13 витаминов. Витамин N (липоевая кислота) пока не входит в него, его называют витаминоподобным веществом. Липоевая кислота была впервые обнаружена в 1948 году, а уже с 1953 года ее начали синтезировать. Липоевая кислота — жирорастворимое вещество, практически не растворяется в воде, но разрушается при воздействии высоких температур и под воздействием света.
Липоевая кислота по характеру биохимического действия подобна витаминам группы В.
Липоевая кислота в качестве кофермента входит в состав ряда ферментов, регулирующих липидный и углеводный обмен, оказывает липотропный эффект, то есть предотвращает жировое перерождение печени. Она влияет на обмен холестерина, улучшает функцию печени (уменьшает расходование важнейшего внутрипеченочного антиоксиданта — глутатиона), что используют при некоторых заболеваниях печени (цирроз, гепатит), сахарного диабета. А также витамин N применяют при нарушении зрительных функций. Он положительно влияет на скорость основного обмена.
Липоевая кислота, участвуя в углеводном обмене, обеспечивает своевременное усвоение головным мозгом глюкозы — основного питательного вещества и источника энергии для нервных клеток, что является важным моментом для улучшения концентрации внимания и памяти.
Липоевую кислоту называют «универсальным антиоксидантом», необходимым для каскадного усиления действия всех остальных антиоксидантов. Особо полезен витамин N жителям крупных городов. Он дает возможность организму строить защиту от солей ртути и свинца, от других тяжелых металлов. Образуя водорастворимые комплексы с ними, выводит их через почки. Предупреждает ожирение печени. Не давая свободным радикалам разрушать молекулы, защищая стенки клеток от их пагубного воздействия, в частности крови и сосудов, липоевая кислота является прекрасным средством профилактики и коррекции сосудистых заболеваний, таких как варикозная болезнь, тромбофлебит.
При сахарном диабете липоевая кислота предупреждает образование избытка свободных радикалов, как следствие повышения сахара в крови и увеличения её вязкости.
Главная функция витамина N – участие в процессах окисления организма, которые помогают нам вырабатывать общую энергию. Липоевая кислота в достаточном объеме гарантирует нам стройность, так как помогает сжигать жиры и углеводы. Липоевая кислота также способствует благополучной работе щитовидной железы, улучшает состояние зрения, защищает нас от ультрафиолетовой радиации.
Недостаток витамина N способен вызвать ацидоз. Ацидоз проявляется рядом симптомов:
- тошнота;
- утомляемость;
- плохой аппетит;
- головокружение;
- головная боль;
- мышечная боль.
Если витамин N находится в недостаточном количестве, организму сложно бороться с вредным воздействием окружающей среды, активизируется процесс старения. Начинает откладываться жир в печени, в сосудах накапливается холестерин. Без витамина N перестают работать в клетках витамины С, Е. Ни жиры, ни углеводы не смогут сгорать без витамина N.
Но важно знать, что даже в достаточном объеме липоевая кислота не работает без лизина (аминокислоты). В этой ситуации в группу риска входят вегетарианцы, особенно строгие вегетарианцы. Они не получают лизин, а значит, витамин N не имеет возможностей для активизации. Так, прием пищи может состоять из низкокалорийной, легкой пищи, а уровень холестерина будет высоким, жировые отложения не будут уменьшаться.
При общей усталости, нарушении концентрации внимания, различных заболеваниях (атеросклероз, ВИЧ, диабет, болезнь Альцгеймера, цирроз и др.), ожирении, злоупотреблении алкоголем потребность в липоевой кислоте повышается.
Симптомы передозировки липоевой кислотой
- изжога
- боли в подложечной области
- аллергические высыпания
- диспепсические симптомы
Содержание витамина N
Растительные: дрожжи, шпинат, рис, капуста.
Животные: сердце, почки и печень, яйца, молоко, говядина.
Синтез в организме
Липоевая кислота синтезируется в организме человека, но с возрастом это функция ухудшается.
Взаимодействие липоевой кислоты
Прием сахароснижающих препаратов, алкоголя снижается эффективность витамина N.
Наиболее эффективно липоевая кислота действует с витаминами группы В.
Источник
Липоевая кислота
Состав
Состав на одну капсулу:
Деиствующее вещество: тиоктовая кислота (липоевая кислота) — 300,0 мг (в пересчете на 100 % вещество).
Вспомогательные вещества: кальция гидрофосфата дигидрат — 81,2 мг, повидон К-30 — 6,8 мг, тальк — 8,0 мг, магния стеарат — 4,0 мг.
Твердые желатиновые капсулы:
состав оболочки капсулы: титана диоксид — 3,0 %, краситель хинолиновый желтый — 0,66 %, краситель солнечный закат желтый — 0,06 %, желатин — до 100 %.
Описание:
Твердые непрозрачные желатиновые капсулы № 0 желтого цвета. Содержимое капсул — порошок светло-желтого или желтого цвета с вкраплениями белого цвета, допускается наличие легко рассыпающихся комков.
Фармакодинамика
Тиоктовая (альфа-липоевая) кислота — эндогенный антиоксидант прямого (связывает свободные радикалы) и непрямого (восстанавливает физиологическую концентрацию глутатиона, повышает активность супероксиддисмутазы) действия; в качестве кофермента митохондриальных мультиферментных комплексов участвует в реакциях окислительного фосфорилирования пировиноградной кислоты (ПВК) и альфа-кетокислот, по биохимическому механизму действия близка к витаминам группы В.
Тиоктовая кислота оказывает антиоксидантное, нейротрофическое, гипогликемическое действие, улучшает метаболизим липидов:
— связываясь с избыточным количеством свободных кислородных радикалов, защищает клетки от повреждения их продуктами распада; при сахарном диабете уменьшает образование конечных продуктов прогрессирующего гликирования белков в нервных клетках, уменьшает эндоневральную гипоксию и ишемию, повышает концентрацию антиоксиданта глутатиона, тем самым, ослабляя проявления полинейропатии в виде парестезии, ощущения жжения, боли и онемения конечностей;
— участвует в регулировании углеводного обмена (способствует снижению концентрации глюкозы в плазме крови и увеличению концентрации гликогена в печени, снижает инсулинорезистентность тканей);
— стимулирует метаболизм холестерина, снижая его концентрацию в плазме крови; участвуя в метаболизме жиров, тиоктовая кислота увеличивает биосинтез фосфолипидов, в частности фосфоинозитидов, благодаря чему улучшается поврежденная структура клеточных мембран; нормализуется энергетический обмен и проведение нервных импульсов.
Фармакокинетика
Абсорбция и распределение
При приеме внутрь быстро и полно всасывается в желудочно-кишечном тракте, прием одновременно с пищей снижает абсорбцию. Биодоступность — 30 % вследствие эффекта «первого прохождения» через печень. Время достижения максимальной концентрации в плазме крови — 40-60 мин. Объем распределения — около 450 мл/кг. Общий плазменный клиренс — 10-15 мл/мин.
Метаболизм и выведение
Метаболизируется в печени путем окисления боковой цепи и конъюгирования.
Тиоктовая кислота и ее метаболиты выводятся почками (80-90 %). Период полувыведения — 20-50 мин.
Показания
Диабетическая полинейропатия, алкогольная полинейропатия.
Противопоказания
— Повышенная чувствительность к компонентам препарата.
— Беременность, период грудного вскармливания (отсутствует достаточный опыт применения препарата).
— Детский возраст до 18 лет (эффективность и безопасность применения не установлены).
Применение при беременности и в период грудного вскармливания
Препарат противопоказан при беременности и в период грудного вскармливания из-за отсутствия достаточного опыта применения.
Исследования репродуктивной токсичности не выявили рисков в отношении влияния на развитие плода и каких-либо эмбриотоксических свойств препарата.
Неизвестно, проникает ли липоевая кислота в материнское молоко. При необходимости применения препарата в период грудного вскармливания, грудное вскармливание необходимо прекратить.
Способ применения и дозы
Капсулы принимают внутрь, по 600 мг (2 капсулы) 1 раз в день.
Принимать натощак, за 30 минут до первого приема пищи, не разжевывая и запивая достаточным количеством воды.
Минимальный курс приема — 3 месяца. В некоторых случаях прием препарата предполагает более длительное применение, сроки которого определяются лечащим врачом.
Предостережения, контроль терапии
У пациентов с сахарным диабетом, особенно в начале лечения, необходим частый контроль концентрации глюкозы в крови. В отдельных случаях требуется снижение дозы инсулина или пероральных гипогликемических препаратов, чтобы избежать развития гипогликемии.
Во время лечения необходимо строго воздерживаться от употребления алкоголя, так как при воздействии алкоголя терапевтический эффект липоевой кислоты ослабляется.
Одновременный прием пищи может препятствовать всасыванию липоевой кислоты.
Описано несколько случаев развития аутоиммунного инсулинового синдрома у пациентов с сахарным диабетом на фоне лечения липоевой кислотой, который характеризовался частыми гипогликемиями в условиях наличия аутоантител к инсулину. Возможность развития аутоиммунного инсулинового синдрома определяется наличием у пациентов гаплотипов НLА-DRВ1*0406 и НLА-DRВ1*0403.
Влияние на способность управлять транспортными средствами, механизмами
Влияние на способность к управлению транспортными средствами и механизмами специально не изучалось. Необходимо соблюдать осторожность при управлении транспортными средствами и выполнении потенциально опасных видов деятельности, требующих внимания и быстроты психомоторных реакций.
Побочные эффекты
Частота возникновения побочных эффектов приведена в соответствие с классификацией ВОЗ: очень часто ( ≥ 1/10); часто ( ≥ 1/100 до
Источник
Место витаминов группы В и липоевой кислоты в фармакотерапии полинейропатий
*Импакт фактор за 2018 г. по данным РИНЦ
Читайте в новом номере
Полинейропатии как осложнения соматических заболеваний
Среди неврологических осложнений соматических заболеваний полинейропатический синдром занимает ведущее место. Нередко именно с поражением периферической нервной системы (ПНС) связаны ограничение трудоспособности и инвалидизация различных категорий больных и, как следствие, – нарушение качества их жизни. Симптомы полинейропатий обусловлены одновременным поражением большего или меньшего количества периферических нервов. Большое число нозологических форм полинейропатий объясняется тем, что, по сути, это заболевание – проявление системного поражения ПНС при различных неблагоприятных условиях [1].
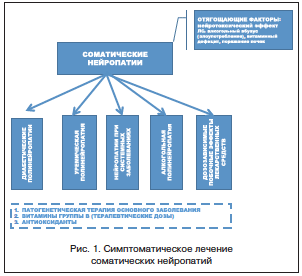
Диабетические нейропатии являются самым частым вариантом соматических нейропатий. Поражение ПНС у больных сахарным диабетом (СД) встречается в 20–40% случаев. Уремическая нейропатия возникает при хронической почечной недостаточности. Нейропатии при системных заболеваниях обусловлены в первую очередь васкулитом. Среди заболеваний этой группы нейропатии наиболее часто встречаются при узелковом периартериите (у 25% больных) и ревматоидном артрите (у 10% пациентов).
Алкогольная полинейропатия по частоте занимает второе место после диабетической нейропатии среди соматических нейропатий. Клинические проявления поражения периферического отдела нервной системы у пациентов, страдающих алкоголизмом, возникают, по данным различных авторов, в 12,5–29,6% случаев. Многие лекарства имеют нейротоксичные побочные эффекты, среди которых наиболее частым является поражение ПНС (полинейропатии). Классическим вариантом лекарственной нейропатии является изониазидная полинейропатия. Эта сенсомоторная нейропатия возникает как следствие дефицита витамина В6, вызванного изониазидом у лиц с генетически детерминированным нарушением метаболизма данного витамина. Назначение совместно с изониазидом пиридоксина позволило практически избавить больных туберкулезом от данного вида нейропатии.
Некоторые лекарственные препараты, используемые для лечения угрожающих жизни состояний, при онкологических заболеваниях, ВИЧ-инфекции, в качестве побочных эффектов вызывают развитие нейропатий.
Клиническая картина полинейропатий зависит от того, какие волокна вовлекаются в процесс и какие морфологические изменения в них развиваются. Как известно, существуют три типа волокон: двигательные, являющиеся толстыми миелинизированными; чувствительные (волокна, проводящие глубокую чувствительность, также толстые миелинизированные; волокна, проводящие болевую и температурную чувствительность – тонкие миелинизированные и немиелинизированные); вегетативные, которые являются тонкими немиелинизированными. Морфологические изменения, возникающие при полинейропатиях, характеризуются либо демиелинизацией, либо аксональной дегенерацией, либо их сочетанием. Демиелинизация развивается при аутоиммунных процессах, в возникновении аксональной дегенерации участвуют токсико-дисметаболические, микроциркуляторные нарушения, а также нарушения энергетического метаболизма и повышение перекисного окисления липидов [1, 2].
Основой терапии является лечение основного заболевания, приведшего к развитию нейропатии. В редких случаях успешная компенсация основного заболевания приводит к спонтанному регрессу нейропатии. Другим важным направлением лечения полинейропатии является воздействие на известные звенья патогенеза и дополнительные факторы, влияющие на течение нейропатии: витаминотерапия (витамины группы В), вазоактивные препараты, антиоксидантная терапия. Отдельного внимания заслуживает симптоматическое лечение, в основном направленное на коррекцию болевого синдрома (рис. 1).
Клинико-фармакологическое обоснование применения витаминов группы В для лечения болевого синдрома
В экспериментальной работе по изучению эффектов комбинации витаминов В1, В6 и В12 при болях показано ингибирование ноцицептивных ответов, вызванных формальдегидом, не меняющееся после введения налоксона. Выдвинуто предположение, что антиноцицептивный эффект комбинированного витаминного комплекса может быть обусловлен ингибированием синтеза и/или блокированием действия воспалительных медиаторов [3]. Было показано, что комплекс витаминов группы В усиливает действие норадреналина и серотонина – главных антиноцицептивных нейромедиаторов. Кроме того, в эксперименте обнаружено подавление ноцицептивных ответов не только в заднем роге, но и в зрительном бугре. Также выявлено, что комплекс витаминов группы В в высоких терапевтических дозировках способен усиливать антиноцицептивные эффекты неопиоидных анальгетиков в исследовании защитных рефлексов.
В эксперименте изучено потенцирование антиноцицептивного эффекта диклофенака витаминами группы В на модели каррагенин-индуцированной гипералгезии в тесте сдавления крысиного хвоста. Было показано, что только высокие дозы комплекса витаминов (667 мг/кг – B1 и B6, 6,7 мг/кг – B12) обладали собственной ноцицептивной активностью. Тем не менее, более низкие дозы (100–250 мг/кг – B1 и B6, 1–2,5 мг/кг – B12) дозозависимо потенцировали антиноцицептивную активность диклофенака. В этой экспериментальной модели показано, что назначение витаминов группы В одновременно с диклофенаком позволяет снизить дозы нестероидных противовоспалительных препаратов (НПВП), не уменьшая их эффективность [4].
В Мексике проведено исследование по изучению синергического взаимодействия между диклофенаком и витаминами группы В (100:100:1 B1, B6 и B12 соответственно) на модели формалинового теста у крыс. Диклофенак (0,31–316 мг/кг), витамины группы В (32–178 мг/кг) или комбинация витаминов и диклофенака назначались перорально, и изучался антиноцицептивный эффект. В результате было показано, что пероральное назначение диклофенака и витаминов группы В обладает синергическими свойствами по уменьшению воспалительной боли и может применяться у пациентов клинически [5].
Клинико-фармакологическое обоснование применения витаминов группы В в комбинации с НПВП для лечения болевого синдрома
Фармакокинетический компонент в действии лекарственных препаратов не отличается значительной специфичностью и в большей степени способен поддаваться регулирующим воздействиям по сравнению с фармакодинамическим компонентом, который жестко детерминирован химической структурой вещества [6].
Важнейшим элементом фармакокинетики является биотрансформация, которая во многих случаях определяет выраженность фармакологического эффекта вещества и его токсичность, т. к. может привести как к образованию биологически неактивных метаболитов, так и к появлению активных и реакционноспособных метаболитов. Особенно важное значение имеют процессы биотрансформации для проявления эффекта диклофенака и других ненаркотических анальгетиков. Одной из задач фармакологии является целенаправленный поиск индукторов и ингибиторов биотрансформации лекарственных веществ, модуляторов биологической активности ксенобиотиков.
Для целенаправленной регуляции биотрансформации лекарственных веществ наиболее пригодны природные регуляторы-витамины и коферменты, которые являются естественными компонентами внутренней среды, отличаются безвредностью и физиологичностью действия.
В отдельных исследованиях была установлена возможность участия витаминов в процессах биотрансформации ксенобиотиков, причем действие витаминов может осуществляться классическим путем (т. е. через коферментные функции), а также, благодаря влиянию на структуру и функции мембран, на участки ферментативного сопряжения обмена витаминов и ксенобиотиков. Таким образом, витамины и коферменты могут выступать в роли средств регуляции биотрансформации и фармакологического действия лекарственных веществ. Биотрансформация является тем звеном фармакокинетики, воздействуя на которое можно влиять на эффективность проводимой терапии.
Недостаточность тиамина и его дополнительное введение оказывают значительное влияние на активность микросомальных ферментов метаболизма ксенобиотиков. В ряде экспериментальных работ продемонстрировано, что дополнительное введение тиамина оказывает тормозящее действие на активность микросомальных монооксигеназ и редуктаз.
Изучено влияние тиамина и его производных на активность цитохром-Р450-зависимых и флавинсодержащих монооксигеназ печени крыс. Было показано, что назначение тиамина (101 мг/кг/сут, внутрибрюшинно, 6 сут) снижает активность NADPH-цитохром-С-редуктазы, метанол-О-деметилазы и содержание цитохрома b5. Введение бенфотиамина (115 мг/кг/сут, внутрижелудочно, 6 сут) приводило к активации NADPH-оксидазы и флавинсодержащих монооксигеназ (субстрат имипрамин). Назначение тиохрома (25 мг/кг/сут, внутрибрюшинно, 6 сут) вызывало ингибирование NADH-специфичной микросомальной электрон-транспортной цепи, этилморфин-N-деметилазы и значительную активацию флавинсодержащих монооксигеназ (субстраты имипрамин, триметиламин, N,N-диметиланилин) в микросомальной фракции печени крыс. Учеными установлена достоверная корреляционная взаимосвязь между скоростью окисления NADPH-оксидазы в присутствии тиамина и скоростью окисления NADPH в присутствии субстратов флавинсодержащих монооксигеназ – имипрамина, триметиламина и N,N-диметиланилина. Таким образом, были получены экспериментальные данные о том, что флавинсодержащие монооксигеназы печени участвуют в биотрансформации тиамина и его производных [7].
Тиамин и его производные оказывают ингибирующее действие на активность ферментов метаболизма ксенобиотиков, причем деметилазная и гидроксилазная активности угнетаются более значительно, чем другие ферменты. Наиболее выраженным ингибирующим действием по отношению к микросомальным монооксигеназам обладали фосфорилированные производные тиамина – тиаминмонофосфат и, в особенности, – тиаминдифосфат (ТДФ). Эффект ТДФ проявлялся даже в минимальных концентрациях, а большие концентрации препарата практически полностью тормозили активность гидроксилазы и деметилазы. Значительным ингибирующим действием обладал и тиаминбромид. NADH-редуктаза оказалась более устойчивой к действию тиамина и его производных. Г-s-Г и АлДГ-ферменты, не связанные с микросомальными мембранами, практически не ингибировались под влиянием тиамина и его производных. Была выявлена особенность в действии тиамина и его производных на активность микросомальных ферментов. Их ингибирующее влияние оказывалось более сильным в том случае, если они прибавлялись к микросомам, выделенным из печени тиамин-дефицитных животных [8].
Результаты собственных исследований
С целью изучения влияния витаминов группы В на биотрансформацию диклофенака путем изменения активности ферментов метаболизма препарата были проведены экспериментальные электрохимические исследования. Исследовано влияние тиамина на активность цитохрома Р450 3А4. Показано, что тиамин не является субстратом этой формы цитохрома Р450 и блокирует (в концентрации 1,5 мМ) каталитические свойства цитохрома Р450 3А4 по отношению к диклофенаку. Поскольку молекула тиамина содержит азот с неподеленной парой электронов в составе пиримидинового гетероцикла и серу в составе тиазола, можно предположить, что тиамин взаимодействует с железом гема, ингибируя связывание кислорода. Кислород является косубстратом цитохрома Р450, участвуя в реакции монооксигенирования, поэтому отсутствие кислорода ингибирует каталитический цикл, где он связывается с восстановленным железом гема. Таким образом, тиамин можно отнести к неконкурентным по отношению к органическому субстрату (диклофенаку) обратимым ингибиторам. Результаты позволили предположить, что, ингибируя каталитическую активность цитохрома Р450 3А4 по отношению к диклофенаку, тиамин может замедлять метаболизм этого лекарственного препарата при совместном назначении.
В опытах с диклофенаком в качестве субстрата и пиридоксином (витамин В6) методом электрохимического анализа (КВВА) регистрировалось увеличение каталитического тока в присутствии пиридоксина (PR), а также наблюдалось отсутствие каталитической реакции с диклофенаком [9].
Таким образом, по результатам электрохимического анализа можно сделать вывод о влиянии витаминов группы В на активность цитохрома Р450 3А4, что в свою очередь может привести к изменению метаболизма НПВП, например диклофенака, при назначении в комплексной терапии с витаминами группы В.
В связи с выявленным влиянием витаминов группы В (В1, и В6) на активность ферментов системы метаболизма и наличием клинического опыта, описанного в литературе по комплексному применению нагрузочных доз витаминов группы В одновременно с НПВП, и усилением при этом фармакодинамических эффектов последних нами были проведены фармакокинетические исследования при однократном разовом приеме диклофенака и однократном приеме диклофенака на фоне курсовой терапии с применением и без применения нагрузочных доз витаминов группы В.
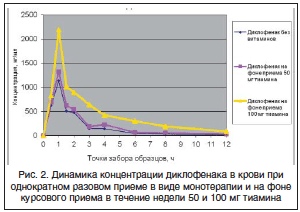
Во всех трех схемах приема диклофенака (прием только диклофенака, прием препарата на фоне 50 мг тиамина и прием препарата на фоне 100 мг тиамина) максимальное значение его концентрации в крови было достигнуто через 1 ч после приема. В случае использования диклофенака без витаминов оно составило 1137,2±82,4 нг/мл. При приеме на фоне 50 мг тиамина максимальная концентрация составила 1326,7±122,5 нг/мл, а при приеме на фоне 100 мг тиамина – 2200,4±111,3 нг/мл. При этом было получено, что величина значения максимальной концентрации диклофенака при однократном разовом приеме статистически достоверно ниже величины значения максимальной концентрации при приеме диклофенака на фоне курсового применения как 50, так и 100 мг тиамина (рис. 2).
Полученные нами данные подтверждаются исследованиями зарубежных ученых, в которых применяли уменьшенную дозу диклофенака в количестве 75 мг/сут. Из 45 больных, закончивших терапию досрочно после 3–4 дней в связи с полным регрессом болевого синдрома, 30 принадлежали к группе комбинированной терапии, а 15 – группе монотерапии диклофенаком (р 5). Сопутствующая терапия не включала препараты, содержащие серу, и витамины группы В.
При оценке эффективности лечения в основной и группе сравнения было отмечено, что по всем показателям результаты лечения были сопоставимы. Кроме того, в основной группе отмечалась более эффективная коррекция сенсомоторных нарушений по шкале NDS (на 7–10-е сут терапии имело место достоверное снижение баллов с 8,4±0,3 до 7,4±0,4 (р Литература
- Курушина О.В., Барулин А.Е. Полинейропатии при соматических заболеваниях: роль невролога в диагностике и лечении // РМЖ. 2013. № 36. С. 1840–1843.
- Воробьева О.В. Полинейропатии. Возможности альфа-липоевой кислоты в терапии полинейропатий, ассоциированных с соматическими заболеваниями // Consilium Medicum. 2006. Т. 8, № 2.
- Franca D.S., Souza A.L., Almeida K.R. et al. B vitamins induce an antinociceptive effect in the acetic acid and formaldehyde models of nociception in mice // Eur. J. Pharmacol. 2001. Vol. 421(3). P. 157–164.
- Bartoszyk G.D., Wild A. B-vitamins potentiate the antinociceptive effect of diclofenac in carrageenin-induced hyperalgesia in the rat tail pressure test // Neurosci Lett. 1989. Vol.101(1). P. 95–100.
- Rocha-Gonza’lez H.I., Tera’n-Rosales F., Reyes-Garcia G. et al. B vitamins increase the analgesic effect of diclofenac in the rat // Proc. West Pharmacol. Soc. 2004. Vol. 47. P. 84–87.
- Холодов Л.Е., Яковлев В.П. Клиническая фармакокинетика. М.: Медицина, 1985. 464 с.
- Мельниченко Н.Г. Активность цитохром-Р450-зависимых и флавинсодержащих монооксигеназ печени крыс после введения тиамина и его производных // Изв. Нац. академии наук Беларуси. Сер. мед. наук. 2007. № 4 С. 86–92.
- Пентюк А.А. Витаминная и коферментная регуляция биотрансформации, фармакологического эффекта и токсичности лекарственных средств: Автореф. дисс… д.м.н., 1990.
- Махова А.А., Шумянцева В.В., Ших Е.В. и др. Регуляция активности ферментов метаболизма лекарственных препаратов – цитохромов р450 3а4 и 2с9 – биологически активными соединениями // Молекулярная медицина. 2013. № 5.
- Kuhlwein A., Meyer H.J., Koehler C.O. Reduced diclofenac administration by B vitamins: results of a randomized double-blind study with reduced daily doses of diclofenac (75 mg diclofenac versus 75 mg diclofenac plus B vitamins) in acute lumbar vertebral syndromes // Klin. Wochenschr. 2003. Vol. 68(2). P. 107–115.
- Vetter G., Bruggemann G., Lettko M. et al. Shortening diclofenac therapy by B vitamins. Results of a randomized double-blind study, diclofenac 50 mg versus diclofenac 50 mg plus B vitamins, in painful spinal diseases with degenerative changes // Z. Rheumatol. 2008. Vol. 47(5). P. 351–362.
- Ших Е.В., Махова А.А. Витамины в клинической практике. М.: «Практическая Медицина», 2014. 367 с.
- Балаболкин М.И., Клебанова Е.М., Креминская В.М. Лечение сахарного диабета и его осложнений: Руководство для врачей. М.: Медицина, 2005. С. 428–429.
- Егоров И.В. Полиневропатический синдром в практике терапевта www.medvestnik.ru
- Петунина. Н.А., Ших Е.В. Роль микронутриентов в терапии и профилактике сахарного диабета // РМЖ. 2012. №13.
Только для зарегистрированных пользователей
Источник