Как избежать ухудшений при болезни Паркинсона? 5 вопросов неврологу
Вылечить болезнь Паркинсона нельзя, но можно держать ее под контролем. Что об этом заболевании должны знать родственники пациента?
Автор: Наталия Федорова
Дата публикации: 29.09.2020
Если у вас остались вопросы, вы можете задать их, воспользовавшись сервисом Доктис.
1. Отцу поставили диагноз «болезнь Паркинсона». Врач назначил лечение и предупредил: «Следите, чтобы не было ухудшений». Каких ухудшений можно ожидать?
При болезни Паркинсона на фоне стабильного состояния иногда в течение нескольких дней или недель начинают нарастать двигательные расстройства: скованность движений или их замедленность, дрожание рук, неустойчивость при ходьбе… Появляются лекарственные дискинезии — насильственные движения в разных группах мышц, как результат приема лекарственных препаратов.
Например, больной принял назначенную дозу леводопы, его движения стали четче, но вдруг возникли необычные подергивания мышц лица, шеи, туловища… Лекарство, которое раньше действовало 4−5 часов, почему-то стало действовать только полтора – два часа, в результате нарастают основные симптомы заболевания.
Если пациент болеет давно, могут возникнуть психические расстройства, галлюцинации, может резко снизиться артериальное давление, появиться боль в мышцах. Об этих состояниях надо сообщить своему врачу.
Еще может случиться акинетический криз – внезапное и быстрое нарастание симптомов паркинсонизма, с полной обездвиженностью, с тяжелыми вегетативными и психическими расстройствами, с нарушением терморегуляции, когда температура не снижается жаропонижающими средствами. Такое состояние иногда сохраняется более суток и оно, конечно, требует госпитализации.
2. Что приводит к ухудшениям?
- Сильный стресс.
- Физическая перегрузка. Например, чрезмерная работа летом на дачном участке. Вообще, физическая активность необходима при болезни Паркинсона. Полезны лечебная гимнастика, скандинавская ходьба, если сохранена координация – плаванье, танцы. Но изнурять себя физически нельзя.
- Изменения погоды: резкие перепады атмосферного давления и температуры воздуха.
- Инфекционные заболевания: грипп, ОРВИ, воспаление легких, инфекции мочевыводящих путей…
- Запоры, которыми страдают почти все пациенты с болезнью Паркинсона. При неправильной моторике кишечника нарушается всасываемость лекарств, и лечение становится малоэффективным.
- Обезвоживание. При болезни Паркинсона мышца мочевого пузыря, выталкивающая мочу, как и остальные мышцы, находится в постоянном тонусе. Гиперактивный мочевой пузырь заставляет часто пробуждаться ночью, чтобы сходить в туалет. Больные, пытаясь избежать этой проблемы, стараются пить как можно меньше. А пить надо. Выход – принимать жидкость в необходимом количестве до 18 часов.
- Нарушение водно-электролитного баланса. Многие пациенты сидят на бессолевой диете, чтобы не провоцировать подъем артериального давления. Это неправильно. Соль задерживает воду в организме и поддерживает артериальное давление, а при болезни Паркинсона пациенты часто страдают колебаниями давления, когда снижение бывает побочным эффектом приема лекарств.
- Наркоз при операциях.
- Травмы.
- Лекарственные каникулы. Отмену всех препаратов на 2−3 недели ради того, чтобы «отдохнули» печень и почки, раньше практиковали многие врачи. Сейчас понятно, что делать такие «каникулы» нельзя, они ведут к резкому ухудшению состояния.
- Нарушение схемы приема лекарств или перевод пациента с одного препарата на другой, например, с оригинального на копию (дженерик).
- Прием тех лекарств, которые противопоказаны при болезни Паркинсона. Это некоторые нейролептики, такие, как галопередол и аминазин; старые снижающие давление препараты (например, резерпин); холинолитики, которые могут вызвать галлюцинации
3. У мужа, больного паркинсонизмом, появились галлюцинации. Так бывает? Нас это пугает.
Психические расстройства при болезни Паркинсона не редкость, хотя больные часто их скрывают от родных и врача. Если такие расстройства появились, надо обязательно сказать о них врачу, потому что при них нельзя назначать никакие паркинсонистические препараты, кроме левоподы.
Что это за расстройства?
- Малые (доброкачественные) галлюцинации. Когда у больного появляется эффект присутствия посторонних людей.
- Истинные галлюцинации, когда пациент видит животных, насекомых, умерших родственников, начинает вступать с ними в контакт.
- Слуховые галлюцинации.
- Обонятельные галлюцинации.
- Иллюзии – искажения восприятия реальных предметов. Например, на вешалке висит пальто, а пациенту кажется, что это стоит человек.
- Бред ревности, ущерба, когда будто бы кто-то, например, соседи, хотят нанести ущерб больному. Бред преследования, плохого отношения.
- Спутанность сознания.
- Дезориентация во времени и пространстве.
Эти расстройства чаще возникают у людей старческого возраста, у больных с депрессией, после травм, болезней, операций. Первый предвестник психотических расстройств – постоянные нарушения сна.
Прежде всего, надо устранить провоцирующие факторы. Позаботиться о том, чтобы больной не находился в социальной изоляции, а постоянно общался с сиделкой, родственниками. Врач отменит некоторые препараты, в частности снотворные, потому что эти средства могут вызвать психозы.
4. Как проявляются нарушения интеллекта при болезни Паркинсона?
Обычно эти нарушения не грубые, но они повышают риск развития галлюцинаций.
Это замедленность мышления, когда пациент долго не может ответить на вопрос; рассеянность внимания; нарушение контроля над своей деятельностью; сложности при запоминании новой информации.
5. Что делать, если при болезни Паркинсона скачет артериальное давление?
Колебания давления, низкое артериальное давление – это часто встречающиеся проявления этой болезни, а также побочный эффект противопаркинсонических средств.
Нужно избегать резких перемен положения тела. Когда утром больной поднимается с постели, он должен сначала сесть, затем опустить ноги и посидеть так несколько минут, и только потом вставать.
Если предстоит долго стоять, например, в транспорте, можно скрестить ноги, как бы сжимая их в икроножных мышцах.
Ни в коем случае нельзя находиться на солнце, перегреваться.
Не рекомендуется в жаркое время принимать алкоголь.
Надо выпивать за день не менее 2 литров воды. Пить по глоточку в течение дня до 18 часов.
Пищу рекомендуется принимать 5−6 раз в день и маленькими порциями – не более 150 мл.
Для нормализации давления можно приподнять изголовье кровати или спать на высоких подушках.
Рекомендуется носить эластичные компрессионные бинты или колготы.
Для поддержания давления полезна лечебная гимнастика.
Важно нормализовать стул.
Если все это не поможет, врач назначит препарат, который задерживает натрий и жидкость в организме.
Онлайн консультации врачей
в мобильном приложении Доктис
Дежурный терапевт и педиатр консультируют бесплатно
Источник
Витамин D поможет пациентам с болезнью Паркинсона
Витамин D улучшит качество жизни больных с паркинсонизмом
Жирорастворимый витамин D жизненно необходим организму человека. Он поступает с пищей, а также небольшие количества витамина синтезируются в коже под действием ультрафиолетовых солнечных лучей. Витамин D регулирует метаболизм кальция и фосфора, способствует формированию костей и набору их минеральной массы, сохраняет зубы здоровыми.
Новое клиническое исследование показало, что это витаминное вещество, помимо своего основного эффекта, оказывает положительное действие на пациентов с паркинсонизмом. Витамин D способен замедлить и отдалить развитие когнитивных нарушений у людей с болезнью Паркинсона, а также предупредить депрессивные расстройства, которыми, согласно статистике, страдают около 60% больных паркинсонизмом.
В некоторых предыдущих исследованиях уже была показана роль витамина D в функционировании головного мозга. Он помогает поддерживать и стабилизировать работу митохондрий нервных клеток. Эти органеллы являются энергетической лабораторией клетки и в случае их неправильной работы, нейрон погибает. Кальциферол предупреждает гибель клеток головного мозга, чем способствует сохранению когнитивных способностей человека.
Принимая во внимание такие данные, ученые Университета Орегона решили проверить, как действует витамин D на пациентов с паркинсонизмом. В исследовании принимали участие 286 пациентов с болезнью Паркинсона. У них определяли уровень памяти, беглость речи и другие когнитивные функции, а также устанавливали наличие депрессивных расстройств. Параллельно всем участникам определяли уровень витамина D в крови.
При обработке данных было установлено, что у людей с более высокой концентрацией кальциферола в крови отмечались намного лучшие показатели, нежели у пациентов с низкой концентрацией. Также у них гораздо реже диагностировали депрессию.
Таким образом, витамин D может применяться в качестве дополнительного препарата для лечения болезни Паркинсона с целью улучшить качество жизни таких людей.
Источник
Болезнь Паркинсона: какие витамины могут помочь?
Материалы и методы
Данные были проанализированы с использованием регрессионных моделей пропорциональных рисков Кокса.
Исследователи изучили данные шведского национального и демографического регистра здоровья.
Наблюдение за пациентами осуществлялось с 1 октября 1997 г. по 31 декабря 2016 г.
Последующее наблюдение завершалось после установления диагноза болезни Паркинсона, смерти, эмиграции пациента или наступления 31 декабря 2016 г., в зависимости от того, какое событие произошло раньше.
Исследователи учли возможные искажающие факторы, такие как пол, ИМТ, общая физическая активность, образование, статус курения и употребление алкоголя.
Дополнительно подверглись сравнению различные методы оценки NEAC.
Было проведено 4 анализа чувствительности.
Исследователи включили в свой анализ 41058 участников, ответивших на 36-страничный вопросник о факторах образа жизни и истории болезни.
В рамках анкеты участники сообщили о своем среднем потреблении различных продуктов питания и напитков в течение предыдущего года.
Среднее время наблюдения составило 17,6 года, за это время было выявлено 465 случаев болезни Паркинсона.
Средний возраст постановки диагноза составил 74,6 года.
Перспективный дизайн исследования и длительный период наблюдения — основные сильные стороны исследования.
Исследование ограничено отсутствием подтверждения случаев болезни Паркинсона посредством обзора медицинских карт. В нем также отсутствует подробная информация о потреблении антиоксидантов в качестве биодобавок.
Участники с наивысшим уровнем потребления витаминов и NEAC, как правило, были старше, были более образованными и имели больше фруктов и овощей в своем рационе.
Участники самого нижнего тертиля с большей вероятностью курили и потребляли большее количество молочных продуктов.
После корректировки данных с учетом потенциальных искажающих факторов исследователи обнаружили, что риск болезни Паркинсона был на 32% ниже среди людей с самым высоким потреблением витамина E по сравнению с людьми с самым низким уровнем его потребления.
Участники с самым высоким уровнем потребления витамина C по сравнению с участниками с самым низким уровнем также имели на 32% меньший риск развития болезни Паркинсона.
Кроме того, участники с самым высоким уровнем потребления витаминов E и C имели на 38% меньший риск развития болезни Паркинсона по сравнению с участниками с самым низким уровнем потребления витаминов.
Однако исследователи не обнаружили никакой связи между бета-каротином или NEAC и риском развития болезни Паркинсона.
Анализ подгрупп показал, что витамин Е сильнее влияет на людей с избыточным весом или ожирением. У таких пациентов, которые получали наибольшее количество витамина Е, риск болезни Паркинсона был на 56% ниже.
Среди участников с низким потреблением кофе у тех, кто потреблял наибольшее количество витамина С, риск болезни Паркинсона снизился на 46%.
Среди участников с избыточным весом и ожирением у тех, кто получал наибольшее количество витамина С, риск развития болезни Паркинсона был на 48% ниже.
Окислительный стресс способствует развитию болезни Паркинсона и приводит к потере дофаминергических клеток. Полиненасыщенные жирные кислоты в головном мозге подвергаются перекисному окислению липидов и продуцируют токсины. Пищевые антиоксиданты улавливают активные формы кислорода и, таким образом, могут защитить от повреждения нейронов.
Национальное когортное исследование подтвердило, что более высокое потребление обоих витаминов С и Е было связано со снижением риска болезни Паркинсона.
Кроме того, ИМТ и потребление кофе, по-видимому, опосредует степень влияния этих витаминов на риск болезни Паркинсона.
Однако бета-каротин и NEAC не влияют на этот риск.
В будущем необходимо провести исследования для изучения конкретных продуктов, богатых витамином Е и витамином С, таких как растительные масла, орехи и семена, фрукты и овощи, а также их связь с риском болезни Паркинсона.
На данный момент отсутствует информация, какое конкретное количество витамина Е и С является наиболее полезным для снижения риска болезни Паркинсона.
Важно сосредоточить внимание на рационе питания в молодом и раннем зрелом возрасте, так как болезнь Паркинсона имеет очень длительную доклиническую стадию, и патологические изменения могут произойти за много лет до манифестации болезни Паркинсона.
Источник
Стандарты лечения болезни Паркинсона
Статья основана на положениях «Протокола ведения пациентов с болезнью Паркинсона», разработанного группой экспертов, в которую вошли ведущие отечественные специалисты по болезни Паркинсона (БП), и утвержденного Минздравсоцразвития РФ в 2005 г. Положения Протокола основаны на анализе в соответствии с принципами доказательной медицины контролируемых исследований, проведенных в нашей стране и за рубежом [1, 2, 4–7, 9–11, 13, 15], и в целом соответствуют недавно опубликованным рекомендациям по лечению БП Европейской федерации неврологических обществ [8] и Американской академии неврологии [12, 14, 16]. Текст Протокола опубликован в журнале «Проблемы стандартизации в здравоохранении» [3]. В Протоколе используется следующая шкала убедительности доказательств данных: А — доказательства убедительны (есть веские доказательства предлагаемому утверждению), B — относительная убедительность доказательств (есть достаточно доказательств в пользу того, чтобы рекомендовать данное предложение), C — достаточных доказательств нет (имеющиеся доказательства недостаточны для вынесения рекомендаций, но они могут быть даны с учетом иных обстоятельств).
Начальный этап лечения
Общие принципы. Поскольку на данный момент нейропротекторный потенциал ни одного средства при БП убедительно не доказан, лечение основывается главным образом на симптоматическом действии противопаркинсонических средств, которые принято назначать в том случае, когда хотя бы одно из проявлений заболевания приводит к ограничению жизнедеятельности пациента.
Лечение начинается с монотерапии. Если препарат оказался неэффективным (нет регресса симптоматики в течение месяца после достижения оптимальной дозы) или плохо переносится, его заменяют средством той же или другой фармакологической группы. При выборе препарата и его дозы следует стремиться не к полному устранению симптомов, а к существенному улучшению функций, позволяющему поддерживать бытовую и профессиональную активность. При частичном эффекте (недостаточное улучшение функций) к принимаемому препарату последовательно добавляют лекарственные средства иной фармакологической группы.
Принципы выбора противопаркинсонического препарата. Выбор препарата на начальном этапе лечения проводят с учетом возраста, выраженности двигательного дефекта, трудового статуса, состояния нейропсихологических функций, наличия сопутствующих соматических заболеваний, индивидуальной чувствительности пациента. Помимо достижения оптимального симптоматического контроля, выбор препарата определяется необходимостью отсрочить момент развития моторных флуктуаций и дискинезий (табл.).
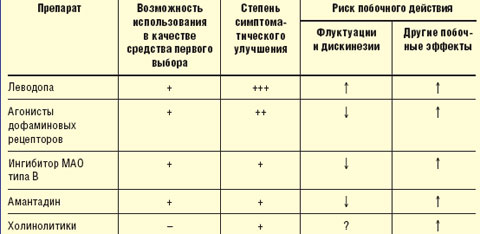 |
| Таблица Выбор препарата для начального лечения болезни Паркинсона |
У лиц моложе 50 лет при умеренной выраженности двигательных нарушений в отсутствие выраженных когнитивных нарушений назначают один из следующих препаратов: агонист дофаминовых рецепторов, ингибитор моноаминооксидазы (МАО) типа В (селегилин), амантадин, антихолинергические средства (тригексифенидил, бипериден).
Лечение предпочтительнее начинать с одного из агонистов дофаминовых рецепторов, которые хотя и не позволяют достичь того же уровня симптоматического контроля, как препараты леводопы, способны обеспечить поддержание уровня жизнедеятельности пациентов в течение длительного времени, отсрочить назначение леводопы и тем самым развитие осложнений долгосрочной терапии леводопой (уровень А). Индивидуальную эффективную дозу препаратов подбирают путем медленного титрования, стремясь получить адекватный эффект, необходимый для продолжения профессиональной деятельности, и избежать побочного действия (уровень С). Неэрголиновые агонисты (пирибедил, прамипексол) ввиду более благоприятного профиля побочных эффектов предпочтительнее, чем эрголиновые (бромокриптин).
Лечение пирибедилом начинают с дозы 50 мг 1 раз в день (днем или вечером — после основного приема пищи), в дальнейшем суточную дозу увеличивают на 50 мг 1–2 раза в неделю — до достижения необходимого эффекта, но не выше 250 мг/сут (50 мг 5 раз в день). Лечение прамипексолом начинают с дозы 0,125 мг 3 раза в день (после еды), затем еженедельно дозу последовательно увеличивают до 0,25 мг 3 раза в день, 0,5 мг 3 раза в день, при недостаточном эффекте — до 1 мг 3 раза в день и 1,5 мг 3 раза в день (максимальная доза — 4,5 мг/сут). Лечение бромокриптином начинают с дозы 2,5 мг 3 раза в день, в дальнейшем ее еженедельно последовательно увеличивают до 5 мг 3 раза в день, 7,5 мг 3 раза в день, 10 мг 3 раза в день, 10 мг 4 раза в день (максимальная доза — 40 мг/сут). При появлении тошноты в период титрования назначают домперидон. При неэффективности или плохой переносимости одного из агонистов дофаминовых рецепторов может быть испробован другой агонист дофаминовых рецепторов или препарат другой фармакологической группы (уровень С).
Антихолинергические средства показаны при наличии выраженного тремора покоя и сохранности нейропсихологических функций (уровень С). Хотя у этой категории лиц они могут применяться в качестве средств первого выбора, более целесообразно их добавление к агонисту дофаминовых рецепторов, если последний не обеспечивает достаточного подавления тремора. Лечение тригексифенидилом начинают с дозы 1 мг 2 раза в день, в дальнейшем дозу не чаще чем 1 раз в неделю последовательно увеличивают до 2 мг 2 раза в день, 2 мг 3 раза в день, 2 мг 4 раза в день (максимальная доза — 10 мг/сут). Лечение бипериденом начинают с дозы 1 мг 2 раза в день, в дальнейшем дозу не чаще чем 1 раз в неделю последовательно увеличивают до 2 мг 2 раза в день, 2 мг 3 раза в день, 2 мг 4 раза в день (максимальная доза — 10 мг/сут).
Лечение амантадином начинают с дозы 100 мг 2 раза в день, при недостаточном эффекте она может быть увеличена до 100 мг 3 раза в день, в дальнейшем — до 100 мг 4–5 раз в день (максимальная доза — 500 мг/сут). Лечение селегилином начинают с дозы 5 мг утром, через 1 нед ее увеличивают до 5 мг 2 раза в день.
Если указанные препараты и их комбинация в максимально переносимых дозах не обеспечивают адекватного состояния двигательных функций и социальной адаптации больных, назначают препарат, содержащий леводопу (стандартный препарат или препарат с замедленным высвобождением) в минимальной эффективной дозе (уровень А).
У лиц в возрасте 50–70 лет при умеренном двигательном дефекте и относительной сохранности нейропсихологических функций лечение начинают с одного из агонистов дофаминовых рецепторов. Если максимальные переносимые дозы одного из этих препаратов не обеспечивают достаточного функционального улучшения, к нему последовательно добавляют по указанным выше схемам один из следующих препаратов: селегилин, амантадин или холинолитик (при наличии тремора покоя). Больным после 65 лет тригексифенидил и другие антихолинергические средства не следует назначать из-за риска ухудшения познавательных функций и других побочных эффектов (уровень В). При недостаточной эффективности к комбинации из двух-трех указанных выше препаратов добавляют средство, содержащее леводопу, в минимальной эффективной дозе (200–400 мг/сут).
У лиц в возрасте 50–70 лет при выраженном двигательном дефекте, ограничивающем трудоспособность и/или возможность самообслуживания, а также при наличии выраженных когнитивных нарушений и необходимости получения быстрого эффекта, лечение начинают с препаратов, содержащих леводопу. Для лечения могут быть использованы как стандартные препараты, так и препараты с замедленным высвобождением. Если небольшие дозы леводопы (200–400 мг/сут) не обеспечивают необходимого улучшения, к ним последовательно добавляют по указанным выше схемам следующие препараты: агонист дофаминовых рецепторов, амантадин, селегилин.
У лиц старше 70 лет лечение следует начинать со средств, содержащих леводопу. Для лечения могут применяться как стандартные препараты, содержащие леводопу, так и препараты с замедленным высвобождением (уровень В).
Другие меры. Поскольку дофаминергические препараты у больных с глаукомой могут повысить внутриглазное давление, перед их назначением у всех пациентов старше 40 лет следует измерить внутриглазное давление. В дальнейшем его измерение проводят после подбора противопаркинсонической терапии (обычно на втором месяце лечения) либо при появлении жалоб на ухудшение зрения. Больным с запорами и другими проявлениями нарушения моторики желудочно-кишечного тракта показана диета с высоким содержанием пищевых волокон (уровень С); при снижении массы тела показана диета с повышенным содержанием белковых продуктов, а также продуктов, богатых витаминами и микроэлементами (уровень С); для подбора диеты назначается консультация врача-диетолога.
При ограничении подвижности и наличии скелетно-мышечных болей показано проведение лечебной физкультуры, включающей упражнение на растяжение мышц, поддержание гибкости и тренировку координации движений (уровень С), физиотерапии (уровень С), рефлексотерапии (уровень С); в связи с этим назначаются консультации врача лечебной физкультуры, физиотерапевта, рефлексотерапевта. Больному рекомендуется посильная двигательная активность с ежедневными занятиями лечебной гимнастикой, по показаниям — занятия с логопедом. В зависимости от тяжести двигательных расстройств больной может продолжать прежнюю работу, перейти на более легкую, изменить условия работы (неполный рабочий день). При стойкой утрате трудоспособности больному определяется группа инвалидности (вопросы трудоспособности определяются МСЭК).
Алгоритм лечения БП представлен на рисунке.
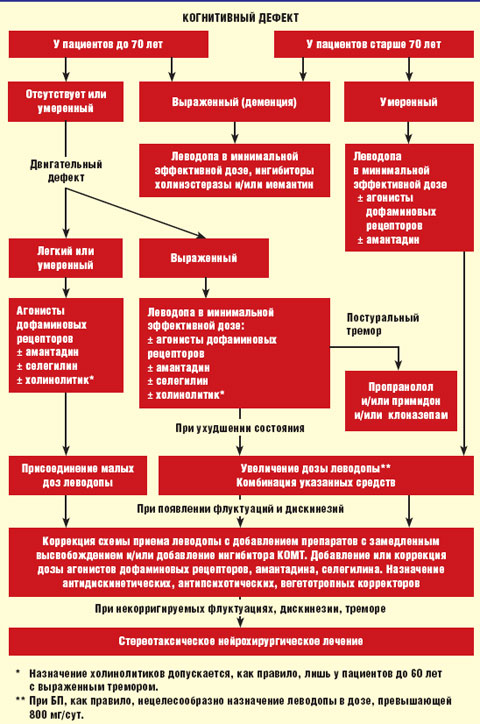 |
| Рисунок. Алгоритм лечения болезни Паркинсона |
Дальнейшая терапия при стабильной реакции на противопаркинсонические средства
Общие принципы лечения. Индивидуальную эффективную дозу препаратов подбирают путем медленного титрования, стремясь получить адекватный эффект, необходимый для продолжения профессиональной деятельности или поддержания повседневной активности, и избежать побочного действия. При необходимости для усиления эффекта противопаркинсонической терапии проводятся следующие мероприятия.
- Увеличение дозы принимаемого препарата — при необходимости до максимального рекомендуемого уровня.
- Замена препарата, не оказавшего терапевтического эффекта в максимальной дозе или вызвавшего неприемлемое побочное действие даже в минимальной терапевтической дозе, препаратом из той же или другой фармакологической группы. Замена препарата одной группы на препарат другой группы (например, холинолитика, амантадина или селегилина на агонист дофаминовых рецепторов) производится путем постепенной отмены принимавшегося ранее препарата с параллельным титрованием дозы вновь назначенного средства до получения эффекта. Во избежание рикошетного усиления симптоматики следует избегать внезапной отмены любого противопаркинсонического препарата, даже если он не оказывал видимого эффекта. Замена принимаемого препарата на иной препарат этой же группы (например, одного агониста дофаминовых рецепторов на другой либо препарата леводопы с одним ингибитором ДОФА-декарбоксилазы — например, карбидопой, на препарат леводопы с другим ингибитором ДОФА-декарбоксилазы (например, бенсеразидом — или наоборот).
- Добавление к ранее назначенному средству, оказавшему частичный эффект, препарата другой группы с переходом от монотерапии к комбинированной терапии (например, к агонисту дофаминовых рецепторов можно добавить малые дозы леводопы — или наоборот).
- Назначение дополнительных средств, воздействующих на отдельные симптомы (например, дрожание или депрессию).
Особенности лечения больных с тремором. При выраженном дрожательном гиперкинезе, нарушающем функции конечностей, особенно если он имеет постурально-кинетический компонент, к противопаркинсоническим средствам при отсутствии противопоказаний добавляют пропранолол (уровень В). Лечение пропранололом начинают с дозы 10 мг 3 раза в день. В дальнейшем дозу последовательно увеличивают не чаще чем 1 раз в неделю до 20 мг 3 раза в день, 40 мг 3 раза в день, 40 мг 4 раза в день (максимально до 320 мг/сут в 3–4 приема). При наличии противопоказаний к применению пропранолола (брадиаритмия, сахарный диабет, заболевания периферических сосудов), непереносимости или неэффективности препарата назначают примидон (уровень С). Первоначально препарат назначают в дозе 31,25 мг на ночь, затем дозу последовательно увеличивают 1 раз в 7–10 дней до 62,5 мг на ночь, 125 мг на ночь, 250 мг на ночь (максимально до 750 мг/сут в 2–4 приема или однократно на ночь).
Если пропранолол вызвал недостаточное улучшение, то к нему добавляют примидон в указанных дозах (уровень С). Клоназепам может быть добавлен к пропранололу или примидону при наличии выраженного кинетического компонента тремора (уровень С). Клоназепам первоначально назначают в дозе 0,5 мг на ночь, затем 1 раз в 7–10 дней дозу последовательно увеличивают до 0,5 мг 2 раза в день, 1 мг 2 раза в день, 2 мг 2 раза в день, пока не будет достигнуто существенное ослабление дрожания. При выраженном треморе может быть также использован клозапин в дозе 12,5–50 мг/сут (уровень В).
Особенности лечения больных с аффективными нарушениями. При наличии аффективных нарушений назначается консультация врача-психотерапевта для решения вопроса о целесообразности проведения аутогенной тренировки или других методов психотерапии. При наличии депрессии у больных без выраженных нарушений познавательных функций лечение следует начинать с одного из агонистов дофаминовых рецепторов (прамипексол, пирибедил), способных корригировать легкую депрессивную симптоматику, или их сочетания с малыми дозами леводопы (уровень В). При выраженной депрессивной симптоматике после консультации с психиатром показано назначение одного из следующих антидепрессантов: амитриптилин (25–150 мг на ночь), имипрамин (50–150 мг/сут), циталопрам (20–40 мг/сут), флуоксетин (20–40 мг/сут), сертралин (50–100 мг/сут), пароксетин (10–20 мг/сут), миртазапин (7,5–30 мг/сут), венлафаксин (75–225 мг/сут). После получения лечебного эффекта продолжительность назначения антидепрессанта в эффективной дозе должна быть не менее 6 мес (уровень С).
Продолжение читайте в следующем номере.
О. С. Левин, доктор медицинских наук, профессор
РМАПО, Центр экстрапирамидных заболеваний, Москва
Источник

