Строение коферментов
Коферменты в каталитических реакциях осуществляют транспорт различных групп атомов, электронов или протонов. Коферменты связываются с ферментами:
— гидрофобными взаимодействиями и т.д.
Один кофермент может быть коферментом для нескольких ферментов. Многие коферменты являются полифункциональными (например, НАД, ПФ). В зависимости от апофермента зависит специфичность холофермента.
Все коферменты делят на две большие группы: витаминные и невитаминные.
Коферменты витаминной природы – производные витаминов или химические модификации витаминов.
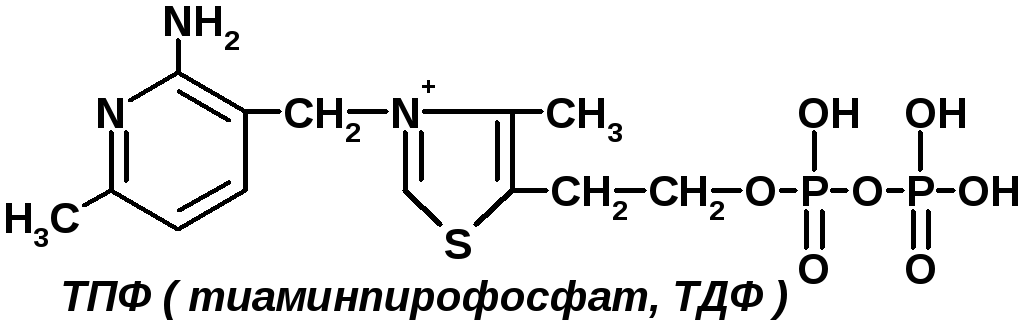
1 группа: тиаминовые – производные витамина В1. Сюда относят:
— тиаминдифосфат (ТДФ) или тиаминпирофосфат (ТПФ) или кокарбоксилаза;
ТПФ имеет наибольшее биологическое значение. Входит в состав декарбоксилазы кетокислот: ПВК, -кетоглутаровая кислота. Этот фермент катализирует отщепление СО.
Кокарбоксилаза участвует в транскетолазной реакции из пентозофосфатного цикла.
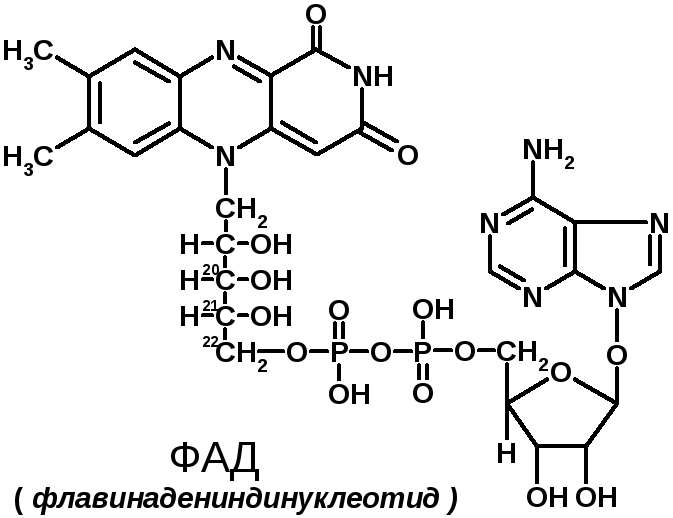
2 группа: флавиновые коферменты, производные витамина В2. Сюда относят:
Ребитол и изоалоксазин образуют витамин В2. Витамин В2 и остаток фосфорной к-ты образуют ФМН. ФМН в соединении с АМФ образуют ФАД.
[рис. изоалоксазиновое кольцо соединено с ребитолом, ребитол с фосфорной к-той, а фосфорная к-та – с АМФ]
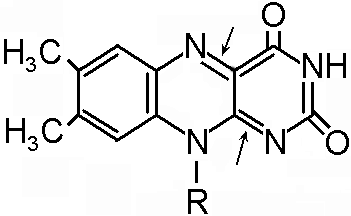
ФАД и ФМН являются коферментами дегидрогеназ. Эти ферменты катализируют отщепление от субстрата водорода, т.е. участвуют в реакциях окисления–восстановления. Например СДГ – сукцинатдегидрогеназа – катализирует превращение янтарной к-ты в фумаровую. Это ФАД-зависимый фермент. [рис. COOH-CH2-CH2-COOH (над стрелкой – СДГ, под – ФАД и ФАДН2) COOH-CH=CH-COOH]. Флавиновые ферменты (флавинзависимые ДГ) содержат ФАД, который в них является первоисточником протонов и электронов. В процессе хим. реакций ФАД превращается в ФАДН2. Рабочей частью ФАД является 2 кольцо изоалоксазина; в процессе хим. реакции идет присоединение двух атомов водорода к азотам и перегруппировка двойных связей в кольцах.
3 группа: пантотеновые коферменты, производные витамина В3 – пантотеновой кислоты. Входят в состав кофермента А, НS-КоА. Этот кофермент А является коферментом ацилтрансфераз, вместе с которой переносит различные группировки с одной молекулы на другую.
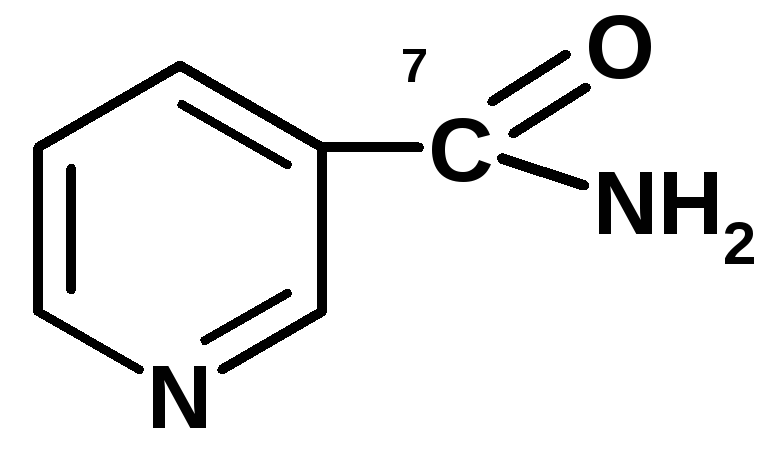
4 группа: никотинамидные, производные витамина РР — никотинамида:
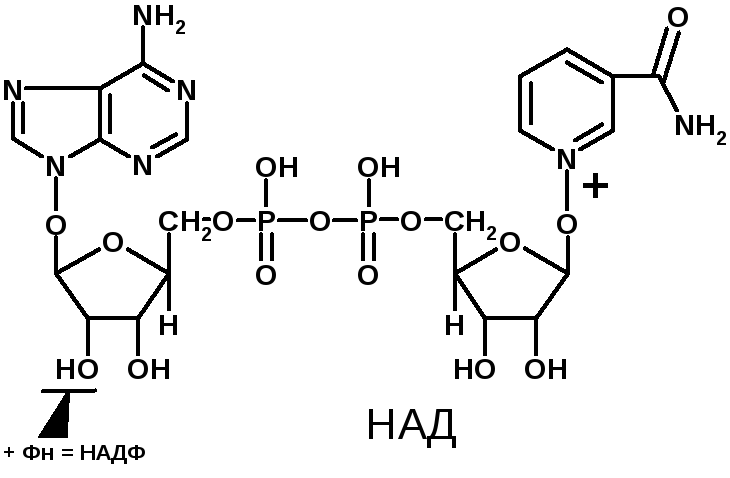
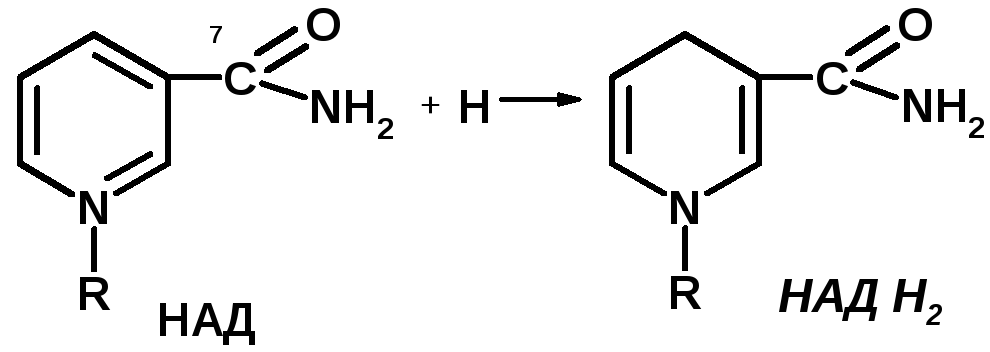
Коферменты НАД и НАДФ являются коферментами дегидрогеназ (НАДФ-зависимых ферментов), например малатДГ, изоцитратДГ, лактатДГ. Участвуют в процессах дегидрирования и в окислительно-восстановительных реакциях. При этом НАД присоединяет два протона и два электрона, и образуется НАДН2.
Рис. рабочей группы НАД и НАДФ: рисунок витамина РР, к которому присоединяется один атом Н и в результате происходит перегруппировка двойных связей. Рисуется новая конфигурация витамина РР + Н + ]
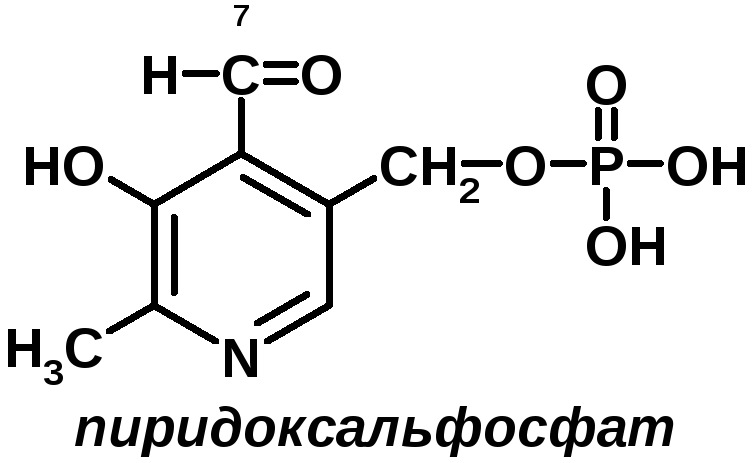
5 группа: пиридоксиновые, производные витамина В6. [рис. пиридоксаля. Пиридоксаль+ фосфорная к-та= пиридоксальфосфат]
Эти формы взаимопревращаются в процессе реакций. При взаимодействии пиридоксаля с фосфорной кислотой получается пиридоксальфосфат (ПФ).
ПФ является коферментом аминотрансфераз, осуществляет перенос аминогруппы от АК на кетокислоту – реакция переаминирования. Также производные витамина В6 входят как коферменты в состав декарбоксилаз АК.
Коферменты невитаминной природы – вещества, которые образуются в процессе метаболизма.
1) Нуклеотиды – УТФ, УДФ, ТТФ и т.д. УДФ-глюкоза вступает в синтез гликогена. УДФ-гиалуроновая к-та используется для обезвреживания различных веществ в трансверных реакциях (глюкоуронил трансфераза).
2) Производные порфирина (гем): каталаза, пероксидаза, цитохромы и т.д.
3) Пептиды. Глутатион – это трипептид (ГЛУ-ЦИС-ГЛИ), он участвует в о-в реакциях, является коферментом оксидоредуктаз (глутатионпероксидаза, глутатионредуктаза). 2GSH(над стрелкой 2Н) G-S-S-G. GSH является восстановленной формой глутатиона, а G-S-S-G – окисленной.
4) Ионы металлов, например Zn 2+ входит в состав фермента АлДГ (алкогольдегидрогеназы), Cu 2+ — амилазы, Mg 2+ — АТФ-азы (например, миозиновой АТФ-азы).
Могут участвовать в:
-присоединении субстратного комплекса фермента;
-стабилизация оптимальной конформации активного центра фермента;
Источник
Аминотрансферазы
ферменты, катализирующие реакцию переноса аминогруппы (NH2-группы) вместе с протоном (ионом водорода) и парой электронов от аминокислот или аминов к кетокислотам или другим соединениям, содержащим в составе своей молекулы карбонильную группу (СО-группу). Биологическую роль А. чрезвычайно велика, т.к. они участвуют в трансаминировании — процессе, имеющем важнейшее значение для энергетического обмена (см. Гликолиз, Дыхание тканевое) и азотистого обмена (Азотистый обмен).Установлено, что любые состояния, требующие срочной мобилизации компонентов белка для покрытия энергетических нужд организма (недостаточное или несбалансированное питание, все виды стресса и т.п.), связаны с адаптивным, гормонально-стимулируемым биосинтезом определенных А., прежде всего А., участвующих в глюконеогенезе (аланин- и аспартат-аминотрансфераз, аминотрансфераз ароматических аминокислот). Генетически обусловленная недостаточность некоторых А. лежит в основе патогенеза ряда наследственных болезней. Так, своеобразная форма прогрессирующей кольцевидной дистрофии сосудистой оболочки и сетчатки (хориоретинопатия) вызывается недостаточностью орнитин-оксокислота — аминотрансферазы. Наследственный дефект или подавление при гиповитаминозе В6 аминобутират-аминотрансферазы (трансаминазы γ-аминомасляной кислоты) является одной из основных причин нарушения деятельности ц.н.с. при этой патологии.
Содержание некоторых аминотрансфераз в крови является важным диагностическим признаком ряда заболеваний. Наибольшее клинико-диагностическое значение имеют аспартат-аминотрансфераза (АсАТ) и аланин-аминотрансфераза (АлАТ). Повышение активности этих А. в крови позволяет распознавать патологические состояния, сопровождающиеся некрозом тканей. Так, при инфаркте миокарда активность АсАТ в крови резко возрастает (в 5—10 раз по сравнению с нормой) через 4—6 ч после начала заболевания, а затем постепенно снижается, достигая нормы примерно через 5 дней (в среднем на 3—7-й день). Повторное повышение активности АсАТ в крови говорит о продолжающемся процессе некротического распада ткани миокарда. При разрушении мышечной ткани (например, вследствие травмы) в крови возрастает активность как АсАТ, так и АлАТ. При вирусном гепатите (см. Гепатиты вирусные) активность АсАТ и АлАТ в сыворотке крови увеличивается, тогда как при механической желтухе, например при желчнокаменной болезни (Желчнокаменная болезнь), активность этих А. в сыворотке крови остается в пределах нормы. Т.о., определение в крови активности АсАТ и АлАТ может использоваться наряду с клиническими признаками для дифференциальной диагностики вирусного гепатита и желчнокаменной болезни. Особенно информативно определение активности АлАТ для ранней диагностики гепатита, поскольку активность АлАТ в сыворотке крови начинает увеличиваться уже в продромальной стадии болезни, когда другие ее признаки еще не определились. Отношение активности АсАТ/АлАТ (коэффициент де Ритиса) в это время становится меньше 1. При тяжелом поражении печени отношение активностей этих ферментов меняется.
В СССР определение активностей АсАТ и АлАТ осуществляют с помощью так называемого оптимизированного оптического теста, основанного на различии спектров поглощения окисленной и восстановленной форм кофермента НАД при длине волны 340 нм. Активность АсАТ в негемолизированной сыворотке крови определяют с использованием субстратно-буферного раствора, содержащего 0,25 моль/л L-аспарагиновой кислоты в 0,1 моль/л фосфатном буфере (рН 7,4). Используемый для определения активности АлАТ субстратно-буферный раствор содержит 0,63 моль/л L-аланина в 0,1 моль/л фосфатном буфере (рН 7,4).
В норме активность АсАТ и АлАТ при 30 колеблется в пределах от 30 до 420 нмоль/(с․л), или от 2 до 25 ME. Международная единица (ME) соответствует 1 мкмоль/(мин․л), или 16,67 нмоль/(с․л).
Унифицированным методом определения АсАТ и АлАТ в СССР признан также динитрофенилгидразиновый метод Райтмана — Френкеля, основанный на том, что продукты реакций, катализируемых АсАт и АлАТ (щавелевоуксусная и пировиноградная кислоты соответственно), при взаимодействии с 2,4-динитрофенил-гидразином в щелочной среде образуют окрашенные гидразоны. Интенсивность окраски, измеренная при длине волны 500—560 нм (зеленый светофильтр) в кювете с толщиной слоя 1 см, пропорциональна активности фермента. Нормальные величины активности АсАТ и АлАТ в крови, определенные методом Райтмана — Френкеля, равны 28—190 нмоль/(с․л), или 0,1—0,68мкмоль/(ч․мл) при 37°.
Аминотрансфера́зы (трансаминазы) — ферменты из группы трансфераз, катализирующие перенос аминогрупп от аминокислот на кетокислоты без образования свободногоаммиака. Эти реакции трансаминирования осуществляют связь между белковым и углеводным обменом. Аминотрансферазы также называют трансаминазами, а реакцию —трансаминированием. Ферменты относятся к подклассу КФ 2.6.
Для аминотрансфераз донором аминогрупп являются аминокислоты, а акцептором — кетокислоты:
AK1 + KK2 ↔ KK1 + AK2
Общая реакция трансаминирования
В составе простетической группы аминотрансферазы содержат производные витамина B6. Во время переноса аминогруппы простетическая группа переходит из пиридоксаль-5-фосфатной формы в пиридосамино-5-фосфатную форму.
Механизм реакции трансаминирования открыт в 1937 году советскими учеными А.Е. Браунштейном и М.Г.Крицман.
Процесс протекает в две стадии.
Альдегидная группа пиридоксальфосфата (-СНО) взаимодействует с аминогруппой аминокислоты с образованием иминной связи в основании Шиффа: сначала α-аминогруппа аминокислоты-донора замещает ε-аминогруппу апофермента, а затем происходит перегруппировка через кетимин и в результате гидролиза образуется пиридосамино-5-фосфат и α-кетокислота.
Реакции повторяются в обратном порядке
Аминотрансферазы являются каталитически совершенными ферментами.
Аминотрансферазы содержатся практически во всех органах, но наиболее активно реакции трансаминирования идут в печени.
К этой группе ферментов относятся такие важные для клинической лабораторной диагностики ферменты, как АСТ и АЛТ.
Источник
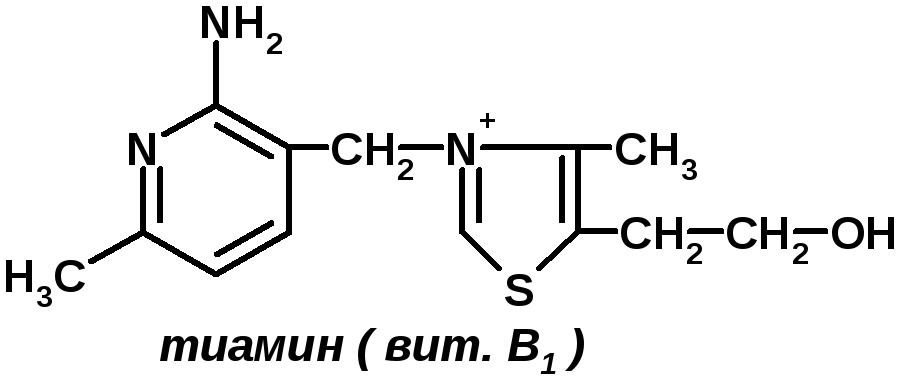
ТИАМИН
Тиамин (син.: витамин B1 устар. анейрин) — один из важнейших водорастворимых витаминов группы B; 4-метил-5β-оксиэтил-N-(2′-метил-4′-амино-5′-метенилпиримидин)-тиазолий. [[Файл: B1.png|center|250px|alt=Тиамин|Тиамин]]
Биологическое значение Тиамина обусловлено действием его производного — тиаминдифосфата (ТДФ; тиаминпирофосфат, кокарбоксилаза), образующегося из тиамина и АТФ при участии фермента тиаминкиназы (КФ 2.7.6.2). Тиаминдифосфат является коферментом (см. Коферменты) ряда ферментов, играющих существенную роль в углеводном обмене (см.), — пируватдегидрогеназы (КФ 1.2.4.1), альфа-кетоглутаратдегидрогеназы (оксоглутаратдегидрогеназы; КФ 1.2.4.2), транскетолазы (КФ 2.2.1.1) и дегидрогеназ кето-кислот с разветвленной боковой цепью. Недостаток Т. в организме человека и животных ведет к нарушению окисления углеводов, торможению зависящих от ТДФ процессов энергетического и пластического обеспечения жизненных функций, накоплению в крови и тканях недоокислениых продуктов обмена веществ, что, в свою очередь, приводит к патофизиологическим и патоморфологичесим изменениям, создающим картину гиповитаминоза (см. Витаминная недостаточность), одной из форм к-рого является бери-бери (см.).
Тиамин широко распространен в живой природе. Он присутствует в микроорганизмах, растениях и всех тканях животного организма. Особенно богаты им дрожжи и пшеничные зародыши. Т. синтезируется растениями и многими микроорганизмами. В организме человека и высших животных Т. не синтезируется, поэтому они должны получать его с пищей. Потребность человека в Т. составляет 0,6 мг на 1000 ккал суточного рациона или от 1.5 до 2,4 мг в сутки в зависимости от энергозатрат.
Наиболее богаты Тиамином хлеб, хлебопродукты (см.) из муки грубого помола или витаминизированной муки, крупы (см. Зерновые продукты), особенно гречневая, овсяная, пшенная, бобовые продукты (см.), печень, нежирная свинина. Молоко и молочные продукты так же, как большинство овощей, бедны тиамином (табл.).
Обычная тепловая кулинарная обработка мало влияет на содержание Т., но нагревание в щелочной среде ведет к значительной инактивации витамина. Большие количества Т. теряются с отрубями при приготовлении муки высших сортов, в связи с чем практикуется витаминизация муки высшего сорта путем добавления в нее в процессе ее изготовления Т. вместе с рибофлавином (см.) и никотиновой кислотой (см.) до уровня, соответствующего их содержанию в исходном зерне (см. Витаминизация пищевых продуктов) .
В живых организмах Тиамин присутствует не только в форме ТДФ. но и в форме свободного Т. и двух других его фосфорных эфиров — тиаминмонофосфата (ТМФ) и тиаминтрифосфата (ТТФ). На долю ТДФ приходится ок. 60—80% всего Т., содержащегося в организхме человека. У растений и микроорганизмов ТДФ участвует в катализе реакций неокислительного декарбоксилирования (см.) альфа-кетокислот.
Тиамин существует обычно в виде солей, одна из к-рых — тиаминхлорид (C12H17ON4SCI-HCl, мол. вес 337,27) кристаллизуется с 1/2 H2O в виде бесцветных моноклинических игл с t°gk 233—244° и 250—252° (с разложением). Известны также тиаминбромид (C12H17ON4SBrHBr-0,5H2O, мол. вес 435,19, t°пл 220° и 229—231°) и тиаминмононитрат (C12H17ON4SNO3, мол. вес 327,37, t°пл 164—165° и 196-200°). Соли Т. хорошо растворимы в воде, несколько хуже в спиртах, не растворимы в эфире, хлороформе, бензоле и ацетоне. Спектр поглощения Т. в водной среде при pH 7,0 имеет два максимума (при 233—235 и 265— 267 нм), а в кислой среде — один максимум (при 245—247 нм). Т. устойчив к нагреванию и действию окислителей в кислой среде; в щелочной среде легко окисляется в тиохром — вещество желтого цвета с t°пл 227° (с разложением), обладающее в этой среде интенсивной синей флюоресценцией с максимумом излучения при 460—470 нм.
В промышленности Тиамин получают конденсацией 2-метил-4-амино-5-аминометенилпиримидина, сероуглерода и 5-хлор-5-оксипентанона-2, а ТДФ — взаимодействием Т. и пирофосфорной к-ты.
Участие Т. в обмене веществ определяется коферментной функцией ТДФ и той ролью, к-рую в метаболизме играют ТДФ-зависимые ферменты.
ТДФ-зависимая пируватдегидрогеназа принимает участие в окислительном декарбоксилировании пировиноградной к-ты с образованием ацетил-КоА, обеспечивающем возможность полного окисления углеводов (см.) и утилизации заключенной в них энергии. В результате этого превращения пировиноградная к-та, образующаяся при гликолизе (см.) из глюкозы (см.), включается в цикл трикарбоновых к-т (см. Трикарбоновых кислот цикл). Образующийся в ходе этого ферментативного процесса ацетил-КоА служит донором остатка уксусной к-ты (так наз. активного ацетата), используемого для биосинтеза важнейших соединений — жирных кислот (см.), стеринов (см.), в т. ч. холестерина (см.), стероидных гормонов (см.), а также желчных кислот (см.) и ацетилхолина (см.).
Другой ТДФ-зависимый фермент — альфа-кетоглутаратдегидрогеназа участвует в окислительном декарбоксилировании альфа-кетоглутаровой к-ты с образованием янтарной к-ты (сукцината). Это превращение является важным этапом цикла трикарбоновых к-т. Кроме того, ТДФ принимает участие в окислительном декарбоксилировании кетокислот с разветвленной углеродной цепью — альфа-кетоизовалериановой, альфа-кетометнлвалериановой и альфа-кетоизокапроновой, являющихся продуктами дезаминирования (см.) валина (см.), изолейцина (см.) и лейцина (см.). Реакция играет существенную роль в процессах катаболизма белков, обеспечивая окисление и утилизацию этих аминокислот.
ТДФ-зависимая транскетолаза является одним из ферментов пентозофосфатного пути окисления углеводов — пентозного цикла (см. Углеводный обмен), служащего основным источником НАДФ-Н (см. Никотинамидадениндинуклеотид) и рибозо-5-фосфата, из к-рых первый используется как донор водорода в многочисленных восстановительных биосинтетических процессах, а второй входит в состав нуклеотидов и нуклеиновых кислот (см.).
Тиамин в форме ТДФ принимает непосредственное участие в осуществлении каталитического акта благодаря своей способности диссоциировать с отщеплением протона при втором углеродном атоме тиазолового кольца, после чего Т. приобретает структуру высокоактивного биполярного иона, к-рый взаимодействует с молекулой превращаемого субстрата.
При недостаточности Т. наиболее значительные патологические изменения развиваются в пищеварительной, нервной и сердечно-сосудистой системах. Характерными проявлениями гиповитаминоза B1 являются общая слабость, потеря веса тела вплоть до кахексии. Нарушения со стороны желудочно-кишечного тракта относятся к числу наиболее ранних проявлений недостаточности Т. и выражаются в потере аппетита, тошноте, снижении желудочной секреции, ахлоргидрии, атонии, запорах.
Нарушения со стороны нервной системы проявляются головными болями, слабостью, быстрой утомляемостью, раздражительностью, ослаблением памяти, поражением периферических нервов. Характерны мышечная слабость, болезненность икроножных мышц при пальпации, утрата мышечного тонуса, парестезии и гиперестезии, полиневриты, угасание сухожильных рефлексов, атрофические параличи мышц конечностей, судороги. Тяжелая форма гиповитаминоза лежит в основе алкогольных энцефалопатий (см.), часто обусловленных хроническим алкоголизмом и сопровождающихся нарушением координации движений, офтальмоплегией, спутанностью сознания.
Гистологически при тяжелой недостаточности Т. обнаруживают дистрофические изменения в дистальных отделах периферических нейронов с распадом миелинового вещества и вакуолизацией нейролеммоцшюв (шванновских клеток). Патоморфол. изменения в сером веществе головного мозга, локализованные преимущественно вокруг желудочков, имеют вид очаговых кровоизлияний с пролиферацией клеток эндотелия кровеносных сосудов и клеток нейроглии.
Патологические изменения в сердечно-сосудистой системе, связанные с расстройством центральной регуляции сосудистого тонуса и нарушениями обмена веществ, проявляются тахикардией, болями в области сердца, понижением АД, расширением границ сердца (преимущественно его правых отделов). В очень тяжелых случаях развиваются сердечная недостаточность с цианозом, застойными явлениями в печени, отеки. Выраженность симптомов гиповитаминоза B1 зависит от степени недостаточности тиамина в организме.
Недостаточность витамина B1 иногда развивается при однообразном питании очищенным рисом, продуктами из муки тонкого помола и др. У пожилых людей недостаток Т., как и ряда других витаминов (см.), может быть обусловлен общим снижением количества потребляемой пищи и уменьшением всасывания витаминов в кишечнике. Причиной недостатка Т. в организме может служить также нарушение всасывания витаминов при хрон. заболеваниях кишечника: энтеритах, энтероколитах и др. В этих случаях дефицит Т., как правило, сочетается с дефицитом других витаминов (полигиповитаминоз). Недостаток Т. может быть также вызван избыточным потреблением продуктов, содержащих тиаминазу (см.), разрушающую Т. (напр., сырой рыбы), или развитием в жел.-киш. тракте патогенной микрофлоры (Вас. thiaminolyticus, Вас. aneurinolyticus), продуцирующей этот фермент.
Наряду с недостаточностью Тиамина алиментарного происхождения известны заболевания, обусловленные генетическими дефектами обмена Т. и ТДФ-зависимых ферментов (см. Энзимопатии). Эти заболевания, клинически сходные с проявлениями гиповитаминоза B1, отмечают при достаточном поступлении Т. в организм. К ним относятся подострая некротическая инфантильная энцефаломиелопатия, впервые описанная Ли (D. J. Leigh), при к-рой в ткани мозга нарушено образование ТТФ в результате генетически обусловленной недостаточности фермента тиаминдифосфаткиназы (КФ 2.7.4.15); вестибуломозжечковая периодическая атаксия, обусловленная врожденным дефектом пируватдегидрогеназного комплекса; тиаминзависимая мегалобластическая анемия (см. Анемия) и тиаминзависимая форма декарбоксилазной недостаточности (см.), при к-рой моча имеет запах кленового сиропа.
Для оценки обеспеченности организма человека Т. широко используют определение его суточной экскреции с мочой. Этот показатель удовлетворительно отражает поступление Т. с пищей; при достаточном поступлении витамина в организм он обычно превышает 100 мкг. При невозможности сбора суточной мочи можно определять содержание Т. в часовой порции, т. е. в моче, собранной натощак через 1 час после опорожнения мочевого пузыря; в норме содержание Т. должно быть не менее 15 мкг. Кроме того, в этом случае экскрецию Т. можно соотнести с экскрецией креатинина (см. Креатин). При достаточном поступлении Т. с пищей этот показатель не должен быть ниже 65 мкг Т. на 1 г креатинина.
Содержание Тиамина в моче обычно определяют флюориметрически (см. Флюориметрия) по методу Ванга — Харриса после окисления тиамина до тиохрома с помощью красной кровяной соли (феррицианида калия).
Для оценки насыщенности организма Тиамином исследуют его содержание в цельной крови или эритроцитах. В норме общее содержание Т. в крови составляет 6—12 мкг/100 мл, снижаясь при дефиците витамина B1 до 2—4 мкг/100 мл и ниже. Т. присутствует преимущественно в форменных элементах крови, тогда как концентрация его в плазме крови очень невелика. Содержание общего Т. в крови определяют флюориметрически после предварительного расщепления ТДФ с помощью фосфатаз (см.), источником к-рых может служить ферментный препарат из Aspergillus niger или Aspergillus oryzae (оризин). В пробах, не обработанных фосфатазами, определяют содержание свободного Т., а разница между общим и свободным Т. дает содержание его фосфорилированных форм, гл. обр. ТДФ. Содержание ТДФ в крови и тканях можно определить также ферментативным методом с апоферментом пируватдекарбоксилазы дрожжей.
Специфическим функциональным тестом обеспеченности организма Т. является определение в гемолизате крови активности ТДФ-зависимого фермента транскетолазы, к-рая значительно снижается уже на ранних стадиях гиповитаминоза B1 (ниже 15—20 мкмоль седогептулозо-7-фосфата в 1 мл в 1 час), что обусловлено нехваткой ее кофермента — ТДФ. Добавление ТДФ к гемолизату крови в этом случае активирует транскетолазу. Степень такой активации, или ТДФ-эффект, служит мерой обеспеченности организма Т. В норме эта величина не превышает 15%, при гиповитаминозе B1 составляет 15—25%, при клинически выраженном авитаминозе B1 достигает 30% и более.
Функциональным тестом обеспеченности организма Т. является также определение содержания в крови и моче пировиноградной к-ты, количество к-рой возрастает при дефиците Т. вследствие блокирования ТДФ-зависимого окислительного де-карбоксилирования этой к-ты. Однако такой показатель менее специфичен, т. к. пировиноградная к-та может накапливаться в организме и в других условиях, в частности при тканевой гипоксии.
Тиамин как препарат
Тиамин как препарат (Thiaminum, Vitaminum B1; син.: Aneurin, Anevryl, Betaneurin, Betavitan, Oryzanin, Vitaplex B1 и др.). В качестве лекарственно-профилактических средств в медицине применяют тиамина бромид, тиамина хлорид, фосфотиамин, бенфотиамин и коферментную форму витамина B1 — кокарбоксилазы гидрохлорид.
Основные фармакол. свойства препаратов обусловлены их специфическим участием в тиаминзависимых метаболических процессах, нарушение к-рых происходит либо при гиповитаминозе Вт и генетически обусловленных нарушениях обмена, либо вторично при нек-рых патол. процессах. Т. оказывает влияние на проведение нервных импульсов в нервно-мышечных синапсах, обладает ганглиоблокирующими и курареподобными свойствами, противосудорожной активностью, положительно воздействует на функциональную деятельность сердечно-сосудистой системы. В эксперименте выявлено, что наиболее выраженным побочным действием обладает тиамина бромид, несколько меньшим — тиамина гидрохлорид, еще меньшим — фосфотиамин и бенфотиамин.
Тиамина хлорид или тиамина бромид, попадая в кишечник в виде свободного Т., подвергаются воздействию фермента тиаминазы, к-рый частично разрушает Т. Однако большая часть Т. всасывается в кровь; затем Т. в ткани печени, почек, сердца, головного мозга и др. фосфори-лируется с образованием его фосфорных эфиров, особенно ТДФ. При высоких концентрациях Т. выводится почками в неизмененном виде или в виде продуктов его распада.
Преимущество фосфотиамина (ТМФ) перед тиамина хлоридом или тиамина бромидом состоит в том, что он представляет собой промежуточный продукт в процессе превращения Т. в его коферментную форму и значительно быстрее превращается в ТДФ. В отличие от ТДФ фосфотиамин способен проникать через мембраны клеток кишечной стенки, не подвергаясь при этом дефосфорилированию; в мед. практике он применяется в виде таблеток. Фосфотиамин обладает способностью депонироваться в тканях организма в большем количестве, чем другие препараты Т.
Бенфотиамин (бензилтиамин-О-монофосфат) по фармакол. свойствам близок к тиамина хлориду, но имеет перед ним ряд преимуществ: его побочное действие менее выражено, он лучше всасывается в кишечнике, более устойчив к действию тиаминазы микрофлоры кишечника и способен более длительное время поддерживать в крови повышенную концентрацию свободного тиамина.
Препараты Т. (кроме кокарбоксилазы) применяют для профилактики или лечения гиповитаминоза B1, а также при неврите, радикулите, невралгии, периферическом параличе, язвенной болезни желудка и двенадцатиперстной кишки, атонии кишечника, хрон. алкоголизхме, хрон. недостаточности кровообращения и миокардиодистрофии, спазме периферических сосудов, нек-рых заболеваниях печени, в дерматол. практике — в комплексном лечении дерматозов нейротрофического происхождения.
Иногда препараты Т. (особенно тиамина хлорид и тиамина бромид) могут вызвать аллергические реакции (отек Квинке, зуд, крапивницу); при внутривенном введении интенсивность аллергических реакций может возрастать вплоть до развития анафилактического шока (см.). Особенно осторожно надо назначать препараты Т. лицам с отягощенным аллергологическим анамнезом, женщинам в нредклимактерическом и климактерическом периоде и лицам, страдающим хроническим алкоголизмом.
Противопоказаниями к применению препаратов Т. служат аллергические заболевания и лекарственная непереносимость в анамнезе. Не рекомендуется одновременное парентеральное введение препаратов Т. с пиридоксином (см.) и цианокобаламином (см.), т. к. первый затрудняет превращение Т. в биологически активную коферментную форму, а второй усиливает аллергизирующее действие Т.
Хранят препараты Т. в герметически или плотно укупоренной таре, в защищенном от света месте.
Бенфотиамин (Benphothiaminum) — белый кристаллический порошок со слабым запахом. Показания к применению те же, что и для всех препаратов Т.; кроме того, бенфотиамин назначают при атеросклерозе, ишемической болезни сердца у лиц пожилого и старческого возраста, при ревмокардите.
Суточная доза 0,1 — 0,2 г (в 1—4 приема, после еды), курс лечения 15—40 дней. Для лиц пожилого возраста дозу снижают до 0,075 г, для лиц старческого возраста — до 0,05 г в сутки; курс лечения 15— 30 дней. При дерматозах суточная доза 0,1 — 0,15 г, курс лечения 30— 40 дней. При заболеваниях печени суточная доза до 0,1 г, курс лечения 15—30 дней.
Форма выпуска: таблетки по 0,005 и 0,025 г.
Кокарбоксилаза (Cocarboxylasum; син.: тиаминпирофосфат, Cocarboxylase, Diphosphothiamin и др.) — белый кристаллический порошок горьковато-кислого вкуса со слабым специфическим запахом. Легко растворим в воде, нерастворим в спирте, при нагревании разлагается; р-ры с концентрацией кокарбоксилазы 2,5% имеют pH 1,4—1,7. Р-ры кокарбоксилазы готовят ex tempore. Для мед. целей используют кокарбоксилазы гидрохлорид (Cocarboxylasi hydrochlo-ridum).
Для лечения гиповитаминоза B1 кокарбоксплазу не применяют. Показаниями к ее назначению служат диабетогенный ацидоз, печеночная и почечная недостаточность, дыхательный ацидоз при хрон. легочно-сердечной недостаточности, диабетической и печеночной коме, недостаточности коронарного кровообращения, невриты, недостаточность углеводного обмена разной этиологии.
Кокарбоксилаза обычно является компонентом комплексной терапии. Вводят препарат внутримышечно, подкожно или внутривенно. Доза для взрослых 0,05—0,1 г, для детей 0,025—0,05 г 1 раз в день.
Форма выпуска: ампулы по 0,05 г лиофилизированного порошка, к каждой прилагается ампула с 2 мл растворителя. Хранят в прохладном месте.
Тиамина бромид (Thiamini bromidum) и тиамина хлорид (Thiamini cbloridum) — белые кристаллические порошки со специфическим запахом дрожжей. Легко растворимы в воде, р-р (pH 2,7 — 3,6) стерилизуют при 100° в течение 30 мин. Назначают взрослым при начальных признаках гиповитаминоза В, по 0,005—0,01. г в день; на более поздних стадиях гиповитаминоза, а также при заболеваниях жел.-киш. тракта, кожи и нервной системы дозу увеличивают до 0,05 г в сутки. Курс лечения взрослых 30—40 дней, детей — в зависимости от возраста.
По активности 1 мг тиамина хлорида соответствует 1,29 мг тиамина бромида из-за большего мол. веса. Парентерально эти препараты применяют в случаях нарушения всасываемости Т. в кишечнике или при необходимости быстрого создания высоких концентраций витамина B1; в крови. Обычно взрослым в сутки вводят внутримышечно и о 0,025— 0,05 г тиамина хлорида (1 мл 2,5 пли 5% р-ра) или по 1 мл 3 или 6% р-ра тиамина бромида. Курс лечения 10—30 дней.
Подкожные (иногда и внутримышечные) инъекции этих препаратов болезненны в связи с низким pH р-ров. В отдельных случаях после инъекций (реже при приеме внутрь) возможны аллергические реакции, к-рые могут быть более выраженными при внутривенном введении.
Формы выпуска: тиамина хлорида — таблетки или драже по 0,002 гг таблетки по 0,005 и 0,01 г, ампулы по 1 мл 2,5 и 5% р-ра; тиамина бромида — таблетки или драже по 0,00258 г, таблетки по 0,00645 и 0,0129 г, ампулы по 1 мл 3 и 6% р-ра.
Фосфотиамин (Phosphothiaminum) — белый, иногда желтоватый порошок кислого вкуса со слабым специфическим для Т. запахом. Легко растворим в воде, нерастворим в спирте.
Фосфотиамин назначают взрослым по 0,01—0,03 г в сутки. Показания к применению те же, что и для других препаратов Т. При экстрасистолиях дозу фосфотиамина увеличивают до 0,07 г. Курс лечения 30—40 дней.
Источник