18. Компоненты дыхательной цепи и их характеристика. Фмн и фад-зависимые дегидрогеназы. Строение окисленной и восстановленной форм фмн.
1 .НИКОТИНЗАВИСИМЫЕ ДГ, т.е. содержащие КОФЕРМЕНТЫ — НАД, НАДФ
2.ФЛАВИНЗАВИСИМЫЕ ДГ, т.е. содержащие КОФЕРМЕНТЫ — ФМН, ФАД.
4.ЦИТОХРОМЫ: в, с, c1., а, а3.
Почти все эти компоненты, за исключением первого, встроены во внутреннюю мембрану МИТОХОНДРИЙ.
ФАД и ФМН-зависимые дегидрогеназы содержат в качестве кофермента фосфорный эфир витамина В2 (ФАД).
СТРОЕНИЕ КОМПОНЕНТОВ ДЫХАТЕЛЬНОЙ ЦЕПИ.
1 .В НАД и НАДФ рабочей частью является витамин РР — НИКОТИНАМИД.
НАД*2Н + 2е = НАДН+Н
2.В ФАД и ФМН рабочей частью является ФЛАВИИ (компонент витамина В2)
3.УБИХИНОН легко переходит в восстановленную форму KOQ +2Н +2е =KOQ*H2
4.ЦИТОХРОМЫ — это ГЕТЕРОПРОТЕИНЫ. Их белковой частью является ГЕМ. Белки хромопротеиды, способные присоединять электроны, благодаря наличию в своем составе в качестве простетических групп железопорфиринов. Они принимают электрон от вещества, являющегося немного боле сильным восстановителем, и передают его более сильному окислителю.
Цитохромы электронтранспортной цепи. Их функционирование. Образование воды как конечного продукта обмена.
ЦИТОХРОМЫ — это ГЕТЕРОПРОТЕИНЫ. Их белковой частью является ГЕМ, структура которого представляет собой 4 ПИРРОЛЬНЫХ кольца и атом железа, который легко меняет валентность. Также могут включать медь.
20. Пути синтеза атф. Субстратное фосфорилирование (примеры). Молекулярные механизмы окислительного фосфорилирования (теория Митчелла). Разобщение окисления и фосфорилирования.
Процесс образования АТФ в дыхательной цепи – окислительное фосфорилирование. За счет энергии транспорта электронов в ДЦ из АДФ и неорганического фосфата образуется АТФ. Субстратное фосфорилирование – процесс синтеза АТФ из АДФ и фосфата за счет энергии окисленного субстрата в цитоплазме клетки. Примером субстратного фосфорилирования могут служить реакции:
Основные положения теории Митчела:
1.Мембрана митохондрий не проницаема для протонов.
2.Образуется протонный потенциал в процессе транспорта электронов и протонов.
3.Обратный транспорт протонов в матрикс сопряжен с образованием атф.
Процесс транспорта электронов происходит во внутренней мембране. Протоны переносятся в межмембранное пространство, а электроны продвигаются по дыхательной цепи. Внутренняя мембрана со стороны матрикса заряжается отрицательно, а со стороны межмембранного пространства — положительно. Во время дыхания создается ЭЛЕКТРО-ХИМИЧЕСКИЙ градиент; концентрационный и разности потенциалов. Электрический и концентрационный градиент составляет ПРОТОНДВИЖУЩУЮ силу, которая дает силу для синтеза АТФ. На определенных участках внутренней мембраны есть протонные каналы. Протоны могут проходить обратно в матрицу, при этом образующаяся энергия идёт на синтез АТФ.
Разобщение дыхания и фосфорилирования
Некоторые химические вещества (протонофоры) могут переносить протоны или другие ионы (ионофоры) из межмембранного пространства через мембрану в матрикс, минуя протонные каналы АТФ-синтазы. В результате этого исчезает электрохимический потенциал и прекращается синтез АТФ. Это разобщение дыхания и фосфорилирования. В результате разобщения количество АТФ снижается, а АДФ увеличивается. Разобщители — липофильные вещества, легко проходящие через липидный слой мембраны. Это 2,4-динитрофенол, присоединяющий протон в межмембранном пространстве и перенося его в матрикс.
Источник
КОФЕРМЕНТЫ
КОФЕРМЕНТЫ (син. коэнзимы) — низкомолекулярные органические соединения биологического происхождения, необходимые в качестве дополнительных специфических компонентов (кофакторов) для осуществления каталитического действия ряда ферментов. Многие К. представляют собой производные витаминов. Биол, эффект значительной группы витаминов (группы В) определяется их превращением в К. и ферменты в клетках организма. Были сделаны попытки (и небезуспешные) прямого использования некоторых К. с леч. целями. Трудности, которые при этом возникают, состоят в том, что не всегда производятся количественные определения содержания К. в крови и органах и еще реже определяется активность ферментов, синтезирующих или разрушающих исследуемые К., в норме и патологии. Обнаруженный при каком-либо заболевании недостаток того или иного К. обычно пытаются устранить, вводя в организм соответствующий витамин. Но если нарушены системы синтеза недостающего К., что нередко имеет место, то введение такого витамина теряет смысл: терапевтический эффект можно получить только введением недостающего кофермента. С леч. целями применяют кокарбоксилазу (см. Тиамин), ФАД, коферментные формы витамина В12 (см. Цианокобаламин) и некоторые другие К. В леч. целях К. вводят парентерально, но и при этом условии не всегда имеется уверенность, что они могут без расщепления проникнуть к месту своего действия (во внутриклеточную среду).
Обладая небольшим мол. весом, К., в отличие от биокатализаторов белковой природы (ферментов), характеризуются термостабильностью и доступностью диализу. Дыхательные хромогены растений (полифенолы), глутаминовую к-ту, орнитин, бисфосфаты (дифосфаты) глюкозы и глицериновой к-ты и другие метаболиты, действующие при определенных обстоятельствах как кофакторы ферментативных процессов переноса, нередко обозначают как К. соответствующих процессов. Правильнее применять термин «кофермент» только к соединениям, биол, функция которых сводится целиком или преимущественно к их специфическому участию в действии ферментов (см.).
Термин «кофермент» был предложен Г. Бертраном в 1897 г. для обозначения функции солей марганца, которые он считал специфическим кофактором фенол азы (лакказы); однако теперь неорганические компоненты ферментных систем не принято относить к числу К. Существование истинного (органического) К. впервые установили англ. биохимики Харден (A. Harden) и Янг (W. Young) в 1904 г., показавшие, что из ферментных экстрактов дрожжевых клеток при диализе удаляется термостабильное органическое вещество, необходимое для действия ферментного комплекса, катализирующего спиртовое брожение (см.). Этот вспомогательный катализатор брожения Харден и Янг назвали козимазой; его строение было установлено в 1936 г. в лабораториях X. Эйлер- Xeльпина и О. Варбурга почти одновременно.
Механизм действия К. неодинаков. Во многих случаях они действуют в качестве промежуточных акцепторов (переносчиков) определенных хим. группировок (фосфатных, ацильных, аминных и др.), атомов водорода или электронов. В других случаях К. участвуют в активировании молекул субстратов ферментативных реакций, образуя с этими молекулами реакционно-способные промежуточные соединения. В виде таких соединений субстраты подвергаются определенным ферментативным превращениям; таковы функции глутатиона (см.) как кофермента глиоксалазы и дегидрогеназы формальдегида, КоА — при ряде превращении жирных кислот (см.) и других органических к-т и т. д.
Типичные К. образуют непрочные сильно диссоциированные соединения со специфическими белками (апоферментами) растворимых ферментов, от которых они легко могут быть отделены путем диализа (см.) или гель-фильтрация (см.). При многих реакциях переноса групп, протекающих при сопряженном действии двух ферментных белков, происходит поочередное обратимое присоединение к молекулам этих белков частиц К. в двух формах — акцепторной и донорной (напр., окисленной и восстановленной, фосфорилированной и нефосфорилированной). В приведенной ниже схеме показан (в несколько упрощенной форме) механизм обратимого переноса водорода между молекулой донора водорода (АН2) и молекулой акцептора (Б) при действии двух дегидрогеназ (Фа и Фб) и кофермента (Ко):
В полном цикле окислительно-восстановительного процесса (реакции 1—6) кофермент кодегидрогеназа не изменяется и не входит в баланс продуктов реакции, т. е. служит катализатором. Если же рассматриваются последовательные фазы цикла, протекающие каждая с участием одного фермента (реакции 1—3 и 4—6), то Ко и КоН2 выступают наравне с молекулами АН2, А, Б, БН2 в качестве второго субстрата. В этом же смысле относительным является различие между субстратами и диссоциирующими К., участвующими в сопряженных реакциях переноса фосфатных, ацильных, гликозильных и других групп.
У многих двухкомпонентных ферментов, построенных по типу протеидов, апофермент образует с небелковым термостабильным компонентом прочное, труднодиссоциирующее соединение. Небелковые компоненты ферментов-протеидов, обычно называемые простетическими группами (напр., флавиновые нуклеотиды, пиридоксальфосфат, металлопорфирины), взаимодействуют с субстратом, оставаясь на всем протяжении ферментативной реакции в составе нерасщепленной молекулы одного протеида. Термин «кофермент» обычно распространяют и на химически взаимодействующие с молекулами субстратов, прочно связанные органические простетические группы ферментов, которые трудно отграничить от легко диссоциирующих К., т. к. между обоими типами кофакторов существуют постепенные переходы.
Точно также нельзя провести резкой грани между К. и нек-рыми промежуточными продуктами обмена веществ (метаболитами), которые в ферментативных процессах выступают то как обычные субстраты, подвергающиеся в данном процессе в основном необратимому изменению, то как необходимые вспомогательные катализаторы при сопряженных ферментативных превращениях, из которых эти метаболиты выходят неизмененными. Метаболиты такого рода могут служить промежуточными акцепторами тех или иных групп в процессах ферментативного переноса, протекающих аналогично процессу, схематично изображенному выше (напр., роль полифенолов как переносчиков водорода в дыхании растительных клеток, роль глутаминовой к-ты в переносе аминных групп путем реакций трансаминирования и т. п.), или в более сложных циклических превращениях с участием нескольких ферментов (примером может служить функция орнитина в цикле образования мочевины). Несколько иной характер носит коферментоподобное действие 1,6-бисфосфоглюкозы, к-рая служит необходимым кофактором и в то же время промежуточной ступенью в процессе межмолекулярного переноса фосфатных остатков при взаимопревращении 1-фосфоглюкозы и 6-фосфоглюкозы под действием фосфоглюкомутазы, когда молекула кофактора переходит в молекулу конечного продукта, отдавая один фосфатный остаток исходному продукту, из к-рого при этом образуется новая молекула кофактора. Точно такую же функцию выполняет 2,3-бисфосфоглицериновая к-та при катализируемом другой фосфомутазой взаимопревращении 2-фосфоглицериновой и 3-фосфоглицериновой к-т.
К. весьма разнообразны по хим. строению. Однако чаще всего среди них встречаются соединения двух типов: а) нуклеотиды и некоторые другие органические производные фосфорной к-ты; б) пептиды и их производные (напр., фолиевая к-та, КоА, глутатион). У животных и у многих микроорганизмов для построения молекул ряда К. необходимы соединения, которые этими организмами не синтезируются и должны доставляться с пищей, т. е. витамины (см.). Водорастворимые витамины группы В в большинстве своем входят в состав К., строение и функции которых известны (это относится к тиамину, рибофлавину, пиридоксалю, никотинамиду, пантотеновой к-те), или же могут сами действовать как активные молекулы К. (витамин В12, фолиевая к-та). То же, вероятно, относится и к другим водо- и жирорастворимым витаминам, роль которых в процессах биол, катализа еще полностью не выяснена.
Ниже перечислены важнейшие К. с указанием типа их строения и основных видов ферментативных превращений, в которых они участвуют. В статьях об отдельных К. приведены более детальные сведения об их структуре и механизме действия.
Коферменты нуклеотидной природы. Адениловые рибонуклеотиды (аденозин-5′-моно-, ди- и трифосфорные к-ты) участвуют в многочисленных реакциях активирования и переноса орто- и пирофосфатных остатков, остатков аминокислот (аминоацилов), угольной и серной к-т, а также в ряде других ферментативных превращений. Аналогичные функции в определенных случаях выполняют производные инозин-5′-фосфорной и гуанозин-5′-фосфорной к-т.
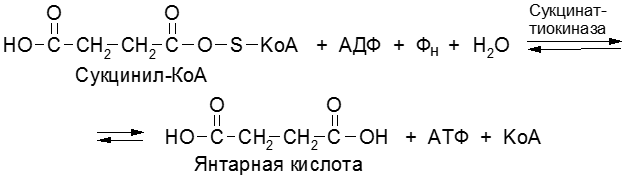
Гуаниловые рибоиуклеотиды (гуанозин-5′-моно-, ди- и трифосфорные к-ты) играют роль К. при реакциях переноса остатка янтарной к-ты (сукцинила), биосинтезе рибонуклеопротеидов в микросомах, биосинтезе адениловой к-ты из инозиновой и, возможно, при переносе остатков маннозы.
Цитидиловые рибонуклеотиды (цитидин-5′-фосфорные к-ты) при биосинтезе фосфатидов играют роль К. переноса остатков О-фосфоэтанол холина, О-фосфоэтаноламина и т. д.
Уридиловые рибонуклеотиды (уридин-5′-фосфорные к-ты) выполняют функции К. в процессах трансгликозилирования, т. е. переноса остатков моноз (глюкозы, галактозы и др.) и их производных (остатков гексозаминов, глюкуроновой к-ты и т. п.) при биосинтезе ди- и полисахаридов, глюкуронозидов, гексозаминидов (мукополисахаридов), а также при активировании остатков сахаров и их производных в некоторых других ферментативных процессах (напр., взаимопревращении глюкозы и галактозы и др.).
Никотинамидадениндинуклеотид (НАД) участвует в важнейших для клеточного обмена реакциях переноса водорода в качестве специфического К. многочисленных дегидрогеназ (см.).
Никотинамидадениндинуклеотидфосфат (НАДФ) участвует в важнейших для клеточного обмена реакциях переноса водорода в качестве специфического К. некоторых дегидрогеназ.
Флавинмононуклеотид (ФМН) участвует в биол, переносе водорода как К. (простетическая группа) некоторых флавиновых («желтых») окислительных ферментов.
Флавинадениндинуклеотид (ФАД) участвует в биол, переносе водорода как К. (простетическая группа) большинства флавиновых («желтых») окислительных ферментов.
Кофермент А (КоА, восстановленная форма — KoA-SH, кофермент ацилирования; соединение аденозин-З’ ,5′-бисфосфорной к-ты с пантотенил-аминоэтантиолом или пантетеином) образует с остатками уксусной и других органических к-т тиоэфиры типа R-СО—S-КоА, где R — остаток органической к-ты, и играет роль К. в переносе и активировании кислотных остатков как при реакциях ацилирования (синтез ацетилхолина, гиппуровой к-ты, парных желчных к-т и т. п.), так и при многих других ферментативных превращениях кислотных остатков (реакции конденсации, оксидоредукции или обратимой гидратации ненасыщенных к-т). При участии КоА протекает ряд промежуточных реакций клеточного дыхания, биосинтеза и окисления жирных к-т, синтеза стероидов, терпенов, каучука и т. п.
Кофермент B12 [KoB12; син. кобаламин, ДБК-кофермент, альфа-(5,6-диметилбензимидазолил)-кобамидцианид]. Возможно, что разнообразные биол, функции витамина В12, хим. механизм которых еще не ясен, напр, в процессе кроветворения, при биосинтезе метильных групп, превращениях сульфгидрильных групп (SH-групп) и т. д., обусловлены его ролью как К. в процессе биосинтеза белков-ферментов.
Другие коферменты, содержащие фосфатные остатки. Дифосфотиамин служит К. при декарбоксилировании (простом и окислительном) пировиноградной, альфа-кетоглутаровой и других альфа-кетокислот, а также при реакциях расщепления углеродной цепи фосфорилированных кетосахаров под действием особой группы ферментов (кетолазы, транскетолазы, фосфокетолазы).
Пиридоксальфосфат конденсируется с аминокислотами (и аминами) в активные промежуточные соединения типа оснований Шиффа (см. Шиффа основания); является К. (простетической группой) ферментов, катализирующих реакции трансаминирования и декарбоксилирования, а также многих других ферментов, которые осуществляют разнообразные превращения аминокислот (реакции расщепления, замещения, конденсации), играющие важную роль в клеточном обмене.
Коферменты пептидной природы. Кофермент формилирования. Восстановленная фолиевая к-та и ее производные, содержащие три или семь остатков глутаминовой к-ты, соединенных гамма-пептидными связями, играют роль К. в промежуточном обмене так наз. одноуглеродных, или «C1», остатков (формила, оксиметила и метила), участвуя как в реакциях переноса этих остатков, так и в их окислительно-восстановительных взаимопревращениях. Формильные и оксиметильные производные Н4-фолиевой к-ты являются «активными формами» муравьиной к-ты и формальдегида в процессах биосинтеза и окисления метильных групп, в обмене серина, глицина, гистидина, метионина, пуриновых оснований и т. д.
Глутатион. Восстановленный глутатион (Г-SH) действует по типу К. при превращении метилглиоксаля в молочную к-ту под влиянием глиоксалазы, при ферментативной дегидрогенизации формальдегида, в определенных стадиях биол, окисления тирозина и т. д. Кроме того, глутатион (см.) играет большую роль в защите различных тиоловых (сульфгидрильных) ферментов от инактивирования в результате окисления SH-групп или связывания их тяжелыми металлами и другими SH-ядами.
Прочие коферменты. Липоевая кислота является вторым К. дегидрогеназ пировиноградной и альфа-кетоглутаровой к-т (наряду с дифосфотиамином); при действии этих ферментов остаток липоевой к-ты, связанный амидной связью (СО — NH) со специфическими ферментными белками, выполняет функции промежуточного акцептора (переносчика) водорода и ацильных остатков (ацетила, сукцинила). Другие предполагаемые функции этого К. недостаточно изучены.
Витамин E (токоферол), витамин К (филлохинон) и продукты их окислительно-восстановительиых превращений или близкородственные производные n-бензохинона (убихинон, кофермент Q) рассматриваются как К. (переносчики водорода), участвующие в определенных промежуточных реакциях дыхательной окислительной цепи и в сопряженном с ними дыхательном фосфорилировании (см.). Установлено, что филлохинон (витамин К) играет роль К. в биосинтезе остатков альфа-карбоксиглутаминовой к-ты, входящих в состав молекул белковых компонентов системы свертывания крови.
Биотин — водорастворимый витамин, выполняющий роль К. или простетической группы в составе ряда ферментов, катализирующих реакции карбоксилирования — декарбоксилирования некоторых органических к-т (пировиноградной, пропионовой и др.). Эти ферменты имеют строение биотинил-протеидов, в которых соответствующий биотину ацильный остаток (биотинил) присоединен амидной связью к N6-аминогруппе одного из остатков лизина молекулы белка.
Аскорбиновая кислота служит активатором ферментной системы окисления тирозина в животных тканях и некоторых других ферментных систем (гидроксилаз), при действии которых в ядро ароматических и гетероциклических соединений, в т. ч. пептидно-связанных остатков пролина при биосинтезе коллагена (см.) и родственных белков, вводятся гидроксильные группы. В этих системах аскорбиновая к-та играет роль второго субстрата — донора водорода, окисляемого молекулярным кислородом параллельно с циклическим субстратом, а не роль истинного К. (специфического биокатализатора).
Библиография: Болдуин Э. Основы динамической биохимии, пер. с англ., с. 55 и др., М., 1949; Витамины, под ред. М. И. Смирнова, М., 1974; Диксон М. и Уэбб Э. Ферменты, пер. с англ., М., 1966; Коферменты, под ред. В. А. Яковлева, М., 1973; Кочетов Г. А. Тиаминовые ферменты, М., 1978, библиогр.; Ферменты, под ред. А. Е. Браунштейна, с. 147, М., 1964, библиогр.
Источник