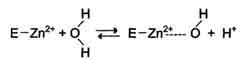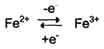АМИНОТРАНСФЕРАЗЫ
АМИНОТРАНСФЕРАЗЫ (синоним трансаминазы; устаревшее название аминоферазы) — ферменты из класса трансфераз, катализирующие реакцию трансаминирования, то есть перенос аминогруппы (—NH2) и атома водорода от одной молекулы субстрата к другой; играют важную роль в азотистом обмене. Общая схема реакции:
Реакция протекает без промежуточного образования аммиака. Ферментативное трансаминирование было открыто в 1937 году А. Е. Браунштейном и М. Г. Крицман, которые показали, что препараты из грудной мышцы голубя катализируют обратимую реакцию образования глутаминовой кислоты (см.) и α-кетокислоты (см. Кетокислоты) из α-кетоглутарата и различных аминокислот.
Аминотрансферазы обнаружены во всех исследованных тканях растений и животных и в клетках микроорганизмов. Известно около 50 аминотрансферазы, которые действуют избирательно на природные α-аминокислоты и многие β-, γ- и δ-аминокислоты. Наиболее активные и самые распространенные аминотрансферазы используют глутаминовую и α-кетоглутаровую кислоты в качестве одной из донорно-акцепторных пар; остальные аминокислоты трансаминируются менее активными аминотрансферазами, обычно проявляющими групповую специфичность (см. Ферменты) к нескольким субстратам сходного строения, например к аминокислотам с разветвленной цепью или ароматическим аминокислотам. В органах высших животных (мышцы, сердце, печень) наиболее активны аспартат-кетоглутарат-аминотрапсферазы и аланин-кетоглутаратамино-трансферазы.
Все очищенные аминотрансферазы, выделенные из тканей животных, высших растений и многих микроорганизмов, стерео-специфичны. Они катализируют, как правило, трансаминирование аминокислот (см.) только L-ряда. Однако известны аминотрансферазы некоторых бактерий, которые действуют только на D-аминокислоты и не действуют на их L-изомеры.
Донорами аминогрупп служат не только α-аминокислоты. Так, в тканях животных и у микроорганизмов обнаружены аминотрансферазы, осуществляющие трансаминирование β-аланина, γ-аминомасляной и некоторых других аминокислот с α-кетоглутаровой (реже с пировиноградной) кислотой. Одним из основных путей метаболизма γ-аминомасляной кислоты в мозге является ее трансаминирование с α-кетоглутаратом, в результате чего образуется глутамат и янтарный полуальдегид (аналогичная реакция имеет место у бактерий). δ-Аминогруппа орнитина и аминолевулиновой кислоты также может переноситься аминотрасферазы на кетокислоты. Глутамин и аспарагин реагируют (при участии аминотрасферазы) с различными кетокислотами с образованием соответствующих аминокислот и амидов (см.) кетоглутаровой и щавелево-уксусной кислот.
За немногими исключениями аминотрасферазы имеют широкий рН-оптимум с максимумом в области 8—9. Коферментами аминотрасферазы являются производные витамина В6 — пиридоксальфосфат и пиридоксаминфосфат. Согласно теории А. Е. Браунштейна и М. М. Шемякина, аминокислоты реагируют с пиридоксальфосфатом (соединенным с белковой частью молекулы А.) с образованием промежуточных альдиминов пиридоксальфосфата (оснований Шиффа) и таутомерных им кетпмпнов пиридоксаминфосфата:
Образовавшийся таким образом кетимин затем гидролизуется с освобождением кетокислоты. соответствующей исходной аминокислоте, и пиридоксаминфосфата:
Далее пиридоксаминфосфат взаимодействует с другой кетокислотой, и все стадии реакции повторяются, протекая в обратном направлении. В результате образуется исходная форма протеида пиридоксальфосфата и новая аминокислота. Суммируя, получаем: фермент-пиридоксальфосфат + аминокислота1ферментпиридоксаминфосфат + кетокислота1 фермент-пиридоксаминфосфат + кетокислота2 фермент-пиридоксальфосфат + аминокислота2.
Спектральные исследования аминотрасферазы показали, что пиридоксальфосфат, связанный с белком,существует не в виде свободного альдегида, а в виде основания Шиффа (см. Шиффа основание).
Образование основания Шиффа между пиридоксальфосфатом и апоферментом объясняет тот факт, что пиридоксальфосфат труднее диссоциирует от аминотрасферазы, чем пиридоксаминфосфат.
Аминотрасферазы участвуют в следующих превращениях: образование аминокислот из кетокислот и обратное превращение (окислительный распад аминокислот); биосинтез γ-аминомасляной кислоты, мочевины, пуриновых и пиримидиновых оснований, порфиринов, флавинов, птеридинов, кобаламина.
Обратимое образование аланина, аспартата и глутамата из соответствующих кетокислот является важным звеном, непосредственно связывающим обмен углеводов с обменом аминокислот.
Аминотрасферазы играют основную роль в азотистом обмене (см.). Окислительное дезаминирование аминокислот (за исключением глутамата) в животном организме осуществляется через реакции трансаминирования с учетом ос-кетоглутаровой кислоты в качестве переносчика аминогрупп. Сначала аминокислоты трансаминируются с кетоглутаровой кислотой. Образующаяся при этом глутаминовая кислота дезаминируется под действием глутаматдегидрогеназы с образованием свободного аммиака и освобождением кетоглутаровой кислоты. Обратимость описанных реакций обеспечивает возможность синтеза аминокислот из аммиака и кетокислот путем непрямого аминирования последних. После перехода азота глутаминовой кислоты в аспарагиновую кислоту под действием аминотрасферазы азот аспартата используется в различных процессах биосинтеза, диссимилируется в других ферментативных превращениях до конечных азотистых продуктов (аммиак, мочевина, мочевая кислота). Определение активности аминотрасферазы в крови и других биологических жидкостях имеет определенное диагностическое значение. Так, содержание аминотрасферазы в плазме крови больных резко возрастает при некоторых патологических состояниях, в частности сопровождающихся деструктивными процессами в паренхиматозных органах. Так, например, содержание аминотрасферазы (и в первую очередь аспарат-кетоглутарат-аминотрансферазы) в плазме крови больного увеличивается многократно при инфаркте миокарда, достигая максимума на вторые и третьи сутки. Это позволяет проводить дифференциальный диагноз (в частности, от приступа стенокардии, при котором активность аминотрасферазы в плазме не повышается). Аналогичным образом при вирусном гепатите из пораженных клеток печени в плазму крови поступает большое количество аминотрасферазы, в особенности аланин-кетоглутарат-аминотрансферазы, чего не наблюдается при иных формах желтухи (например, обструкционной). При вирусном гепатите и других поражениях паренхимы печени определение аминотрасферазы в плазме крови имеет не только диагностическое, но и прогностическое значение.
Библиография: Молекулярные основы действия и торможения ферментов, Труды 5-го Международного биохим. конгресса, Симпозиум 4, М., 1962; Guirard В. М. а. Snell Е. Е. Vitamin B6 function in trans-amination and decarboxylation reactions, Cpmprehens. Biochem., v. 15, p. 138, 1964, bibliogr.
Источник
16. Кофакторы ферментов: ионы металлов их роль в ферментативном катализе. Коферменты как производные витаминов. Коферментные функции витаминов в6, рр, в2 на примере трансаминаз и дегидрогеназ.
Большинство ферментов для проявления ферментативной активности нуждается в низкомолекулярных органических соединениях небелковой природы (коферментах) и/или в ионах металлов (кофакторах).
Термин. «кофермент» был введён в начале XX века и обозначал часть некоторых ферментов, которая легко отделялась от белковой молекулы фермента и удалялась через полупроницаемую мембрану при диализе. Несколько позже было выяснено, что большинство ферментов состоит из термолабильной белковой части и термостабильного небелкового фактора — кофермента. Белковая часть получила название «апофермент», который в отсутствие кофермента не обладает каталитической активностью. Кофермент с белковой молекулой (апоферментом) формируют молекулу холофермента, обладающую каталитической активностью.
Более 25% всех ферментов для проявления полной каталитической активности нуждается в ионах металлов. Рассмотрим роль кофакторов в ферментативном катализе.
Роль металлов в ферментативном катализе
Не менее важную роль отводят ионам металлов в осуществлении ферментативного катализа.
Участие в электрофильном катализе
Наиболее часто эту функцию выполняют ионы металлов с переменной валентностью, имеющие свободную d-орбиталь и выступающие в качестве электрофилов. Это, в первую очередь, такие металлы, как Zn 2+ , Fe 2+ , Mn 2+ , Cu 2+ . Ионы щёлочно-земельных металлов, такие как Na + и К+ , не обладают этим свойством. В качестве примера можно рассмотреть функционирование фермента карбоангидразы. Карбоангидраза — цинксодержащий фермент, катализирующий реакцию образования угольной кислоты:
Ион Zn 2+ в результате электрофильной атаки участвует в образовании Н + и ОН — ионов из молекулы воды:
Протон и гидроксйльная группа последовательно присоединяются к диоксиду углерода с образованием угольной кислоты.
В ходе электрофильного катализа ионы металлов часто участвуют в стабилизации промежуточных соединений.
Участие в окислительно-восстановительных реакциях
Ионы металлов с переменной валентностью могут также участвовать в переносе электронов. Например, в цитохромах (гемсодержащих белках) ион железа способен присоединять и отдавать один электрон:
Благодаря этому свойству цитохромы участвуют в окислительно-восстановительных реакциях.
Другой пример участия ионов металлов в окислительно-восстановительных реакциях — работа фермента дофамингидроксилазы, катализирующего реакцию образования норадреналина при участии витамина С
За окислительно-восстановительные свойства у дофамингидроксилазы отвечает ион меди
Фермент, содержащий ион Сu 2+ , не вступает в реакцию с молекулой кислорода. При восстановлении Си 2+ до Си + с помощью аскорбиновой кислоты образуется ион меди, способный взаимодействовать с кислородом с образованием перекисного соединения. Далее гидроксильная группа переносится на молекулу дофамина с образованием норадреналина.
Как уже было сказано, для проявления каталитической активности большинству ферментов необходимо наличие кофермента. Исключение составляют гидролитические ферменты (например, протеазы, липазы, рибонуклеаза), выполняющие свою функцию в отсутствие кофермента.
Кофермент, локализуясь в каталитическом участке активного центра, принимает непосредственное участие в химической реакции, выступая в качестве акцептора и донора химических группировок, атомов, электронов. Кофермент может быть связан с белковой частью молекулы ковалентными и нековалентными связями. В первом случае он называется простетической группой (например, FAD, FMN, биотин, липоевая кислота). Вместе с тем известны примеры, когда кофермент присоединяется к ферменту нековалентными связями настолько прочно, что не диссоциирует от белковой молекулы, например тиаминдифосфат.
Во втором случае кофермент взаимодействует с ферментом только на время химической реакции и может рассматриваться в качестве второго субстрата. Примеры — NAD + , NADP + .
Апофермент обеспечивает специфичность действия и отвечает за выбор типа химического превращения субстрата. Один и тот же кофермент, взаимодействуя с различными апоферментами, может участвовать в разных химических превращениях субстрата. Например, пиридоксальфосфат в зависимости от того, с каким апоферментом взаимодействует, участвует в реакциях трансаминирования или декарбоксилирования аминокислот.
Химическая природа коферментов, их функции в ферментативных реакциях чрезвычайно разнообразны. Традиционно к коферментам относят производные витаминов, хотя помимо них есть значительный класс небелковых соединений, принимающих участие в проявлении каталитической функции ферментов.
К коферментам относят следующие соединения:
-гемы, входящие в состав цитохромов, каталазы, пероксидазы, гуанилатциклазы, NO-синтазы и являющиеся простетической группой ферментов;
-нуклеотиды — доноры и акцепторы остатка фосфорной кислоты;
-убихинон, или кофермент Q, участвующий в переносе электронов и протонов в ЦПЭ;
-фосфоаденозилфосфосульфат, участвующий в переносе сульфата;
-S-аденозилметионин (SAM) — донор метильной группы;
-глутатион, участвующий в окислительно-восстановительных реакциях.
Строение и функции этих коферментов подробно рассмотрены в соответствующих разделах учебника.
Водораствор витамины являются энзимовитаминами, то есть выполняют коферментные функции в составе ферментов. Проявления и механизмы гиповитаминозов по различным энзимовитаминам взаимосвязаны и перекрываются, хотя для большинства из них описаны и специфические авитаминозы. Витамин В2, рибофлавин. входит в состав двух коферментов ФМН и ФАД, являющихся компонентами таких ферментов как сукцинатдегидрогеназа, дегидрогеназы жирных кислот, оксидаз аминокислот, МАО, цитохромредуктазы.Витамин В5, РР входит в состав коферментов НАД и НАДФ,которые являются коферментами более ста дегидрогеназ, участвующих в тканевом дыхании, окислении молочной, яблочной, кетоглутаровой, изолимонной кислот, фосфоглицеринового альдегида, жирных кислот и т.п.Витамин В6, пиридоксин Этот витамин в виде коферментов ПАЛФ (пиридоксальфосфата) и ПАМФ(пиридоксаминфосфата) входит в состав ферментов переаминирования, дезаминирования и декарбоксилирования аминокислот. В реакциях с участием пиридоксина, осуществляется всасывание и транспорт аминокислот, балансируется аминокислотный состав организма.Витамин Н, биотин служит коферментом карбоксилаз, таких как пируваткарбоксилаза, ацетил-КоА-карбоксилаза, пропионил-КоА-карбоксилаза. Биотин связывает молекулу углекислого газа и включает его в органическое вещество. Как кофермент витамин Н участвует т в синтезе жирных кислот, стеринов, пуриновых оснований, мочевины, превращении пиовиноградной кислоты в щавелевоуксусную кислоту.Витамин В3, пантотеновая кислота входит в состав кофермента ацетилирования (КоА), который активирует ацетат и ацильные группы, необходимые для синтеза жирных кислот, стеролов, ацетилхолина. Пантотеновая кислота участвует в биосинтезе жирных кислот
Источник
Кофермент — витамин, необходимый для функционирования фермента

 | Коферменты (коэнзимы) — органические соединения небелковой природы, необходимые для осуществления каталитического действия многих ферментов. Многие коферменты легко отделяются от ферментного белка и служат переносчиками электронов, отдельных атомов или групп атомов субстрата, превращение которого катализирует данный фермент, т.е. функционируют в качестве промежуточных акцепторов. Наиболее распространенную группу составляют соединения нуклеотидной природы, а также коферменты, содержащие остатки фосфорной кислоты. Адениловые нуклеотиды — аденозин-5-трифосфат (АТФ), аденозин-5-дифосфат (АДФ), Р1,Р5 –ди(аденозин -5-) пентафосфат (АП5А) и аденозин-5-монофосфорной кислоты (АМФ) наряду с их ключевой ролью в обмене энергии участвуют в реакциях переноса и активации орто- и пирофосфатных остатков, аминоацильных групп, остатков неорганических кислот.
N-Ацетил-L-Цистеин — это модифицированная форма цистеина, которая была присоединена к ацетил группе. Было доказано, что N-Ацетил-L-Цистеин способен увеличивать уровень антиоксиданта глутатиона. Свойства N-Ацетил-L-Цистеин главным образом связаны с его тиоловой группой, которая делает его эффективным в большинстве биохимических путей, где задействован трипептидглутатион. Цистеин находится среди трех аминокислот, содержащих трипептидглутатион, так что N-Ацетил-L-Цистеин считается предшественником трипептидглутатиона с его деацетилированным цистеином. Ацетил-L-Цистеин использовался и по-прежнему широко используется в качестве муколитического агента, когда способ действия в целом относится к окислительно-восстановительному разрушению чувствительных дисульфидных мостиков цистеина в белках слизи. Источник ➤ Adblockdetector |