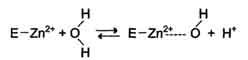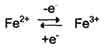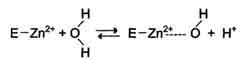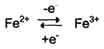Лекция 1.4 Кофакторы ферментов и их роль в катализе Коферменты, простетические группы, ионы металлов
В настоящее время получены неопровержимые экспериментальные доказательства белковой природы ферментов. Единственным исключением из этого положения является обнаружение у молекулы ряда предшественников РНК ферментативной активности, получившей название рибозима и катализирующей самосплайсинг, то есть отщепление интронных нетранслируемых последовательностей от предшественника РНК.
Ферменты, как и все белки, обладают рядом свойств, характерных для высокомолекулярных соединений: амфотерностью, электрофоретической подвижностью и неспособностью к диализу через полупроницаемые мембраны. Подобно белкам, ферменты имеют большую молекулярную массу: от десятков тысяч до нескольких миллионов Да. Им присущи все особенности структурной организации белковых молекул (первичный, вторичный, третичный и четвертичный уровни организации).
В природе существуют как простые, так и сложные ферменты. Большинство природных ферментов относится к классу сложных белков, содержащих помимо полипептидных цепей какой-либо небелковый компонент (кофактор), присутствие которого является абсолютно необходимым для каталитической активности. Кофакторы могут иметь различную химическую природу и различаться по прочности связи с полипептидной цепью (рис. 1.4.1).
Р
Если константа диссоциации сложного фермента настолько мала, что в растворе все полипептидные цепи оказываются связанными со своими кофакторами и не разделяются при выделении и очистке, то такой фермент получает название холофермента (холоэнзима), а кофактор – название простетической группы, рассматривающейся как интегральная часть молекулы фермента (например, FAD, FMN, биотин, липоевая кислота). Полипептидную часть фермента принято называть апоферментом. Если же дополнительная группа легко отделяется от апофермента при диализе, в этом случае она называется коферментом (например, NAD + , NADP + ). Кроме этого, роль кофактора могут выполнять металлы: Mg 2+ , Мn 2+ , Са 2+ и др.
Химическая природа кофакторов, их функции в ферментативных реакциях очень разнообразны. Согласно одной из классификаций все коферменты и простетические группы делят на 2 группы:
1. производные витаминов (табл. 1.4.1);
2. невитаминные кофакторы.
Важнейшие коферменты и простетические группы ферментов
Источник
16. Кофакторы ферментов: ионы металлов их роль в ферментативном катализе. Коферменты как производные витаминов. Коферментные функции витаминов в6, рр, в2 на примере трансаминаз и дегидрогеназ.
Большинство ферментов для проявления ферментативной активности нуждается в низкомолекулярных органических соединениях небелковой природы (коферментах) и/или в ионах металлов (кофакторах).
Термин. «кофермент» был введён в начале XX века и обозначал часть некоторых ферментов, которая легко отделялась от белковой молекулы фермента и удалялась через полупроницаемую мембрану при диализе. Несколько позже было выяснено, что большинство ферментов состоит из термолабильной белковой части и термостабильного небелкового фактора — кофермента. Белковая часть получила название «апофермент», который в отсутствие кофермента не обладает каталитической активностью. Кофермент с белковой молекулой (апоферментом) формируют молекулу холофермента, обладающую каталитической активностью.
Более 25% всех ферментов для проявления полной каталитической активности нуждается в ионах металлов. Рассмотрим роль кофакторов в ферментативном катализе.
Роль металлов в ферментативном катализе
Не менее важную роль отводят ионам металлов в осуществлении ферментативного катализа.
Участие в электрофильном катализе
Наиболее часто эту функцию выполняют ионы металлов с переменной валентностью, имеющие свободную d-орбиталь и выступающие в качестве электрофилов. Это, в первую очередь, такие металлы, как Zn 2+ , Fe 2+ , Mn 2+ , Cu 2+ . Ионы щёлочно-земельных металлов, такие как Na + и К+ , не обладают этим свойством. В качестве примера можно рассмотреть функционирование фермента карбоангидразы. Карбоангидраза — цинксодержащий фермент, катализирующий реакцию образования угольной кислоты:
Ион Zn 2+ в результате электрофильной атаки участвует в образовании Н + и ОН — ионов из молекулы воды:
Протон и гидроксйльная группа последовательно присоединяются к диоксиду углерода с образованием угольной кислоты.
В ходе электрофильного катализа ионы металлов часто участвуют в стабилизации промежуточных соединений.
Участие в окислительно-восстановительных реакциях
Ионы металлов с переменной валентностью могут также участвовать в переносе электронов. Например, в цитохромах (гемсодержащих белках) ион железа способен присоединять и отдавать один электрон:
Благодаря этому свойству цитохромы участвуют в окислительно-восстановительных реакциях.
Другой пример участия ионов металлов в окислительно-восстановительных реакциях — работа фермента дофамингидроксилазы, катализирующего реакцию образования норадреналина при участии витамина С
За окислительно-восстановительные свойства у дофамингидроксилазы отвечает ион меди
Фермент, содержащий ион Сu 2+ , не вступает в реакцию с молекулой кислорода. При восстановлении Си 2+ до Си + с помощью аскорбиновой кислоты образуется ион меди, способный взаимодействовать с кислородом с образованием перекисного соединения. Далее гидроксильная группа переносится на молекулу дофамина с образованием норадреналина.
Как уже было сказано, для проявления каталитической активности большинству ферментов необходимо наличие кофермента. Исключение составляют гидролитические ферменты (например, протеазы, липазы, рибонуклеаза), выполняющие свою функцию в отсутствие кофермента.
Кофермент, локализуясь в каталитическом участке активного центра, принимает непосредственное участие в химической реакции, выступая в качестве акцептора и донора химических группировок, атомов, электронов. Кофермент может быть связан с белковой частью молекулы ковалентными и нековалентными связями. В первом случае он называется простетической группой (например, FAD, FMN, биотин, липоевая кислота). Вместе с тем известны примеры, когда кофермент присоединяется к ферменту нековалентными связями настолько прочно, что не диссоциирует от белковой молекулы, например тиаминдифосфат.
Во втором случае кофермент взаимодействует с ферментом только на время химической реакции и может рассматриваться в качестве второго субстрата. Примеры — NAD + , NADP + .
Апофермент обеспечивает специфичность действия и отвечает за выбор типа химического превращения субстрата. Один и тот же кофермент, взаимодействуя с различными апоферментами, может участвовать в разных химических превращениях субстрата. Например, пиридоксальфосфат в зависимости от того, с каким апоферментом взаимодействует, участвует в реакциях трансаминирования или декарбоксилирования аминокислот.
Химическая природа коферментов, их функции в ферментативных реакциях чрезвычайно разнообразны. Традиционно к коферментам относят производные витаминов, хотя помимо них есть значительный класс небелковых соединений, принимающих участие в проявлении каталитической функции ферментов.
К коферментам относят следующие соединения:
-гемы, входящие в состав цитохромов, каталазы, пероксидазы, гуанилатциклазы, NO-синтазы и являющиеся простетической группой ферментов;
-нуклеотиды — доноры и акцепторы остатка фосфорной кислоты;
-убихинон, или кофермент Q, участвующий в переносе электронов и протонов в ЦПЭ;
-фосфоаденозилфосфосульфат, участвующий в переносе сульфата;
-S-аденозилметионин (SAM) — донор метильной группы;
-глутатион, участвующий в окислительно-восстановительных реакциях.
Строение и функции этих коферментов подробно рассмотрены в соответствующих разделах учебника.
Водораствор витамины являются энзимовитаминами, то есть выполняют коферментные функции в составе ферментов. Проявления и механизмы гиповитаминозов по различным энзимовитаминам взаимосвязаны и перекрываются, хотя для большинства из них описаны и специфические авитаминозы. Витамин В2, рибофлавин. входит в состав двух коферментов ФМН и ФАД, являющихся компонентами таких ферментов как сукцинатдегидрогеназа, дегидрогеназы жирных кислот, оксидаз аминокислот, МАО, цитохромредуктазы.Витамин В5, РР входит в состав коферментов НАД и НАДФ,которые являются коферментами более ста дегидрогеназ, участвующих в тканевом дыхании, окислении молочной, яблочной, кетоглутаровой, изолимонной кислот, фосфоглицеринового альдегида, жирных кислот и т.п.Витамин В6, пиридоксин Этот витамин в виде коферментов ПАЛФ (пиридоксальфосфата) и ПАМФ(пиридоксаминфосфата) входит в состав ферментов переаминирования, дезаминирования и декарбоксилирования аминокислот. В реакциях с участием пиридоксина, осуществляется всасывание и транспорт аминокислот, балансируется аминокислотный состав организма.Витамин Н, биотин служит коферментом карбоксилаз, таких как пируваткарбоксилаза, ацетил-КоА-карбоксилаза, пропионил-КоА-карбоксилаза. Биотин связывает молекулу углекислого газа и включает его в органическое вещество. Как кофермент витамин Н участвует т в синтезе жирных кислот, стеринов, пуриновых оснований, мочевины, превращении пиовиноградной кислоты в щавелевоуксусную кислоту.Витамин В3, пантотеновая кислота входит в состав кофермента ацетилирования (КоА), который активирует ацетат и ацильные группы, необходимые для синтеза жирных кислот, стеролов, ацетилхолина. Пантотеновая кислота участвует в биосинтезе жирных кислот
Источник
16. Кофакторы ферментов: ионы металлов их роль в ферментативном катализе. Коферменты как производные витаминов. Коферментные функции витаминов в6, рр, в2 на примере трансаминаз и дегидрогеназ.
Большинство ферментов для проявления ферментативной активности нуждается в низкомолекулярных органических соединениях небелковой природы (коферментах) и/или в ионах металлов (кофакторах).
Термин. «кофермент» был введён в начале XX века и обозначал часть некоторых ферментов, которая легко отделялась от белковой молекулы фермента и удалялась через полупроницаемую мембрану при диализе. Несколько позже было выяснено, что большинство ферментов состоит из термолабильной белковой части и термостабильного небелкового фактора — кофермента. Белковая часть получила название «апофермент», который в отсутствие кофермента не обладает каталитической активностью. Кофермент с белковой молекулой (апоферментом) формируют молекулу холофермента, обладающую каталитической активностью.
Более 25% всех ферментов для проявления полной каталитической активности нуждается в ионах металлов. Рассмотрим роль кофакторов в ферментативном катализе.
Роль металлов в ферментативном катализе
Не менее важную роль отводят ионам металлов в осуществлении ферментативного катализа.
Участие в электрофильном катализе
Наиболее часто эту функцию выполняют ионы металлов с переменной валентностью, имеющие свободную d-орбиталь и выступающие в качестве электрофилов. Это, в первую очередь, такие металлы, как Zn 2+ , Fe 2+ , Mn 2+ , Cu 2+ . Ионы щёлочно-земельных металлов, такие как Na + и К+ , не обладают этим свойством. В качестве примера можно рассмотреть функционирование фермента карбоангидразы. Карбоангидраза — цинксодержащий фермент, катализирующий реакцию образования угольной кислоты:
Ион Zn 2+ в результате электрофильной атаки участвует в образовании Н + и ОН — ионов из молекулы воды:
Протон и гидроксйльная группа последовательно присоединяются к диоксиду углерода с образованием угольной кислоты.
В ходе электрофильного катализа ионы металлов часто участвуют в стабилизации промежуточных соединений.
Участие в окислительно-восстановительных реакциях
Ионы металлов с переменной валентностью могут также участвовать в переносе электронов. Например, в цитохромах (гемсодержащих белках) ион железа способен присоединять и отдавать один электрон:
Благодаря этому свойству цитохромы участвуют в окислительно-восстановительных реакциях.
Другой пример участия ионов металлов в окислительно-восстановительных реакциях — работа фермента дофамингидроксилазы, катализирующего реакцию образования норадреналина при участии витамина С
За окислительно-восстановительные свойства у дофамингидроксилазы отвечает ион меди
Фермент, содержащий ион Сu 2+ , не вступает в реакцию с молекулой кислорода. При восстановлении Си 2+ до Си + с помощью аскорбиновой кислоты образуется ион меди, способный взаимодействовать с кислородом с образованием перекисного соединения. Далее гидроксильная группа переносится на молекулу дофамина с образованием норадреналина.
Как уже было сказано, для проявления каталитической активности большинству ферментов необходимо наличие кофермента. Исключение составляют гидролитические ферменты (например, протеазы, липазы, рибонуклеаза), выполняющие свою функцию в отсутствие кофермента.
Кофермент, локализуясь в каталитическом участке активного центра, принимает непосредственное участие в химической реакции, выступая в качестве акцептора и донора химических группировок, атомов, электронов. Кофермент может быть связан с белковой частью молекулы ковалентными и нековалентными связями. В первом случае он называется простетической группой (например, FAD, FMN, биотин, липоевая кислота). Вместе с тем известны примеры, когда кофермент присоединяется к ферменту нековалентными связями настолько прочно, что не диссоциирует от белковой молекулы, например тиаминдифосфат.
Во втором случае кофермент взаимодействует с ферментом только на время химической реакции и может рассматриваться в качестве второго субстрата. Примеры — NAD + , NADP + .
Апофермент обеспечивает специфичность действия и отвечает за выбор типа химического превращения субстрата. Один и тот же кофермент, взаимодействуя с различными апоферментами, может участвовать в разных химических превращениях субстрата. Например, пиридоксальфосфат в зависимости от того, с каким апоферментом взаимодействует, участвует в реакциях трансаминирования или декарбоксилирования аминокислот.
Химическая природа коферментов, их функции в ферментативных реакциях чрезвычайно разнообразны. Традиционно к коферментам относят производные витаминов, хотя помимо них есть значительный класс небелковых соединений, принимающих участие в проявлении каталитической функции ферментов.
К коферментам относят следующие соединения:
-гемы, входящие в состав цитохромов, каталазы, пероксидазы, гуанилатциклазы, NO-синтазы и являющиеся простетической группой ферментов;
-нуклеотиды — доноры и акцепторы остатка фосфорной кислоты;
-убихинон, или кофермент Q, участвующий в переносе электронов и протонов в ЦПЭ;
-фосфоаденозилфосфосульфат, участвующий в переносе сульфата;
-S-аденозилметионин (SAM) — донор метильной группы;
-глутатион, участвующий в окислительно-восстановительных реакциях.
Строение и функции этих коферментов подробно рассмотрены в соответствующих разделах учебника.
Водораствор витамины являются энзимовитаминами, то есть выполняют коферментные функции в составе ферментов. Проявления и механизмы гиповитаминозов по различным энзимовитаминам взаимосвязаны и перекрываются, хотя для большинства из них описаны и специфические авитаминозы. Витамин В2, рибофлавин. входит в состав двух коферментов ФМН и ФАД, являющихся компонентами таких ферментов как сукцинатдегидрогеназа, дегидрогеназы жирных кислот, оксидаз аминокислот, МАО, цитохромредуктазы.Витамин В5, РР входит в состав коферментов НАД и НАДФ,которые являются коферментами более ста дегидрогеназ, участвующих в тканевом дыхании, окислении молочной, яблочной, кетоглутаровой, изолимонной кислот, фосфоглицеринового альдегида, жирных кислот и т.п.Витамин В6, пиридоксин Этот витамин в виде коферментов ПАЛФ (пиридоксальфосфата) и ПАМФ(пиридоксаминфосфата) входит в состав ферментов переаминирования, дезаминирования и декарбоксилирования аминокислот. В реакциях с участием пиридоксина, осуществляется всасывание и транспорт аминокислот, балансируется аминокислотный состав организма.Витамин Н, биотин служит коферментом карбоксилаз, таких как пируваткарбоксилаза, ацетил-КоА-карбоксилаза, пропионил-КоА-карбоксилаза. Биотин связывает молекулу углекислого газа и включает его в органическое вещество. Как кофермент витамин Н участвует т в синтезе жирных кислот, стеринов, пуриновых оснований, мочевины, превращении пиовиноградной кислоты в щавелевоуксусную кислоту.Витамин В3, пантотеновая кислота входит в состав кофермента ацетилирования (КоА), который активирует ацетат и ацильные группы, необходимые для синтеза жирных кислот, стеролов, ацетилхолина. Пантотеновая кислота участвует в биосинтезе жирных кислот
Источник