Карбоновые кислоты
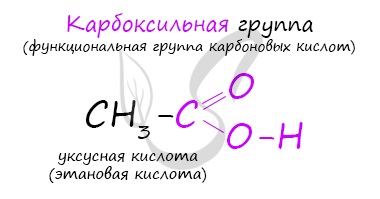
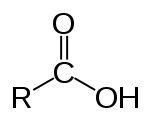
Карбоновые кислоты — класс органических соединений, молекулы которых содержат одну или несколько карбоксильных групп COOH.
Имеют разнообразное промышленное применение и большое биологическое значение. Общая формула одноосновных карбоновых кислот CnH2nO2 .
Классификация карбоновых кислот
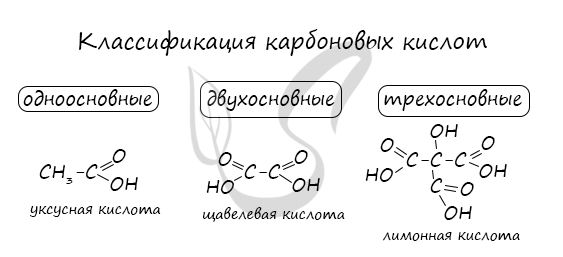
По количеству карбоксильных групп в молекуле карбоновые кислоты подразделяются на:
- Одноосновные — 1 карбоксильная группа
- Двухосновные — 2 карбоксильных группы
- Трехосновные — 3 карбоксильных группы
Высшие карбоновые кислоты называют жирными кислотами. Более подробно мы изучим их теме, посвященной жирам, в состав которых они входят.
Номенклатура и изомерия карбоновых кислот
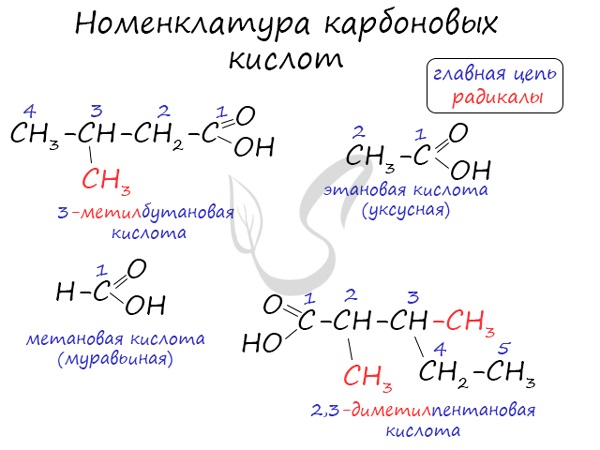
Названия карбоновых кислот формируются путем добавления суффикса «овая» к названию алкана с соответствующим числом атомов углерода и слова кислота: метановая кислота, этановая кислота, пропановая кислота, и т.д.
Многие карбоновые кислоты имеют тривиальные названия. Наиболее известные:
- Метановая — HCOOH — муравьиная кислота
- Этановая — CH3-COOH — уксусная кислота
- Пропановая — C2H5-COOH — пропионовая кислота
- Бутановая — C3H7-COOH — масляная кислота
- Пентановая — C4H9-COOH — валериановая кислота
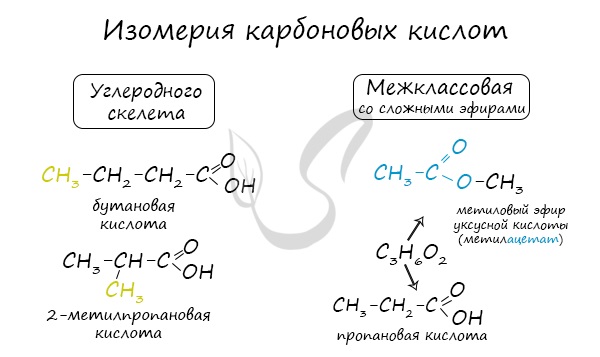
Для предельных карбоновых кислот характерна структурная изомерия: углеродного скелета, межклассовая изомерия со сложными эфирами.
Получение карбоновых кислот
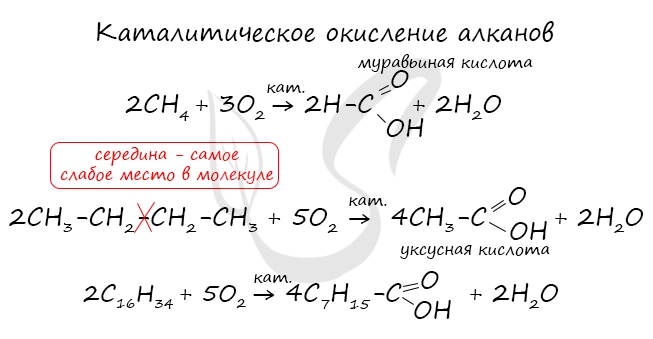
При повышенной температуре и в присутствии катализатора становится возможным неполное окисление алканов, в результате которого образуются кислоты.
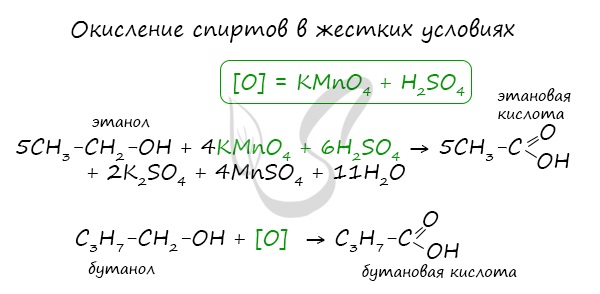
При реакции спиртов с сильными окислителями, такими как подкисленный раствор перманганата калия, спирты окисляются до соответствующих кислот.
При окислении альдегиды образуют соответствующие карбоновые кислоты. Окисление можно проводить качественной реакцией на альдегиды — реакцией серебряного зеркала.
Обратите особое внимание, что при написании реакции с аммиачным раствором серебра в полном виде, правильнее будет указать не кислоту, а ее аммиачную соль. Это связано с тем, что выделяющийся аммиак, который обладает основными свойствами, реагирует с кислотой с образованием соли.
Окисление альдегидов также может быть успешно осуществлено другим реагентом — свежеосажденным гидроксидом меди II. В результате такой реакции образуется осадок кирпично-красного цвета оксида меди I.
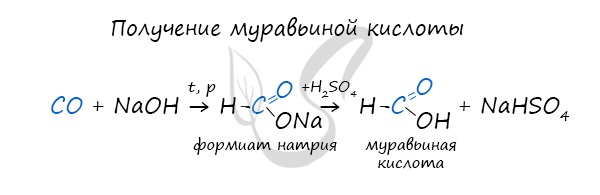
Существует специфический способ получения муравьиной кислоты, который заключается в реакции твердого гидроксида щелочного металла с угарным газом под давлением и температуре 200°С — образуется формиат (соль муравьиной кислоты).
При дальнейшей обработке формиата серной кислотой образуется муравьиная кислота.
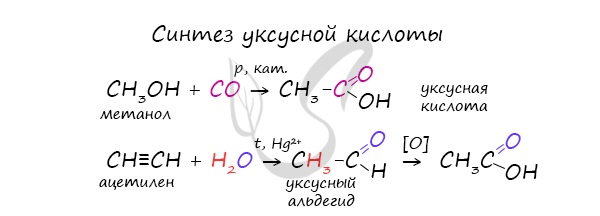
Специфичность синтеза уксусной кислоты заключается в реакции угарного газа с метанолом, в результате которой она образуется.
Также уксусную кислоту можно получить другим путем: сначала провести реакцию Кучерова, в ходе которой образуется уксусный альдегид. Окислить его до уксусной кислоты можно аммиачным раствором оксида серебра или гидроксидом меди II.
Химические свойства карбоновых кислот
Для карбоновых кислот не характерны реакции присоединения. Карбоновые кислоты обладают более выраженными кислотными свойствами, чем спирты.
Карбоновые кислоты вступают в реакции с металлами, которые способны вытеснить водород (стоят левее водорода в ряду напряжений металлов) из кислоты. Реагируют также с основаниями, с солями более слабых кислот, например, угольной кислоты.
Галогенирование происходит по типу замещения в радикале, который соединен с карбоксильной группой. Напомню, что наиболее легко замещается водород у третичного, чуть сложнее — у вторичного, и значительно сложнее — у первичного атома углерода.
Сила карбоновых кислот тем выше, чем меньше электронной плотности сосредоточено на атоме углерода в карбоксильной группе. Поэтому самая слабая из трех кислот — уксусная, чуть сильнее — хлоруксусная, за ней — дихлоруксусная и самая сильная — трихлоруксусная.
Перераспределение электронной плотности в молекулах этих кислот для лучшего запоминания лучше увидеть наглядно. Это перераспределение обусловлено большей электроотрицательностью хлора, который притягивает электронную плотность.
Муравьиная кислота отличается от своих гомологов. За счет наличия у нее альдегидной группы, она, единственная из карбоновых кислот, способна вступать в реакцию серебряного зеркала.
В такой реакции идет ее окисление до нестойкой угольной кислоты, которая распадается на углекислый газ и воду.
При нагревании и в присутствии серной кислоты (водоотнимающего компонента) муравьиная кислота распадается на воду и угарный газ.
Сложные эфиры
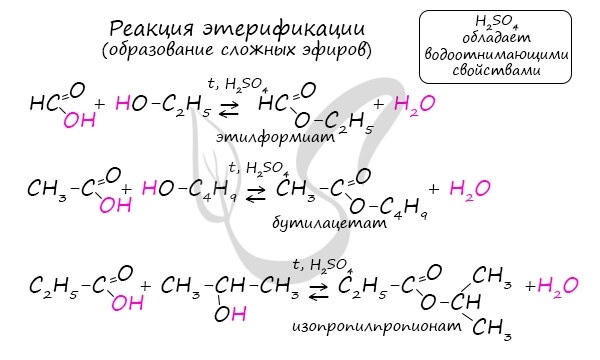
Получение сложных эфиров происходит в реакции этерификации (лат. aether — эфир), заключающейся во взаимодействии карбоновой кислоты и спирта.
Названия сложных эфиров формируются в зависимости от того, какой кислотой и каким спиртом эфир образован. Примеры:
- Метановая кислота + метанол = метиловый эфир метановой кислоты (метилформиат)
- Этановая кислота + этанол = этиловый эфир уксусной кислоты (этилацетат)
- Метановая кислота + этанол = этиловый эфир метановой кислоты (этилформиат)
- Пропановая кислота + бутанол = бутиловый эфир пропионовой кислоты (бутилпропионат)
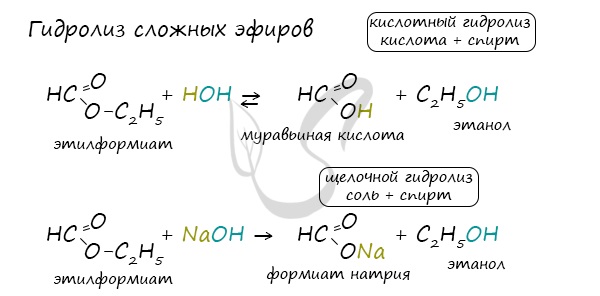
Для сложных эфиров характерной реакцией является гидролиз — их разложение. Возможен щелочной гидролиз, при котором образуется соль кислоты и спирт, и кислотный гидролиз, при котором образуются исходные спирт и кислота.
Кислотный гидролиз протекает обратимо, щелочной — необратимо. Реакция щелочного гидролиза по-другому называется реакция омыления, и напомнит о себе, когда мы дойдем до темы жиров.
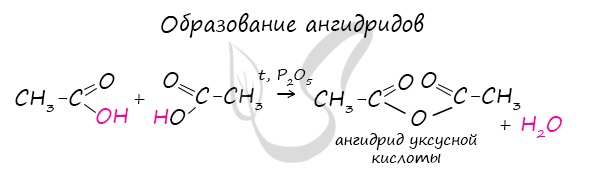
Ангидриды
Ангидриды — химические соединения, производные неорганических и органических кислот, образующиеся при их дегидратации.
Хлорангидриды карбоновых кислот образуются в реакции карбоновых кислот с хлоридом фосфора V.
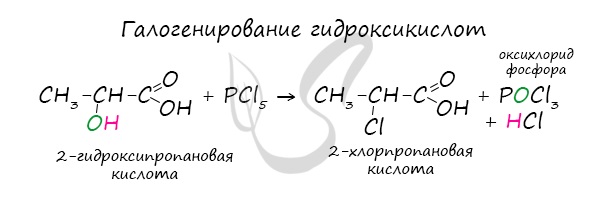
Следующая реакция не имеет отношения к ангидридам, однако (из-за их схожести) вы увидите ее здесь для наилучшего запоминания. Это реакция галогенирования гидроксикислот, в результате которой гидроксогруппа в радикале меняется на атом галогена.
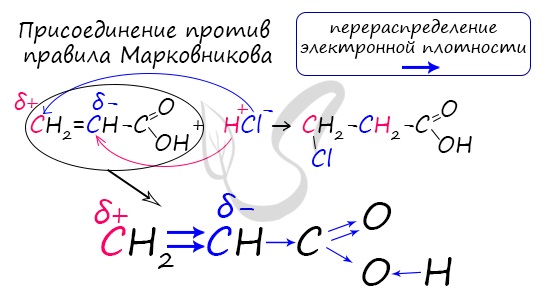
Непредельные карбоновые кислоты
Распределение электронной плотности в молекулах творит чудеса: иногда реакции идут против правила Марковникова. Так происходит в непредельной акриловой кислоте.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Источник
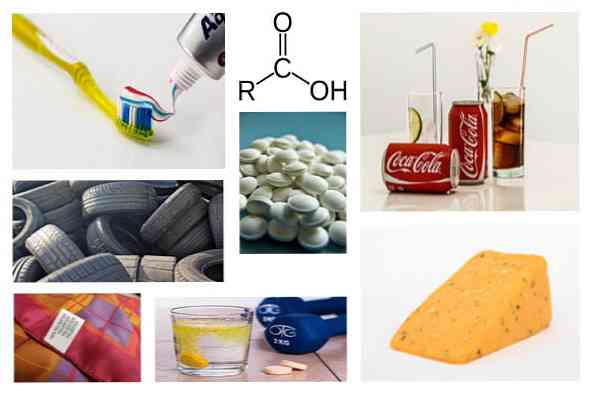
30 видов использования карбоновых кислот в повседневной жизни
использование карбоновых кислот они настолько обширны, что их можно разделить на несколько отраслей, таких как фармацевтическая (активная для производства лекарств на основе витамина С) или пищевая (производство безалкогольных напитков, приготовление добавок) и другие.
Карбоновые кислоты, по существу, представляют собой органические кислоты, имеющие карбоксильную группу среди своих компонентов, присоединенную к алкильной или арильной группе..
Они представлены в химической формуле следующим образом: COOH, и его название связано с конъюгацией или комбинацией карбонила (C = O) и гидроксила.
Если углеродная цепь имеет одну карбоксильную группу, кислоты называются монокарбоновыми кислотами или жирными кислотами, а если у вас две карбоксильные группы, кислоты называются дикарбоновыми кислотами..
Они также называются органическими кислотами и, как правило, являются «слабыми» кислотами, при этом только 1% молекул RCOOH диссоциирует на ионы (при обнаружении при комнатной температуре и в водном растворе)..
Они являются более слабыми кислотами, чем минеральные кислоты, такие как соляная кислота или серная кислота. Однако его кислотность выше, чем у спиртов.
Это полярные вещества, которые образуют водородные мостики между собой или с молекулами другого вещества.
Каковы основные области применения карбоновых кислот?
Карбоновые кислоты встречаются в природе в жирах, кисломолочных продуктах и цитрусовых, и среди их наиболее важных применений:
Пищевая промышленность
2- Консерванты (сорбиновая и бензойная кислоты).
3- Регулятор щелочности многих продуктов.
4- Производство безалкогольных напитков.
5- Антимикробные агенты против действия антиоксидантов. В этом случае наблюдается тенденция к жидким противомикробным препаратам, которые позволяют биодоступность.
6- Основной ингредиент общего уксуса (уксусная кислота).
7- Подкислитель в газированных напитках и продуктах питания (лимонная кислота и молочная кислота).
8- Помощник в созревании швейцарского сыра (пропионовая кислота).
9- Разработка сыра, квашеной капусты, квашеной капусты и безалкогольных напитков (молочная кислота).
Фармацевтическая промышленность
10- Жаропонижающее и обезболивающее (ацетилсалициловая кислота).
11- Активен в процессе синтеза ароматов, в некоторых препаратах (масляная или бутановая кислота).
12- Антимикотик (бензойная кислота в сочетании с салициловой кислотой).
13- Активен для изготовления лекарств на основе витамина С (аскорбиновой кислоты).
14- Фунгицид (каприловая кислота).
15- Производство некоторых слабительных (гидроксибутандиоевая кислота).
Другие отрасли
16- Производство пластмасс и смазочных материалов (сорбиновая кислота).
17- Производство лаков, эластичных смол и прозрачных клеев (акриловая кислота).
18- Производство красок и лаков (линолевая кислота).
19- Производство мыла, моющих средств, шампуней, косметики и средств для чистки металлов (олеиновая кислота).
20- Производство зубной пасты (салициловая кислота).
21- Производство вискозного ацетата, фотопленок и растворителей для красок (уксусная кислота).
22- Производство красителей и дубильных веществ (метановая кислота).
23- Производство смазочных масел, водостойких материалов и краски для сушки (пальмитиновая кислота).
24- Производство резины (уксусная кислота).
25- Обработка резины и гальваника.
27- Производство парфюмерии (бензойная кислота).
28- Производство пластификаторов и смол (фталевая кислота).
29- Разработка полиэфира (терефталевой кислоты).
30- Приготовление парафиновых свечей (стеариновая кислота).
В сельском хозяйстве они также склонны использовать его для улучшения качества посевов плодовых растений, увеличения количества и веса плодов на некоторых растениях, а также их внешнего вида и продолжительности после сбора урожая..
Карбоновые кислоты очень присутствуют в достижениях экспериментальной химии и биохимии, особенно в тех, которые связаны с ферментацией, необходимой для производства нескольких продуктов, представляющих коммерческий интерес (среди прочего, антибиотики, органические растворители и витамины).
Свойства карбоновых кислот
Некоторые свойства этих химических веществ:
растворимость
Первые четыре алифатических монокарбоновых кислоты являются жидкими и растворимыми в воде.
Это свойство уменьшается, если число атомов углерода увеличивается, поэтому начиная с додекановой кислоты они начинают растворяться в воде.
Точка кипения
Температура кипения этих веществ повышается благодаря наличию двойного водородного мостика между их компонентами..
Точка плавления
Это свойство меняется в зависимости от количества атомов углерода, так как они влияют на связь между молекулами..
Из 6 атомов углерода начинается нерегулярная высота в точке плавления.
Источник
Карбоновые кислоты
Карбо́новые кисло́ты — класс органических соединений, молекулы которых содержат одну или несколько функциональных карбоксильных групп -COOH. Кислые свойства объясняются тем, что данная группа может сравнительно легко отщеплять протон. За редкими исключениями карбоновые кислоты являются слабыми. Например, у уксусной кислоты CH3COOH константа кислотности равна 1,75·10 −5 . Ди- и трикарбоновые кислоты более сильные, чем монокарбоновые.
Содержание
Номенклатура
По международной номенклатуре ИЮПАК, карбоновые кислот называют, выбирая за основу наиболее длинную углеродную цепочку, содержащую группу -СООН, и добавляя к названию соответствующего углеводорода окончание «овая» и слово «кислота«. При этом атому углерода, входящему в состав карбоксильной группы, присваивается первый номер. Например СН3-СН2-СООН — пропановая кислота, СН3-С(СН3)2-СООН — 2,2-диметилпропановая кислота.
По рациональной номенклатуре к названию углеводорода добавляют окончание «карбоновая» и слово «кислота«, не включая при этом в нумерацию цепи атом углерода карбоксильной группы. Например, С5Н9СООН — циклопентанкарбоновая кислота, СН3-С(СН3)2-СООН — трет-бутилкарбоновая кислота.
Многие из карбоновых кислот имеют тривиальные названия (некоторые из них приведены в таблице).
| Формула | Название по ИЮПАК | Тривиальное название |
|---|---|---|
| НСООН | метановая кислота | муравьиная кислота |
| СН3-СООН | этановая кислота | уксусная кислота |
| СН3-СН2-СООН | пропановая кислота | пропионовая кислота |
| СН3-(СН2)2-СООН | бутановая кислота | масляная кислота |
| СН3-(СН2)3-СООН | пентановая кислота | валериановая кислота |
| СН3-(СН2)4-СООН | гексановая кислота | капроновая кислота |
| СН3-(СН2)5-СООН | гептановая кислота | энантовая кислота |
| СН3-(СН2)6-СООН | октановая кислота | каприловая кислота |
| СН3-(СН2)7-СООН | нонановая кислота | пеларгоновая кислота |
| СН3-(СН2)8-СООН | декановая кислота | каприновая кислота |
| СН3-(СН2)9-СООН | ундекановая кислота | ундециловая кислота |
| СН3-(СН2)10-СООН | додекановая кислота | лауриновая кислота |
| СН3-(СН2)11-СООН | тридекановая кислота | тридециловая кислота |
| СН3-(СН2)12-СООН | тетрадекановая кислота | миристиновая кислота |
| СН3-(СН2)13-СООН | пентадекановая кислота | пентадециловая кислота |
| СН3-(СН2)14-СООН | гексадекановая кислота | пальмитиновая кислота |
| СН3-(СН2)15-СООН | гептадекановая кислота | маргариновая кислота |
| СН3-(СН2)16-СООН | октадекановая кислота | стеариновая кислота |
| СН3-(СН2)17-СООН | нонадекановая кислота | стеариновая кислота |
| С6Н5-СООН | бензолкарбоновая кислота | бензойная кислота |
| СН2=СН-СООН | пропеновая кислота | акриловая кислота |
| СН≡С-СООН | пропиновая кислота | пропиоловая кислота |
| СН3-С(СН3)2-СООН | 2,2-диметилпропановая | пивалиновая кислота |
Классификация
В зависимости от радикала, связанного с карбоксилом, различают следующие группы карбоновых кислот:
ароматические алифатические (в том числе предельные и непредельные) алициклические гетероциклические.
По числу карбоксильных групп кислоты могут быть одно-, двух- и многоосновными. При введении в молекулы кислоты других функциональных групп (например, -ОН, =CO, -NH2 и др.) образуются окси-, кето-, аминокислоты и другие классы соединений.
Применение
Карбоновые кислоты — исходные соединения для получения промежуточных продуктов органического синтеза, в частности кетенов, галогенангидридов, виниловых эфиров, галогенкислот. Соли карбоновых кислот и щелочных металлов применяют как мыла, эмульгаторы, смазочные масла; соли тяжелых металлов — сиккативы, инсектициды и фунгициды, катализаторы. Эфиры кислот — пищевые добавки, растворители; моно- и диэфиры гликолей и полигликолей пластификаторы, компоненты лаков и алкидных смол; эфиры целлюлозы — компоненты лаков и пластмассы. Амиды кислот эмульгаторы и флотоагенты.
Получение
- Карбоксилирование металлорганических соединений
- Гидролиз сложных эфиров
Катализируется кислотой или основанием; первоначально образуется амид, который гидролизуется до кислоты; лишь в редких случаях амид устойчив к гидролизу; удобный лабораторный метод (если нитрил доступен)
Используется для получения высших гомологов кислот из низших.
Физические свойства
Низшие карбоновые кислоты — жидкости с острым запахом, хорошо растворимые в воде. С повышением относительной молекулярной массы растворимость кислот в воде и их плотность уменьшаются, а температура кипения повышается. Высшие кислоты, начиная с пеларгоновой (н-нонановой) СН3-(СН2)7-СООН, — твердые вещества, без запаха, нерастворимые в воде. Низшие карбоновые кислоты в безводном виде и в виде концентрированных растворов раздражают кожу и вызывают ожоги, особенно муравьиная кислота и уксусная кислота.
На физических свойствах карбоновых кислот сказывается значительная степень ассоциации вследствие образования водородных связей. Кислоты в отличие от спиртов, образуют более прочные водородные связи, вследствие того что связи 

Характерные химические реакции
Наиболее важные химические свойства, характерные для большинства карбоновых кислот:
1. Карбоновые кислоты при реакции с металлами, их оксидами или их осно́вными гидроксидами дают соли соответствующих металлов:


2. Карбоновые кислоты могут вытеснять более слабую кислоту из её соли, например:

3. Карбоновые кислоты в присутствии кислого катализатора реагируют со спиртами, образуя сложные эфиры (реакция этерификации):
4. При нагревании аммонийных солей карбоновых кислот образуются их амиды:
5. Под действием 
Литература
- Общая органическая химия т. 4 под ред. Д. Бартона и Д. Оллиса. М.: Химия. 1983
- Сайкс П. Механизмы реакций в органической химии. М.: Химия. 1991
- Адамс М. Карбоновые кислоты в органике. М.: Химия. 1990
- Дж. Роберт, М.Касерио «Основы органической химии» т. 1 Издание 2-е, дополненное. 1978
Ссылки
См. также
 | Портал «Наука» |
|---|---|
| Карбоновые кислоты в Викисловаре ? | |
| Карбоновые кислоты на Викискладе ? | |
 | Проект «Химия» |
- карбоксильная группа
- оксикислоты
- кетокислоты
- аминокислоты
- сложные эфиры
- хлорангидриды карбоновых кислот
- ангидриды карбоновых кислот
- амины
- нитрилы
- Найти и оформить в виде сносок ссылки на авторитетные источники, подтверждающие написанное.
- Исправить статью согласно стилистическим правилам Википедии.
- Добавить иллюстрации.

























 Органические вещества
Органические вещества