Кальцитриол это активная форма витамина
Кальцитриол является активным метаболитом витамина D3 и в отличие от двух других кальцийрегулирующих гормонов — паратирина и кальцитонина — имеет стероидную природу.
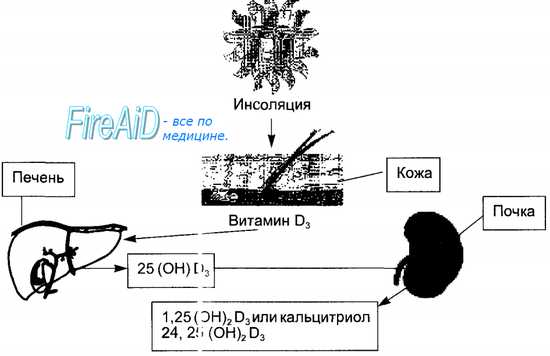
Синтез кальцитриола происходит в три этапа (рис. 6.24). Первый этап протекает в коже, где под влиянием ультрафиолетовых лучей из провитамина образуется витамин D3 или холекальциферол. Второй — связан с печенью, куда холека льциферол транспортируется кровью и где в эндоплазматическом ретикул ‘ме гепатоцитов происходит его гидроксилирование по 25-му атому углерода с образованием 25(OH)D3. Этот метаболит поступает в кровь и циркулирует в связи с альфа-глобулином. Его физиологические концентрации не влияют на обмен кальция. Третий этап осуществляется в почках, где в митохондриях клеток проксимальных канальцев происходит второе гидроксилирование и образуются два соединения: l,25-(OH)2-D и 24,25-(OH)2-D. Первое — является наиболее активной формой витамина D3, обладает мощным регуляторным влиянием на обмен кальция в организме и называется кальцитриолом. Образование в почках этого гормона регулируется паратирином, который стимулирует гидроксилирование по первому атому углерода. Таким же эффектом обладает и гипокальциемия. При избытке кальция в крови гидроксилирование происходит по 24-му атому углерода и синтезируется второе соединение — 24,25-(OH)2-D, которое обладает способностью угнетать секрецию паратирина по принципу обратной связи. Инактивация кальцитриола происходит в печени.
Основной эффект кальцитриола (рис. 6.25) заключается в активации всасывания кальция в кишечнике. Гормон стимулирует все три этапа всасывания: захват ворсинчатой поверхностью клетки, внутриклеточный транспорт, выброс кальция через базолатеральную мембрану во внеклеточную среду. Действие кальцитриола на эпителиальные клетки кишечника состоит в индуцировании синтеза энтероцитами специальных кальций-связывающих и транспортирующих белков — кальбайндинов. Кальцитриол повышает в кишечнике и всасывание фосфатов. Почечные эффекты гормона заключаются в стимуляции реабсорбции фосфата и кальция канальцевым эпителием. Эффекты кальцитриола на костную ткань связаны с прямой стимуляцией остеобластов и обеспечением костной ткани усиленно всасывающимся в кишечнике кальцием, что активирует рост и минерализацию кости.
Эффекты кальцитриола, как и всех стероидных гормонов, делятся на геномные и негеномные. Геномные эффекты обусловливают синтез кальбайндинов, активирование остеобластов и синтеза костной ткани. Увеличение транспорта кальция внутрь клеток, например в скелетных и сердечной мышцах, в остеобластах, энтероцитах, гепатоцитах и клетках околощитовидных желез, происходит быстро и обусловлено негеномным действием гормона. Под влиянием гормонрецепторного мембранного комплекса в клетках происходит образование вторичного посредника диацил-глицерола и активация протеинкиназы С. Кальцитриол меняет в клетке и уровень цАМФ и цГМФ, что ведет к модификации геномного эффекта. Наличие специфических рецепторов к гормону у многих клеток тканей (в молочной железе, эндокринных железах, нервной системе), способность кальцитриола активировать транспорт кальция в большинстве из них свидетельствуют о широком спектре эффектов этого гормона.
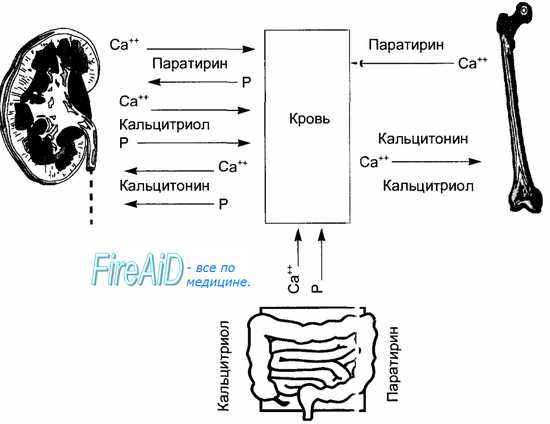
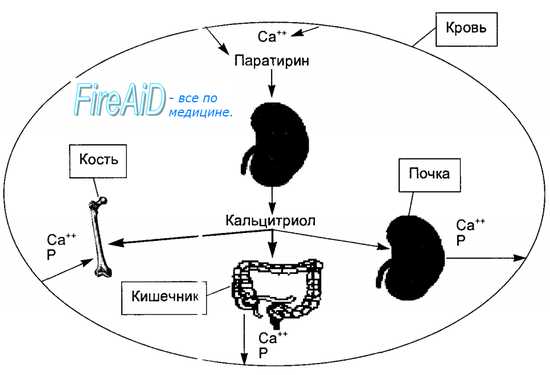
Участие трех кальций регулирующих гормонов в гомеостазисе кальция и фосфора показано на рис. 6.26.
Недостаточность кальцитриола проявляется в виде рахита, т. е. нарушения созревания и кальцификации хрящей и кости у детей, либо остеомаляции, т. е. падения минерализации костей после завершения роста скелета. При этом сдвиги уровня кальция в крови и клетках обусловливают угнетение нейромышечной возбудимости и мышечную слабость.
Источник
Кальцитриол: новые возможности известного соединения
- КЛЮЧЕВЫЕ СЛОВА: остеопороз, болезнь почек, патология, витамины D, кальцитриол, Парикальцитол, Доксекальциферол
Кальцитриол (1,25-дигидроксихолекальциферол) – метаболит витамина D (ВД), образующийся путем присоединения к нативному ВД двух гидроксильных групп (ОН) в 1 и 25 положении. Термином «витамин D» объединяют группу сходных по химическому строению (сексостероиды) нескольких форм ВД (D1— D5), из которых только D2 и D3 нашли широкое клиническое применение при различной патологии человека.
ВД традиционно относят к группе жирорастворимых витаминов, однако ВД не является собственно витамином, поскольку только за счет двухступенчатой метаболизации превращается в активную форму и оказывает подобно гормону многообразные биологические эффекты путем взаимодействия со специфическими рецепторами в ядрах клеток различных органов и тканей. Поэтому оправдано образующийся в почках кальцитриол называют D -гормоном.
Открытие и уточнение механизмов действия ВД тесно связано с историей рахита, первое достоверное описание которого относится к середине XVII века, хотя инвалидизирующиие изменения скелета, связанные с недостаточным пребыванием на солнце по религиозным и другими соображениями, были известны еще в глубокой древности. В последней четверти XIX века данные аутопсий, проведенных в Бостоне и Лейдене, свидетельствовали, что у 80-90% умерших детей имелись признаки рахита. В 1822 г. J. Sniadecki распознал важность пребывания на солнце для лечения и предупреждения рахита, а T. Palm (1890) лечил рахит солнечными ваннами.
Экспериментальное изучение рахита началось в начале ХХ века, когда B. Mellanby и соавт. воспроизвели рахит у собак и лечили животных маслом печени трески. Ультрафиолетовое облучение продуктов, например, молока, усиливало его антирахитическое свойства. Аналогичный эффект достигался скармливанием коровам облученных ультрафиолетом дрожжей. Проведенные исследования позволили установить, что существуют 2 основные формы ВД: витамин D3 (холекальциферол) и витамин D2 (эргокальциферол). Источником холекальциферола являются животные продукты – рыбий жир, печень, яйца и т.д. Частично D3 образуется в коже человека из 7 дегидрохолестерина под влиянием ультрафиолета, причем за ультрафиолетовые лучи конкурирует кожный меланин и людям с темной кожей необходима более длительная ультрафиолетовая экспозиция, чем белокожим, для выработки равного количества холекальциферола. У пожилых людей кожная продукция D3 снижена на 70% по сравнению с молодыми. В силу этого пожилым и темнокожим людям в физиологических условиях необходимо увеличивать потребление пищевого холекальциферола.
Эргокальциферол образуется из эргостерола под влиянием ультрафиолетового облучения. Эргостерол является основным компонентом мембран растительных клеток, выполняя ту же функцию, что и холестерин у животных и человека.
В организме человека и других млекопитающих витамины D2 и D3 включаются в хиломикроны, поступают в лимфатическую систему и в дальнейшем в циркуляцию, связываясь с белком-переносчиком (ДВП). В печени оба соединения подвергаются гидроксилированию (присоединению группы ОН к атому углерода в 25 положении) с участием 25-гидроксилазы. 25(ОН) D (кальцидиол) – основная циркулирующая форма ВД, период полувыведения которого равен 14 дням, отражающая запасы ВД в организме, и концентрация которого коррелирует с развитием рахита у детей, остеомаляции у взрослых и вторичного гиперпаратиреоза (ВГПТ) у больных с ХПН. Комплекс 25(ОН) D-ДВП, профильтровавшись в почечных клубочках, связывается с мегалином плазменных мембран проксимальных канальцев и поступает в клетки канальцевого эпителия. В митохондриях 25(ОН) D высвобождается из связи с ДВП и конвертируется 1α-гидроксилазой в 1,25(ОН)2 D3-кальцитриол, являющийся активной формой ВД, участвующей в различных биологических реакциях и в регуляции минерального гомеостаза у здорового человека и больных ХБП.
Совместно с паратгормоном (ПТГ) кальцитриол обеспечивает стабильный уровень кальция в крови, повышая абсорбцию Са 2+ в желудочно-кишечном тракте, и способствует высвобождению кальция из скелета за счет усиления остеокластической резорбции, а также усиливает всасывание фосфата в кишечнике путем транслокации Na/Pi переносчика фосфата IIв типа из цитоплазмы на апикальную мембрану энтероцитов. В почках кальцитриол усиливает экспрессию мегалина в проксимальных канальцах, супрессирует активность 1α-гидроксилазы и активирует 24-гидроксилазу, контролируя собственный гомеостаз, усиливает ПТГ-зависимую реабсорбцию кальция в канальцах, в костной ткани способствует дифференциации и созреванию остеокластов. Реагируя с VDR на паращитовидных железах (ПЩЖ), кальцитриол влияет на пролиферацию клеток железы и контролирует секрецию ПТГ.
Перечисленные эффекты кальцитриола осуществляются его взаимодействием со специфическими рецепторами (VDR) и комплексированием этой структуры с RXR (Х рецептором ретиноидной кислоты). Образовавшийся комплекс (кальцитриол-VDR-RXR) поступает в ядро клеток, например, энтероцитов, где реагирует с D-респонсивным элементом (VDRE). Результатом взаимодействия является экспрессия на апикальной мембране энтероцитов Ca-каналов, по которым кальций входит в энтероцит и с участием кальций связывающего белка (калбиндина 9К) быстро преодолевает внутриклеточные пространства и поступает в циркуляцию; одновременно усиливается транскрипция генов и синтез остеокальцина, остепонтина, щелочной фосфатазы и снижается продукция провоспалительных цитокинов (интерлейкина-2 и интерлейкина-12), пептидов, родственных ПТГ.
При пищевом дефиците кальция ВД взаимодействует с VDR на остеобластах, индуцируя на плазменной мембране клеток экспрессию RANKL (лиганда рецептора активатора ядерного фактора (NF-κВ). Рецептор активатор NF-kВ (RANK) плазменной мембраны преостеокластов, взаимодействует с RANKL, ускоряя дифференцировку преостеокластов в зрелые остеокласты. Последние, продуцируя HCl и коллагеназы, растворяют матрикс костной ткани, высвобождая кальций и фосфор в циркуляцию, поддерживая постоянный уровень кальция в крови. Таким образом, основной физиологической функцией ВД является поддержание нормального содержания в крови фосфора и кальция, необходимого для минерализации скелета, обеспечения метаболических функций, включая проведение возбуждения по нервам.
Традиционными органами-мишенями для кальцитриола считают скелет, желудочно-кишечный тракт, почки, ПЩЖ, однако VDR обнаружены также в миокарде, мышцах, головном мозге, поджелудочной железе, гонадах и т.д., свидетельствуя о многочисленных регуляторных функциях этого метаболита ВД. Геномные эффекты кальцитриола реализуются в сроки от нескольких часов до нескольких дней. К негеномным эффектам, развивающимся в интервале от нескольких минут до нескольких часов, относят быстрое интестинальное увеличение абсорбции кальция (транскальтахия), повышение секреции инсулина β-клетками поджелудочной железы, открытие Са и Cl каналов остеобластов, усиление миграции эндотелиальных клеток. Считают, что негеномные эффекты кальцитриола осуществляются через VDR, присутствующими на апикальной мембране клеток.
Взаимодействие кальцитриола с VDR на клетках ПЩЖ снижает экспрессию мРНК ПТГ, уменьшая тем самым синтез и секрецию ПТГ, и подавляет гиперплазию клеток ПЩЖ. На фоне прогрессирующих нефропатий, протекающих с гипокальциемией и гиперфосфатемией, на клетках ПЩЖ увеличивается экспрессия трансформирующего фактора роста альфа (ТФР-α) и его рецептора и рецептора эпидермального фактора роста (ЭФР), вызывающих гиперплазию клеток ПЩЖ и повышающих секрецию ПТГ. Кальцитриол индуцирует образование внутриклеточных ингибиторов (р21 и р27), прерывающих сигнал на активацию ТФР-α/ЭФР (1).
У больных с ХБП нарушаются все звенья регуляции фосфорно-кальциевого обмена, включая снижение продукции кальцитриола. Основной причиной снижения образования 1,25(ОН)2D3 является деструкция мест его образования в области почечных проксимальных канальцев, но одновременно под влиянием гиперфосфатемии, развивающейся вследствие уменьшения экскреции фосфата почками и повышения в крови уровня фактора роста фибробластов (FGF23), снижается активность 1α-гидроксилазы, конвертирующей 25ОНД в 1,25 (ОН)2 D 3. Помимо почек кальцитриол синтезируется активированными макрофагами, с чем ассоциирована гиперкальцемия при саркоидозе, и в плаценте, однако макрофагальная продукция не компенсирует дефицит кальцитриола у больных с заболеванием почек, что нарушает всасывание кальция в кишечнике и перманентную гипокальцемию. Последняя наряду с гиперфосфатемией является триггером развития вторичного гиперпаратиреоза (ВПТГ) – самой частой формой ренальной остеодистрофии.
Повышение концентрации ПТГ в крови больных ХБП отмечается при величине клубочковой фильтрации ≤ 60мл/мин и увеличивается по мере прогрессирования нефропатии. Под влиянием секретируемого в избытке ПТГ в костях образуются полости резорбции, выполненные неорганизованным остеоидом, при минерализации которого образуется неупорядочная кость (woven lone), склонная к длительно неконсолидирующимся переломам. При пролонгированном течении ВГПТ развивается фиброз трабекулярной кости (фиброзивный остеит), а высвобождающийся в результате резорбции костной ткани кальций при недостаточно жестком контроле гиперфосфатемии вызывает отложения фосфата кальция в различных органах и тканях, в том числе в стенках сосудов, включая коронарные, и клапанах сердца, усугубляя сердечно-сосудистую морбидность и летальность. Наиболее выраженные проявления ВГПТ наблюдаются у больных на заместительной почечной терапии, однако профилактику и лечение ВГПТ необходимо начинать на ранних стадиях ХБП.
Лечение ВГПТ включает контролирование гиперфосфатемии (назначение фосфатсвязывающих гелей) и гипокальцемии (кальцитриол и другие активаторы VDR), назначение по строгим показаниям кальциймиметиков, коррекцию ацидоза, усиливающего мобилизацию кальция из скелета.
Доза кальцитриола, лечебное применение которого началось еще в 1972 г. (2), колеблется от 0,25 мкг или через 1 день у больных с начальной ХПН до 1,5 мкг/сут. у пациентов на ЗПТ. У последних препарат можно назначать ежедневно или в удвоенной дозе через день или 2 раза в неделю, что обеспечивает такое же снижение интактного ПТГ (иПТГ), как и ежедневный прием, но урежает эпизоды гиперкальцемии. Еще более эффективным считается внутривенное введение кальцитриола. Мета-анализ 21 клинического исследования по пероральному и внутривенному применению кальцитриола в дозе от 2,0 до 7,4 мкг/нед. продемонстрировал более быструю и более глубокую супрессию продукции ПТГ при внутривенном введении препарата (3). При пероральном приеме биодоступность кальцитриола не превышает 50%, а побочные реакции развиваются чаще.
Кальцитриол повышает абсорбцию кальция в тонком кишечнике и поэтому его назначение сочетают с дополнительным приемом кальция (500-1000 мг/сут.), что особенно важно для больных с преддиализной ХПН, находящихся на диете с ограничением белка и, соответственно, кальция. Одновременно с кальцием кaльцитриол увеличивает всасывание в желудочно-кишечном тракте фосфата, которым особенно богаты мясо, рыба, молочные продукты. Повышение в крови уровня фосфора стимулирует продукцию ПТГ и индуцирует метастатическую кальцификацию. Поэтому коррекция гиперфосфатемии является важнейшим элементом профилактики и лечения ВГПТ.
Помимо традиционных органов-мишеней, регулирующих фосфорно-кальциевый обмен, ВД, точнее кальцитриол, исторически длительно считавшийся антирахитическим фактором, взаимодействуя со специфическими рецепторами, контролирует множество биологических процессов в организме.
D-гормон влияет на сердечно-сосудистую, ренин-ангиотензиновую, мышечную, кроветворную системы, процессы дифференциации, пролиферации и апоптоза, благодаря чему витамин D с успехом используется для лечения псориаза, различных злокачественных образований, аутоиммунных заболеваний и т.д. D-гормон супрессирует продукцию в миокарде коллагена I типа, скопления которого в первую очередь подвержены кальцификации (4), ингибирует образование факторов кальцификации – матриксного Gla-протеина и Runx2/Gbfal (5) и повышает экспрессию ингибиторов кальцификации – МВР2, β-катенина, интерлейкина-6. Подавляя образование и секрецию ПТГ, кальцитриол смягчает негативное влияние ПТГ на сердечно-сосудистую систему, эндотелиальную дисфункцию, ГЛЖ, развитие фиброза миокарда (6), пролиферацию гладкомышечных клеток (7). У нокаутных по VDR мышей ренин-ангиотензивная система (РАС) гиперактивна, что вызывает ГЛЖ, в то время как у животных, получавших D гормон, эти изменения отсутствуют, как и повышение продукции атриального натрийуретического пептида (АНП) кардиомиоцитами, обработанными эндотелином-1 (8). Лечение кальцитриолом уменьшает ГЛЖ как у животных со спонтанной гипертензией, так и у больных на программном гемодиализе (9).
В общей популяции дефицит витамина D сочетается с сердечно-сосудистой патологией (10), а применение витамина D модифицирует такие факторы риска как резистентность к инсулину, метаболический синдром, ожирение, склонность к тромбозам (11). Обеспеченность в популяции витамином D ассоциируется с более низкими цифрами артериального давления (АД) (12).
VDR обнаружены на В и Т лимфоцитах и дефицит ВД сопровождается снижением Т-клеточного иммунитета (уменьшение числа натуральных Т киллеров, продукции γ-интерферона, ИЛ-2) (13), в то время как восполнение дефицита ВД нормализует иммунный ответ (14).
Кальцитриол блокирует у животных обострения рецидивирующего энцефаломиелита, являющегося моделью рассеянного склероза, и профилактирует и даже излечивает у крыс аутоиммунный диабет I типа, предупреждая деструкцию островковых клеток поджелудочной железы. Отмечено благоприятное влияние кальцитриола на течение волчаночного нефрита, воспалительных заболеваний кишечника, ревматоидного артрита (15) и отторжение трансплантата (16).
У больных с терминальной уремией различные инфекции встречаются во много раз чаще, чем в популяции, являясь второй основной причиной (после сердечно-сосудистых осложнений) летальных исходов. Помимо ассоциированных с сосудистым доступом осложнений, диализные больные подвержены респираторным инфекциям. Кателицидины представляют собой семейство антимикробных пептидов, являющихся частью системы врожденного иммунитета, активных в отношении грамположительных и грамотрицательных микробов, вирусов и грибов. У человека обнаружен только один из этих пептидов (hCAP 18-cathelicidin autimicrolal peptide), обозначаемый LL-37 по своему активному фрагменту (17). Ген человека, кодирующий hCAP18, транскрипционально регулируется VDR и назначение кальцитриола усиливает in vitro продукцию hCAP18 во многих органах и тканях. У больных на гемодиализе с низким уровнем циркулирующего hCAP18 повышен риск инфекционных осложнений (18).
VDR экспрессированы на клетках скелетных мышц у животных и человека, а у мышей, нокаутных по VDR, наряду с изменением структуры (укорочение) мышечных волокон, наблюдаются гипокальциемия, гиперфосфатемия, усиленная продукция патологически измененных мышечных белков (myf5, миогенина, изоформ легких цепей миозина). У лиц старческого возраста число VDR мышечной ткани прогрессивно сокращается, однако кальцитриол возможно способен замедлить возрастные изменения мышц (24).
Кальцитриол и другие метаболиты витамина D, благодаря влиянию на активность РАС, могут усиливать эритропоэтический ответ на рчЭРП, а, уменьшая протеинурию, замедлять прогрессирование ХПН. На фоне лечения кальцитриолом крыс с субтотальной нефрэктомией у животных замедлялось развитие гломерулосклероза (20).
Многие эффекты кальцитриола воспроизводимы его предшествующим метаболитом 25(OH)D, являющимся также субстратом для lα-гидроксилазы, и др. метаболитами. Активность 25ОНD3 в 1000 раз меньше, чем 1,25(ОН)2D3, однако он оказывает схожие с кальцитриолом эффекты, поскольку его концентрация в сыворотке в 1000 выше (30 мкг/л), компенсируя в определенной степени низкое сродство 25(ОН)D3 к VDR.
Содержание 25(ОН)D3 в крови считается индикатором запасов витамина D в организме. У пожилых здоровых людей уровень 25(ОН)D3
Источник