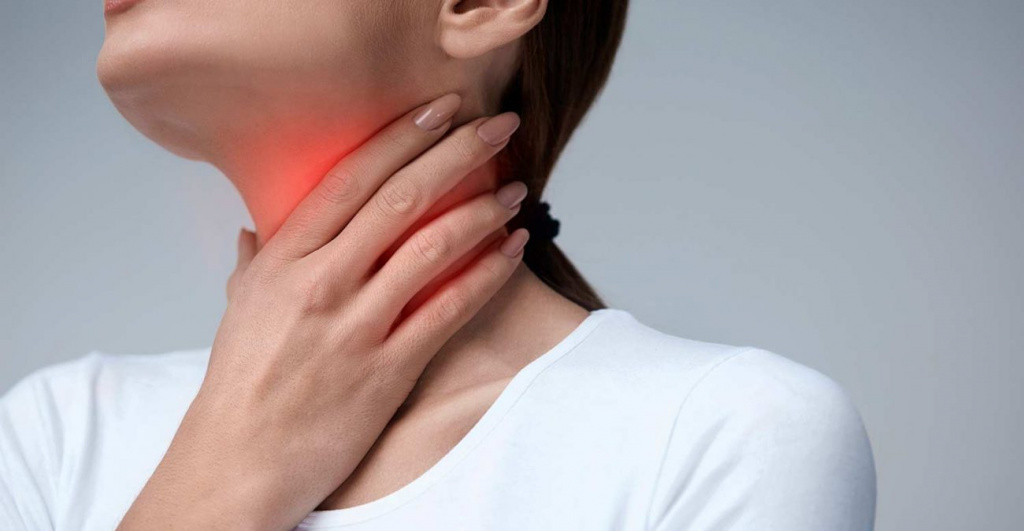
Инфекционный мононуклеоз: особенности развития и лечения
Это заболевание провоцирует ДНК-содержащий вирус Эпштейна-Барра, поражающий обычно детей, подростков и молодежь. Среди людей старше 30 лет инфекция встречается крайне редко, но протекает со схожими симптомами. Возбудитель легко передается от зараженных окружающим, а специфическая вакцина против него до сих пор не разработана. По этим причинам профилактика патологии затруднена. Но при адекватном лечении большинство заболевающих благополучно выздоравливают, приобретая пожизненную иммунную защиту.
Что такое инфекционный мононуклеоз
Вирус Эпштейна-Барра относится к герпесной группе, но имеет характерное отличие. Он не разрушает пораженные клетки, а вызывает их патологический рост, превращая в так называемые атипичные мононуклеары. Возбудитель передается от носителей аэрозольным путем: с капельками слюны и мокроты. Заразиться можно при тесных контактах, в быту, используя посуду или белье больных. Носители вируса распространяют его в течение нескольких месяцев, начиная с инкубационного периода. Инфекция Эпштейна-Барра не имеет сезонного характера. По окончании заболевания возбудитель сохраняется в организме. При резких снижениях иммунитета вероятны обострения заболевания, но на практике случаи рецидивов встречаются редко.
Инфекционный мононуклеоз обычно протекает в стертой форме, сопровождается лихорадкой, покраснением ротоглотки, увеличением лимфатических узлов и красной сыпью на коже. Генерализованное поражение организма встречается у носителей ВИЧ и при других состояниях иммунодефицита. Основная часть больных — дети и подростки младше 17 лет.
Стадии развития и симптомы мононуклеоза
При заражении инфекционный агент, оседая на слизистой рта и носа, проникает в дыхательные пути и устремляется к В-лимфоцитам. Инкубационный период болезни продолжается обычно 7–12 суток. В некоторых случаях затягивается до 1,5 месяцев. Все это время вирус активно размножается и разносится с током лимфы и крови по организму.
Первые признаки мононуклеоза напоминают ОРВИ или ангину:
в очагах поражения развивается воспаление: краснеет и отекает горло, увеличиваются миндалины, появляется заложенность носа, небольшой насморк;
температура тела увеличивается до +37–38°С, у маленьких детей возможен сильный жар;
мучают физическая слабость, озноб, головокружение, ноющие боли в мышцах.
По мере распространения инфекции развивается лимфаденит: шейные, затылочные, подчелюстные лимфатические узлы увеличиваются, уплотняются, но остаются безболезненными. Отек их заметен невооруженным взглядом, явно чувствуется при ощупывании.
В течение нескольких суток или недель, пока болезнь прогрессирует, лихорадочные симптомы могут нарастать или сохраняются в виде легкого недомогания. При затяжном характере инфекции самочувствие то улучшается, но вновь становится хуже. У большинства отмечаются выраженные боли в горле при глотании.
По мере развития заболевания вирус поражает печень и селезенку, вызывая системные симптомы:
пожелтение склер глаз и кожи;
тошноту, резкое снижение аппетита;
характерную папуллезную сыпь на шее, груди и спине: красноватые пятна не сопровождаются нагноением или зудом, безболезненны, не требуют специальной обработки.
При остром инфекционном мононуклеозе у большинства больных отмечается гепатоспленомегалия: увеличение размеров печени и селезенки. Патологические изменения легко обнаружить при врачебном осмотре.
Воспаление слизистой гортани напоминает состояние при фолликулярной или стрептококковой ангине: горло покрывает желтоватый налет, стенки становятся зернистыми, на них могут появиться характерные багровые изъязвления. В некоторых случаях болезнь сопровождается бронхоспазмом и кашлем с небольшим отхождением мокроты.
Катаральные симптомы и лихорадка острее выражены в детском возрасте. У взрослых мононуклеоз чаще поражает печень, сопровождается признаками общей интоксикации, головными болями, астенией.
Острый период мононуклеоза продолжается 2–4 недели, затем признаки патологии постепенно уменьшаются. Физическое состояние больных нормализуется после возвращения в норму функций печени. Кожная сыпь исчезает самостоятельно. Субфебрилитет, некоторая слабость и отечность лимфоузлов могут сохраняться еще 1–2 недели после устранения основных признаков болезни. К этому моменту уже формируется стойкий специфический иммунитет.
Осложнения инфекционного мононуклеоза
При общем истощении организма патология хронизируется и приобретает рецидивирующий характер. Мононуклеоз в таких случаях затягивается до 1,5–2 лет, периодически проявляясь снижением функций печени, лихорадкой или катаральными симптомами.
При вторичной стрептококковой или стафилококковой инфекции на фоне мононуклеоза возможно развитие менингоэнцефалита. Распухшие миндалины могут привести к обструкции дыхательных путей. При тяжелом течении инфекции вероятен острый гепатит или двусторонняя инфильтрация легких. В единичных случаях может произойти разрыв селезенки из-за растяжения ее капсулы.
Лечение мононуклеоза
Диагностика заболевания базируется на результатах физикального осмотра больных и лабораторном изучении состава крови. При мононуклеозе увеличивается лимфоцитов и моноцитов, уровень атипичных мононуклеаров превышает 10% от общего количества клеток. На УЗИ явно видны увеличения размеров селезенки и печени. Анализ ПЦР на выявление антител к вирусу Эпштейна-Барра проводят при затяжном течении патологии и развитии осложнений.
Специфического лечения вирусного мононуклеоза не существует. Терапия направлена на подавление воспаления, снижение патологических иммунных реакций, устранение болезненных симптомов и предупреждение вторичной инфекции. В ходе лечения применяют:
антибиотики пенициллиновой группы, сульфаниламиды, тетрациклин;
при обширных воспалениях и угрозе асфиксии показан Преднизолон, другие глюкокортикоидные гормоны;
в составе симптоматической и поддерживающей терапии применяют комплексы витаминов, НПВС, гепатопротекторы.
Для снижения общей интоксикации организма и предупреждения пищеварительных нарушений назначают лечебное меню: отварную легкую пищу с умеренным содержанием жиров, без острых приправ и экстрактивных веществ.
После выздоровления пациентам показан диспансерный учет в течение полугода. В этот период рекомендуется принимать иммуномодуляторы, избегать переохлаждений и изнурительных нагрузок.
Все представленные на сайте материалы предназначены исключительно для образовательных целей и не предназначены для медицинских консультаций, диагностики или лечения. Администрация сайта, редакторы и авторы статей не несут ответственности за любые последствия и убытки, которые могут возникнуть при использовании материалов сайта.
Источник
Новые подходы к терапии инфекционного мононуклеоза

Инфекционный мононуклеоз — вирусное, широко распространенное заболевание, для которого характерна системность поражения с вовлечением в патологический процесс лимфоидных органов и тканей, сердечно-сосудистой, иммунной, систем, костного мозга, печени, селе
Infectious mononucleosis is a viral, widely-spread disease characterized by systemacy of the lesion, with involvement of lymphoid organs and tissues, cardiovascular and immune systems, marrow, liver, spleen and other organs in the pathological process. Comparative study of clinical and laboratory indices in the acute period of infectious mononucleosis was conducted, including treatment with human recombinant interferon alpha-2b, along with highly active antioxidants — C and E vitamins.
Герпесвирусные инфекции широко распространены среди детей и взрослых. По данным Всемирной организации здравоохранения (ВОЗ) до 90% взрослого и детского населения планеты инфицировано герпесвирусами, причем у 50% из них отмечают манифестное, рецидивирующее течение вызываемых ими заболеваний. Инфекционный мононуклеоз является наиболее характерным типичным клиническим проявлением герпесвирусных инфекций [1]. Инфекционный мононуклеоз (ИМ) — вирусное, широко распространенное заболевание, для которого характерна системность поражения с вовлечением в патологический процесс лимфоидных органов и тканей, сердечно-сосудистой, иммунной систем, костного мозга, печени, селезенки и других органов [2, 3]. В мире инфекционным мононуклеозом ежегодно заболевают от 16 до 800 лиц на 100 тыс. населения. В России ежегодно регистрируют 40–80 случаев ИМ на 100 тыс. населения [1, 2, 4]. Установлена роль вируса Эпштейна–Барр в развитии злокачественных новообразований, аутоиммунных, неврологических заболеваний и синдрома хронической усталости. Показано, что после перенесенной инфекции новое поколение В-клеток содержит несколько генокопий вируса Эпштейна–Барр в латентной форме, в результате чего вирус может длительно персистировать в организме, вызывая иммунодефицитное состояние и повышая риск развития онкогематологических заболеваний [5–7]. В последние годы доказана гепатотропность герпетических вирусов, которые могут вызывать различные поражения печени — от бессимптомного гепатита до гепатоцеллюлярной карциномы [2].
В связи с этим назначение интерферона α-2b человеческого рекомбинантного в комплексе с высокоактивными антиоксидантами витаминами Е и С (препарата Виферон®), обладающего иммуномодулирующими, противовирусными, антипролиферативными свойствами, подавляющего репликацию РНК- и ДНК-содержащих вирусов, могло бы способствовать более быстрому клиническому выздоровлению, оказать положительное влияние на лабораторные показатели и тем самым предотвратить хроническое течение.
Целью данного исследования явилось сравнительное изучение клинико-лабораторных показателей в острый период ИМ при лечении препаратом Виферон®.
В задачи иследования входило:
1) оценить эффективность использования симптоматической и патогенетической терапии у пациентов с ИМ;
2) оценить эффективность применения препарата Виферон® у пациентов с ИМ на фоне симптоматической и патогенетической терапии;
3) исследовать сравнительную эффективность лечения препаратом Виферон® с базисной стандартной терапией у пациентов с ИМ.
Материал и методы исследования
Проведено открытое проспективное рандомизированное контролируемое исследование в группах больных с острым ИМ. В исследование были включены 40 пациентов, больных острым ИМ средней степени тяжести, проходивших стационарное лечение в Воронежской областной клинической инфекционной больнице. Основная группа (1-я группа) — 20 пациентов, наряду с базисной терапией получала препарат рекомбинантного интерферона α-2b в комплексе с высокоактивными антиоксидантами витаминами Е и С Виферон®, и группа сравнения (2-я группа) — 20 пациентов, которым проводили только базисную стандартную терапию. Критерии включения пациентов были: лечение в стационаре, верифицированный диагноз ИМ, возраст старше 18 лет, поступавших в клинику на 1–5 день от начала заболевания и не получавших в домашних условиях препаратов интерферона и иммуномодуляторов, наличие информированного согласия на участие в исследовании.
Лечение пациентов в группах на всех этапах исследования осуществляли согласно стандартным режимам лечения (на основании основных положений Федеральных клинических рекомендаций по диагностике и лечению инфекционного мононуклеоза, 2013), включающего базисную стандартную терапию (дезинтоксикационная, десенсибилизирующая и антибактериальная терапия).
- 1-й группе пациентов наряду с базисной терапией назначали Виферон® по следующей схеме: по 1 суппозиторию (1 000 000 МЕ) 2 раза в сутки в течение 10 дней.
- 2-я группа пациентов получала только базисную стандартную терапию.
Набор больных в группы осуществляли методом пар, рандомизация проводилась с помощью генератора случайных чисел, больные в группах были сопоставимы по полу и возрасту.
Для обработки полученных данных использовали пакеты программ Microsoft Excel 2007 и Statistica 6.0. Проверку статистических гипотез проводили при критическом уровне значимости р = 0,05, т. е. различие считали статистически значимым при p Нормализация некоторых лабораторных показателей, больных острым инфекционным мононуклеозом, принимавших в комплексной терапии Виферон®, по сравнению с больными, получавшими только стандартную терапию.
Литература
- Тюняева Н. О., Софронова Л. В. Инфекционный мононуклеоз: этиологические факторы, проблемы диагностики и лечения (научный обзор) // Вестник новых медицинских технологий. 2014. Т. 21, № 3. С. 184–190.
- Краснов М. В., Стекольщикова И. А., Боровкова М. Г., Андреева Л. В. Инфекционный мононуклеоз у детей // Современные проблемы науки и образования. 2015. № 2–1.
- Шарипова Е. В., Бабаченко И. В. Герпесвирусные инфекции и инфекционный мононуклеоз (обзор литературы) // Журнал инфектологии. 2013. Т. 5, № 2. С. 5–12.
- Баранова И. П., Курмаева Д. Ю., Лесина О. Н. Инфекционный мононуклеоз: клиника, диагностика, лечение рекомбинантным интерфероном А-2ß // Фарматека. 2014. № 1 (274). С. 40–44.
- Лесина О. Н., Курмаева Д. Ю. Катамнез часто болеющих пациентов, перенесших инфекционный мононуклеоз и эффективность иммунореабилитации // Известия высших учебных заведений. Поволжский регион. Медицинские науки. 2010. № 2. С. 63–68.
- Белоконова Л. В., Каулин В. В., Приходкин Н. Н., Ермакова К. В. Клинико-лабораторные особенности инфекционного мононуклеоза у взрослых // Молодой ученый. 2018. № 46. С. 76–79. URL https://moluch.ru/archive/232/53951/ (дата обращения: 06.05.2019).
- Гилева Р. А., Хохлова З. А., Чечет Ю. С. Клинико-лабораторная характеристика инфекционного мононуклеоза, обусловленного вирусом Эпштейна–Барр // Казанский медицинский журнал. 2014. Т. 95, № 5. С. 722–725.
Ю. Г. Притулина* , 1 , доктор медицинских наук, профессор
В. В. Кунина*, кандидат медицинских наук
А. А. Монастырский**
Т. Н. Малюткина**
В. В. Малиновская***, доктор биологических наук, профессор
А. Н. Шувалов***, кандидат медицинских наук
* ФГБОУ ВО ВГМУ им. Н. Н. Бурденко Минздрава России, Воронеж
** БУЗ ВО ВОКИБ, Воронеж
*** ФГБУ НИЦЭМ им. Н. Ф. Гамалеи Минздрава России, Москва
Новые подходы к терапии инфекционного мононуклеоза/ Ю. Г. Притулина, В. В. Кунина, А. А. Монастырский, Т. Н. Малюткина, В. В. Малиновская, А. Н. Шувалов
Для цитирования: Лечащий врач № 9/2019; Номера страниц в выпуске: 57-59
Теги: герпесвирусные инфекции, иммунодефицитные состояния, интерферон
Источник
Современные подходы к лечению Эпштейна–Барр-вирусной инфекции у взрослых
Одной из актуальных проблем современной медицины является высокая инфицированность населения одним из представителей оппортунистических возбудителей — вирусом Эпштейна–Барр (ВЭБ).
Одной из актуальных проблем современной медицины является высокая инфицированность населения одним из представителей оппортунистических возбудителей — вирусом Эпштейна–Барр (ВЭБ). Практикующие врачи в своей повседневной практике чаще сталкиваются с клинически манифестными формами первичной Эпштейна–Барр-вирусной инфекции (ЭБВИ) в виде острой, как правило, не верифицированной респираторной инфекцией (более 40% случаев) или инфекционным мононуклеозом (около 18% всех заболеваний) [1, 2]. В большинстве случаев эти заболевания протекают доброкачественно и заканчиваются выздоровлением, но с пожизненной персистенцией ВЭБ в организме переболевшего [1, 3–5].
Однако в 10–25% случаев первичное инфицирование ВЭБ, протекающее бессимптомно, и острая ЭБВИ могут иметь неблагоприятные последствия [6–9] с формированием лимфопролиферативных и онкологических заболеваний, синдрома хронической усталости, ВЭБ-ассоциированного гемофагоцитарного синдрома и др. [7, 9, 11–14].
До настоящего времени нет четких критериев, позволяющих прогнозировать исход первичного инфицирования ВЭБ. Перед врачом, к которому обращается пациент с острой ЭБВИ, всегда встает вопрос: что предпринять в каждом конкретном случае, чтобы максимально снизить риск развития хронической ЭБВИ и ВЭБ-ассоциированных патологических состояний Этот вопрос не праздный, и ответить на него действительно очень трудно, т. к. до сих пор нет четкой патогенетически обоснованной схемы лечения больных, а имеющиеся рекомендации часто противоречат друг другу.
По мнению многих исследователей, лечение ЭБВИ-мононуклеоза (ЭБВИМ) не требует назначения специфической терапии [15–17]. Лечение больных, как правило, проводится в амбулаторных условиях, изоляция пациента не требуется. Показаниями к госпитализации следует считать длительную лихорадку, выраженный синдром тонзиллита и/или синдром ангины, полилимфаденопатию, желтуху, анемию, обструкцию дыхательных путей, боли в животе и развитие осложнений (хирургических, неврологических, гематологических, со стороны сердечно-сосудистой и дыхательной системы, синдром Рейе).
При легком и среднетяжелом течении ЭБВ ИМ больным целесообразно рекомендовать палатный или общий режим с возвращением к обычной деятельности на адекватном для каждого конкретного больного физическом и энергетическом уровне. Проведенное многоцентровое исследование показало, что необоснованно рекомендуемый строгий постельный режим удлиняет период выздоровления и сопровождается длительным астеническим синдромом, требующим нередко медикаментозного лечения [18].
При легком течении ЭБВ ИМ лечение больных ограничивается поддерживающей терапией, включающей адекватную гидратацию, полоскание ротоглотки раствором антисептиков (с добавлением 2% раствора лидокаина (ксилокаина) при выраженном дискомфорте в глотке), нестероидные противовоспалительные препараты, такие как парацетамол (Ацетаминофен, Тайленол). По мнению ряда авторов назначение блокаторов Н2 рецепторов, витаминов, гепатопротекторов и местная обработка миндалин различными антисептиками являются малоэффективными и необоснованными способами лечения [19, 20]. Из экзотических методов лечения следует упомянуть рекомендуемое Ф. Г. Боковым и соавт. (2006) применение мегадоз бифидобактерий при лечении больных острым мононуклеозом [21].
Мнения о целесообразности назначения антибактериальных препаратов при лечении ЭБВИМ весьма противоречивы. По мнению Gershburg E. (2005) тонзиллит при ИМ часто асептический и назначение антибактериальной терапии не оправдано. Также нет смысла в применении антибактериальных средств при катаральной ангине [4]. Показанием для назначения антибактериальных препаратов является присоединение вторичной бактериальной инфекции (развитие у больного лакунарной или некротической ангины, таких осложнений, как пневмония, плеврит и др.), о чем свидетельствуют сохраняющиеся более трех суток выраженные воспалительные изменения показателей крови и фебрильная лихорадка. Выбор препарата зависит от чувствительности микрофлоры на миндалинах больного к антибиотикам и возможных побочных реакций со стороны органов и систем.
По данным H. Fota-Markowcka et al. (2002) у больных чаще выделяют гемофильную палочку, стафилококк и пиогенный стрептококк, реже — грибы рода Candida [22], поэтому следует признать обоснованным назначение этим больным препаратов из группы цефалоспоринов 2–3 поколения, линкосамидов, макролидов и противогрибковых средств (флуконазол) в терапевтических дозах на 5–7 дней (реже — 10 дней) [4]. Некоторые авторы при наличии некротической ангины и гнилостном запахе изо рта, вызванных, вероятно, ассоциированной анаэробной флорой, рекомендуют использовать метронидазол по 0,75 г/сут, разделенных на 3 приема, в течение 7–10 дней.
Противопоказаны препараты из группы аминопенициллинов (ампициллин, амоксициллин (Флемоксин Солютаб, Хиконцил), амоксициллин с клавуланатом (Амоксиклав, Моксиклав, Аугментин)) из-за возможности развития аллергической реакции в виде экзантемы. Появление сыпи на аминопенициллины не является IgE-зависимой реакцией, поэтому применение блокаторов Н1 гистаминовых рецепторов не имеет ни профилактического, ни лечебного эффекта [19].
По мнению ряда авторов до настоящего времени сохраняется эмпирический подход к назначению глюкокортикостероидов больным с ЭБВИ [23]. Глюкокортикостероиды (преднизолон, преднизон (Делтазон, Метикортен, Оразон, Ликвид Пред), Солу Кортеф (гидрокортизон), дексаметазон) рекомендуются больным с тяжелым течением ЭБВИМ, с обструкцией дыхательных путей, неврологическими и гематологическими осложнениями (тяжелая тромбоцитопения, гемолитическая анемия) [4, 24]. Суточная доза преднизолона составляет 60–80 мг в течение 3–5 дней (реже 7 дней) с последующей быстрой отменой препарата. Одинаковой точки зрения на назначение этим больным глюкокортикостероидов при развитии миокардита, перикардита и поражениях ЦНС нет.
При тяжелом течении ЭБВИМ показана внутривенная дезинтоксикационная терапия, при разрыве селезенки — хирургическое лечение.
Наиболее дискуссионным остается вопрос о назначении противовирусной терапии больным с ЭБВИ. В настоящее время известен большой перечень препаратов, являющихся ингибиторами ВЭБ репликации в культуре клеток [4, 25–27].
По данным E. Gershburg, J. S. Pagano (2005) все современные «кандидаты» для лечения ЭБВИ могут быть разделены на две группы:
I. Подавляющие активность ДНК-полимеразы ВЭБ:
- ациклические аналоги нуклеозидов (ацикловир, ганцикловир, пенцикловир, валацикловир, валганцикловир, фамцикловир);
- ациклические аналоги нуклеотидов (цидофовир, адефовир);
- аналоги пирофосфатов (Фоскарнет (фоскавир), фосфоноацетиловая кислота);
- 4 оксо-дигидрохинолины (возможно).
II. Различные соединения, не ингибирующие вирусной ДНК-полимеразы (механизм изучается): марибавир, бета-L-5 урацил йододиоксолан, индолокарбазол.
Однако проведенный метаанализ пяти рандомизированных контролируемых испытаний с участием 339 больных ЭБВИМ, принимавших ацикловир (Зовиракс), показал неэффективность препарата [28, 29].
Одна из возможных причин кроется в цикле развития ВЭБ, в котором ДНК вируса имеет линейную либо циркулярную (эписома) структуру и размножается в ядре клетки хозяина. Активная репликация вируса происходит при продуктивной (литической) стадии инфекционного процесса (ДНК ВЭБ линейной формы). При острой ЭБВИ и активации хронической ЭБВИ происходит цитолитический цикл развития вируса, при котором он запускает экспрессию собственных ранних антигенов и активирует некоторые гены клеток макроорганизма, продукты которых участвуют в репликации ВЭБ. При латентной ЭБВИ ДНК вируса имеет вид эписомы (круговой суперспиральный геном), находящейся в ядре. Циркулярный геном ДНК ВЭБ характерен для CD21+ лимфоцитов, в которых даже при первичном инфицировании вирусом практически не наблюдается литической стадии инфекционного процесса, а ДНК воспроизводится в виде эписомы синхронно с клеточным делением инфицированных клеток. Гибель пораженных ВЭБ В лимфоцитов связана не с опосредованным вирусом цитолизом, а с действием цитотоксических лимфоцитов [4].
При назначении противовирусных препаратов при ЭБВИ врач должен помнить, что их клиническая эффективность зависит от правильной трактовки клинических проявлений болезни, стадии инфекционного процесса и цикла развития вируса на этой стадии. Однако не менее важным является и тот факт, что большинство симптомов ЭБВИ связаны не с прямым цитопатическим действием вируса в инфицированных тканях, а с опосредованным иммунопатологическим ответом ВЭБ-инфицированных В лимфоцитов, циркулирующих в крови и находящихся в клетках пораженных органов. Именно поэтому аналоги нуклеозидов (ацикловир, ганцикловир и др.) и ингибиторы полимеразы (Фоскарнет), подавляющие репликацию ВЭБ и уменьшающие содержание вируса в слюне (но не санирующие ее полностью [4], не оказывают клинического эффекта на тяжесть и продолжительность симптомов ЭБВИМ.
Показаниями для лечения ЭБВИМ противовирусными препаратами являются: тяжелое, осложненное течение болезни, необходимость профилактики ВЭБ-ассоциированной В-клеточной лимфопролиферации у иммунокомпрометированных пациентов, ВЭБ-ассоциированная лейкоплакия. Bannett N. J., Domachowske J. (2010) рекомендуют применять ацикловир (Зовиракс) внутрь в дозе 800 мг внутрь 5 раз в сутки в течение 10 дней (или 10 мг/кг каждые 8 часов в течение 7–10 дней). При поражениях нервной системы предпочтителен внутривенный способ введения препарата в дозе 30 мг/кг/сут 3 раза в сутки в течение 7–10 дней.
По мнению E. Gershburg, J. S. Pagano (2005), если под действием каких-либо факторов (например, иммуномодуляторов, при ВЭБ-ассоциированных злокачественных опухолях — применение лучевой терапии, гемцитабина, доксорубицина, аргинина бутирата и др.) удается перевести ДНК ВЭБ из эписомы в активную репликативную форму, т. е. активировать литический цикл вируса, то в этом случае можно ожидать клинический эффект от противовирусной терапии.
В комплексной терапии рекомендуется внутривенное введение иммуноглобулинов (Гаммар-П, Полигам, Сандоглобулин, Альфаглобин и др.) 400 мг/кг/сут, № 4–5.
В последние годы все чаще для лечения ЭБВИ стали применять рекомбинантные альфа-интерфероны (Интрон А, Роферон-А, Реаферон-ЕС) по 1 млн ME в/м в течение 5–7 дней или через день; при хронической активной ЭБВИ — 3 млн ME в/м 3 раза в неделю, курс 12–36 недель.
В качестве индуктора интерферона при тяжелом течении ЭБВИ рекомендуется использовать Циклоферон по 250 мг (12,5% 2,0 мл) в/м, 1 раз в сутки, № 10 (первые двое суток ежедневно, затем через день) или по схеме: 250 мг/сут, в/м на 1-й, 2-й, 4-й, 6-й, 8-й, 11-й, 14-й, 17-й, 20-й, 23-й, 26-й и 29-й день в сочетании с этиотропной терапией. Перорально Циклоферон назначается по 0,6 г/сут, курсовая доза (6–12 г, т. е. 20–40 таблеток).
Медикаментозная коррекция астенического синдрома при хронической ЭБВИ включает назначение адаптогенов, высоких доз витаминов группы В, ноотропных препаратов, антидепрессантов, психостимуляторов, препаратов с прохолинергическим механизмом действия и корректоров клеточного метаболизма [30–32].
Залогом успешного лечения больного с ЭБВИ являются комплексная терапия и строго индивидуальная тактика ведения как в стационаре, так и во время диспансерного наблюдения.
Литература
- Li Z. Y., Lou J. G., Chen J. Analysis of primary symptoms and disease spectrum in Epstein-Barr virus infected children // Zhonghua Er Ke Za Zhi. 2004. Vol. 42. № 1. P. 20–22.
- Grotto I., Mimouni D., Huerta M., Mimouni M., Cohen D., Robin G., Pitlik S., Green M. S. Clinical and laboratory presentation of EBV positive infectious mononucleosis in young adults // Epidemiol Infect. 2003, August; 131 (1): 683–689.
- Поляков В. Е., Лялина В. Н., Воробьева М. Л. Инфекционный мононуклеоз (болезнь Филатова) у детей и подростков //Эпидемиология и инфекционные болезни. 1998. № 6. С. 50–54.
- Gershburg E., Pagano J. S. Epstein-Barr infections: prospects for treatment // Journal of Antimicrobial Chemotherapy. 2005. Vol. 56. № 2. P. 277–281.
- Nelson textbook of pediatrics, 17 th Edition /[edited by] R. E. Behrman, R. M. Kliegman, H. B. Jenson. 2004. P. 2615–2619.
- Cohen J. I., Kimura H., Nakamura S., Ko Y.-H., Jaffe E. S. Epstein-Barr virus-associated lymphoproliferative disease in non-immunocompromised hosts: a status report and summary of an international meeting, 8–9 September 2008 // Ann Oncol. 2009 September; 20 (9): 1472–1482.
- Cohen J. I. Epstein-Barr virus infection // The New Engl. J. of Med. 2000. V. 343, № 7. Р. 481–491.
- Glenda C. Faulkner, Andrew S. Krajewski and Dorothy H. CrawfordA The ins and outs of EBV infеction // Trends in Microbiology. 2000, 8: 185–189.
- Симованьян Э. Н., Денисенко В. Б., Бовтало Л. Ф., Григорян А. В. Эпштейна–Барр-вирусная инфекция у детей: современные подходы к диагностике и лечению // Лечащий Врач. 2007; № 7: С. 36–41.
- Foerster J. Infectious mononucleosis. In: Lee. Wintrobe’s Clinical Hematology. 10 th ed. 1999: 1926–1955.
- Okano M. Epstein-Barr virus infecion and its role in the expanding spectrum of human diseases // Acta Paediatr. 1998. Jan; 87 (1): 11–18.
- Pagano J. S. Viruses and lymphomas // N. Eng. J. Med. 2002. Vol. 347. № 2. P. 78–79.
- Lande M. B. et al. Immune complex disease associated with Epstein–Barr virus infectious mononucleosis // Pediatr. Nephrol. 1998. Vol. 12. № 8. P. 651–653.
- Thracker E. L., Mirzaei F., Ascherio A. Infectious mononucleosis and risk for multiple sclerosis: a metaanalysis // Ann. Neurol. 2006. Vol. 59. № 3. P. 499–503.
- Краснов В. В. Инфекционный мононуклеоз. Клиника, диагностика, современные принципы лечения. СПб: Н. Новгород, 2003.
- Mark H. Ebell Epstein-Barr Virus Infectious Mononucleosis Fam // Physician. 2004 Oct. 1; 70 (7): 1279–1287.
- Okano M., Gross G. Advanced therapeutic and prophylactic strategies for Epstein-Barr virus infection in immunocompromised patients // Expert. Rev. Anti. Infect. Ther. 2007. Vol. 5. № 3. P. 403–413.
- Dalrymple W. Infectious mononucleosis. Relation of bed rest and activity to prognosis. Postgrad Med. 1964; 35: 345–349.
- Кудин А. П. Эта «безобидная» вирус Эпштейна-Барр инфекция. Часть 2. Острая ВЭБ-инфекция: эпидемиология, клиника, диагностика, лечение // Медицинские новости. 2006; № 8. Т. 1: С. 25–31.
- Vendelbo J. L, Lildholdt T., Bende M., Toft A., Brahe Pedersen C., Danielsson G. P. Infectious mononucleosis treated by an antihistamine: a comparison of the efficacy of ranitidine (Zantac) vs placebo in the treatment of infectious mononucleosis // Clin Otolaryngol. 1997; 22: 123–125.
- Боковой Ф. Г., Лыкова Е. А., Дегтярева В. А. и др. Лечение острых форм инфекционного мононуклеоза у детей в стационаре // Эпидемиология и инфекционные болезни. 2007. № 1. С. 53–56.
- Fota-Markowcka H. et al. Profile of microorganisms isolated in nasopharyngeal swabs from the patients with acute infectious mononucleosis // Wiad. Lek. 2002. Vol. 55. № 3–4. P. 150–157.
- Tynell E., Aurelius E., Brandell A. et al. Acyclovir and prednisolone treatment of acute infectious mononucleosis: a multicenter, double-blind, placebo-controlled study // J Infect Dis. 1996; 174: 324–331.
- Roy M., Bailey B., Amre D. K. et al. Dexamethasone for the treatment of sore throat in children with suspected infectious mononucleosis: a randomized, double-blind, placebo-controlled, clinical trial // Archiv Pediatric Adolescent Med. 2004; 158: 250–254.
- Furman P. A., de Miranda P., St. Clair M. H. et al. Metabolism of acyclovir in virus-infected and uninfected cells. Antimicrob // Agents Chemother. 1981; 20: 518–524.
- St Clair M. H., Furman P. A., Lubbers C. M. et al. Inhibition of cellular alpha and virally induced deoxyribonucleic acid polymerases by the triphosphate of acyclovir // Antimicrob Agents Chemother. 1980; 18: 741–745.
- Meerbach A. et al. Inhibitory effects of novel nucleoside and nucleotide analogues on Epstein-Barr virus replication // Antivir. Chem. Chemother. 1998. Vol. 9. № 3. P. 275–282.
- Torre D., Tambini R. Acyclovir for treatment of infectious mononucleosis: a meta-analysis // Scand J Infect Dis. 1999; 31: 543–547.
- Van der Horst C., Joncas J., Ahronheim G. et al. Lack of effect of peroral acyclovir for the treatment of acute infectious mononucleosis // J Infect Dis. 1991; 164: 788–792.
- Демиденко Т. Д., Ермакова Н. Г. Основы реабилитации неврологических больных. СПб.: ООО «Издательство ФОЛИАНТ», 2004. 304 с.
- Мохорт Т. В. Возможности коррекции и профилактики синдрома хронической усталости // Медицинские новости. 2003. № 2. С. 71–78.
- Albrecht F. Chronic fatigue syndrome // J. Am. Acad. Child. Adolesc. Psychiatry. 2000. V. 39, № 7. P. 808–809.
Источник
➤ Adblockdetector